一种新型开菲尔风味复合发酵剂的研制
2022-12-14张亦王亮吕自力巩小芬邓凯文吴涛顾雅纯梁采莹
张亦,王亮*,吕自力,巩小芬,邓凯文,吴涛,顾雅纯,梁采莹
(1.江苏大学食品与生物工程学院,江苏镇江 212000)(2.成都中医药大学医学与生命科学学院/附属生殖妇幼医院,四川成都 610000)
开菲尔最初由高加索地区的牧民将牛羊乳置于羊皮袋中发酵制得。经过不断补加底物,最终在羊皮袋壁上形成的许多的胶状颗粒,即开菲尔粒[1]。开菲尔粒呈乳白色,形似花椰菜,直径范围为0.3~3 cm[2],主要由水、蛋白质及多糖等物质构成[3]。作为一种天然菌种发酵剂,开菲尔粒中定植多种微生物,且开菲尔粒的来源不同,其内部的微生物构成差异也较为明显。因此,开菲尔粒菌群构成呈多样化、不固定等特点。开菲尔具有降解乳糖、降低胆固醇和血压、修复肝脏功能和增加免疫力等功能[4]。经过开菲尔粒的发酵作用,牛乳中的各种营养物质发生了不同程度的降解,并进一步生成醇、醛、酸、酮、酯等挥发性香气物质[5]。
开菲尔粒直接生产开菲尔,其增殖速度有一定限制,菌种组成易变,使发酵后产品品质的稳定性无法保证。乳酸菌在开菲尔粒中数量最多,可以显著改善发酵乳的酸度和粘度。酵母菌经过发酵会生成乙醇和CO2,丰富产品风味,其存在是开菲尔粒与酸乳发酵剂的最大差异,但酵母菌含量过高,会产生酵母异味[6]。为解决开菲尔大规模生产存在的问题,研究者们开展大量研究。Gadaga 等[7]利用分离得到的酵母菌和乳酸菌复配发酵牛乳后,与自然发酵乳的挥发性风味物质相比较,发现前者的风味和口感更好。Agat[8]等对比分析不同菌种发酵过程中的pH 值、乙醇含量、质地等指标,最终发现Lactococcus lactissubsp.cremoris和Saccharomycesfragilis发酵制得的山羊酸奶整体质量最佳。
本研究通过对10 种开菲尔粒中分离菌种进行筛选,将获得的菌种按一定比例复配,研制出最接近开菲尔粒发酵效果的发酵剂,对探究和生产具有开菲尔风味的发酵剂具有重要的生产实践意义。
1 材料与方法
1.1 实验材料
开菲尔粒采集于新疆地区,分别命名为B、D、F、K、M、N、S、T、X、Y;纯牛乳购自内蒙古蒙牛乳业股份有限公司;De Man Rogosa Sharpe(MRS)培养基、Yeast extract Peptone Dextrose(YPD)培养基,青岛海博生物有限公司;2,3,5-Triphenyte-trazoliumchloride(TTC)平板培养基:TTC 0.5 g/L,葡糖糖5 g/L,琼脂50 g/L。
1.2 主要仪器设备
5418R 高速离心机,德国Eppendorf 公司;Bio-rad T100 梯度PCR 仪、琼脂糖凝胶电泳仪,美国Bio-rad公司;凝胶成像系统,英国Syngene 有限公司;HP6890/5973 气相色谱-质谱、SPME-57328 顶空固相微萃取、7890B 气相色谱仪,美国Agilent 公司;TA-XT2i质构仪,英国Stable Micro Systerm 公司。
1.3 开菲尔粒的采集与活化
将采集的开菲尔粒存放于100 mL 离心管中,并添加60 mL 纯牛乳,保存于4 ℃。收集结束后滤去牛乳,用灭菌后0.85wt% NaCl 溶液冲洗开菲尔粒,5%(m/V)重新活化于纯牛乳中,140 r/min、28 ℃培养24 h。循环培养6 次至pH 值稳定。
1.4 分离菌株的分子生物学鉴定
取新鲜活化出的开菲尔液1 mL及充分研磨的开菲尔粒(约1 cm3)共同稀释于9 mL 0.85wt% NaCl(m/m)溶液中。经过梯度稀释后,将上述接种液分别涂布于MRS 培养基于37 ℃培养48 h 和YPD 培养基于28 ℃培养48 h。挑取不同菌落在相应的培养基上分离纯化3次。然后,对不同菌落的DNA 进行提取并PCR 扩增,所用引物为通用引物27F(agagtttgatcctggctcag)和1492R(tacggctaccttgttacgactt)[9]。采用1.0wt%琼脂糖凝胶电泳检测PCR 反应效果,选择条带明显的待测菌株的PCR 扩增产物送样测序。在Genbank 检索系统,将待测菌株的测序结果进行BLAST 比对和同源性分析,从而确定所分离的菌种信息。
1.5 乳酸菌的筛选
1.5.1 产香能力及蛋白分解能力测定
分别测定不同单菌发酵乳中乙醛、双乙酰[10]及氨基氮的含量[11],获得优质乳酸菌菌株。
1.5.2 全质构分析
参照Domagała 等[12]的方法,测定不同乳酸菌单菌发酵乳的全质构指标包括硬度、稠度、凝聚性和粘性。
1.6 酵母菌的筛选
1.6.1 产乙醇能力测定
参照如意[13]的方法,测定22株酵母菌的产香能力。酵母菌菌液稀释涂布于YPD 培养基中,于28 ℃倒置培养2 d 后,选择菌落数约为100~300 的平板,往上倒入冷却至室温的15 mL TTC 培养基,于28 ℃条件下培养。记录4 h 内,每小时培养基中菌落周围颜色的变化,一般认为,颜色与产乙醇能力成正相关,从而初步判断不同菌株产生乙醇能力。
1.6.2 遗传稳定性及乳糖分解能力测定
将初步筛选获得酵母菌连续传代30 次,按照一定比例稀释后,测定OD600的大小。同时参照刘曜综等[14]的方法,测定酵母菌菌株代谢乳糖能力。
1.7 复合菌种发酵剂的研制
1.7.1 三种乳酸菌比例的优化
分别取3 株30 mL 活化后的乳酸菌菌液于50 mL离心管中,4 ℃,6 000 r/min 离心15 min 后弃上清,并用纯牛乳等体积重悬菌泥,忽略离心条件对活菌数的影响。按照表1中设置的27 组比例(NLM2:MLK5:SLC1)制作发酵乳。37 ℃培养至凝乳,于4 ℃冷藏1 d。邀请具有专业经验的20 名人员对不同比例乳酸菌发酵乳的外观、质地、风味和可接受性进行评估。根据文献方法并稍作修改[15]。感官评分包括:极致喜欢=10;非常喜欢~不喜欢也不讨厌=9~5;些许不喜欢~非常不喜欢=4~2;极致不喜欢=1。根据感官评分,从而确定最佳比例。
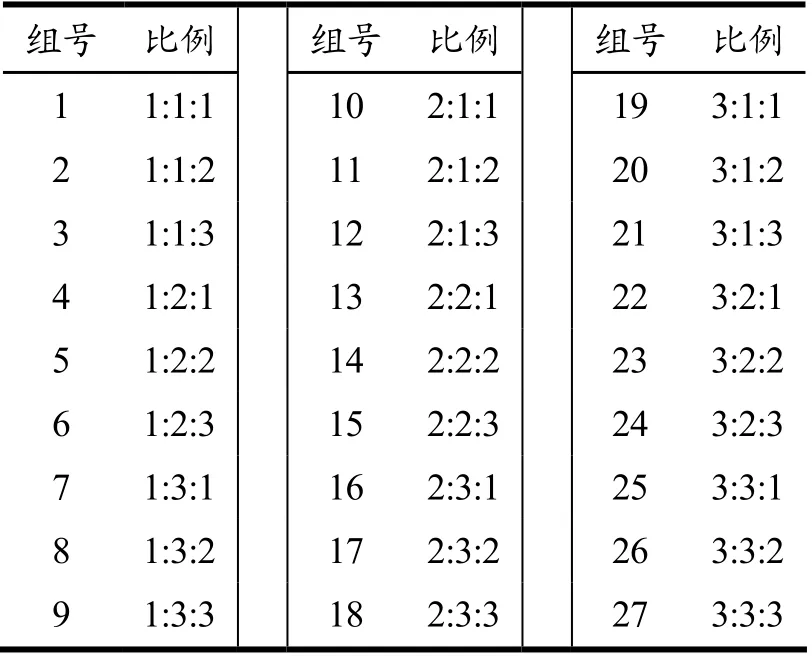
表1 3 株乳酸菌间比例的优化Table 1 Optimization of the ratio of three LAB strains
1.7.2 乳酸菌与酵母菌比例的优化
设定乳酸菌与酵母菌的比例分别为1:1、2:1、3:1、4:1、5:1、6:1、7:1,其中,三株乳酸菌间的比例依据表1所优化出的结果。按1×106CFU/mL 活菌数接种于100 mL 纯牛乳中,34 ℃培养至凝乳,于4 ℃冷藏1 d。邀请20 个具有经验的人员进行感官评定,评定标准见表2。

表2 复合发酵乳的感官评价标准Table 2 The standard for sensory evaluation index of fermented milk
1.7.3 发酵温度的优化
由于不同菌种的生长温度变化,可能导致菌种活力改变,进而影响发酵乳的品质。因此,对复合发酵剂的培养温度作进一步的优化具有重要意义。根据1.7.2 优化出乳酸菌与酵母菌比例,按1×106CFU/mL活菌数接种于100 mL 纯牛乳中,设置发酵温度为28、30、32、34、36、38、40 ℃,培养至凝乳后,于4 ℃冷藏1 d 后,参照表2进行感官评价。
1.7.4 凝乳时间、活菌数、酸度、持水力及乙醇含量测定
纯牛乳从接种菌种至完全凝固的时间为凝乳时间。参照文献[16-18],分别测定活菌数、酸度、持水力和乙醇含量。
1.7.5 GC-MS 分析
参照李海燕等[19]的方法,采用GC-MS 试验测定不同发酵乳中挥发性风味物质。
1.8 数据处理
使用Excel 2020 对数据初步处理,每个样品试验重复三次,最终结果为平均值±标准差。数据采用SPSS 19.0 进行方差分析(ANOVA);Origin 2018 软件用于绘图;R Studio 软件用于绘制热图,分析不同样品的挥发性代谢物的差异。
2 结果与讨论
2.1 优势菌种分析
本研究从10 种开菲尔粒中,共分离获得51 株乳酸菌、22 株酵母菌,不同开菲尔粒中菌种构成如表1所示,分析发现不同开菲尔粒中微生物组成差异较大,易受地理、气候等自然因素以及发酵工艺等人为因素的影响。以10 种开菲尔粒为例,乳酸菌中优势菌种为开菲尔乳杆菌、干酪乳杆菌,分别占分离菌种的28.77%和20.55%;酵母菌中优势菌种为马克思克鲁维酵母、单孢酿酒酵母,分别占分离菌种的12.33%和6.85%。

表3 10 种开菲尔粒中菌种组成及其占比Table 3 Composition and proportion of bacteria in 10 kinds of kefir grains
2.2 乳酸菌的筛选
2.2.1 产香能力测定
乳酸菌产香能力主要呈现为发酵乳中乙醛、双乙酰浓度。文献认为,乙醛和双乙酰的浓度分别达到5 mg/L、1 mg/L 时,发酵产品具有特征风味,而乙醛质量浓度大于30 mg/L 时会生成不愉快的风味[20]。因此,在适度范围内,随着乙醛质量浓度的升高,发酵乳的风味愈佳[21]。乙醛质量浓度最高的菌株MLC1 为28.82 mg/L,其次菌株FLC2 浓度为28.65 mg/L,两者无显著性差异(p>0.05)。双乙酰质量浓度过高也将造成产品风味欠缺[20]。双乙酰质量浓度最高的菌株YLP3 浓度为8.97 mg/L,与其他菌株具有显著性差异(p<0.05),其次为菌株DLP3 和TLP5,质量浓度分别为6.39 mg/L、6.34 mg/L,两者无显著性差异(p>0.05)。当乙醛与双乙酰均在最适质量浓度范围内,且两者间比例高于3 时,发酵乳风味与比例成正相关[22]。根据实验结果,构建的双乙酰标准曲线为:
y=0.098 1x+0.032,R²=0.99。
如表4,为28 株乳酸菌单菌发酵乳的乙醛、双乙酰浓度,其余23 株乳酸菌发酵乳经单菌发酵后有异味、颜色异常等,故不计入。表4中,乙醛与双乙酰质量浓度比例大于3 的乳酸菌有22 株,其中,14 株乳酸菌(BLK3、BLK4、KLC1、KLC2、KLK4、MLK3、MLK5、NLM2、NLK3、SLC1、XLC2、XLK4、YLK4、YEF5)发酵乳中乙醛质量浓度在5~30 mg/L 范围内,说明这14 株乳酸菌的产香能力更强。

表4 28 株乳酸菌发酵乳的乙醛、双乙酰质量浓度Table 4 Acetaldehyde and diacetyl concentrations of fermented milk of 28 LAB strains
2.2.2 蛋白分解能力测定
蛋白分解能力测定以发酵乳中氨基氮质量浓度为重要指标,其浓度大小反映了乳中短肽和游离氨基酸的含量,其值越高,说明蛋白类物质越易被人体吸收,同时对发酵乳的感官评价也有一定影响[11]。根据实验得出氨基氮含量的标准曲线为:
y=0.002x+0.011 6,R²=0.99。
表5为28 株乳酸菌发酵乳中氨基氮质量浓度。其中 9 株乳酸菌发酵乳的氨基氮质量浓度为570.98~684.92 mg/L,具有显著性差异(p<0.05),且远大于商业发酵剂制备发酵乳中氨基氮质量浓度409.50 mg/L[23],也大于干酪乳杆菌与商业发酵剂共同发酵后发酵乳中的氨基氮质量浓度500.88 mg/L[24]。剩余19 株乳酸菌发酵乳的氨基氮质量浓度范围为333.19~505.33 mg/L,除菌株SLP3 与XLK4,菌株FLC2与TLP5 无显著性差异外(p>0.05),其余菌株间均具有显著性差异(p<0.05)。不同菌株间的蛋白降解能力的不同,可能由于菌株及生长环境不同,造成蛋白酶活力的差异。
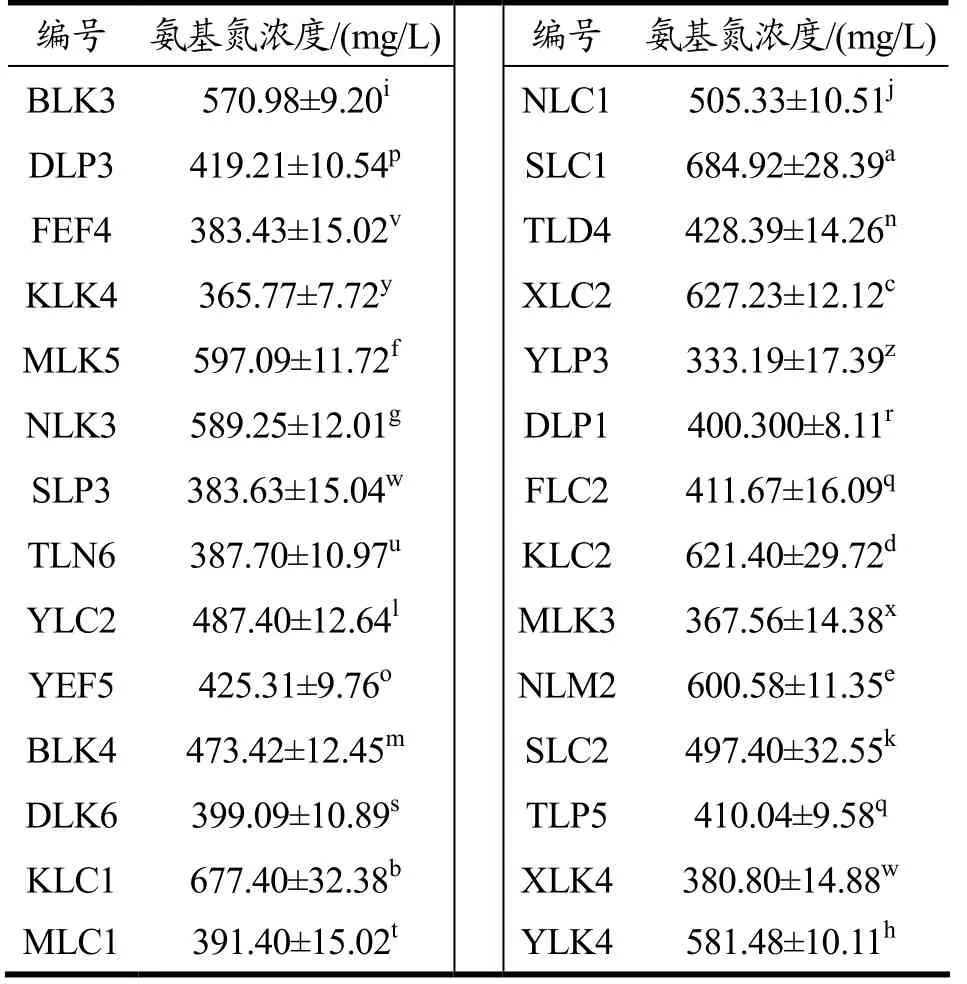
表5 28 株乳酸菌发酵乳的氨基氮质量浓度Table 5 Amino nitrogen concentration of fermented milk of 28 LAB strains
综合乙醛、双乙酰及氨基氮质量浓度,菌株BLK3、KLC1、KLC2、MLK5、NLM2、NLK3、SLC1、XLC2及YLK4 表现较优,故测定这9 株乳酸菌发酵乳的全质构特性的差异。
2.2.3 全质构分析
物性仪可以用于测量食品质构特性,灵敏度高,能够量化待测样品的硬度、稠度、凝聚性及粘性等指标,使结果具备客观性和可比性[25]。如表6所示,9 株乳酸菌发酵乳的硬度均处于适宜范围33.90~39.90 g,此硬度范围的发酵乳更容易为消费者接受。发酵乳稠度与菌株的胞外多糖产量成负相关,稠度越大,则均一性和流畅度越差[26]。菌株MLK5、SLC1、NLM2 的发酵乳稠度显著小于其余菌株(p<0.05),说明这三种发酵乳的均一性和流畅度较好。菌株KLC1、MLK5、SLC1、NLM2 发酵乳的凝聚性和粘性都显著大于其余菌株(p<0.05),表明菌株KLC1、MLK5、NLM2、SLC1 发酵过程中产胞外多糖多、微观网络结构更好。综合全质构特性的四个指标,判定乳酸菌菌株MLK5、NLM2、SLC1 的表现最优。因此,选择乳酸菌MLK5、NLM2、SLC1 作为开菲尔风味复合发酵剂的复配菌种。

表6 9 株乳酸菌发酵乳的全质构分析Table 6 Texture profile analysis of fermented milk of 9 LAB strains
2.3 酵母菌的筛选
2.3.1 产乙醇能力测定
通过TTC 平板的显色反应,可分辨出不同酵母菌产乙醇能力的差异,即颜色越深则产乙醇能力越强。根据结果,1 株酵母菌不显色,6 株酵母菌呈微粉色,12 株酵母菌呈粉红色,3 株酵母菌呈深红色。为避免产乙醇能力过强或不足而影响复合发酵乳的品质,因此,初步选择产乙醇能力适中的酵母菌,即BY1、BY2、DY2、FY1、KY1、MY1、MY3、NY1、NY2、SY2、TY1、XY1,并对其进行后续的筛选试验。
2.3.2 遗传稳定性及乳糖利用率
菌种在连续传代培养过程中可能出现退化现象,表现为生长速度放缓,代谢特征减弱等,故测定遗传稳定性是筛选优异菌种的重要标准。其由表7可知,在多次传代后,菌株MY3、NY1、NY2 于600 nm 处的吸光度为0.145~0.32,低于剩余9 株吸光度0.487~0.777。其中,FY1 的吸光值最大,并与其余菌株具有显著性差异(p<0.05)。酵母菌通过代谢乳糖,实现更好的发酵。根据实验结果得出,乳糖的标准曲线为:

表7 12 株酵母菌的遗传稳定性及乳糖利用率Table 7 Genetic stability and utilization rate of lactose of 12 yeast strains
y=0.224 1x-0.005 6,R2=0.99。
测得纯牛奶中乳糖含量为1.465 mg/mL,并以此为对照,分析不同酵母菌的乳糖利用率。由表7可知,12 株酵母菌在一定程度上均可利用乳糖,并且利用率高于15%。由于长期生长于乳品中,酵母菌从而逐步进化为能够代谢乳糖的菌株。
通过对12 株酵母菌的乳糖代谢能力比较,发现菌株FY1 的乳糖利用率最高,乳糖含量显著低于其余菌株(p<0.05),结合遗传稳定性,发现其最适于发酵牛乳,因此选取酵母菌FY1 为开菲尔风味复合发酵剂的复配菌株之一。
2.4 复合菌种发酵剂的研制
2.4.1 三株乳酸菌比例的优化
经活化后,开菲尔乳杆菌MLK5、干酪乳杆菌SLC1、肠膜明串珠NLM2 的活菌数分别达5.86×108、3.15×108、1.98×109CFU/mL,3 株乳酸菌根据不同比例制备27 组发酵乳的感官评价结果如表8。外观方面,27 组发酵乳均呈乳白色,并无显著差异(p>0.05)。质地方面,1 号发酵乳的组织结构最佳,且无气泡及乳清析出等现象,评分为8.33 分,其次为4 号与13 号发酵乳,均为8.29 分,与1 号发酵乳差异不显著(p>0.05),其余22 组发酵乳与之差异显著(p<0.05)。风味方面,主要涉及酸甜、爽口两个指标,4 号和6 号发酵乳风味较好,其次为19 号发酵乳,三者差异不显著(p>0.05),其他组发酵乳与上述三组差异显著(p<0.05)。可接受性方面,4 号发酵乳的评分最高,其次为24 号和8 号,该三组发酵乳与1 号发酵乳差异不显著(p>0.05),与其余组发酵乳差异显著(p<0.05)。综合外观、质地、风味、可接受性4 个指标,发现4 号发酵乳的整体感官评价较为突出,因此,3 株乳酸菌间的最佳比例确定为NLM2: MLK5: SLC1=1:2:1。

表8 不同比例发酵乳的感官评价结果Table 8 Sensory evaluation results of different ratios of fermented milk
2.4.2 乳酸菌与酵母菌比例的优化

图1 接种比例的变化对发酵乳感官评分的影响Fig.1 The influence of the change in inoculation proportion on sensory score of fermented milk
开菲尔乳杆菌MLK5、干酪乳杆菌SLC1、肠膜明串珠NLM2、马克思克鲁维酵母菌FY1 的重新活化后,活菌数分别为5.23×108、3.25×108、2.03×109、1.13×107CFU/mL。当乳酸菌与酵母菌的比例设置为1:1、2:1、3:1、4:1、5:1、6:1、7:1(其中三种乳酸菌比例肠膜明串珠菌:开菲尔乳杆菌:干酪乳杆菌=1:2:1)时,发酵乳的感官评分先升高再降低。当两者比例为5:1时,感官评分达到最高,因此确定开菲尔风味复合发酵剂中乳酸菌与酵母菌的比例为5:1。
2.4.3 发酵温度的优化
由图2可知,在接种量为1×106CFU/mL,乳酸菌:酵母菌为5:1 时,随着发酵温度的升高,感官评分先升高在降低,于34 ℃时,感官评分达到最高。因此,确定复合发酵乳的最佳发酵温度为34 ℃。
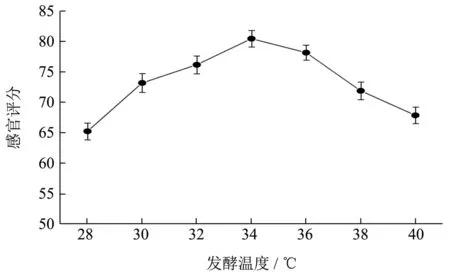
图2 发酵温度的变化对发酵乳感官评分的影响Fig.2 The influence of the changes in fermentation temperature on sensory scores of fermented milk
2.4.4 发酵乳的凝乳时间、酸度、活菌数、乙醇含量及感官评价
为验证复合发酵剂的可行性,挑选性状稳定的开菲尔粒C、H、M、N 作为对照,比较分析不同发酵乳间质量差异。表9为5 种不同发酵乳的指标测定结果。比较发现,复合发酵乳的凝乳时间最短,并低于开菲尔粒凝乳所需时间。复合发酵乳的酸度为84.66 ºT,4 种开菲尔粒发酵乳的酸度范围为73.27~84.21 ºT,都满足国标要求。复合发酵乳的持水力显著大于与开菲尔粒发酵乳(p<0.05)。四种开菲尔粒发酵乳的乙醇含量范围为0.37%~0.56%(V/V),复合发酵乳中乙醇含量介于之中,说明复合发酵剂中酵母菌产乙醇能力尚可。而且,不同发酵乳中酵母菌与乳酸菌的活菌数均达到106CFU/mL 与109CFU/mL,符合国标要求。

表9 不同发酵乳指标测定结果Table 9 Determination results of different fermented milk indexes
2.4.5 发酵乳的主成分分析
主成分分析是一种多元统计工具,主要应用于降维数据处理[27]。根据上述表9测得指标,对复合发酵乳及开菲尔粒发酵乳主成分分析。前三个主成分特征值累计贡献量达99.50%(分别为50.90%、34.10%和14.50%,图3a)。PC1 方向与凝乳时间、酸度、持水力、及感官评价相关性较大,其载荷绝对值均大于4。PC2方向与乙醇含量、乳酸菌活菌量、及酵母菌活菌量有较大的相关性,载荷绝对值均大于4.4。PC3 方向与持水力、乙醇含量、乳酸菌活菌量有较大相关性,载荷绝对值大于4。

图3 不同发酵乳理化特性的主成分分析Fig.3 Principal component analysis of the physical and chemical properties of different fermented milks
图3b 中的得分图显示出5 种发酵乳的分布情况,不同发酵乳间有明显区分。PC1 得分越高,凝乳时间、酸度、持水力、及感官评价指标值就越高,开菲尔粒C、开菲尔粒M 及复合发酵乳的PC1 得分为正值。PC2 得分越高,乙醇含量、乳酸菌活菌量、及酵母菌活菌量指标值越高,PC2 方向上的开菲尔粒C、开菲尔粒N及复合发酵乳得分为正值。PC3 得分越高,持水力、乙醇含量、乳酸菌活菌量指标值越高,只有开菲尔粒N的PC3 得分为正值。进一步说明,复合发酵乳与开菲尔粒C 各项指标较为接近,整体质量表现接近开菲尔粒发酵乳。
2.4.6 不同发酵乳的挥发性香味物质比较
采用GC-MS,测定不同发酵乳中挥发性香气成分,共检测到风味物质35 种。5 种发酵乳的风味物质均包括醇、醛、酮、酯、酸类。醇类物质相对含量最为丰富,占25%~50%,主要为酵母菌发酵产生,为开菲尔风味发酵乳的风味物质的主要构成成分。复合发酵乳中醇类物质检测到6 种,含量高于其他发酵乳的醇类分别为苯乙醇和异丁醇。苯乙醇作为一种令人愉悦的具有花香味的芳香醇,广泛存在于植物精油中,也是葡萄酒等发酵食品中天然的风味物质,是决定发酵食品品质关键因素之一[28]。异丁醇主要由支链氨类基酸分解途径产生,不仅能起到呈味的作用,还是构成酯类的前体物质[29]。醛类物质阈值低,主要产生各种氧化风味。复合发酵乳共检测到醛类物质4 种,其中二甲基丁醛为优势风味物质,具有青草香气,由氨基酸与羰基化合物通过Strecker 降解反应生成,使发酵后的产品具有清新自然风味[30]。酮类物质具有浓郁的奶香味,使发酵乳风味更馥郁。复合发酵乳检测到酮类有6种,但总含量低于开菲尔粒发酵乳。酯类物质阈值较低,且大部分呈现出果香味,为乳制品中重要的风味成分之一。复合发酵乳中共检测到7 种酯类物质,其中,丁酸乙酯、己酸乙酯、和乙酸异丁酯为优势风味成分。丁酸乙酯具有浓烈的水果香甜味;己酸乙酯具有酒香、菠萝香型的香气,工业上常用在香精调制及酒类调香;乙酸异丁酯有贮藏的鲜果香气[31]。酸类物质影响发酵乳的爽口感,一般控制酸类物质产生于发酵前期,避免后期发酵过度产生后酸化现象。复合发酵乳检测到6 种酸类物质,丁酸、已酸、辛酸含量最高。丁酸具有刺激性气味,已酸的气味表现为辛辣、腐臭、花香等气;辛酸呈淡淡脂肪和肥皂气味[32]。由图4可知,与开菲尔粒发酵乳相比,复合发酵乳的香气物质种类数最多,各种物质间构成和谐。可能由于纯菌种发酵并且各菌种最大限度的发挥了作用,一定程度上降低了醋酸菌等其他菌种对发酵过程产生的消极影响。

图4 不同发酵乳挥发性化合物的热图及聚类分析Fig.4 Heatmap and cluster analysis of volatile compounds in different fermented milks
3 结论
为研制一种新型开菲尔风味复合发酵剂,本研究对10 种开菲尔粒中优势菌种进行了分离,筛选出性能稳定的开菲尔乳杆菌MLK5、干酪乳杆菌SLC1、肠膜明串珠菌NLM2 和马克思克鲁维酵母菌FY1。最终确定发酵剂中最佳的菌种配比为乳酸菌:酵母菌=5:1(乳酸菌之间配比为NLM2:SLC1:MLK5=1:2:1)。经过对比分析,复合发酵剂发酵产品的凝乳时间、酸度、持水力、乙醇含量、活菌数及感官评价指标与开菲尔粒发酵产品类似,挥发性风味物质构成协调、稳定。故本研究可为开菲尔风味复合发酵剂的研制及不同风味酸奶的规模化生产奠定理论及实际应用基础。
