抑制辣椒采后疫霉菌的乳酸菌筛选及相关特性分析
2022-12-14孙若兰易有金夏菠胡楠邓后勤朱树清朱利红朱妮娜
孙若兰,易有金*,夏菠*,胡楠,邓后勤,朱树清,朱利红,朱妮娜
(1.湖南农业大学食品科学技术学院,湖南长沙 410128)(2.汝城县繁华食品有限公司,湖南郴州 424100)(3.汝城县鑫利食品有限公司,湖南郴州 424100)(4.张家界洞溪七姊妹辣椒开发有限公司,湖南张家界 427209)
辣椒疫霉菌(Phytophthora capsici)是引起辣椒采后病害的常见病原菌之一,最适生长温度为24~26 ℃[1,2]。在侵染发病之前,辣椒疫霉菌具有2 d左右的潜伏期,因此采收时看起来健康的果实在采后贮藏和运输过程中可能会出现腐烂[3]。肖晶等[4]研究发现,辣椒常温贮存5 d 后,果身可出现疫霉病害症状,15 d 后平均发病率为5%,在辣椒采后病害中排名第六。辣椒疫霉菌寄主广泛,除侵染辣椒之外,还能够侵染黄瓜、番茄和南瓜等其他茄果类蔬菜,因此使果蔬采后经济价值受到了较大的损失[5]。目前,暂未见关于采后辣椒疫霉菌的生物防治研究,所以开发一种安全、绿色且高效的辣椒采后疫霉病抑制剂变得十分迫切[6]。
乳酸菌(Lactic Acid Bacteria,LAB)是一类常见于发酵食品、人类胃肠道中的益生菌,能通过发酵多种碳源产生具有抑菌能力的有机酸和细菌素,具有抗氧化、改善肠道环境、抗菌保鲜的功效[7-9]。因具有公认的安全状态(GRAS),乳酸菌被认为是抑制食品真菌生长及霉菌毒素产生的天然防腐剂,成为了许多传统化学杀菌药剂的替代品[10-12]。近年来,使用乳酸菌及其代谢产物对果蔬采后抑菌及保鲜的研究逐渐深入,已被证实具有抑制真菌效果的乳酸菌主要有植物乳杆菌、乳酸链球菌、鼠李糖乳杆菌等[13]。Xiang 等[14]研究发现,保加利亚乳杆菌F17 和乳酸明串珠菌H52对霉菌和大肠菌群具有明显的抑制作用,具有草莓采后保鲜效果。Melo 等[15]研究发现乳酸菌发酵液对樱桃番茄采后致病镰刀菌、黑曲霉菌和匍匐根霉菌具有抑制效果,然而,关于乳酸菌及其代谢产物对辣椒采后疫霉病的生物防治研究尚未见报道。
鉴于此,本研究旨在从发酵蔬菜中分离筛选出一株对辣椒疫霉菌具有明显抑菌效果的乳酸菌,并对该乳酸菌进行菌种鉴定、对其产酸能力进行测定。研究发酵上清液对辣椒疫霉菌的抑制效果以及理化性质,为抑制辣椒疫霉菌生长和防控辣椒采后疫霉病提供乳酸菌菌种资源及数据参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
蔬菜原材料(辣椒、豇豆、白萝卜、黄瓜、卷心菜、甘薯)购于湖南省衡阳市。
1.1.2 试验菌株
辣椒疫霉菌(Phytophthora capsici)由湖南农业大学植物保护学院赠予。辣椒根霉菌(Rhizopusspp.)、辣椒红色炭疽菌(Colletotrichum gloeosporioides)、辣椒黑色炭疽菌(Colletotrichum nigrum)、金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella)、志贺氏菌(Shigella)、阪崎肠杆菌(Enterobacter sakazakii)、单核细胞增生李斯特氏菌(Listeriamonocytogenes)由湖南农业大学食品科技学院微生物实验室提供。
1.1.3 培养基与试剂
MRS 肉汤、营养肉汤(NB)、马铃薯葡萄糖培养基(PDB)广东环凯微生物科技有限公司;脑心浸液肉汤(BHI)杭州百思生物技术有限公司;以上培养基加入18 g 琼脂粉即配制为相对应的固体培养基。
碳酸钙、氯化钠、明胶、体积分数30%过氧化氢(分析纯)国药集团化学试剂有限公司;过氧化氢酶、蛋白酶K、胰蛋白酶、胃蛋白酶福州飞净生物科技有限公司;Ezup 柱式细菌基因组DNA 抽提试剂盒、SanPrep 柱式DNAJ 胶回收试剂盒、DNA Ladder Mix maker、dNTP 生工生物工程(上海)有限公司;氨苄青霉素钠上海瑞永生物科技有限公司;多菌灵江苏达捷生物科技有限公司。
1.2 仪器与设备
净化工作台,上海新苗医疗器械制造有限公司;7200分光光度计,上海尤尼柯仪器有限公司;LRH-250智能生化培养箱,上海飞跃实验仪器有限公司;HR/T16M 台式高速冷冻离心机,湖南赫西仪器装备有限公司;HR/T16M 台式高速冷冻离心机,湖南赫西仪器装备有限公司;FD-1-50 真空冷冻干燥机,北京博医康实验仪器有限公司。
1.3 试验方法
1.3.1 自然发酵蔬菜制作
将辣椒、豇豆、白萝卜、黄瓜、卷心菜、甘薯洗净切分晾晒至表面无水分后入坛,加入5%(m/m)食用盐,冷开水浸没蔬菜,密封坛盖,室温静置发酵14 d;或加入8%(m/m)食用盐至上述晾干蔬菜表面,进行盐渍处理,室温静置发酵14 d。
1.3.2 乳酸菌初步分离
采用稀释涂布平板法,取10 g 采集样品至50 mL无菌0.85%(m/V)NaCl,旋涡混匀,依次进行10-1~10-4浓度梯度的稀释。各梯度取100 μL 涂布在含2%CaCO3(m/V)的MRS 固体培养基,37 ℃培养48 h~72 h。挑取具有明显溶钙圈的菌落,多次划线纯化直至菌落形态单一、镜检无杂菌,将革兰氏染色阳性、过氧化氢酶阴性的乳酸菌株,4 ℃斜面保藏备用。
1.3.3 乳酸菌发酵上清液制备
取保藏菌株,经MRS 肉汤活化两次后,以3%添加量添加菌株至MRS 肉汤,37 ℃静置培养72 h,8 000 r/min 离心10 min,上清液经0.22 μm 滤膜过滤除菌,4 ℃保存。
1.3.4 乳酸菌筛选
采用固体稀释法,待PDA 培养基冷却至55 ℃左右,以发酵上清液为试验组、无菌水为对照,按照1:9(V:V)的比例(发酵上清液为1,PDA 培养基为9)将发酵上清液与培养基混合均匀,每平皿注入约20 mL 混合液。培养基冷却凝固后,在中央加入一块4 mm 辣椒疫霉菌菌饼,28 ℃正置培养7 d,采用十字交叉法测量菌落生成直径,并代入公式计算菌落生长抑制率,记录抑菌效果最佳的菌株,-80 ℃甘油冻存管保藏菌株备用。

式中:
B——菌落生长抑制率,%;
d0——对照组菌落直径,mm;
d1——试验组菌落直径,mm。
1.3.5 菌株鉴定
参考《伯杰细菌鉴定手册》[16]对筛选菌株进行生理生化试验,使用Ezup 柱式细菌基因组DNA 抽提试剂盒进行菌株基因组DNA 提取;选用细菌通用引物27F:5'-AGT TTG ATC MTG GCT CAG-3',1492R:5'-GGT TAC CTT GTT ACG ACT T-3'进行PCR 扩增;PCR 产物经1wt%琼脂糖凝胶电泳纯化后,交由生工生物工程(上海)股份有限公司进行16S rDNA 序列比对鉴定。
1.3.6 乳酸菌生长曲线、产酸能力
于超净台挑取一环菌落接入30 mL MRS 肉汤,静置培养18 h 作为种子培养液,以5%的接种量转移至新鲜MRS 肉汤,37 ℃静置培养,在0、2、4、6、8、10、16、22、28、34、40、46、52、58 h 取样,测定pH 值及其在600 nm 处吸光度值,绘制变化曲线。
1.3.7 发酵上清液理化性质
1.3.7.1 过氧化氢酶敏感性
在菌株O2 的发酵上清液中加入过氧化氢酶,使其终浓度为5 mg/mL,37 ℃水浴24 h 后,80 ℃水浴处理5 min 对酶灭活,恢复室温后0.22 μm 滤膜过滤除菌,按照“1.3.4”进行抑菌检测,以不做任何处理为对照。
1.3.7.2 蛋白酶敏感性
使用6 mol/L HCl 和10 mol/L NaOH 将发酵上清液pH 值分别调至蛋白酶K、胰蛋白酶、胃蛋白酶最适pH值,以1 mg/mL 的浓度分别添加三种蛋白酶至上清液,37 ℃水浴2 h 后,调节pH 值至上清液原浓度,以不做任何处理为对照,按照“1.3.4”进行抑菌检测。
1.3.7.3 热稳定性测定
发酵上清液分别于40、60、80、100、120 ℃条件下加热30 min,以不做任何处理的室温为对照,按照“1.3.4”进行抑菌检测。
1.3.7.4 紫外线照射敏感性
取发酵上清液置于15 W 紫外灯25 cm 处,分别照射30、60、90、120、150 min,以未处理发酵上清液作为对照,按照“1.3.4”进行抑菌检测。
1.3.7.5 酸碱稳定性
使用6 mol/L HCl 和10 mol/L NaOH 于室温下将发酵上清液pH 值分别调至2、3、4、5、6、7、8、9、10、11、12,用无菌水定容发酵上清液至同等体积作为对照(pH 值3.60),0.22 μm 滤膜过滤除菌后按照“1.3.4”进行抑菌检测;
1.3.8 发酵上清液冻干制备
菌株O2 以3%添加量添加至MRS 肉汤,37 ℃静置培养72 h,8 000 r/min离心10 min,上清液经0.22 μm滤膜过滤除菌后取10 mL分装于50 mL离心管,-80 ℃预冷12 h,冷冻干燥48 h 后得到褐色蜂窝状冻干,置于-80 ℃保藏备用。
1.3.9 发酵上清液对辣椒疫霉菌最小抑菌浓度(MIC)和最小杀菌浓度(MBC)
称取适量发酵上清液冻干粉溶解于PDB 培养基中,采用二倍稀释法分别配制成256.0、128.0、64.0、32.0、16.0、8.0、4.0、2.0、1.0 mg/mL 九个浓度梯度,以无菌水为对照,使用0.22 μm 滤膜过膜除菌,4 ℃保存备用。按照“1.3.4”方法进行处理,使发酵上清液终浓度分别为25.6、12.8、6.4、3.2、1.6、0.8、0.4、0.2、0.1、0 mg/mL,以无疫霉菌生长的最低发酵上清液浓度为最小抑菌浓度。在最小抑菌浓度试验的基础上,继续培养7 d,以在14 d 内无辣椒疫霉菌生长的最低发酵上清液浓度为最小杀菌浓度。
1.3.10 发酵上清液抑菌谱
1.3.10.1 发酵上清液对辣椒采后致病菌的抑菌作用
辣椒采后致病菌抑菌试验以乳酸菌发酵上清液为试验组、无菌MRS 肉汤为对照、5 μg/mL 多菌灵为阳性对照,无菌水为空白对照,按“1.3.4”进行抑菌检测。
1.3.10.2 发酵上清液对常见食源性致病菌的抑菌作用
食源性致病菌抑菌试验采用牛津杯法[17],每平皿倾注20 mL 培养基(金黄色葡萄球菌、大肠杆菌、沙门氏菌使用NA 培养基;志贺氏菌、阪崎肠杆菌、单核细胞增生李斯特氏菌使用BHI 培养基),调整致病菌浓度至每毫升1×108个,每平皿涂布100 μL菌悬液,静置5 min 后,将无菌牛津杯置于固体培养基表面,添加100 μL 发酵液至牛津杯,同时以无菌MRS 肉汤作为对照,以100 μg/mL 氨苄青霉素钠作为阳性对照,4 ℃静置4 h 后,37 ℃静置16 h,测量抑菌圈直径,每个处理重复三次。
1.4 数据处理与统计分析
采用Excel 2010 与SPSS 20 统计软件进行试验数据处理与分析,使用OriginPro 2021 进行图片绘制,显著性分析采用Tukey test 法,p<0.05 为差异显著。
2 结果与讨论
2.1 乳酸菌筛选
本试验从不同自制发酵蔬菜中初步筛选出生长良好的乳酸菌8 株,分别命名为C1、E2、G1、G2、M1、O1、O2、P1。采用固体稀释法,从8 株菌株中筛选一株对辣椒疫霉菌具有抑菌活性乳酸菌,结果见图1。
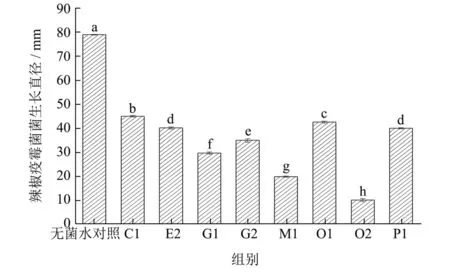
图1 不同乳酸菌对辣椒疫霉菌的菌落生长抑制率Fig.1 The colony growth inhibition rate of different lactic acid bacteria against Phytophthora capsici
PDA 培养基28 ℃培养7 d 后,加有无菌水的对照组辣椒疫霉菌菌落生长直径为(79.01±0.13)mm,加有菌株C1、E2、G1、G2、M1、O1、O2、P1 发酵上清液的试验组辣椒疫霉菌菌落生长直径分别为44.94、40.06、29.71、34.92、19.86、42.48、10.13、39.92 mm。其中,加有菌株O2 发酵上清液的试验组对辣椒疫霉菌的抑制效果最佳,与C1、E2、G1、G2、M1、O1、O2、P1 试验组、无菌水对照组相比,差异显著(p<0.05),对疫霉菌的生长抑制率为87.18%,因此选取菌株O2 进行下一步试验。

图2 菌株O2 发酵液在PDA 培养基对辣椒疫霉菌的抑制效果Fig.2 Inhibitory effect of strain O2 fermentation broth on Phytophthora capsici in PDA
2.2 菌株鉴定
2.2.1 形态学鉴定
如图3a,O2 在2% CaCO3(m/V)MRS 固体培养基呈乳白色菌落,周边具有典型溶钙圈,菌落呈圆形、边缘整齐、表面光滑且湿润、中央隆起、不透明;在光学显微镜下观察,菌体革兰氏染色呈阳性、长约6~10 μm,无芽孢、无荚膜、无鞭毛(图3b)。

图3 菌株O2 在2% CaCO3 MRS 培养基菌落形态(a)与菌体形态(×1 000)(b)Fig.3 O2 Colony morphology (a) and cell morphology (×1 000)(b) in 2% CaCO3 MRS
2.2.2 生理生化特征鉴定
由表1可知,菌株O2 碳水化合物反应皆为阳性,触酶试验、葡萄糖产气试验、硝酸盐还原试验、VP试验、H2S 试验、明胶液化试验、吲哚试验皆为阴性,在pH 值4.5、pH 值6.5、4%~8% NaCl、10 ℃、15 ℃环境下正常生长,45 ℃生长停滞。根据《伯杰细菌鉴定手册》(第八版)中乳杆菌科描述,菌株O2 生理生化试验的结果与乳杆菌属植物乳杆菌(Lactobacillus plantarum)描述相符合。

表1 菌株O2 生理生化试验结果Table 1 O2 results of physiological and biochemical tests
2.2.3 16S rDNA 序列比对鉴定
如图4,菌株O2 的PCR 扩增产物经1wt%琼脂糖凝胶电泳纯化后,在1 500 bp 处出现特异清晰的单一条带。经生工生物工程(上海)股份有限公司测序分析获得16S rDNA 基因序列,将O2 菌株16S rDNA 基因序列上传至BLAST,使用GenBank 搜索同源性高的相似菌株16S rDNA 序列进行相似性分析,在MEGA X 软件中使用Neighbor-Joining(N-J)法构建系统发育树。结果表明,O2 菌株与植物乳杆菌同源性为98%,鉴定O2 菌株为植物乳杆菌Lactobacillus plantarum(GenBank 登陆号为OL616071)。


图4 菌株O2 PCR 产物电泳图(a)与系统发育树(b)Fig.4 O2 Electrophoretic map of PCR products (a) and phylogenetic tree (b)
2.3 植物乳杆菌O2 生长曲线及产酸能力
如图5,植物乳杆菌O2 在0~58 h 培养时间内的生长曲线主要表现为3 个阶段:0~2 h 为菌株O2 的生长延滞期,此时期细菌数目增加不明显,OD600值从0.437 上升至0.456;2~28 h 为生长对数期,菌体代谢旺盛,菌体数量呈几何级数增加,OD600值从0.456 上升至8.716(发酵液原液稀释OD600值至0.5~0.6 左右后再乘以稀释倍数);28~58 h 为生长稳定期,随着培养时间的延长细菌增长速度逐渐趋向于零,OD600值从8.716 降低至7.833。植物乳杆菌O2 在0~58 h 培养时间内的产酸能力与其生长曲线的变化相吻合,在0~2 h 内,发酵液pH 值出现缓慢降低,从5.18 降至5.10;在2~28 h 内,随着细菌进入生长对数期,菌体内酶系活跃,迅速产酸,发酵液pH 值从5.10 迅速下降至3.64;在28~58 h 内,发酵液pH 值逐渐趋于稳定维持在3.60。
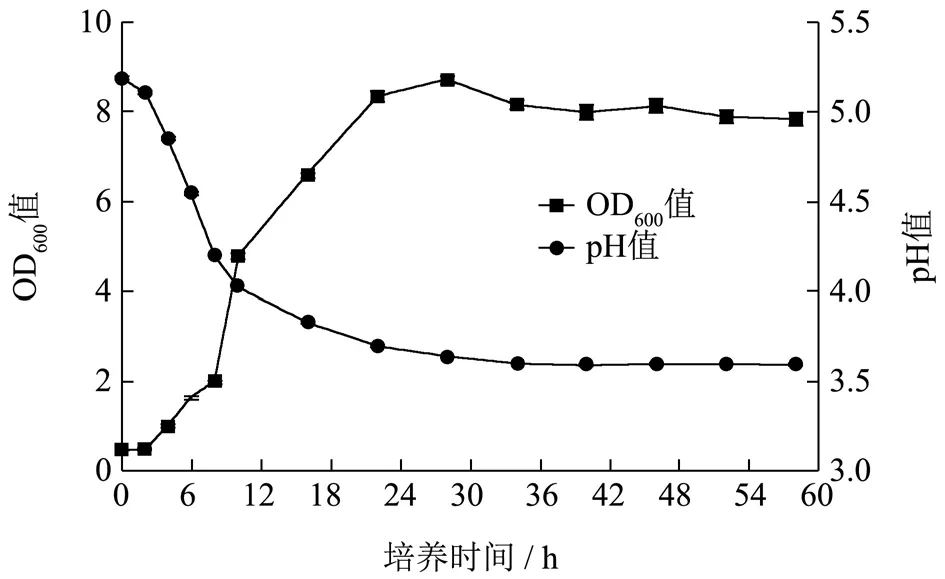
图5 植物乳杆菌O2 在MRS 肉汤中的生长曲线和产酸曲线Fig.5 Lactobacillus plantarum O2 growth curve and acid production curve in MRS
2.4 发酵上清液理化性质
2.4.1 发酵上清液过氧化氢酶、蛋白酶敏感性
乳酸菌可产生过氧化氢、黏蛋白以及细菌素等代谢产物,通过破坏细胞膜、羟基自由基等方法抑制致病菌生长繁殖[18,19]。如图6a 所示,经过氧化氢酶、蛋白酶K、胰蛋白酶和胃蛋白酶处理的O2 发酵上清液的菌落生长抑制率与未经处理的原液相比,菌落生长抑制率无显著差异(p>0.05)。说明O2 发酵上清液对过氧化氢酶、蛋白酶K、胰蛋白酶和胃蛋白酶不敏感,这与黄晓英等[20]的结果相同。

图6 不同方式处理植物乳杆菌O2 发酵上清液对辣椒疫霉菌生长抑制率的影响Fig.6 Effect of differents treatment of Lactobacillus plantarum O2 fermentation supernatant on growth inhibition rate of Phytophthora capsici
2.4.2 发酵上清液热稳定性测定
抑菌剂的适用范围主要受温度的影响,Digaitiene等[21]研究发现,清酒乳杆菌KTU05-6 具有良好的热稳定性,即使在100 ℃下处理60 min 其抑菌物质也能保持稳定。本试验分别在40、60、80、100、120 ℃条件下处理上清液30 min,如图6b 所示,在40~120 ℃的温度范围内,O2 发酵上清液对疫霉菌生长抑制率与发酵上清液原液的差异不显著(p>0.05),证明发酵上清液的主要抑菌物质具有良好的热稳定性。
2.4.3 发酵上清液紫外线照射敏感性
紫外线敏感试验同热稳定性试验相似,其测定结果对抑菌物质的应用范围有所影响。Banerjee 等[22]研究发现,紫外线照射对短乳杆菌FPTLB3 的抑菌成分无影响。如图6c 所示,O2 发酵上清经15 W 紫外灯照射30、60、90、120 及150 min 处理后,对疫霉菌生长抑制率分别为87.87%、87.06%、86.11%、87.63%和 87.09%,与发酵上清液原液的差异不显著(p>0.05),证明O2 发酵上清液的主要抑菌物质在15 W 紫外线下不敏感,这与Banerjee 的结果一致。
2.4.4 发酵上清液酸碱稳定性测定
大多数有机酸在酸性条件具有最高抑菌活性,通过测定发酵上清液对酸碱的耐受程度,可进一步鉴别抑菌物质最高抑菌活性的范围,对抑菌物质纯化鉴定也有着重大意义[23]。如图6d 所示,在O2 发酵上清液pH 值为2~3 时,发酵上清液对疫霉菌生长抑制率为100%,与对照组的抑制率相比有显著差异(p<0.05)。随着O2 发酵上清液pH 值的升高,菌生长抑制率逐渐降低,当pH 值为5 时,发酵上清液已无法抑制疫霉菌的生长,且当pH 值>6 时,碱性环境下的某些物质促进了疫霉菌的生长。说明O2 发酵上清液对辣椒疫霉菌的主要抑菌物质在pH 值<5 时有较好的稳定性。
2.5 发酵上清液对辣椒疫霉菌最小抑菌浓度(MIC)及最小杀菌浓度(MBC)测定
取冷冻干燥后发酵上清进行称重,经测定每10 mL 发酵上清液冻干后质量为494.6 mg,冻干转化率为49.46 mg/mL。取适量发酵上清液冻干溶解于PDB 中,采用二倍稀释法进行MIC 和MBC 测定,结果如表2和图7所示,从质量浓度为0.8 mg/mL 开始,O2 发酵上清液对疫霉菌的生长出现显著抑制作用(p<0.05),菌落生长抑制率达到7.87%。随着PDA培养基中植物乳杆菌O2 发酵上清液含量的上升,疫霉菌的菌落生成直径逐渐减小,其对疫霉菌的生长抑制率逐渐上升。当O2 发酵上清液质量浓度达到12.8 mg/mL 后,菌落生长抑制率达到100%,7 d 内未见菌丝生长,故确定12.8 mg/mL 为菌株O2 发酵上清液对辣椒疫霉菌的MIC。由表2可知,28 ℃培养14 d时,质量浓度为12.8 mg/mL 的O2 发酵上清液对疫霉菌的生长抑制率为91.30%,具有较好的抑菌效果,但要使疫霉菌生长抑制率达到100%,需进一步提高O2发酵上清液质量浓度至25.6 mg/mL,故25.6 mg/mL为菌株O2 发酵上清液对辣椒疫霉菌的MBC。

图7 植物乳杆菌O2 发酵上清液对辣椒疫霉菌的MICFig.7 The MIC of Lactobacillus plantarum O2 fermentation to Phytophthora capsici

表2 植物乳杆菌O2 发酵上清液对辣椒疫霉菌的最小杀菌浓度(MIC)和最小杀菌浓度(MBC)Table 2 The MIC and MBC of Lactobacillus plantarum O2 fermentation to Phytophthora capsici
MIC 和MBC 分别表示最小抑制病原微生物繁殖或杀灭病原微生物生存的药物浓度,用于定量表示抑菌剂的抑菌或杀菌性能[24]。胡诚[25]采用液体二倍稀释法对轮枝镰孢菌孢子进行MIC 测定,研究表明当乳酸菌上清液含量在8 mg/mL及以上时可抑制轮枝镰孢菌菌丝生长,使液体培养基保持清澈透明。致病菌和乳酸菌的种类是影响MIC 的重要因素,此外,不同的试验方法对MIC 的结果也具有显著差异。因此可通过进一步纯化O2 上清液的抑菌物质,以达到低剂量且高效的抑菌效果。
2.6 抑菌谱测定
2.6.1 辣椒采后致病菌抑菌试验
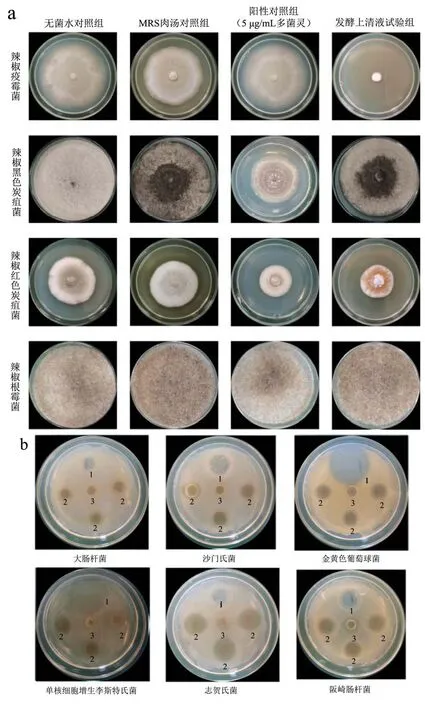
图8 植物乳杆菌O2 发酵上清液抑菌谱Fig.8 The antibacterial spectrum of Lactobacillus plantarum O2 fermentation supernatant
辣椒疫霉菌、辣椒红色炭疽菌、辣椒黑色炭疽菌以及根霉菌是辣椒采后常见的致病菌[26,27],本试验用以上四种辣椒采后致病菌为指示菌进行抑菌试验,结果由表3可知,O2 发酵上清液对4 种指示菌的菌落生长抑制率分别为87.18%、31.43%、0.00%和0.00%。其中,O2 发酵上清液对疫霉菌的生长抑制率最佳,优于阳性对照组,差异显著(p<0.05)。其次,O2 发酵上清液对红色炭疽菌的生长抑制率可达到阳性对照组抑菌效果,差异不显著(p>0.05)。O2 发酵上清液对于辣椒黑色炭疽菌和根霉菌无抑制效果,且根霉菌抑菌试验中四组试验结果差异不显著(p>0.05)。Cortes-Zavaleta 等[28]研究发现,植物乳杆菌NRRL B-4496 发酵上清液对红色炭疽菌的生长抑制率较低,25 ℃培养4 d 后仅为8.63%,远低于嗜酸乳杆菌(41.57%)对红色炭疽菌的抑制效果。与上述研究结果比较,本试验中O2 发酵上清液对红色炭疽菌展现出明显的抑菌效果。
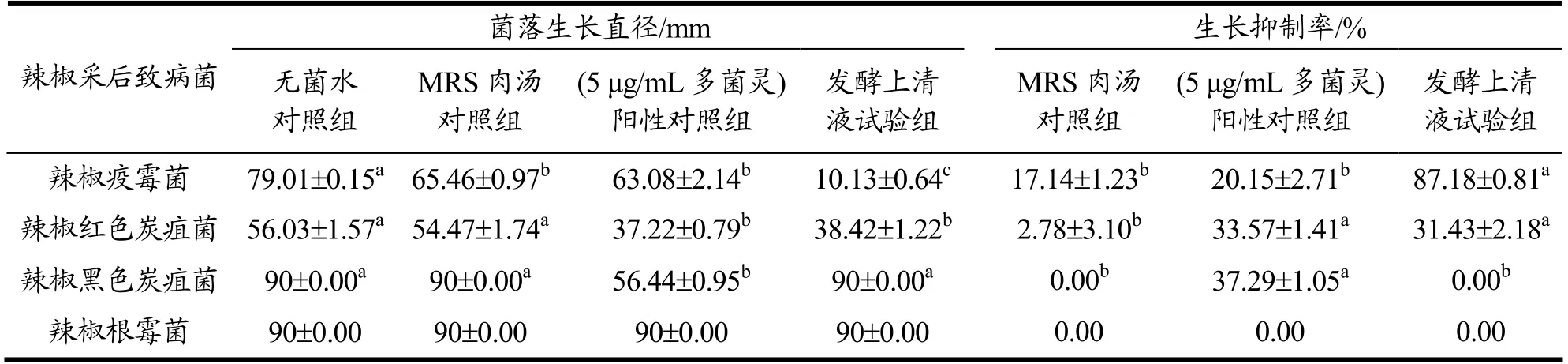
表3 植物乳杆菌O2 发酵上清液对辣椒采后致病菌抑菌谱Table 3 The antibacterial spectrum of Lactobacillus plantarum O2 fermentation supernatant on postharvest capsicum pathogens
2.6.2 常见食源性致病菌抑菌试验
大肠杆菌、沙门氏菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、和志贺氏菌是果蔬、乳制品及肉制品中的主要致病菌,可导致人体产生发热、呕吐以及腹泻等症状[29,30]。阪崎肠杆菌常见于婴幼儿配方奶粉及乳制品中,婴幼儿误食阪崎肠杆菌污染的乳制品后会引起婴儿脑膜炎、脓血症等病症[31]。本试验用以上六种食源性致病菌为指示菌进行抑菌试验,由表4可知,O2 发酵上清液对6 种指示菌的抑菌直径分别为11.06、10.06、13.56、14.38、18.40、13.20 mm。与对照组相比,试验组对六种食源性致病菌的抑菌试验结果均具有显著差异(p<0.05)。与阳性对照组相比较,在沙门氏菌和志贺氏菌抑菌试验中,试验组抑菌效果优于阳性对照组,差异显著(p<0.05);在大肠杆菌和阪崎肠杆菌抑菌试验中,试验组抑菌效果与阳性对照组差异不显著(p>0.05),证明O2 发酵上清液的抑菌物质对大肠杆菌、沙门氏菌、志贺氏菌和阪崎肠杆菌这四种食源性致病菌具有良好的抑制效果。
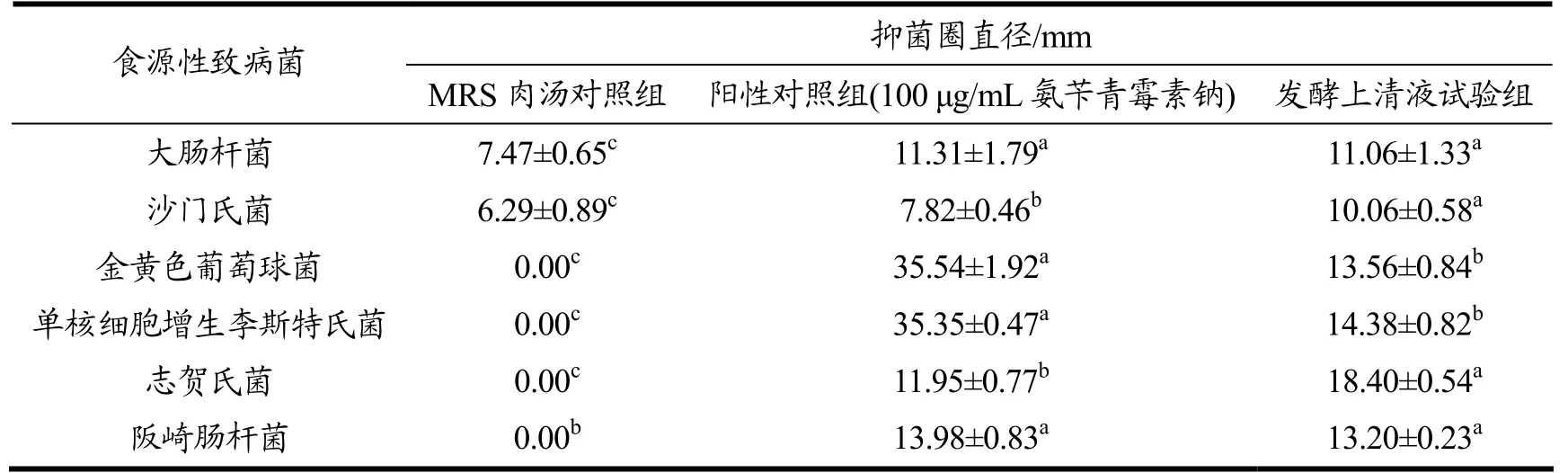
表4 植物乳杆菌O2 发酵上清液对常见食源性致病菌抑菌谱Table 4 The antibacterial spectrum of Lactobacillus plantarum O2 fermentation supernatant on common foodborne pathogens
Monika 等[32]对传统泡菜中分离到的15 株乳酸菌进行食源性致病菌抑菌试验,研究结果显示植物乳杆菌PKL-21 比粪肠球菌和肠系膜明串珠菌有更好的抑菌特性,对大肠杆菌、志贺杆菌和金黄色葡萄球菌的抑菌圈直径分别为13.1、12.86、8.3 mm。与上述研究结果相比较,O2 发酵上清液对大肠杆菌的抑菌效果稍差一些,但对志贺杆菌和金黄色葡萄球菌的抑菌效果更好,且抑菌谱更广。
3 结论
从自制发酵蔬菜中初步筛选出8 株乳酸菌,通过固体稀释法筛选出一株对辣椒疫霉菌具有明显抑菌效果的乳酸菌O2,其发酵上清液对辣椒疫霉菌抑制率为87.18%,经16S rDNA 和生理生化实验鉴定其为植物乳杆菌(Lactobacillus plantarum)。植物乳杆菌对O2过氧化氢酶、蛋白酶K、胰蛋白酶、胃蛋白酶不敏感,在温度40~120 ℃、15 W 紫外灯照射30~150 min 和pH 值<5 范围内抑菌物质稳定,对辣椒疫霉的MIC和MBC 分别为12.8 mg/mL 和25.6 mg/mL。此外,O2 发酵上清液对红色炭疽菌、大肠杆菌、沙门氏菌、志贺氏菌和阪崎肠杆菌具有显著抑制效果,后续可通过纯化鉴定深入研究该乳酸菌的抑菌成分及抑菌机理,进一步探究其对辣椒采后保鲜的效果,为开发辣椒采后防腐保鲜剂建立一定的基础。
