番石榴叶提取物对抵抗素诱导的人膝关节软骨细胞炎症的缓解作用及机制研究
2022-12-12王海斌
王海斌,王 颖,田 昕,时 亮,姬 乐
(1.陕西省人民医院骨科,陕西 西安 710068;2.陕西省中西医结合医院 西安市第五医院中医风湿科,陕西 西安 710082)
膝骨关节炎(Knee osteoarthritis,KOA)的发病率逐渐升高。研究[1]表明,软骨细胞死亡与细胞外基质的丢失是关节软骨退变和KOA病情发展的关键。其特征包括关节软骨进行性退变和关节炎症[2]。治疗KOA的方法有限,只能缓解疼痛或进行关节置换[3]。减轻软骨细胞凋亡和炎性反应是有效的KOA治疗手段[4]。微小RNA(microRNA,miR)-181a-5p对高糖诱导的肾小球系炎症反应具有明显的调控作用,提示其在细胞层面的炎症调控中的具有一定的作用[5]。抵抗素被认为是一种与炎症疾病相关的因子[6],具有独特的表达模式和生物学功能。 番石榴叶为番石榴属植物,研究[7]表明番石榴叶提取物(Guava leaf extract,GLE)具有抗水肿、抗炎、镇痛作用。本研究探讨GLE对抵抗素诱导的人膝关节软骨细胞炎症的缓解作用,并分析其机制。
1 材料与方法
1.1 细胞株 人膝关节软骨细胞,20%胎牛血清加入10% DMSO混合均匀,置于4 ℃冰箱保存于本实验室。
1.2 主要试剂 胎牛血清(货号:11091,美国Gibco公司);0.25%胰酶(货号:15050065,美国Gibco公司);青链霉素(货号:V900929-100ML,上海西格玛奥德里奇贸易有限公司);DEME培养基(货号:L110KJ,美国Gibco公司),酶联免疫吸附试验(ELISA)试剂盒(货号:BMS2279,美国赛默飞公司);CCK-8试剂盒(货号:C0037,上海碧云天公司);辣根过氧化物酶(HRP)标记IgG二抗(货号:31460,美国赛默飞公司);甘油醛-3-磷酸脱氢酶(GAPDH)抗体(货号:ab181602,英国Abcam公司);实时荧光定量PCR(RT-qPCR)试剂盒(货号:ZY90408,上海泽叶生物科技有限公司);BCA蛋白定量试剂盒(货号:P0011,上海碧云天公司)。
1.3 实验方法
1.3.1 细胞培养及实验分组:将本实验室保存的人膝关节软骨细胞培养在含有10%胎牛血清的DMEM培养液中,置于37 ℃、含5% CO2培养箱中培养[8]。当细胞长至80%左右时,用0.25%胰酶进行消化传代。将软骨细胞分为对照组、抵抗素组(使用500 ng/ml诱导分离的软骨细胞)及不同浓度(30、60、120 μg/ml)GLE组。
1.3.2 实时荧光定量PCR(RT-qPCR)检测细胞miR-181a-5p表达[9]:使用RNA提取试剂盒提取RNA,反转录后用生物系统Quant Studio 6 RT-PCR进行qRT-PCR,使用TBGreen®预处理ExTaqTMⅡ。扩增条件:95 ℃ 10 min;95 ℃ 10 s,40个循环;60 ℃ 34 s。试验重复3次。以2-ΔΔCt法测定靶基因mRNA相对表达水平。
1.3.3 CCK-8检测细胞增殖[10]:将软骨细胞接种于96孔板,贴壁后加入番石榴叶乙醇提取物进行处理。将细胞分为对照组、抵抗素组及30、60、120 μg/ml GLE组。培养24、48、72 h后在每孔中加入10 μl CCK-8试剂,37 ℃恒温培养箱中培养2 h后使用酶标仪检测490 nm波长处光密度(OD)值。
1.3.4 流式细胞术检测细胞凋亡[11]:将软骨细胞接种于96孔板,培养48 h后收集细胞,使用流式细胞仪检测细胞凋亡率。
1.3.5 Western blot检测各组细胞凋亡蛋白[12]:取对数生长期软骨细胞,37 ℃、5% CO2培养箱中培养48 h。将细胞分为对照组、抵抗素组及GLE(30、60、120 μg/ml)组。培养48 h后RIPA裂解缓冲液分离总蛋白。通过SDS-PAGE将蛋白裂解液分离,转移到PDVF膜上。室温下用脱脂牛奶封闭1 h,之后加入抗白细胞介素(IL)-6(1∶2000)、抗肿瘤坏死因子(TNF)-α(1∶2000)及抗TNF-β1(1∶2000)一抗。4 ℃下孵育过夜,用1×TBST冲洗膜,然后与HRP标记的IgG(1∶3000)二抗室温下孵育1 h。以GAPDH(1∶3000)作为内参。最后ECL曝光,扫膜仪成像。目的蛋白包括裂解形式的半胱氨酸蛋白酶蛋白-3(Cl-caspase-3)以及B淋巴细胞瘤-2(Bcl-2)、Bcl-2关联X蛋白(Bax)蛋白。
1.3.6 ELISA检测各组细胞炎症因子表达[13]:各组细胞相应孔中加入50 μl样本分析缓冲液,室温下孵育2 h,洗涤板5次。加入100 μl抗体工作液,室温下孵育1 h。加入100 μl酶结合物,避光孵育20 min。加入显色剂,避光孵育20 min。加入50 μl终止液,混匀后使用分光光度计测量450 nm处OD值,设置5个空白孔进行平行对照,根据标准曲线得到各指标浓度。 炎症因子包括白细胞介素6(IL-6)、肿瘤坏死因子(TNF)-α和TNF-β1。
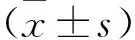
2 结 果
2.1 各组细胞miR-181a-5p表达水平比较 见图1。与对照组比较,抵抗素组软骨细胞miR-181a-5p表达水平升高(P<0.05)。与抵抗素组比较,60、120 μg/ml GLE组软骨细胞miR-181a-5p表达水平降低(均P<0.05)。后续实验研究GLE浓度选择为120 μg/ml。

注:与对照组比较,*P<0.05;与抵抗素组比较,#P<0.05
2.2 各组细胞增殖能力比较 见表1。与对照组比较,抵抗素组细胞OD值降低(P<0.05)。与抵抗素组比较,GLE组细胞OD值升高(P<0.05)。
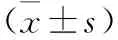
表1 各组细胞增殖能力比较
2.3 各组细胞凋亡率及凋亡相关蛋白表达比较 表2。与对照组比较,抵抗素组细胞凋亡率、Cl-caspase-3及Bax蛋白表达水平升高,Bcl-2蛋白表达水平降低(均P<0.05)。与抵抗素组比较,GLE组细胞凋亡率、Cl-caspase-3及Bax蛋白表达水平降低,Bcl-2蛋白表达水平升高(均P<0.05)。
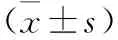
表2 各组细胞凋亡率及凋亡相关蛋白表达比较
2.4 各组细胞炎症因子水平比较 见表3。与对照组比较,抵抗素组IL-6、TNF-α及TNF-β1水平升高(均P<0.05)。与抵抗素组比较,GLE组IL-6、TNF-α及TNF-β1炎症因子水平降低(均P<0.05)。
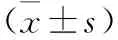
表3 各组细胞炎症因子水平比较
3 讨 论
KOA严重影响人们身体健康与生活质量,给人们甚至社会带来负担[14]。临床上,多是缓解关节疼痛,维持或改善关节功能,保护关节结构,但效果不理想[15]。患者常出现关节疼痛、肿胀和其他症状[16]。
研究[17]发现,番石榴叶水提物能有效抑制急性炎症。KOA也是炎症相关疾病,因此本研究也尝试使用番石榴叶乙醇提取物作用于人膝关节软骨细胞,试图发现一些KOA防治的新策略。研究表明,抵抗素水平与KOA严重程度、软骨磨损程度及滑膜炎严重程度呈现正相关[18]。同时,通过抵抗素水平的高低也能判断膝关节病变的严重程度,因此抵抗素在减缓膝关节炎症状方面具有一定作用。miRNA可以作为KOA有前景的生物标志物[19]。miR-181a-5p可以保护IL-β诱导的软骨细胞损伤[20]。本研究中,与对照组比较,抵抗素组软骨细胞miR-181a-5p表达水平升高;与抵抗素组比较,60、120 μg/ml GLE组软骨细胞miR-181a-5p表达水平降低,表明抵抗素可使人膝关节软骨细胞miR-181a-5p表达水平升高,而GLE可降低降低抵抗素的这一作用。
KOA多发生于中老年人群中,疼痛、肿胀、限制性活动等是其主要的临床症状[21],其中的炎症因子可以通过多种方式刺激级联反应,触发KOA[22]。TNF-β1可以参与多种疾病的发生与发展[23]。宫凤艳[24]研究发现,TNF-β1发挥其调节细胞外基质成分沉积的作用,其表达水平升高时可加重肾脏损害。IL-6和TNF-α也是促进炎症发展的主要因子。本研究结果表明,抵抗素组IL-6、TNF-α及TNF-β1炎症因子水平较对照组升高,GLE组IL-6、TNF-α及TNF-β1炎症因子水平较抵抗素组降低,表明GLE与抵抗素可能通过调节炎症因子水平调控人膝关节软骨细胞免疫应答。
Caspase-3是细胞凋亡的执行因子[25]。Bc1-2是抗凋亡蛋白,细胞凋亡信号会引起Bc1-2表达量变化。Bc1-2可进一步调节激活Caspase-3,诱导细胞凋亡[26]。本研究证实,与对照组比较,抵抗素组细胞凋亡率、Cl-caspase-3及Bax蛋白表达水平升高,Bcl-2蛋白表达水平降低;与抵抗素组比较,GLE组细胞凋亡率、Cl-caspase-3及Bax蛋白表达水平降低,Bcl-2蛋白表达水平升高。这些结果提示GLE与抵抗素对细胞的调控是通过对应的关键蛋白来完成的。但是细胞凋亡与增殖相关的靶点与通路有许多,本研究只是着眼于几个标志性蛋白,具有一定的局限性,因此后续会从高通量入手,更广泛地筛选GLE的作用通路与对应靶点,以进行更深入的研究。
综上所述,GLE可缓解抵抗素诱导的人膝关节软骨细胞炎症,其机制可能与降低miR-181a-5p表达有关。但本研究不足之处在于,对治疗机制的验证不够充分,后续加强完善,做更深层次的研究。
