裸鼠肺腺癌移植瘤组织中缺氧诱导因子-1α蛋白、血清蛋白和淋巴管内皮细胞透明质酸受体1蛋白表达及意义
2022-12-12孔凡龙信洪武美国白玉勤
孔凡龙,吴 宝,信洪武(美国),白玉勤
(1.锦州医科大学,辽宁 锦州 121001;2.赤峰学院基础医学院组织学与胚胎学教研室,内蒙古 赤峰 024000;3.长江大学医学部分子医学中心肿瘤学研究室,湖北 荆州 434023;4.赤峰学院医学院分子医学中心,内蒙古 赤峰 024000;5.赤峰市肿瘤医院 赤峰学院第二附属医院病理科,内蒙古 赤峰 024000)
在动物切除组织的标本制作过程中,传统方法制备标本时容易产生人工假象[1]。活体冷冻技术(In vivo cryotechnique,IVCT)是日本山梨大学野伸一教授所研究开发的技术,反映的是活体状态下细胞和组织的形态、结构和功能,克服了传统标本制作方法中缺血、缺氧所造成的缺陷[2]。我们第一次清晰地观测到血清蛋白表达的分布情况,是应用IVCT技术在异种移植人非小细胞肺癌(Non-small cell lung cancer,NSCLC)模型上,提出了不同分子量的血清蛋白在细胞外基质的表达不同,阐明了功能性血管与血清蛋白、血管生成因子的密切关系[3-4]。据文献[5]报道,缺氧诱导因子-1α(Hypoxia-inducible factor-1α,HIF-1α)蛋白表达与NSCLC患者血管生成及预后不良密切相关。肿瘤细胞蛋白表达与肿瘤细胞异质性有关[6]。但是我们的前期研究证明,在大细胞肺癌移植瘤组织中HIF-1α蛋白表达与功能性和非功能性血管数目无关,而与肿瘤细胞异质性有关。为了进一步研究肺腺癌移植瘤组织中HIF-1α蛋白与血管生成和侵袭转移关系,开展了本研究。
1 材料与方法
1.1 实验动物 购自日本SLC株式会社的7~8周裸鼠(BALB/c-nu/nu)20只。动物模型建立和饲养在日本山梨大学动物实验室的SPF条件下进行。本实验由日本山梨大学动物保护与使用委员会批准同意。
1.2 肺癌细胞系 A549细胞株由日本东北大学生物医学研究所提供[7]。在日本山梨大学医学部解剖组胚室的细胞培养室,以含20%小牛血清的RPMI-1640培养液对A549细胞进行培养[3-4]。
1.3 主要试剂 北京中杉金桥生物技术有限公司生产的羊抗鼠血清蛋白(批号:ZA16388和20062916)、兔抗人HIF-1α(批号:20101991)、显色剂二氨基联苯胺(DAB)试剂盒(批号:221020513);英国Abcam公司生产的兔抗鼠淋巴管内皮细胞透明质酸受体1(Lymphatic vessel endothelial hyaluronic acid receptor-1,LYVE-1)单克隆抗体(批号:615-478-250);美国Invitrogen公司生产的细胞核TOPRO-3染色试剂(批号:815-361-120);与第一抗体种属匹配的第二抗体是Alexa 488和Alexa 546标记的兔抗羊IgG(批号:645-320-111和981-456-715),购自美国Invitrogen公司;福州迈新生物技术开发公司生产的羊抗兔IgG(批号:220324S409b)。
1.4 肿瘤移植 收集传代培养后的A549细胞约5×106个,接种到裸鼠背部皮下。接种后每周2次使用电子天平称量裸鼠体重,观察裸鼠进食、饮水以及肿瘤的生长情况,应用游标卡尺测量肿瘤长径和短径并记录。肿瘤体积为1000 mm3时准备制备标本[4]。
1.5 标本制备 IVCT制备标本顺序[4]:乙醚麻醉裸鼠→背部皮肤剪开→呈现移植瘤→移植瘤被液氮里制冷的异戊烷-丙烷冷冻液(-193 ℃)瞬间冷冻固定→移植瘤在液氮里用牙科电钻取下→干冰(-80 ℃)预冷的2%多聚甲醛-丙酮液冷冻置换[2]。冷冻置换逐渐升温顺序:2%多聚甲醛-丙酮液的冷冻标本-193 ℃→-80 ℃→-20 ℃→-10 ℃→-4 ℃→室温。聚乙二醇和聚乙烯醇的水溶性混合物和石蜡包埋移植瘤组织,用冰冻切片机和石蜡切片机进行切片,染色后在光学和荧光显微镜下观察。
1.6 HE与免疫组织化学(IHC)染色 含MAS的黏附载玻片上黏附3 μm厚度的连续石蜡切片。一部分切片进行HE染色,一部分切片用于IHC染色。IHC染色采用ABC法。IHC染色顺序:脱蜡(二甲苯)→水化(梯度乙醇)→PBS清洗→1%过氧化氢阻断内源性过氧化物酶活性→2%鱼明胶溶液封闭→PBS漂洗3次→分别滴加一抗羊抗鼠血清白蛋白(Albumin)、免疫球蛋白M(IgM)、HIF-1α和LYVE-1单克隆抗体→4 ℃冰箱孵育(过夜)→PBS液3次冲洗→羊抗兔IgG或者Alexa 488、546二抗→滴加细胞核染色用的TOPRO-3试剂→室温孵育1 h。用苏木精和甲基绿染色DAB显色的细胞核,水化(梯度乙醇)后二甲苯透明,中性树胶封片,显微镜下观察。每次染色均采用空白对照(PBS)和自身阳性对照。阳性对照是在同一切片上与试验对象比较,血管腔和间质中的Albumin应为阳性,免疫细胞质或血管腔中的IgM应为阳性,HIF-1α在肿瘤细胞膜浆、核内应为阳性,LYVE-1在淋巴管内皮细胞浆应为阳性。判断标准:根据IHC染色程度,分为强阳性()、中等阳性()和弱阳性(+),无染色为阴性(-)。在同一切片中统计分析A549肺腺癌细胞异种移植瘤组织(包括血管、肿瘤基质和肿瘤细胞外基质)中的Albumin和IgM蛋白表达水平。癌细胞细胞核或细胞质中的HIF-1α蛋白呈棕色颗粒状染色为阳性,无染色为阴性。淋巴管内皮细胞胞浆或细胞膜中LYVE-1蛋白呈棕色为阳性,未染色为阴性。血管腔内Albumin和IgM蛋白呈中-强度阳性,此血管周围细胞外基质IgM蛋白呈阴性,判定为功能性血管。LYVE-1蛋白在内皮细胞呈阳性则判定为淋巴管。计数功能性血管和淋巴管时,用低倍数物镜观察,再用高倍数物镜随机数10个视野,计算平均值,计算功能血管和淋巴管密度(个/HPF,HPF为高倍视野)。
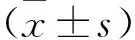
2 结 果
2.1 A549移植瘤组织HE染色和HIF-1α蛋白IHC染色结果 见图1。在HE切片上,腺癌浸润组织中可见扩张的血管和血管内的红细胞。在IHC切片上,HIF-1α蛋白阳性细胞在肿瘤周围和间质某细胞浆呈棕黄色着色,而肿瘤细胞无着色,即HIF-1α蛋白在侵袭部位和非侵袭部位肿瘤细胞中均呈阴性表达。

图1 A549移植瘤组织HE染色(A)和HIF-1α蛋白IHC染色(B)结果(×200)
2.2 A549移植瘤组织Albumin和IgM蛋白染色结果 见图2、3。Albumin在血管、癌周纤维结缔组织和细胞外基质中呈强阳性至中度阳性。在侵袭部位,肿瘤周围血管和结缔组织中的IgM蛋白呈中度阳性,而癌细胞的细胞外基质中为阴性;在非侵袭性组织部位,血管和肿瘤细胞外基质中IgM蛋白呈强阳性至中阳性。此外,在双免疫荧光染色中,Albumin在血管、癌周围纤维结缔组织和细胞外基质中呈中强阳性(绿色),IgM蛋白在血管和癌周围纤维结缔组织中呈中阳性(红色),在癌周围细胞外基质中呈阴性。在A549移植瘤侵袭组织内部,IgM蛋白除了在免疫细胞浆呈强阳性外,在血管腔内与Albumin蛋白共同阳性表达(功能性血管)。半定量分析显示,每标本同一部位连续10张切片的A549移植瘤侵袭组织Albumin和IgM蛋白呈阳性的功能性血管密度高于非侵袭组织[(14.80±1.03)个/HPF与(3.50±0.53)个/HPF,P<0.01]。
2.3 A549移植瘤组织LYVE-1蛋白染色结果 见图4。LYVE-1蛋白在肺腺癌侵袭组织和非侵袭组织淋巴管内皮细胞浆呈深棕黄色颗粒状着色,为强阳性表达。LYVE-1蛋白呈强阳性的淋巴管呈不规则形状,管壁薄,内含淋巴液和淋巴细胞。LYVE-1蛋白还在某梭形细胞浆呈浅棕黄色颗粒状着色,为弱阳性表达。半定量分析结果显示,每标本同一部位连续10张切片的A549移植瘤侵袭组织LYVE-1蛋白呈阳性的淋巴管密度高于非侵袭组织[(25.90±4.43)个/HPF与(3.60±0.52)个/HPF,P<0.01]。
3 讨 论
局部侵袭是影响恶性肿瘤如甲状腺乳头状癌[8]、肺腺癌[9]、结直肠癌[10]、膀胱尿路上皮癌[11]等患者预后的主要病理基础。在基础医学和临床医学切除的组织制备石蜡或冷冻切片标本过程中,由于血流中断或标本的化学固定和乙醇脱水等步骤会导致组织收缩、分子易位和抗原封蔽等人工假象的产生[12]。IVCT技术能瞬间冷冻固定器官、组织、细胞,防止传统方法制备标本的人工假象[1-4]。我们首次通过异种移植A549细胞模型,明确IVCT制备的NSCLC标本HE染色侵袭性组织的组织学特征,并结合Albumin、IgG1和IgM免疫组化染色分析[13],得出Albumin、IgG1和IgM蛋白在非小细胞肺癌侵袭性组织中的表达及分布差异明显的结论,进一步说明在肿瘤细胞外基质的Albumin(分子量约67 kDa)、IgG1(分子量约170 kDa)和IgM(分子量约9700 kDa)蛋白表达可能与其分子量密切相关,反映了非小细胞肺癌侵袭组织中肿瘤细胞之间复杂的相互作用引起的局部微环境的变化。该研究[13]还表明,A549异种移植瘤组织中细胞外基质Albumin、IgG1和IgM的免疫组化染色分布与VEGF和表皮生长因子受体(EGFR)的表达无关。另外,还报道了EphA7蛋白表达与肺腺癌侵袭进展无明显关系,Ki67蛋白表达可能会影响肺腺癌侵袭[9]。本研究进一步证明了A549细胞株移植瘤非侵袭组织血管、肿瘤间质、细胞外基质Albumin和IgM蛋白均阳性表达,与Albumin和IgM蛋白分子量无关。
HIF-1α是第一个被证实参与调控VEGF转录的因子。HIF-1α是HIF-1的活性亚基,是一种异源二聚体(bHLH-PAS),包含碱性螺旋-环-螺旋结构和PAS(Per/Amt/Sim)结构,与炎症和肿瘤血管生成等相关[14-15]。HIF-1α蛋白表达与肺鳞状细胞癌和腺癌(非小细胞肺癌)组织的血管形成和VEGF蛋白表达相关[5]。但我们研究发现在大细胞肺癌移植瘤组织中HIF-1α蛋白与血清蛋白、VEGF、Ki67蛋白表达无关,且与功能性血管数量多少无关[6]。为了进一步研究分析HIF-1α蛋白在移植瘤肺腺癌组织的功能性血管和淋巴管生成及侵袭的关系,我们开展了本次研究。
在本研究中,通过HIF-1α蛋白免疫组化分析发现A549移植瘤侵袭和非侵袭组织癌细胞均阴性表达,肿瘤间质淋巴细胞和巨噬细胞HIF-1α蛋白阳性表达,这与文献[16]报道结果相同。我们推断,HIF-1α蛋白阴性表达可能与肿瘤细胞异质性有关,但是与A549移植瘤组织血清蛋白相关的功能性血管分布无关。移植瘤侵袭组织的功能性血管分布可能与血管结构、血清蛋白分子量和电荷、肿瘤微环境等有关[1,3-4]。
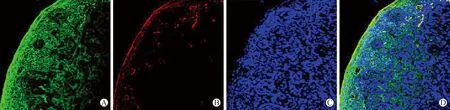

注:图A为A549移植瘤组织HE染色结果(×100);图B为LYVE-1蛋白在淋巴管内皮细胞和某梭形细胞浆或细胞膜呈棕黄色颗粒状着色(×100);图C为LYVE-1蛋白在侵袭组织组织淋巴管内皮细胞和某梭形细胞浆活细胞膜呈棕黄色颗粒状着色(×600);图D为LYVE-1蛋白在非侵袭组织淋巴管内皮细胞和某梭形细胞浆或细胞膜呈棕黄色强着色(×600)
研究[4,17]表明,肺腺癌侵袭组织的功能性血管密度高于非侵袭组织,这可能与NSCLC VEGF蛋白表达相关,VEGF蛋白表达促进了肿瘤周边部位功能性血管生成,并为肿瘤细胞侵袭和转移奠定基础。
除了功能性血管生成外,淋巴管生成也是肿瘤细胞侵袭和转移所必需的。Skobe等[18]和沈小玥等[19]利用淋巴管内皮细胞的特异性标志物LYVE-1在乳腺癌、肺腺癌淋巴管增生和淋巴管不同分布进行了研究。我们利用IVCT技术对小鼠肠系膜淋巴结内皮细胞LYVE-1蛋白进行了免疫组织化学分析,首次发现了淋巴结边缘窦内侧和髓窦内皮细胞LYVE-1蛋白阳性表达,但是边缘窦外侧内皮细胞LYVE-1蛋白呈阴性表达[20]。本研究利用IVCT技术结合LYVE-1蛋白免疫组织化学染色技术研究了肺腺癌移植瘤侵袭和非侵袭组织中LYVE-1蛋白的表达,结果发现肺腺癌侵袭组织LYVE-1蛋白阳性的淋巴管密度高于非侵袭组织,该结果与沈小玥等[19]研究结果一致。并且,我们推断该结果可能与VEGF蛋白表达有关[4]。
综上所述,HIF-1α蛋白表达与肺腺癌侵袭和功能性血管、淋巴管密度无关,但是功能性血管和淋巴管密度与肺腺癌的侵袭、发展密切相关。
