丁苯酞联合美多芭对帕金森病伴抑郁模型小鼠黑质纹状体Ⅱ型髓系细胞触发受体及小胶质细胞炎症标志物表达的影响
2022-12-12杨浩辉范少凯毛文静王雅楠吴小坤
刘 斌,杨浩辉,任 伯,范少凯,毛文静,王雅楠,吴小坤
(华北理工大学附属医院神经内一科,河北 唐山 063000)
帕金森病(Parkinson’s disease,PD)是临床上常见于中老年的中枢神经系统变性疾病,以运动迟缓、静止性震颤、肌强直和姿势步态障碍等运动症状为主要表现,常伴发抑郁、焦虑、认知障碍等非运动症状,其中抑郁症状的发生率高达76%[1]。抑郁的发生会加大帕金森病患者的身心痛苦,还会导致帕金森病患者的临床治疗效果降低[2]。帕金森病伴抑郁症状的病因及发病机制十分复杂,可能是多种因素共同参与的结果,除了神经解剖因素、α-突触核蛋白异常聚集和错误折叠、神经递质因素,有研究[3-4]报道炎症反应与帕金森病的发生和发展有密切关系。炎症反应也与抑郁的发生和发展有密切关系[5]。Ⅱ型髓系细胞触发受体(Triggering receptor expressed on myeloid cells 2,TREM2)可调节小胶质细胞介导的凋亡神经元吞噬清除和炎症反应,是小胶质细胞中表达量最高的受体之一[6]。目前已经证实TREM2在阿尔茨海默病模型中可以促进小胶质细胞向M2活化从而保护神经细胞[7],但TREM2在帕金森病伴抑郁发病机制中的作用尚不清楚。丁苯酞(L-3-丁基苯酞,L-3-n-butylphthalide,L-NBP)是一种小分子化合物,在抗炎及抗氧化方面具有重要作用[8]。研究[9]表明丁苯酞可通过抗氧化应激而挽救多巴胺能神经元,进而改善帕金森病的相关临床症状,但确切机制尚不清楚。本研究应用制备的帕金森病伴抑郁(Parkinson’s disease depression,PDD)小鼠模型,观察丁苯酞联合美多芭对帕金森病伴抑郁模型小鼠黑质纹状体TREM2及小胶质细胞M1型炎症标志物[白细胞介素-1β(Interleukin-1β,IL-1β)和肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)]及M2型炎症标志物[IL-10和精氨酸酶-1(Arginase-1,Arg-1)]表达的影响,探讨丁苯酞联合美多芭治疗帕金森病伴抑郁的作用机制。
1 材料与方法
1.1 实验动物 雄性健康成年C57BL/6小鼠40只由北京华阜康生物科技股份有限公司提供,10~12周龄,体重20~30 g,生产许可证号:SCXK(京)2020-0004。小鼠在SPF 级清洁动物实验室(湿度45%~55%,温度18 ℃左右)饲养1周,遵照实验动物3R原则给予人道关怀。动物实验方法研究经由华北理工大学动物实验伦理委员会审批通过(审批号:2020197)。
1.2 主要试剂 1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)生产于中国阿拉丁公司;鼠抗TREM2试剂盒生产于Affinity公司;IL-1β、TNF-α、IL-10、Arg-1试剂盒生产于Affinity公司;美多芭(国药准字H10930198)生产于上海罗氏制药有限公司;丁苯酞胶囊(国药准字H20050299)生产于石药集团恩必普药业有限公司。
1.3 实验方法
1.3.1 动物分组:随机将40只C57BL/6成年雄性小鼠分为正常对照组(对照组)、帕金森病伴抑郁模型组(模型组)、美多芭治疗组和丁苯酞联合美多芭治疗组,每组10只。
1.3.2 模型制备:MPTP腹腔注射(30 mg/kg×7 d)制备帕金森病小鼠模型,根据帕金森病震颤麻痹评分标准筛选出2~3分帕金森病模型小鼠[10]。帕金森病小鼠模型制备成功后,采用慢性不可预知温和应激刺激诱导产生帕金森病伴抑郁小鼠模型,刺激包括禁食、禁水、冷水游泳、热烘、潮笼、昼夜颠倒、夹尾、束缚等,各项刺激随机安排,每种刺激重复2~3次,刺激时间为21 d。通过强迫游泳测试、悬尾测试和糖水偏好实验对小鼠的抑郁样行为进行评价[11],筛选出符合要求的帕金森病伴抑郁模型小鼠进行后续实验。
1.3.3 给药方法:帕金森病伴抑郁小鼠模型制备成功后,给予美多芭治疗组小鼠美多芭(6.25 mg/kg)灌胃治疗,1次/d,持续1周;给予丁苯酞联合美多芭治疗组小鼠美多芭(6.25 mg/kg)和丁苯酞(120 mg/kg)灌胃治疗,1次/d,共治疗1周。对照组和模型组给予0.9%氯化钠溶液1 ml灌胃,1次/d,共1周。
1.3.4 免疫组化检测α-突触核蛋白阳性表达情况:采用免疫组化定性分析黑质纹状体内α-突触核蛋白阳性表达情况,严格按说明书要求操作。α-突触核蛋白阳性细胞计数标准:目镜400倍下,选取各组小鼠黑质致密部(SNC)3个不重叠视野,核呈浅蓝色或紫蓝色,胞浆呈棕黄色为阳性细胞,记录阳性细胞数量。
1.3.5 酶联免疫吸附(ELISA)法测定5-羟色胺(5-HT)含量:样品称重后加入PBS缓冲液,缓冲液和组织比例为1∶10,充分混合后冰上裂解半小时,在4 ℃环境下离心15 min,获得上部清液。根据试剂盒说明书要求设标准品孔、空白孔以及待测样品孔。标准品孔中每孔加入100 μl,待测样品孔分别加入待测样品和样品稀释液50 μl,接着在各孔中分别加入生物素化抗体工作液50 μl,常温环境下孵育2 h,清洗并晾干。再在各孔分别加入100 μl酶结合工作液,常温孵育0.5 h,清洗并晾干。然后在各孔中加入100 μl显色剂,注意避光储存,在室温环境下静置20 min。最后在各孔中加入100 μl终止液。检测各孔的光密度(OD)值,波长为450 nm,参考标准曲线换算标准计算样品浓度。
1.3.6 免疫印迹法(Western blot)检测相关蛋白表达情况:操作前1 d小鼠禁食不禁水。待行为检测完毕后,立即将小鼠断头处死,取出整个大脑置于冰上,立即分离出实验小鼠的黑质纹状体组织,液氮速冻,-80 ℃条件下保存待测。将小鼠黑质纹状体组织剪成小块,加入蛋白裂解液,提取蛋白质,离心提取上清液,取50 μg上清液用于SDS-PAGE电泳,随后将蛋白转至PVDF膜上。用10%脱脂奶粉室温封闭2 h,加1∶1000相关一抗,以β-actin为内参,4 ℃ 孵育过夜后TBST缓冲盐溶液洗涤,根据一抗种属加入相应二抗,室温孵育1 h 。ECL化学发光法检测蛋白条带并拍照。 目的蛋白包括TREM2、IL-1β、TNF-α、IL-10和Arg-1。
1.3.7 聚合酶链式反应(PCR)检测相关基因mRNA表达情况:采用TRIzol试剂从小鼠黑质纹状体组织中提取总mRNA。以提取的总mRNA为模板反转录合成为cDNA,采用SYBR Green实时PCR预混试剂盒进行反转录酶 RT-qPCR分析。目的基因特异性引物序列:IL-1β正向为5’-GCAGTGGTTCGAGGCCTAAT-3’,反向为5’-GCTGCTTCAGACACTTGCAC-3’;TNF-α正向为5’-CAGGCGGTGCCTATGTCTC-3’,反向为5’-TGGATGCTCATCAGGACAG-3’;Arg-1正向为5’-TTGGCTTGCTTCGGAACTCA-3’,反向为5’-CATTGTTGCCCAGGTTCAGC-3’;IL-10正向为5’-CAGTACAGCCGGGAAGACAA-3’,反向为5’-AGGCTTGGCAACCCAAGTAA-3’。 应用Nanodrop测量小鼠黑质纹状体组织RNA样品在260~280 nm的吸收值,计算RNA纯度和浓度。
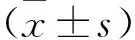
2 结 果
2.1 各组小鼠黑质纹状体α-突触核蛋白检测结果 见图1。对照组小鼠黑质纹状体中有极少量α-突触核蛋白表达,模型组小鼠黑质纹状体部位可见大量α-突触核蛋白异常积聚;美多芭治疗组及丁苯酞联合美多芭治疗组α-突触核蛋白阳性表达明显减少,染色变浅,以丁苯酞联合美多芭治疗组减少更明显。

对照组 模型组 美多芭治疗组 丁苯酞联合美多芭治疗组
2.2 各组小鼠黑质纹状体5-HT含量比较 见表1。与对照组比较,模型组5-HT含量明显减低(P<0.05);与模型组比较,美多芭治疗组及丁苯酞联合美多芭治疗组5-HT含量明显增加,以丁苯酞联合美多芭治疗组增加更明显(均P<0.05)。

表1 各组黑质纹状体组织5-HT含量比较(μg/L)
2.3 各组小鼠黑质纹状体TREM2蛋白相对表达水平比较 见表2。与对照组比较,模型组TREM2明显减低(P<0.05);与模型组比较,美多芭治疗组及丁苯酞联合美多芭治疗组TREM2明显增加,以丁苯酞联合美多芭治疗组增加更明显(均P<0.05)。
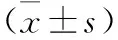
表2 各组小鼠黑质纹状体TREM2蛋白相对表达水平比较
2.4 各组小鼠黑质纹状体M1型促炎因子和M2型抑炎症因子蛋白相对表达水平比较 见表3。与对照组比较,模型组M1型促炎因子IL-1β和TNF-α蛋白表达升高,M2型抑炎因子IL-10和Arg-1蛋白表达明显下降(均P<0.05);与模型组比较,美多芭治疗组及丁苯酞联合美多芭治疗组M1型促炎因子IL-1β和TNF-α蛋白表达下降,M2型抑炎因子IL-10和Arg-1蛋白表达增加,以丁苯酞联合美多芭治疗组变化更明显(均P<0.05)。
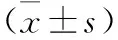
表3 各组小鼠黑质纹状体M1型促炎因子和M2型抑炎症因子蛋白相对表达水平比较
2.5 各组小鼠黑质纹状体M1型促炎症因子和M2型抑炎症因子mRNA相对表达水平比较 见表4。与对照组比较,模型组M1型促炎因子IL-1β和TNF-α mRNA表达升高,M2型抑炎因子IL-10和Arg-1 mRNA表达明显下降(均P<0.05);与模型组比较,美多芭治疗组及丁苯酞联合美多芭治疗组M1型促炎因子IL-1β和TNF-α mRNA表达下降,M2型抑炎因子IL-10和Arg-1 mRNA表达增加,以丁苯酞联合美多芭治疗组变化更明显(均P<0.05)。
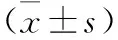
表4 各组小鼠黑质纹状体M1型促炎症因子和M2型抑炎症因子mRNA相对表达水平比较
3 讨 论
帕金森病主要由黑质纹状体致密部中多巴胺能神经元逐渐丢失、α-突触核蛋白异常聚集和错误折叠引起[12-13]。帕金森病患者常伴抑郁,但其发病机制目前尚不明确。研究[14]发现主要可能与线粒体功能障碍、氧化应激及慢性神经炎症等因素造成多巴胺能及5-HT能神经元变性出现缺失有关。本研究结果显示,模型组小鼠黑质纹状体可见大量α-突触核蛋白表达及异常积聚,模型组5-HT含量明显减低。此结果一方面表明α-突触核蛋白异常积聚和5-HT能神经元变性与帕金森病伴抑郁密切相关,另一方面也验证了帕金森病伴抑郁模型制备成功的可靠性。
左旋多巴“替代疗法”是治疗帕金森病最基本、最主要的方法,但左旋多巴往往只能缓解或改善临床症状。随着病程进展会出现疗效减退,需增加剂量,不良反应也将随之增加,甚至患者的生活质量受到严重影响。因此,寻找能够增强左旋多巴疗效且能减轻其不良反应的药物是防治帕金森病的探讨热点。丁苯酞是从芹菜和西洋菜种子中提取分离出来的一种小分子化合物,目前临床上主要用于治疗急性缺血性脑梗死,它可通过多种机制来保护神经细胞[15-18]。丁苯酞可通过抗氧化应激挽救多巴胺能神经元,具有神经保护作用,可改善帕金森病临床相关运动症状[19-20]。丁苯酞对抑郁症状也有一定的疗效[21],文献资料[22]表明经丁苯酞治疗后,帕金森病合并抑郁症状患者的汉密尔顿抑郁量表评分较治疗前明显下降。我们的前期实验研究[23]也证明丁苯酞能够减轻帕金森病伴抑郁小鼠的抑郁行为。本研究结果发现,与模型组比较,美多芭治疗组及丁苯酞联合美多芭治疗组α-突触核蛋白阳性表达明显减少,染色变浅,5-HT含量明显增加,以丁苯酞联合美多芭治疗组减少更明显,表明丁苯酞联合美多芭治疗可以减少α-突触核蛋白的异常积聚,增加5-HT含量,对神经元具有保护作用。
免疫炎症反应是导致帕金森病、阿尔茨海默病等诸多神经系统退行性疾病的重要危险因素[24-25]。神经炎症反应主要由小胶质细胞驱动,活化的小胶质细胞被认为是促炎因子的主要来源[26]。TREM2是免疫球蛋白超家族的一种跨膜蛋白,其作为一个具有免疫调节作用的受体,主要在中枢神经系统的小胶质细胞上表达[27]。TREM2参与小胶质细胞的增殖、运输、吞噬作用及炎症反应,在抑制神经炎症方面有重要作用[28]。我们采用Western blott检测帕金森病伴抑郁小鼠黑质纹状体中TREM2的含量,结果显示:与对照组比较,模型组TREM2表达明显减低;与模型组比较,美多芭治疗组及丁苯酞联合美多芭治疗组TREM2表达明显增加,以丁苯酞联合美多芭治疗组增加更明显。此结果表明丁苯酞联合美多芭能促进帕金森病伴抑郁模型小鼠黑质纹状体中TREM2表达的增加。
当神经系统功能紊乱时,小胶质细胞将被激活,激活后的小胶质细胞将发生一系列形态和功能转变,包括吞噬功能增强、细胞因子分泌增加[29]。小胶质细胞活化可分为两个表型:具有促炎作用的M1表型,其主要炎症标志物包括IL-1β、TNF-α等,对神经系统具有破坏作用;具有抗炎作用的M2表型,其主要炎症标志物包括IL-10、Arg-1等,参与神经修复及免疫抑制等过程,对神经细胞具有保护作用[30-31]。M1型及M2型炎症标志物的表达可以反映小胶质细胞的激活情况。我们采用Western blot和PCR分别检测帕金森病伴抑郁模型小鼠黑质纹状体中小胶质细胞的IL-1β、TNF-α、IL-10、Arg-1的表达情况,结果均显示:与对照组比较,模型组小胶质细胞M1型促炎因子IL-1β和TNF-α表达明显升高,M2型抑炎因子IL-10和Arg-1表达明显下降;与模型组比较,美多芭治疗组及丁苯酞联合美多芭治疗组M1型促炎因子IL-1β和TNF-α表达下降,M2型抑炎因子IL-10和Arg-1表达增加,以丁苯酞联合美多芭治疗组更明显。
综上所述,丁苯酞联合美多芭能抑制帕金森病伴抑郁模型小鼠黑质纹状体小胶质细胞的炎症反应,保护神经元,从而改善帕金森及抑郁症状。
