沙利度胺对类风湿关节炎滑膜细胞及外周血单个核细胞分泌肿瘤坏死因子-α和血管内皮生长因子的影响及机制研究
2022-12-12何家锐孙红兵刘剑平
杨 婧,何家锐,孙红兵,刘剑平
(1.南充市中心医院 川北医学院第二临床学院风湿免疫科,四川 南充 637000;2.南江县人民医院中医内分泌科,四川 南江 635600;3.川北医学院附属医院风湿免疫科,四川 南充 637000)
类风湿关节炎(Rheumatoid arthritis,RA)是一种慢性自身免疫性疾病,以对称性多关节肿痛为主要表现,基本病理变化为关节滑膜的慢性炎症、血管翳形成,可导致关节软骨和软骨下骨的破坏,最终引起关节畸形和功能丧失,使患者丧失劳动力,给家庭和社会造成了极大的经济负担。RA的发病机制十分复杂,越来越多的研究[1-2]证明多种炎症细胞因子参与其中并贯穿RA始终。研究[3-5]发现,在RA病变关节中有大量炎症细胞浸润,可释放血管内皮生长因子(Vascular endothelial growth factor,VEGF)、白细胞介素(Interleukin,IL)-1、IL-6、IL-17、IL-37和肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)等多种细胞因子,促进滑膜细胞增殖、滑膜血管增生及关节破坏。目前,已研制出了多种靶向细胞因子类的生物制剂用于治疗RA,靶向药物可通过抑制RA的核心致炎因子或关键免疫细胞功能达到缓解RA病情的作用。其中,TNF-α抑制剂是现有证据较为充分、应用最早且最常用的治疗RA的生物制剂,包括依那西普/注射用重组人Ⅱ型TNF受体抗体融合蛋白、英夫利西单抗、阿达木单抗、戈利木单抗等[6]。生物制剂的使用是RA治疗史上的一个里程碑,但这类药物价格昂贵,绝大多数患者不能坚持使用。沙利度胺(Thalidomide,THD)是一种常用的抗血管生成剂和免疫调节剂,可以通过调节机体免疫反应抑制TNF-α、VEGF等的释放,发挥其抗炎作用[7]。大量临床研究[8-9]表明,THD治疗RA疗效确切,但其具体作用机制尚不明确。本研究通过观察THD对RA患者成纤维样滑膜细胞(Fibroblast-like synoviocytes,FLS)增殖的影响以及对FLS和外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs)分泌TNF-α和VEGF的影响,探讨其治疗RA的可能机制。
1 材料与方法
1.1 实验细胞标本 FLS标本取自本院明确诊断的7例RA患者的膝关节腔积液。PBMCs标本取自本院明确诊断的20例RA患者。所有患者诊断均符合2010年美国风湿病协会(ACR)和欧洲抗风湿病联盟(EULAR)制定的RA分类标准。本研究标本采集经患者同意及医院伦理委员会批准。
1.2 主要试剂 0.01 mol/L PBS磷酸盐缓冲液购自北京中杉金桥生物技术有限公司;人淋巴细胞分离液购自天津灏洋生物制品科技有限公司;胰蛋白酶、脂多糖(LPS)、二甲基亚砜(DMSO)及台盼蓝购自美国Sigma公司;四甲基偶氮唑蓝(MTT)购自美国R&D公司;RPMI1640培养基及DMEM-LG培养基购自美国Invitrogen公司;THD原料药由江苏常州制药厂惠赠;四季青无支原体胎牛血清购自浙江天杭生物科技有限公司;TNF-α酶联免疫吸附试验(ELISA)试剂盒(货号:EHC103a.48)及人VEGF ELISA试剂盒(货号:EHC108.48)购自欣博盛生物科技有限公司。
1.3 实验方法
1.3.1 THD药液配制:将THD原料药充分溶解于DMSO配成浓度为50 mg/ml的储存液,微孔滤器过滤除菌后分装,-20 ℃保存。临用时加入DMEM-LG培养液及RPMI1640培养液稀释至所需浓度,终浓度为10、50、100、200、500 μg/ml。
1.3.2 FLS分离培养及THD刺激实验:FLS分离自RA患者的关节腔积液,使用四季青无支原体胎牛血清培养液培养,经体外传代培养获得,用生长状态良好的第3~5代FLS进行实验。取对数生长期的FLS,按细胞密度为1×106个/ml、1 ml/孔接种于24孔细胞培养板中,培养24 h后洗掉悬浮细胞,加入含有不同浓度THD(0、50、100、200 μg/ml)的DMEM-LG培养液(含10%胎牛血清和LPS 5 μg/ml),分别干预24、48 h后收集细胞液,在4 ℃条件下经低温离心机以5000 r/min离心10 min,取上清液置于-80 ℃冰箱内保存备用。
1.3.3 PBMCs提取培养及THD刺激实验:取肝素抗凝的RA患者外周静脉血10 ml,应用淋巴细胞分离液梯度离心法获取PBMCs。用移液管吸取该层细胞置于15 ml离心管中,用0.01 mol/L PBS洗涤细胞2次。用台盼蓝排斥试验检测细胞活力大于95%后调整细胞密度,按1×106个/ml、1 ml/孔接种于24孔细胞培养板中,每个标本设置8个孔,加入含有不同浓度THD(0、50、100、200 μg/ml)的DRPMI1640培养液(含10%胎牛血清和LPS 5 μg/ml),置37 ℃二氧化碳恒温培养箱培养24、48 h后收集细胞悬液。经4 ℃低温离心机以5000 r/min离心10 min,取上清液置于-80 ℃冰箱内保存备用。
1.3.4 MTT法检测FLS增殖水平:取处于对数生长期、生长状态良好的FLS,用0.25%胰蛋白酶消化后制成5×104个/ml的细胞悬液,接种于96孔培养板,每孔100 μl。待细胞贴壁后,每孔分别加入浓度为10、50、100、200、500 μg/ml的THD溶液,同时设置LPS组(含LPS 5 μg/ml的DMEM-LG培养液)和对照组(不含LPS及THD),每组设6次重复,分别于培养24、48 h后,每孔分别加入5 mg/ml的MTT液20 μl,置37 ℃二氧化碳恒温培养箱继续培养4 h。然后弃培养液,每孔分别加入150 μl DMSO,室温下低速震荡溶解,利用酶标仪在570 nm波长处测定各孔光密度(OD)值。
1.3.5 细胞形态学观察:分别于加药前及加入不同浓度药物处理后的不同时间将细胞培养皿放置于倒置显微镜下观察PBMCs和FLS的形态、大小、密度及生长情况变化。
1.3.6 ELISA法检测细胞培养上清液中TNF-α、VEGF水平:收集不同浓度不同作用时间的THD刺激后FLS及PBMCs培养上清液,参照试剂盒说明书,采用 ELISA法检测TNF-α及VEGF水平,实验重复3次,取平均值。
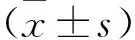
2 结 果
2.1 FLS形态学变化 见图1。镜下观察,分离的FLS培养24 h后开始贴壁,培养2~3 d后伸出生长突,呈梭形、多角形、极向排列。在含10%胎牛血清的DMEM-LG培养液中培养的FLS分裂增殖迅速,传至第3代时获得纯化的呈梭状FLS。不同浓度不同作用时间的THD对FLS进行干预后细胞形态也发生明显改变,FLS贴壁能力减弱,开始出现突触回缩,体积变小,细胞核出现固缩,由梭形变成圆形或不规则形,部分由贴壁变为悬浮。浓度为500 μg/ml的THD作用48 h时变化最明显,细胞大量脱离,出现大量核固缩。

图1 FLS传至第3代(A)及THD 500 μg/ml干预48 h后(B)形态学变化(×200)
2.2 THD对FLS增殖的影响(MTT法) 见表1。LPS 5 μg/ml对FLS增殖无影响,10 μg/ml THD对FLS有增殖抑制趋势,但与对照组比较差异无统计学意义(均P>0.05)。浓度范围在50~500 μg/ml的THD干预FLS 24、48 h后,OD值低于对照组(均P<0.05),表明FLS增殖受到抑制。
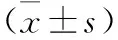
表1 THD对FLS增殖的影响
2.3 THD对FLS分泌TNF-α及VEGF的影响 见表2。THD 50、100、200 μg/ml 干预FLS 24、48 h后,TNF-α和VEGF浓度低于对照组(均P<0.05),表明FLS分泌TNF-α及VEGF受到抑制。

表2 THD对FLS分泌TNF-α及VEGF的影响(pg/ml)
2.4 THD对PBMCs形态学及分泌TNF-α和VEGF的影响 见表3(图2)。不同浓度THD(50、100、200 μg/ml)分别干预PBMCs 24、48 h后,PBMCs贴壁能力减弱,细胞核出现固缩,部分由贴壁变为悬浮。THD 50、100、200 μg/ml 干预PBMCs 24、48 h后TNF-α和VEGF浓度低于对照组(均P<0.05),表明PBMCs分泌TNF-α及VEGF受到抑制。

表3 THD对PBMCs分泌TNF-α及VEGF的影响(pg/ml)

图2 PBMCs干预前(A)及THD 200 μg/ml干预48 h后(B)形态学变化(×200)
3 讨 论
THD是一种人工合成的谷氨酸衍生物,1956年以非处方药的形式作为镇静剂首先在德国上市,随后被广泛用于治疗孕妇的妊娠反应性呕吐,之后因为严重致畸性于1961年撤出市场。但是学者们对THD的研究并未停止,近年来人们对THD又有了新的认识,研究发现该药具有良好的抗炎、抗血管生成和免疫调节的作用,在临床上被广泛用于治疗多种免疫相关性疾病及恶性肿瘤并取得良好疗效,但其具体作用机制尚不明确。大量研究证实THD可抑制TNF-α、IL-6、VEGF等炎症细胞因子的产生。众所周知,肿瘤的生、长转移与新生血管的生成密切相关,而肿瘤细胞分泌的VEGF在血管生成中发挥重要的作用。文献[10-14]报道,THD在淋巴瘤、小细胞肺癌、食管癌、宫颈癌等疾病中均有抑制VEGF的作用,而且THD对VEGF分泌的抑制作用呈时间剂量依赖性。因此推测,THD主要通过抑制VEGF来达到抗肿瘤新生血管生成的目的,从而起到抗肿瘤的作用。THD还可抑制肿瘤细胞产生TNF-α[13,15]。THD联合化疗可进一步降低多发性骨髓瘤患者的VEGF、TNF-α和IL-6水平,从而证实了THD对多发性骨髓瘤有抑制VEGF、TNF-α和IL-6生成的作用[16]。在溃疡性结肠炎、肺间质纤维化等疾病中,THD同样可减低TNF-α的产生[17-18]。因此THD在临床上常作为一种TNF-α抑制剂使用。
随着对THD研究的不断深入,其在治疗风湿性疾病方面表现出巨大潜力,如RA、系统性红斑狼疮、白塞病、强直性脊柱炎和皮肌炎等[19]。THD治疗银屑病关节炎效果良好并可有效降低其血清VEGF水平,而其用于治疗强直性脊柱炎也有十多年历史并取得良好效果,可能得益于其对TNF-α的抑制作用及患者血清炎症因子水平[20]。临床研究证明,沙利度胺治疗RA疗效确切,但其治疗RA的机制仍未明确。RA的发病机制与炎症因子关系密切,VEGF和TNF-α是RA发病过程中最重要的两种炎症细胞因子,与RA滑膜血管增生和炎症反应密切相关。血管增生在RA发病机制中起着重要作用,阻断滑膜新生血管的形成可以有效缓解RA滑膜炎症和血管翳的形成。在RA发病过程中慢性炎症和血管增生是同时存在的,炎症细胞因子(IL-6、IL-8、TNF-α、VEGF等)不仅可以直接诱导炎症反应,还可以间接促进滑膜血管生成。THD不仅能够减少VEGF的分泌,抑制血管生成,还可以有效阻碍 TNF-α等炎症因子的释放,进而起到抗炎作用。因此推测,THD治疗RA可能与其抑制TNF-α及VEGF等炎症细胞因子的分泌有关。
为了进一步探讨THD治疗RA的可能机制,本研究对RA FLS及PBMCs给予不同浓度THD干预,观察THD对RA FLS的抑制作用及对FLS、PBMCs分泌VEGF和TNF-α影响,结果显示THD浓度范围在50~500 μg/ml,干预24、48 h对FLS增殖均有抑制作用。同时,本研究发现THD浓度在50~200 μg/ml范围均能够明显抑制PBMCs和FLS分泌TNF-α、VEGF。
综上所述,THD可能通过抑制RA患者 FLS增殖,抑制FLS及PBMCs分泌VEGF、TNF-α,减少新生血管的形成,减轻炎症反应,从而起到治疗RA的作用。但由于本研究所选取的标本数较少,得到的研究结果可能存在一定的局限性,其具体作用机制尚需进一步研究,以期能为THD临床治疗RA提供科学的指导和理论依据。
