磁共振扩散加权成像定量参数对宫颈癌的诊断效能及其一致性的多中心评价
2022-12-12代敏王雪卢毅宋娇叶芷君李淑健严志汉
代敏,王雪,卢毅,宋娇,叶芷君,李淑健,严志汉
(1.温州医科大学附属第二医院,育英儿童医院放射科,浙江 温州 325027;2.四川大学华西第二医院放射科,四川 成都 610000;3.郑州大学第一附属医院磁共振科,河南 郑州 450000)
宫颈癌的发病年龄趋于年轻化,原位癌高发年龄低至30~35岁[1],在发展中国家,宫颈癌患者的死亡率居女性生殖系统恶性肿瘤之首。MR 扩散加权成像(Diffusion weighted imaging,DWI)不仅可以准确定位宫颈癌病灶、确定肿瘤边界,同时可以提供组织代谢、分子及微循环等生物学方面的信息,被纳入MRI 常规扫描序列,辅助临床进行鉴别诊断[2-5]。常用的DWI 定量参数来自于表观扩散系数(Apparent diffusion coefficient,ADC)单指数模型及体素内不相干运动(Intravoxel incoherent motion,IVIM)模型。定量参数应用于临床必备的3 个条件:明确的生物学意义;可以诊断或反映疾病的病理过程;具备较好的一致性(或可重复性)。本研究基于3 个临床中心的数据,评估ADC 单指数模型及IVIM 模型的定量参数对宫颈癌的诊断效能,分析DWI 定量参数术前对宫颈癌病理分级的价值,并进一步探讨DWI 定量参数在不同临床中心设备间的一致性。
1 资料与方法
1.1 研究对象
3 个临床中心纳入标准:①术前MRI 常规序列及多b 值DWI 扫描序列完整;②手术病理诊断为宫颈癌。排除标准:①MRI 图像质量不符合质控标准;②术后病理资料不完整;③MRI 检查前曾有放化疗治疗史。本研究为回顾性分析,患者无需签署知情同意书。宫颈癌分期参照2018 年国际妇产科联盟(Federation internationale of gynecologie and obstetrigue,FIGO)的分期标准[6]。根据本研究纳入排除标准,收集2015 年6 月—2021 年5 月病理影像资料完整的宫颈癌(194 例)及宫颈平滑肌瘤(12 例)患者共计206例,年龄40~79岁,平均56.4 岁。其中临床中心1 宫颈癌患者50例,宫颈平滑肌瘤患者12例(用于勾画其正常宫颈组织)。50 例宫颈癌患者中5 例Ⅰa 期及4 例Ⅰb 期宫颈癌患者在MRI 上未见明确肿块显示。因此,最终临床中心1 中共41 例宫颈癌患者勾画肿块感兴趣区(Regions of interest,ROI),参照本课题组前期工作,正常宫颈组织ROI来源于宫颈平滑肌瘤患者及宫颈癌患者[7-8]。在勾画正常宫颈组织ROI时,尽可能远离肿块区域,如果肿块比较大无法准确勾画正常宫颈组织,则放弃勾画该病例的正常宫颈组织(4 例),最终临床中心1宫颈正常组织来源于48 例患者,包括12 例宫颈平滑肌瘤患者及36 例宫颈癌患者。临床中心2 之设备1 宫颈癌患者55例,3 例Ⅰa 期及4 例Ⅰb 期宫颈癌患者在MRI 上未见明确肿块显示,1 例宫颈癌患者肿块较大无法勾画正常宫颈组织,最终48 例宫颈癌患者勾画肿块ROI,47 例宫颈癌患者可勾画正常宫颈组织。临床中心2 之设备2 宫颈癌患者31例,2例Ⅰa 期及2 例Ⅰb 期宫颈癌患者在MRI 上未见明确肿块显示,4 例宫颈癌患者肿块较大无法勾画正常宫颈组织,最终27 例宫颈癌患者勾画肿块ROI,23 例宫颈癌患者可勾画正常宫颈组织。临床中心3宫颈癌患者58例,其中4 例Ⅰb 期宫颈癌患者在MRI 上未见明确肿块显示,14 例Ⅲc 期及4 例Ⅳ期宫颈癌患者肿块较大无法勾画正常宫颈组织,最终54 例宫颈癌患者勾画肿块ROI,36 例宫颈癌患者可勾画正常宫颈组织。
1.2 检查方法
1.2.1 临床中心1 MRI 检查
所有患者均行3.0T MR 扫描(Discovery MR 750w,General Electric,USA)。采用腹部相控阵线圈,扫描序列为常规MRI 序列、DWI。①T1WI:TR 为704 ms,TE 为8 ms,层厚为5 mm,层间距为5 mm,层数为20。②T2WI:TR 为3000~4 000 ms,TE 为70~76 ms,层厚为5 mm,层间距为5 mm。③多b 值DWI:TR 为2 400 ms,TE 为74 ms,FOV 为360 mm×360mm,矩阵为256×256,层厚为5mm,层间距为5mm。多b 值DWI 共设置6 个b值,分别为0、30 s/mm2、100 s/mm2、200 s/mm2、400 s/mm2、1 000 s/mm2。
1.2.2 临床中心2 之设备1 MRI 检查
采用1.5T MR 扫描仪(Philips Achieva),腹部相控阵线圈,行常规MRI 序列、DWI 扫描。①T1WI:TR 为498 ms,TE 为10 ms,层厚为5 mm,层间距为6 mm,相位视野为104%。②T2WI:TR 为3 000 ms,TE 为80 ms,层厚为5 mm,层间距为6 mm,相位视野为115%。③DWI:TR 为3 000 s,TE 为66 ms,矩阵为116×116,相位视野为79%,层厚为5 mm,层间距为6 mm。多b 值DWI 共设置6 个b值,分别为0、50 s/mm2、100 s/mm2、200 s/mm2、400 s/mm2、1 000 s/mm2。
1.2.3 临床中心2 之设备2 MRI 检查
采用3.0T MR 扫描仪(Skyra,Siemens),腹部相控阵线圈,行常规MRI 序列、DWI 扫描。①T1WI:TR为674ms,TE 为10ms,层厚为4mm,层间距为4.8mm,相位视野为100%。②T2WI:TR 为7 440 ms,TE 为73 ms,层厚为4 mm,层间距为4.8 mm,相位视野为100%。③多b 值DWI:TR 为4 100 s,TE 为58 ms,矩阵为140×112,相位视野为100%,层厚为5 mm,层间距为6 mm。多b 值DWI 共设置9 个b值,分别为0、10 s/mm2、30 s/mm2、50 s/mm2、100 s/mm2、150 s/mm2、200 s/mm2、400 s/mm2、1 000 s/mm2。
1.2.4 临床中心3 MRI 检查
所有患者均行3.0T MR 扫描(Skyra,Siemens)。采用腹部相控阵线圈,行常规MRI 序列、DWI 扫描。①T1WI:TR 为450 ms,TE 为18 ms,层厚为4 mm,层间距为5 mm。②T2WI:TR 为2 200 ms,TE 为86 ms,层厚为5 mm,层间距为6 mm。③DWI:TR 为4 800 ms,TE 为85 ms,相位视野为100%,矩阵为128×109,层厚为5 mm,层间距为6 mm。多b 值DWI 共设置12 个b值,分别为0、10 s/mm2、20 s/mm2、30 s/mm2、50 s/mm2、70 s/mm2、100 s/mm2、150 s/mm2、200 s/mm2、400 s/mm2、800 s/mm2、1 500 s/mm2。
1.3 ROI 勾画
参照本课题组前期经验,3 个临床中心的宫颈癌肿块及正常宫颈组织ROI 统一由1 名具有10 年以上妇科影像诊断经验的医师在DWI 图像的每个层面上手动选取尽可能大的ROI[7-8]。勾画宫颈癌肿块ROI时,结合MRI 常规序列及增强扫描确定肿块的位置及边界,尽量避开肿块内部囊变、出血、坏死区域;勾画正常宫颈组织ROI时,尽可能远离宫颈肿块区域[7-8]。
1.4 图像分析
所有图像通过MItalytics 软件(Fitpu Healthcare)基于Matlab 及C 语言进行后处理。DWI 数据采用IVIM 模型进行分析,并获得4 个定量参数,包括纯扩散系数(D)、伪扩散系数(D*)、灌注分数(f)、fD*。
IVIM 模型计算公式:Sb/S0=(1-f)×e(-bD)+f×e(-b(D+D*)),其中S 是平均信号强度,所采用的多b 值的设定要同时包括小于200 s/mm2和大于200 s/mm2的b值,并且小于200 s/mm2的b 值和大于200 s/mm2的b值分别至少有两个,实际应用中,b 值的个数更多,通常为4~10 个b 值。
ADC 单指数模型计算公式:Sb/S0=exp(-bD)。
1.5 统计学方法
采用SPSS 25.0 软件进行统计学分析。①根据DWI 定量参数(D、D*、f、fD*、ADC 值)的正态性检验结果,采用Man-Whitney U 检验分析DWI 定量参数在宫颈癌及正常宫颈组织之间的差异。②使用受试者工作特征(Receiver operating characteristic,ROC)曲线分析IVIM 模型和ADC 模型各定量参数的诊断效能,计算ROC 曲线下面积(Area under the curve,AUC)。AUC 值≥0.9 表示诊断效能非常好,AUC 值为0.8~<0.9 表示较好,AUC 值为0.7~<0.8表示中等,AUC 值<0.7 表示较差[9]。并计算诊断效能较好的DWI 定量参数的截断值、敏感度、特异度、阳性预测值、阴性预测值。③根据DWI 定量参数(D、D*、f、fD*、ADC 值)的正态性检验结果,采用Man-Whitney U 检验分析DWI 定量参数在低分化宫颈癌与中高分化宫颈癌之间的差异。④3 个临床中心共4 个设备之间DWI 定量参数的差别采用Kruskal-Wallis 单因素ANOVA(多样本)方法进行比较。P<0.05 为差异有统计学意义。
2 结果
2.1 病理结果
本研究3 个临床中心最终用于数据分析的研究对象包括170 例宫颈癌及12 例宫颈平滑肌瘤患者,共勾画170 个宫颈癌肿块ROI 及154 个正常宫颈组织ROI。170 例宫颈癌中,Ⅰb 期87例,Ⅱa 期42例,Ⅱb 期16例,Ⅲa 期8例,Ⅲc 期12例,Ⅳa 期4例,Ⅳb 期1 例;高分化宫颈癌(G1)19例,中分化宫颈癌(G2)42例,低分化宫颈癌(G3)56例,其余53个病例的病理分化程度未知。
2.2 DWI 定量参数(D、D*、f、fD*、ADC 值)ROC 曲线分析
宫颈癌DWI 定量参数(D、D*、f、fD*、ADC 值)均明显小于正常宫颈组织(P<0.05),详见表1。大部分DWI 定量参数(D、f、fD*、ADC 值)在宫颈癌的诊断中均获得了较高的AUC 值(0.866~0.962),其中D、f 及ADC 值的AUC 值均大于0.95。D* 在宫颈癌的诊断中表现欠佳(AUC 值<0.7)(图1,2)。根据ROC 曲线结果,进一步计算具有较高诊断效能的DWI 定量参数(D、f、fD*、ADC 值)诊断宫颈癌的截断值、敏感度、特异度、阳性预测值及阴性预测值,详见表2。
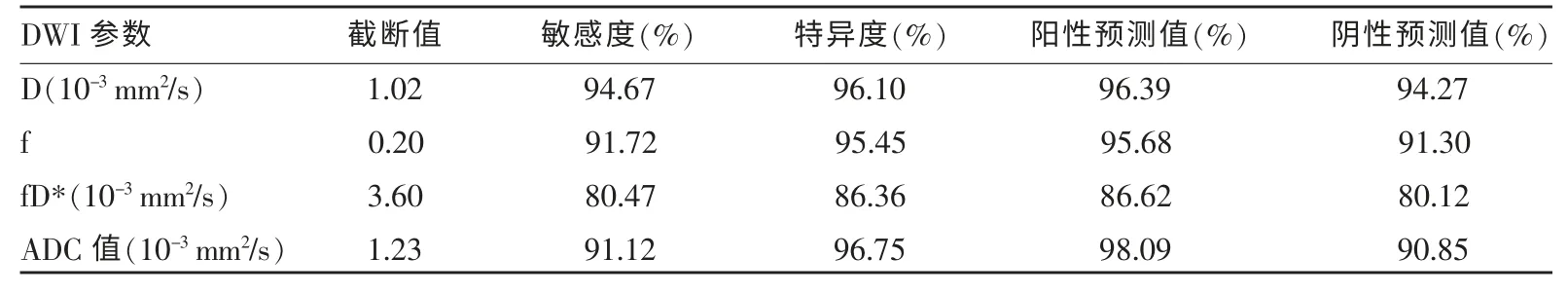
表2 宫颈癌诊断效能较高的DWI 定量参数(D、f、fD*、ADC 值)的截断值、敏感度、特异度、阳性预测值及阴性预测值
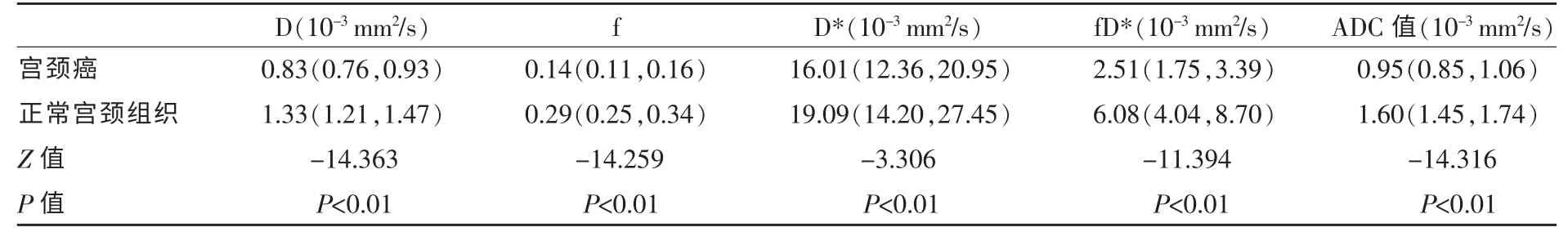
表1 宫颈癌及正常宫颈组织之间DWI 定量参数(D、D*、f、fD*、ADC 值)的差异
2.3 DWI 定量参数(D、D*、f、fD*、ADC 值)对宫颈癌病理分级的鉴别价值
本研究根据宫颈癌分化程度分为中高分化组(G1~G2)及低分化组(G3),分析DWI 定量参数(D、D*、f、fD*、ADC 值)对宫颈癌病理分级的鉴别价值,结果显示低分化(G3)宫颈癌的D 和ADC 值低于中高分化(G1~G2)宫颈癌(P<0.05)。DWI 定量参数D*、f、fD* 在低分化(G3)宫颈癌和中高分化(G1~G2)宫颈癌之间的差异无统计学意义(P>0.05)(表3)。
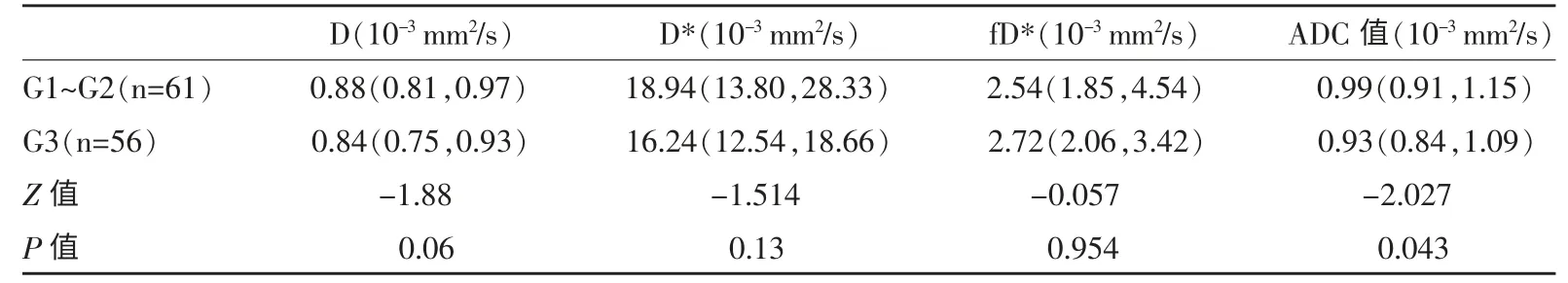
表3 中高分化(G1~G2)与低分化(G3)宫颈癌之间DWI 定量参数(D、D*、f、fD*、ADC 值)的差异
2.4 对比分析宫颈癌DWI 定量参数(D、f、D*、fD*、ADC 值)在不同临床中心不同设备之间的差异
结果显示在宫颈癌肿块中,临床中心2 的设备2 与临床中心3 之间DWI 定量参数(D、f、D*、fD*、ADC 值)无明显差异(P>0.05)。DWI 定量参数D 及ADC 值在3 个中心共4 个设备之间,除临床中心1和临床中心2 的设备1 之间及临床中心2 的设备2与临床中心3 之间外,其余不同临床中心不同设备之间均表现为显著差异(P<0.05)。宫颈癌灌注相关参数(f、D*、fD*)在不同临床中心不同设备之间无明显差异(P>0.05)(表4)。
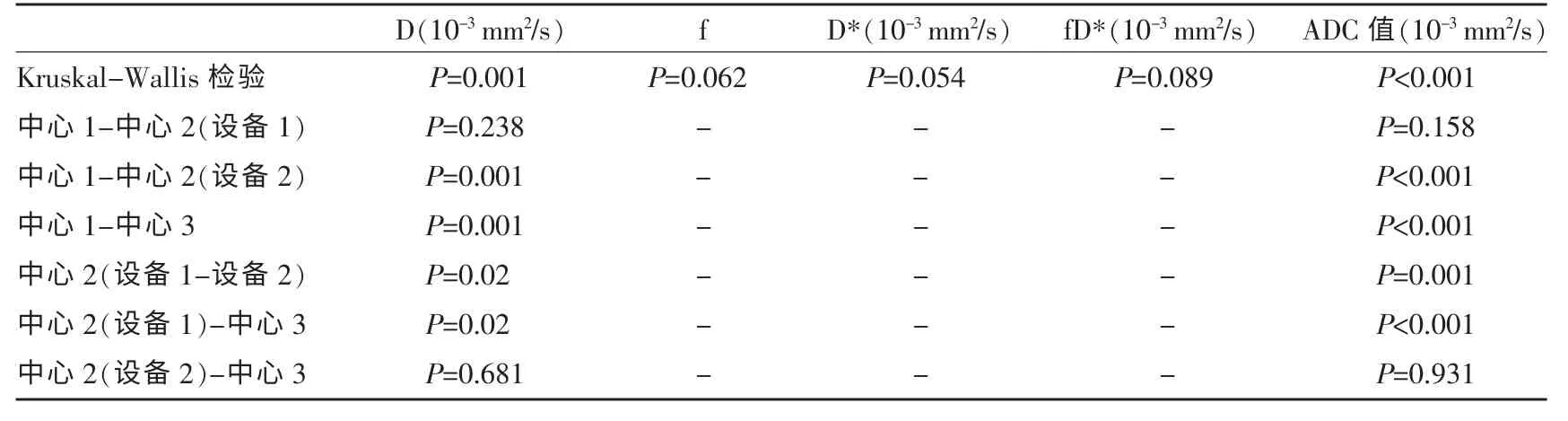
表4 宫颈癌肿块DWI 定量参数(D、f、D*、fD*、ADC 值)在不同临床中心不同设备之间的差异
3 讨论
3.1 ADC 单指数模型及IVIM 模型的理论基础
ADC 单指数模型假设组织中水是自由运动的,其扩散运动符合高斯定律。ADC 值反映的是水分子在组织中的扩散速度,目前在临床中应用广泛,主要用于良恶性肿瘤的鉴别诊断。但是该模型的假设过于理想,组织中水分子的真实运动状态绝非自由扩散,而是受到细胞膜、生物大分子等阻碍,该模型也没有考虑血管内血流对水分子扩散的影响。IVIM 模型由LeBihan等[10]提出,可以包含每幅图像像素内所有的不一致运动。该模型采用多个b 值进行扫描,将组织微循环信号从水分子的扩散信息中分离出来,获得相关参数(D、f、D*、fD*)。
3.2 正常宫颈组织的DWI 各定量参数低于宫颈癌肿块的原因
本研究结果显示正常宫颈组织的DWI 各定量参数(D、f、D*、fD*、ADC 值)均低于宫颈癌肿块,分析其原因:①恶性肿瘤细胞的快速增殖,使细胞外间隙变小[11-12],导致肿瘤组织细胞外水分子的活动受限,ADC 值和D 值下降。②宫颈癌肿块虽然血管增生较正常组织多,但是肿块微血管结构紊乱,血管壁不完整,血管通透性异常增加,这种微血管复杂结构及功能异常导致肿块血流速度降低,从而致使反映肿瘤灌注信息的定量参数(f、D*、fD*)下降。因此,肿瘤细胞的快速增殖及异常的微血管功能同样可以很好地解释这种现象。也有学者认为,恶性肿瘤细胞快速生长,其速度远远超过了血管增生的速度,导致肿瘤核心部分的微血管密度减低[13]。本研究结果表明DWI 各定量参数可以全面反映肿瘤组织的增殖及微循环状态,术前无创性评估宫颈微循环,从而指导临床决策。
3.3 DWI 定量参数对宫颈癌病理分级的诊断价值
本研究结果显示DWI 定量参数D 和ADC 值能够区分低分化(G3)及中高分化(G1~G2)宫颈癌。DWI 定量参数f、D* 及fD* 均不能区分低分化(G3)及中高分化(G1~G2)宫颈癌。这与以往的研究结论不完全一致。以往研究结果显示在3 种病理分级两两之间的比较中,DWI 定量参数D 和ADC 值对宫颈癌病理分级均有价值,DWI 定量参数f 仅在高分化(G1)及低分化(G3)宫颈癌间差别显著,而DWI 定量参数D*对3 种病理分级均无鉴别意义[14]。McVeigh等[15]研究发现DWI 定量参数在中分化(G2)及低分化(G3)宫颈癌中无明显差异。相世峰等[16]对比分析DWI 定量参数对中低分化(G2~G3)宫颈癌与高分化(G1)宫颈癌的鉴别价值,发现D 和ADC 值在两者之间存在显著差异。以往研究显示DWI 定量参数D* 和f 值对宫颈癌病理分级无明显鉴别价值,而本研究ROC 曲线分析结果显示f、fD* 对鉴别宫颈癌及正常宫颈组织具有较好的价值(AUC 值>0.85),表明与DWI 扩散相关参数(D、ADC 值)相比,宫颈癌的分化程度对DWI 灌注相关参数(D*、f、fD*)的影响较小,本研究样本量相对较小,仍需扩大样本量进一步研究。
3.4 宫颈癌DWI 定量参数在不同临床中心不同设备间的一致性
本研究结果显示宫颈癌DWI 各定量参数(D、f、D*、fD*、ADC 值)在临床中心2 的设备2 与临床中心3 之间差异均无统计学意义(P>0.05)。临床中心2 的设备2 与临床中心3 所使用的MR 扫描仪均为3.0T Simens Skyra,表明扫描设备相同、扫描方案统一的情况下,DWI 各定量参数在诊断宫颈癌的效能方面具有很好的可靠性。灌注相关参数(f、D*、fD*)在不同中心不同设备之间均无明显差异(P>0.05)。因此,我们推测组织中水分子的扩散情况受不同场强及扫描参数的影响较大,而组织的灌注情况受不同设备的影响较小。
3.5 本研究的局限性
①宫颈癌病理分级受3 个临床中心样本量的限制,仅分析DWI 定量参数对低分化和中高分化宫颈癌的鉴别价值,下一步将扩大每个中心的样本量,针对宫颈癌3 个病理分级两两之间深入探讨DWI 定量参数对宫颈癌病理分级的鉴别价值。②本研究宫颈癌病例来自3 个临床中心,使用3 种型号的MRI设备进行扫描,接下来将纳入更多不同的MRI 设备进行研究,验证DWI 定量参数的可重复性及一致性,探讨DWI 定量参数在宫颈癌诊断及疗效评估中的泛化能力。
DWI 定量参数(D、f、D*、fD*、ADC 值)可以反映宫颈癌肿瘤细胞增殖、灌注等微环境信息。定量参数D、f 及ADC 值具有良好的诊断效能(AUC 值均大于0.95)。DWI 扩散相关参数D 和ADC 值可以区分宫颈癌的病理分级,且在不同中心相同型号的扫描设备中具有较好的一致性。
