18F-FDG PET 显像对脑内多发性高级别胶质瘤与淋巴瘤的鉴别诊断
2022-12-12王凯吴桐陈谦艾林
王凯,吴桐,陈谦,艾林
(首都医科大学附属北京天坛医院核医学科,北京 100070)
高级别胶质瘤、原发性中枢神经系统淋巴瘤(Primary central nervous system lymphoma,PCNSL)和转移瘤是成年人常见的恶性脑肿瘤。这些肿瘤在MRI 图像上有时具有相似的影像表现,临床鉴别诊断存在一定困难[1-2]。高级别胶质瘤患者的一般治疗方式为最大程度切除,并辅助放化疗;而PCNSL 确诊后一般采用无创性的化疗方法进行治疗[3]。由于这些肿瘤的治疗方法和预后差异较大,因此对其进行准确的鉴别诊断具有重要的临床意义。
目前MRI 是鉴别脑内胶质瘤和PCNSL 最主要的成像方法之一,但也会出现鉴别诊断困难的情况。18F-FDG PET 能够获取病灶的代谢信息,可帮助进行鉴别诊断[4]。对于脑转移瘤,全身18F-FDG PET 显像能够显示原发恶性病变的部位[5],因此临床实践中主要需区分高级别胶质瘤和淋巴瘤,尤其是弥漫性大B 细胞淋巴瘤(Diffuse large B-cell lymphoma,DLBCL)。既往研究发现,肿瘤病灶18F-FDG PET 显像的最大标准化摄取值(Maximum standardized uptake value,SUVmax)与正常组织SUVmax 的比值(Tumor/background ratio,TBR)可用于区分DLBCL与胶质母细胞瘤[4,6]。
脑内多发性高级别胶质瘤一般具有2 个及以上病灶,位于不同脑叶或深部灰质核团,不沿单一纤维束走行方向扩散生长。PCNSL 通常起源于大脑半球深处,一般为单发病灶,也可表现为相互分离的多个病灶[7]。由于二者的MRI 图像特征具有一定相似性,包括占位效应、瘤周明显水肿和明显强化,给影像学鉴别诊断造成一定困难。对于脑内单发肿瘤性病灶,有研究发现肿瘤病灶的SUVmax 和TBR 能有效区分胶质瘤和淋巴瘤[4,6,8],但18F-FDG PET 对鉴别诊断脑内多发性高级别胶质瘤和DLBCL 价值的相关研究较少。本研究旨在探讨18F-FDG PET 对脑内多发性高级别胶质瘤和DLBCL 的鉴别诊断价值,提出新的鉴别诊断方法,为临床选择治疗决策提供帮助。
1 材料与方法
1.1 患者入组
回顾性研究2020 年11 月—2021 年12 月在我科首次诊断为多发性颅内肿瘤的24 例患者。入组标准:①MRI 对比增强T1加权图像证实的多发性颅内肿瘤灶;②术前于我院行18F-FDG PET 脑显像检查,图像质量可用于进一步分析研究;③经神经外科手术或立体定向活检病理诊断为高级别胶质瘤(WHO 3~4 级)或DLBCL。根据病理结果将患者分为胶质瘤组和DLBCL 组。本研究经首都医科大学附属北京天坛医院伦理委员会批准,免除受试者知情同意。
1.2 18F-FDG PET 图像采集
本研究入组患者均在首都医科大学附属北京天坛医院核医学科进行18F-FDG PET 脑显像,所有患者均按照相同方法进行18F-FDG PET 图像采集。患者行18F-FDG PET 图像采集前1~2 d 避免做剧烈运动,检查前4~6 h 禁食,停服一切不必要的药物,环境气温较低时应注意保暖。注射18F-FDG 前空腹血糖应控制在11.1 mmol/L 以下。通过肘静脉注射18FFDG 溶液,放化纯度>95%,注射活度为3.7 MBq/kg。注射后患者在安静、黑暗环境中等待40~60 min,之后进行图像采集,采集范围为1 个床位,采集时间为8~10 min。患者采取仰卧位,在整个检查过程中保持静止。患者PET 图像采集使用PET/MR 一体化扫描仪(Discovery 750w,GE Healthcare,美 国),MRI 采集序列包括轴位T1WI、T2WI、FALIR、DWI 和对比增强T1WI。成像参数:T1WI,TE/TR 为24 ms/1 750 ms;T2WI,TE/TR 为110 ms/8 425 ms;FLAIR,TE/TR 为120 ms/9 000 ms;DWI,TR 为11 121 ms,TE 取 值minimum,击发次数为1.0;图像层厚为5 mm,层间距为0.5 mm。采用零回波时间(Zero echo time,ZTE)方法对PET 图像进行衰减校正。PET/MR 多模态数据采集后图像传送至GE AW VolumeShare 4工作站进行图像重建和数据测量。
1.3 图像测量与分析
在GE AW VolumeShare 4 工作站上读取患者图像,使用工作站内置测量软件在脑内病灶部位勾画感兴趣区(ROI)。由两位分别具有6 年和8 年神经影像诊断经验的主治医师以上职称的核医学科医师在不了解患者临床和病理结果的情况下,采用单盲法对例24 例患者脑内病灶进行数据测量,每例患者各参数测量结果取两名医师测量的平均值。7 d 后重复上述测量方法,取前后两次测量的平均值纳入统计分析。PET 图像上以病灶处18F-FDG 最高摄取区域为ROI区,病灶摄取阈值取42%,测量病灶部位的SUVmax 和TBR 值。
本研究所有入组患者脑内均具有多发病灶,不同病灶具有其各自的SUVmax。因此对于高级别胶质瘤和DLBCL 患者,我们定义同一患者脑内病灶中SUVmax 最高者为最大SUVmax,SUVmax 最低者为最小SUVmax;同理,同一患者不同病灶中TBR 最高者为最大TBR,TBR 最低者为最小TBR。多发性高级别胶质瘤或DLBCL 病灶间SUVmax 最大差值(DSUV)为最大SUVmax 和最小SUVmax 之间的差值,TBR 最大差值(DTBR)为最大TBR 与最小TBR 之间的差值。病灶的DSUV或DTBR百分比计算如下:DSUV%=DSUV/最大SUVmax;DTBR%=DTBR/最大TBR。
1.4 统计学分析
采用SPSS 22.0 软件进行统计学分析。采用两独立样本t 检验或秩和检验比较胶质瘤组和DLBCL组之间的18F-FDG PET 摄取参数差异,检验类型取决于两组数据的分布特征。采用卡方检验对两组间分类变量进行比较。对两名医师间数据测量的差异进行Kappa 一致性检验。应用受试者工作特征(ROC)曲线比较不同参数对鉴别高级别胶质瘤和DLBCL 的诊断效能,并计算诊断阈值、敏感度和特异度。P<0.05 为差异有统计学意义。
2 结果
2.1 患者临床信息
本研究入组的24 名颅内多发肿瘤患者中,多发性高级别胶质瘤14 例(男10例,女4 例),年龄16~71岁,平均(53.1±14.3)岁;14 例高级别胶质瘤患者中WHO 3 级6例,WHO 4 级8 例。DLBCL 患者10例(男3例,女7 例),年龄34~70岁,平均(59.4±10.1)岁。所有入选患者均接受18F-FDG PET/MR 检查。脑内多发性高级别胶质瘤和DLBCL 患者的18FFDG PET/MR 图像见图1,2。
2.2 脑内多发性高级别胶质瘤和DLBCL 患者之间临床特征及18F-FDG PET 显像参数比较
脑内多发性高级别胶质瘤和DLBCL 患者之间临床信息、PET 脑显像参数(最大SUVmax、最小SUVmax、最大TBR、最小TBR、DSUV、DTBR、DSUV%、DTBR%)比较结果见表1。两名医师对两组患者脑内病灶PET参数值测量一致性的Kappa 值为0.88(P=0.026)。
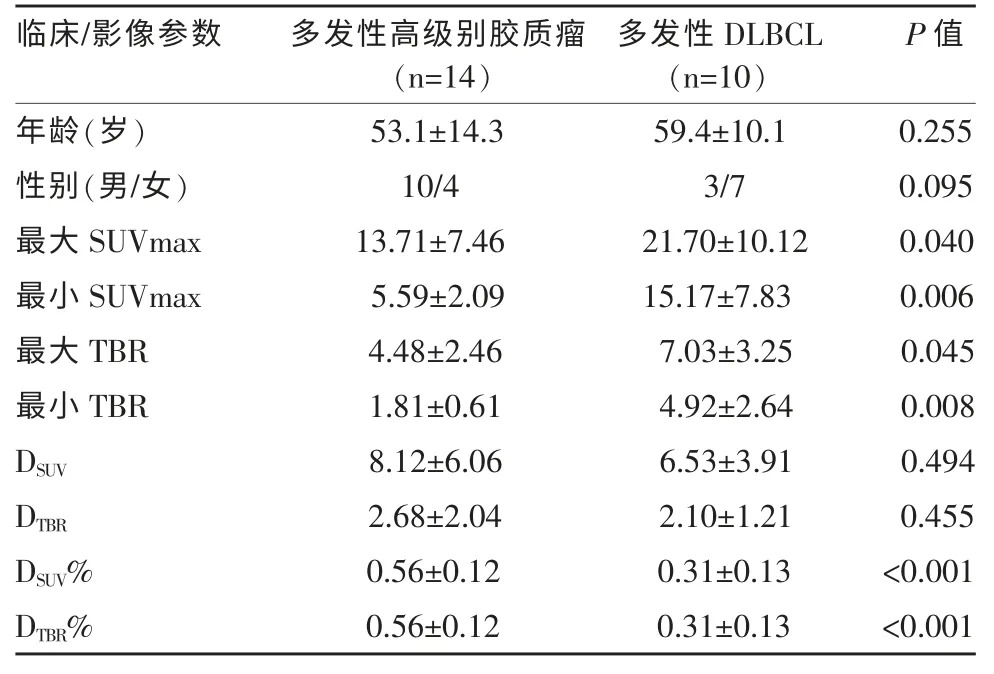
表1 脑内多发性高级别胶质瘤和DLBCL 患者临床及影像参数比较
2.3 18F-FDG PET 脑显像各参数对鉴别脑内多发性高级别胶质瘤和DLBCL 的诊断效能
18F-FDG PET 脑显像各参数对鉴别诊断多发性高级别胶质瘤和DLBCL 的效能见表2 所示。其中DSUV%和DTBR%的曲线下面积(AUC)最高且二者诊断效能一致,AUC 为0.944。当DSUV%或DTBR%≥39.8%时,提示诊断为脑内多发性高级别胶质瘤,其敏感度为92.9%,特异度为88.9,约登指数为0.818。
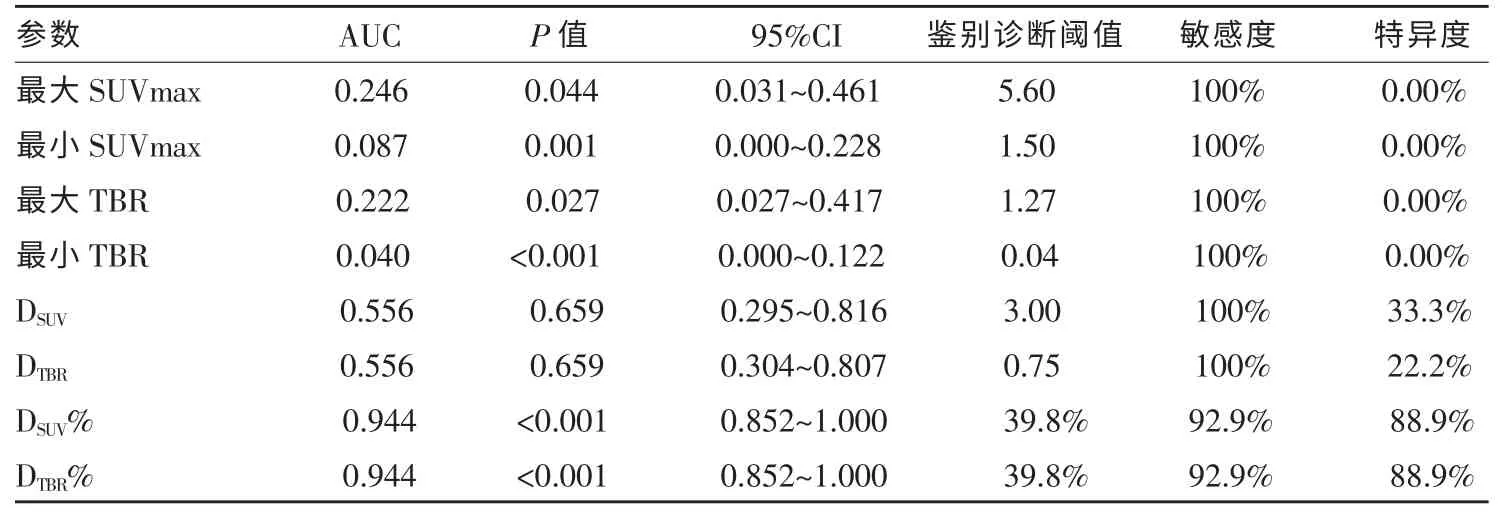
表2 18F-FDG PET 图像参数对脑内多发性高级别胶质瘤和DLBCL 的鉴别诊断效能
3 讨论
本研究发现DLBCL对18F-FDG 的摄取明显高于高级别胶质瘤。此外,18F-FDG PET 显像的DSUV%和DTBR%可作为鉴别脑内多发性高级别胶质瘤和DLBCL 的有效方法。
18F-FDG 作为中枢神经系统病变使用最广泛的放射性示踪剂,已在临床实践中用于脑肿瘤的诊断。胶质瘤细胞对18F-FDG 的摄取与肿瘤细胞密度和代谢活性有关。肿瘤细胞数量增加和细胞外基质减少与18F-FDG PET 图像上葡萄糖摄取增加相关[9]。相比之下,当胶质瘤组织中细胞密度下降或细胞外基质增加时,胶质瘤的18F-FDG SUVmax 降低[10]。因此,SUVmax 可提示肿瘤组织内细胞密度和肿瘤分级。胶质瘤通常表现出明显异质性,同一肿瘤内可能存在不同的组织学特征和分级。由于胶质瘤起源的异质性,在多发胶质瘤病灶间,18F-FDG 的摄取程度存在不同程度的差异,因此其SUVmax 和TBR 的差异相对显著。
PCNSL 以前被认为是一种罕见的脑内肿瘤,但在过去20 年中其发病率一直上升[11]。在组织学上,大多数PCNSL 属于DLBCL,由丰富的肿瘤细胞组成,在DWI 图像上表现为高信号,反映肿瘤的细胞密度较高[12]。DLBCL 很少发生瘤内坏死和出血,MRI对比增强通常表现为明显均匀强化[13]。既往研究发现,DLBCL对18F-FDG 的摄取程度较高,在18F-FDG PET 显像中的TBR 明显高于高级别胶质瘤,引起这种差异的原因可能是因为DLBCL 中肿瘤细胞的细胞密度和消耗率均较高[14]。脑内DLBCL 一般多为单发病灶,位于深部脑组织,但也可表现为多发病变,侵犯大脑各个结构,包括脑叶、胼胝体和脑室等。在这种情况下,一些病变可能位于大脑半球的浅表位置,同时对18F-FDG 的摄取程度可能不如典型的DLBCL高[15]。尽管18F-FDG PET 显像被认为是诊断PCNSL 的有用方法,但对脑内多发性DLBCL的18FFDG 摄取特征的研究尚未充分。有研究发现在18FFDG PET 显像中,高级别胶质瘤或DLBCL 有时表现为低代谢或等代谢,这可能是该技术的一个局限性[1]。
由于脑内多发性高级别胶质瘤和DLBCL 的MRI和18F-FDG PET 图像特征相似,因此准确区分这两种肿瘤对于确定合适的治疗策略非常重要。既往研究发现PCNSL的18F-FDG PET 参数值(包括SUVmax 和TBR)均明显高于高级别胶质瘤[16-17]。ROC曲线分析结果提示SUVmax 阈值在12~15 之间可能是鉴别PCNSL 和高级胶质瘤的可靠指标[18]。然而,胶质瘤的SUVmax 可能受到各种因素的影响,包括血糖水平和类固醇治疗,为了消除这些混杂因素的影响,既往研究将TBR 作为诊断指标,发现其与SUVmax 相比具有更高的准确性,对PCNSL 的鉴别诊断阈值为2.36~2.79[19-20]。
对于脑内多发性高级别胶质瘤和DLBCL 患者,在本研究中我们旨在探究新的鉴别诊断方法,可以更好地区分这两种肿瘤。本研究发现,18F-FDG PET显像的DSUV%和DTBR%能够有助于区分脑内多发性高级别胶质瘤和DLBCL,ROC 曲线分析示DSUV%和DTBR%的AUC 最大(AUC=0.944),鉴别诊断效能最优。本研究中,对于脑内多发性高级别胶质瘤或DLBCL 的不同病灶,每个病灶对18F-FDG 的摄取程度均不相同,这可能是由于病灶的异质性造成的,尤其是在多发性高级别胶质瘤病灶。为了更好地利用每个病灶的图像信息,我们研究了DSUV和DTBR对脑内多发性高级别胶质瘤和DLBCL 的鉴别诊断能力,结果提示效能较弱,可能是因为18F-FDG PET 显像的DSUV和DTBR不能较好反映脑内多病灶对18F-FDG的摄取间差异。因此,我们进一步采用DSUV%和DTBR%对脑内多发性高级别胶质瘤和DLBCL 进行鉴别诊断,发现其更适用于二者的鉴别。与现有诊断方法相比,18F-FDG PET 显像中DSUV%和DTBR%可以更好地反映多发性高级别胶质瘤或DLBCL 病灶葡萄糖代谢的实际变化程度,以及脑内多发病灶对18F-FDG摄取的实际差异。相反DSUV、DTBR、最大/最小SUVmax、最大/最小TBR 均不能有效反映脑内多发性高级别胶质瘤(或DLBCL)不同病灶的葡萄糖代谢水平的差异。本研究认为,脑内多发性高级别胶质瘤不同病灶对18F-FDG 摄取程度存在较大差异,可能是因为病灶的异质性较大,包括组织病理学起源和肿瘤成分的差异。相比之下,DLBCL 多发病灶间的18F-FDG 摄取的差异相对不明显。
本研究存在一些局限性:首先,本研究为单中心、小样本、回顾性研究;其次,本研究结果未在验证性患者样本中进行诊断检验。因此,本研究提出的鉴别诊断方法还需在未来大样本前瞻性研究中进一步验证。
综上,脑内多发性高级别胶质瘤和DLBCL的18F-FDG PET 显像参数DSUV%和DTBR%能够反映二者各自多个病灶之间的实际葡萄糖代谢水平的差异,可用于对二者进行鉴别诊断。
