卡培他滨联合同步放化疗治疗中晚期食管癌
2022-12-10税明才叶丹丹熊林温均红
税明才,叶丹丹,熊林,温均红
(重庆市开州区人民医院肿瘤科,重庆 405400)
食管癌多发于中老年人群,随着患者病情进展,患者食管部位异物感和吞咽困难症状越来越明显,只能采取保守治疗控制病情进展,延长患者生存时间[1]。紫杉醇和顺铂化疗是临床治疗恶性肿瘤的常规化疗方案,可对肿瘤细胞的增殖产生抑制作用,放疗是通过放射性射线将肿瘤细胞杀死的一种物理疗法,其与化疗联合可有效提高临床疗效,但不良反应较多,不适用于长时间治疗[2-3]。卡培他滨是一种碱基类似物,可通过竞争尿嘧啶与脱氧核糖的结合位点有效抑制肿瘤细胞遗传物质复制[4-5]。本研究采用卡培他滨联合同步放化疗治疗中晚期食管癌患者,疗效明显,报道如下。
1 资料与方法
1.1 一般资料
选择2017年1月-2019年2月我院收治的中晚期食管癌患者142例,随机分为放化疗组与联合治疗组,各71例。放化疗组,男37例,女34例;年龄36~63岁,平均(51.52±2.64)岁;体质量指数(BMI)18~ 27 kg·m-2,平均(22.64±0.73)kg·m-2;病理类型[6]:鳞状细胞癌64例,非鳞状细胞癌7例;临床分期[7]:Ⅱ期38例,Ⅲ期33例。联合治疗组,男39例,女32例;年龄37~64岁,平均(52.10±2.66)岁;BMI 17~27 kg·m-2,平均(22.25±0.68)kg·m-2;病理类型:鳞状细胞癌67例,非鳞状细胞癌4例;临床分期:Ⅱ期40例,Ⅲ期31例。
1.2 纳入与排除标准
纳入标准:1)符合食管癌诊断标准者[8];2)处于中晚期者;3)治疗和随访期间未接受其他治疗者。排除标准:1)合并其他恶性肿瘤者;2)放射性过敏或对本研究所用药物过敏者;3)治疗或随访期间因意外或其他原因死亡者等。
1.3 治疗方法
放化疗组进行紫杉醇(生产企业:远大医药黄石飞云制药有限公司,国药准字:H20056466,规格:5 mL,30 mg)、顺铂(生产企业:贵州汉方制药有限公司,国药准字:H20020272,规格:100 mL, 顺铂100 mg与氯化钠900 mg)联合放射治疗。对患者进行钡餐造影、胃镜检查及影像学扫描等确定或勾画肿瘤靶区、临床靶区、计划靶区,照射部位经热塑体膜固定,影像学检查定位后进行放射治疗,计划靶区照射总剂量为56~64 Gy,每次2 Gy,每天1次,每周5次。在放射治疗的同时给予患者紫杉醇联合顺铂化疗,放射治疗第1天给予紫杉醇静脉滴注,175 mg·m-2,持续3 h;第2天,顺铂静脉滴注75 mg·m-2,持续3 h,治疗21 d为1个疗程,放疗期间共接受2个疗程的化疗。
联合治疗组在放化疗组基础上采用卡培他滨片(生产企业:成都苑东生物制药股份有限公司,国药准字:H20203570,规格:500 mg)进行治疗,口服,1 250 mg·m-2,每日2次,治疗21 d为1个疗程,共治疗2个疗程。2组治疗后均随访2年。
1.4 观察指标
1.4.1 临床疗效治疗后,根据相关标准将治疗效果分为完全缓解、部分缓解、疾病稳定、疾病进展,治疗总有效率=(完全缓解+部分缓解)例数/总例数×100%。
1.4.2 免疫功能治疗前和治疗后,采用ELISA检测2组血清免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)水平(上海纪宁生物科技有限公司)。
1.4.3 血清炎性因子水平血清制备同1.4.2,采用ELISA检测患者血清肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、白介素-8(IL-8)水平。
1.4.4 生存及不良反应发生情况治疗期间,观察2组恶心呕吐、放射性食管炎、血小板减少、中性粒细胞减少、脱发发生情况,统计2组随访期间患者总生存率和无进展生存率。
1.5 统计学方法
使用SPSS 21.0统计软件进行数据分析,计量资料和计数资料分别采用(±s )、例(%)表示,并分别采用t检验和χ2检验进行比较,以P<0.05表示差异具有统计学意义。
2 结果
2.1 2组临床疗效结果比较
见表1。

表1 2组临床疗效结果比较(n = 71)例
2.2 2组治疗前后免疫功能比较
见表2。
表2 2组治疗前后免疫功能比较(±s,n = 71)g·L-1
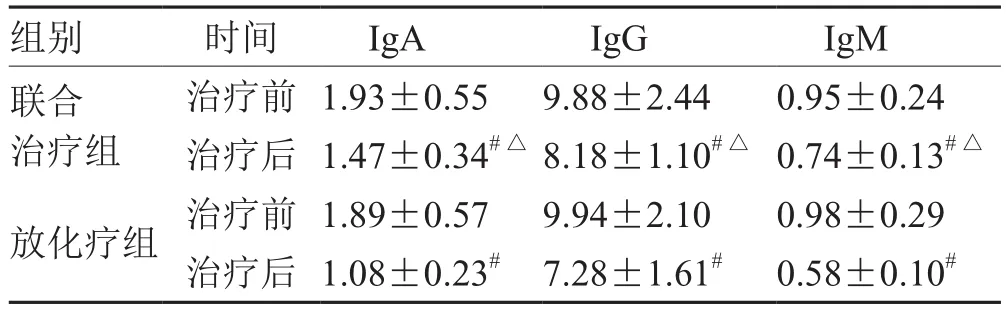
表2 2组治疗前后免疫功能比较(±s,n = 71)g·L-1
注:与治疗前比较,# P<0.05;与放化疗组比较,△P<0.05
组别 时间IgA IgG IgM联合治疗组治疗前1.93±0.559.88±2.440.95±0.24治疗后1.47±0.34#△8.18±1.10#△0.74±0.13#△放化疗组 治疗前1.89±0.579.94±2.100.98±0.29治疗后1.08±0.23# 7.28±1.61# 0.58±0.10#
2.3 2组治疗前后血清炎性因子水平比较
见表3。
表3 2组治疗前后血清炎性因子水平比较(±s,n = 71)ng·L-1

表3 2组治疗前后血清炎性因子水平比较(±s,n = 71)ng·L-1
注:与治疗前比较,# P<0.05;与放化疗组比较,△P<0.05
组别 时间TNF-α IL-6IL-8联合治疗组治疗前62.98±8.2952.97±6.8453.27±8.05治疗后26.87±3.08#△23.74±2.38#△23.28±3.08#△放化疗组治疗前63.28±8.4853.28±6.4852.47±7.38治疗后38.28±4.38# 29.06±3.86# 32.57±4.97#
2.4 2组不良反应发生情况比较
见表4。

表4 2组不良反应发生情况比较(n = 71)例
2.5 2组总生存率与无进展生存率比较
随访期间,联合治疗组总生存率(76.06%,54/71)高于放化疗组(61.97%,44/71)(P<0.05),联合治疗组无进展生存率(52.11%, 37/71)高于放化疗组(30.99%,22/71)(P<0.05)。
3 讨论
食管癌是消化系统常见的一种恶性肿瘤,发病隐匿,患者早期仅表现为吞咽粗硬食物不适,病情发展至中晚期后,大部分患者表现为吞咽困难症状,对日常生活和工作造成严重影响,对于中晚期食管癌患者,临床通常进行保守治疗[9-10]。紫杉醇是一种二萜类生物碱化合物,可通过干扰肿瘤细胞遗传物质复制过程中微丝和微管抑制肿瘤细胞遗传物质的复制,顺铂可通过与细胞核内脱氧核糖核酸的碱基结合,破坏脱氧核糖核酸复制和转录,抑制细胞有丝分裂,抑制肿瘤细胞增殖,放射治疗可在此基础上进一步杀灭肿瘤细胞,同步放化疗联合治疗可有效控制患者病情,但治疗期间患者不良反应较多,不利于长时间治疗,因此需要联合其他药物治疗提高疗效,进一步控制患者病情[11-12]。
卡培他滨可转化为氟尿嘧啶,代替尿嘧啶进入肿瘤细胞脱氧核糖核酸,有效抑制肿瘤细胞遗传物质的复制,阻断肿瘤细胞的增殖过程[13-14]。卡培他滨在体内经多次转化进入肿瘤细胞后再发挥作用,可有效降低对正常组织细胞的毒性作用,安全性良好,可有效提高患者对化疗耐受,改善患者生存状况[15]。本研究结果显示,联合治疗组治疗后临床总有效率显著高于放化疗组,随访期间,联合治疗组总生存率和无进展生存率均高于放化疗组,说明卡培他滨联合同步放化疗可有效提高中晚期食管癌患者临床疗效,改善患者生存状况,安全性良好。
免疫功能紊乱在食管癌的发生和发展中起着重要作用,同时炎症反应对于食管癌患者病情进展也有着重要影响。免疫球蛋白与免疫器官和免疫细胞共同组成机体免疫系统,其水平异常可能导致肿瘤细胞免疫逃逸的发生,导致食管癌患者肿瘤细胞增殖和转移[16];TNF-α、IL-6、IL-8是机体重要的炎性因子,可有效促进机体淋巴细胞和中性粒细胞激活,促进机体免疫功能紊乱的同时对患者血管内皮产生损伤[17]。本研究结果显示,联合治疗组治疗后血清IgA、IgG、IgM水平高于放化疗组,血清TNF-α、IL-6、IL-8水平低于放化疗组。一方面,卡培他滨可通过一种肿瘤细胞增殖降低其对中晚期食管癌患者机体免疫系统的影响及对机体的癌性浸润,降低机体炎症反应;另一方面,卡培他滨可有效抑制患者血管内皮生长因子合成,抑制肿瘤细胞的增殖、迁移和侵袭,可对免疫功能产生保护作用,因此可进一步改善机体免疫功能,降低机体炎症反应[18-19]。
综上所述,卡培他滨联合同步放化疗可降低中晚期食管癌患者机体炎症反应,提高患者2年生存率,具有较好的治疗效果,安全性良好,可能与其对患者免疫抑制较小有关,值得在临床中推广。
