HPLC法测定不同石竹中山奈酚三糖苷的含量
2022-12-09王苗苗孙瑞芬王均亮李赵菊周旭红
王苗苗,孙瑞芬,王均亮,李赵菊,张 婷,周旭红*
(1. 云南中医药大学 中药学院,云南 昆明 650500;2. 云南中医药大学 科技处科研实验中心,云南 昆明 650500)
石竹为石竹科石竹属植物,多年生草本。石竹属DianthusL.植物全球约600种,广泛分布于北温带,大部分产于欧洲和亚洲。我国有16种10变种,南北均产之,大多生于干燥向阳处。现已广泛栽培,是很好的观赏花卉,耐瓶插,常用作切花[1]。同时石竹属植物也具有很好的药用价值。因此,研究其植物活性成分的含量具有重要意义,可以为石竹属植物提供更为广阔的市场前景。
香石竹DianthuscaryophyllusL.具有清热利尿、破血、通便的功效,其花可用作芳香矫味剂、解痉剂、镇静剂[2]。在过去很长一段时间里,香石竹被用于愈合伤口,治疗咽喉和牙龈感染,胃肠道疾病以及其他各种疾病。中药瞿麦来源于石竹属植物瞿麦DianthussuperbusL. 或石竹DianthuschinensisL. 的干燥地上部分,具有利尿通淋、活血通经的功效。用于热淋、血淋、小便不通、经闭瘀阻等症[3]。现代药理学研究表明,石竹还具有抗肿瘤、抗病毒、抗氧化、抗菌和杀虫等作用[4-8]。
山奈酚三糖苷是石竹的活性成分之一,属于黄酮醇类化合物。在植物中,黄酮醇的作用是保护植物抵抗环境的各种刺激。在人体中,黄酮醇对人体的生物反应起修饰作用,具有广泛的药理作用。Liu等[9]研究发现山奈酚三糖苷可能对小鼠烧伤有疗效。用主要含有山奈酚三糖苷成分的山茶花提取物对烧伤小鼠进行治疗,可以降低促炎细胞因子的表达水平并增加胶原合成。可能通过抑制 NF-κB信号通路降低 LPS刺激的人皮肤角质形成细胞中促炎细胞因子的表达水平。因此,山奈酚三糖苷是治疗人类烧伤的有效、安全的潜在药物。Shkondrov等[10]在6-羟多巴胺诱导的离体大鼠脑突触体体外模型上发现山奈酚三糖苷具有与水飞蓟素相似的神经保护活性, 具有神经退行性疾病治疗作用。但目前对不同品种石竹中山奈酚三糖苷含量的分析评价研究尚少。
参考文献[11-13],建立合适的石竹植物中山奈酚三糖苷的含量测定方法,并使用所建HPLC法对云南省玉溪市江川区石竹种植基地采集的16种石竹以及石竹不同部位进行山奈酚三糖苷成分的含量测定,通过比较不同品种、不同部位的含量差异,为培育或采收合适的品种、植物的不同组织提供参考依据。为进一步开发利用石竹植物资源提供一定的理论基础。
1 材料与方法
1.1 试验仪器
Agilent 1260 型高效液相色谱仪(包括DAD 检测器,美国 Agilent 公司);电子天平EX125DZH(奥豪斯仪器有限公司);超声波清洗器SG3300HDT(上海冠特超声仪器有限公司);医用离心机L550(湘仪离心机仪器有限公司)。
1.2 试验材料
山奈酚三糖苷(Kaempferol-3-O-(2”-glucosyl)rutinoside)对照品(云南西力生物技术有限公司,纯度≥98%);甲醇、乙腈为色谱纯;水为超纯水;磷酸、冰乙酸等化学试剂为分析纯。石竹16个不同品种见图1以及‘BRINA’花的不同发育时期见图2,均采自云南省玉溪市江川区石竹种植基地,具体信息见表1。
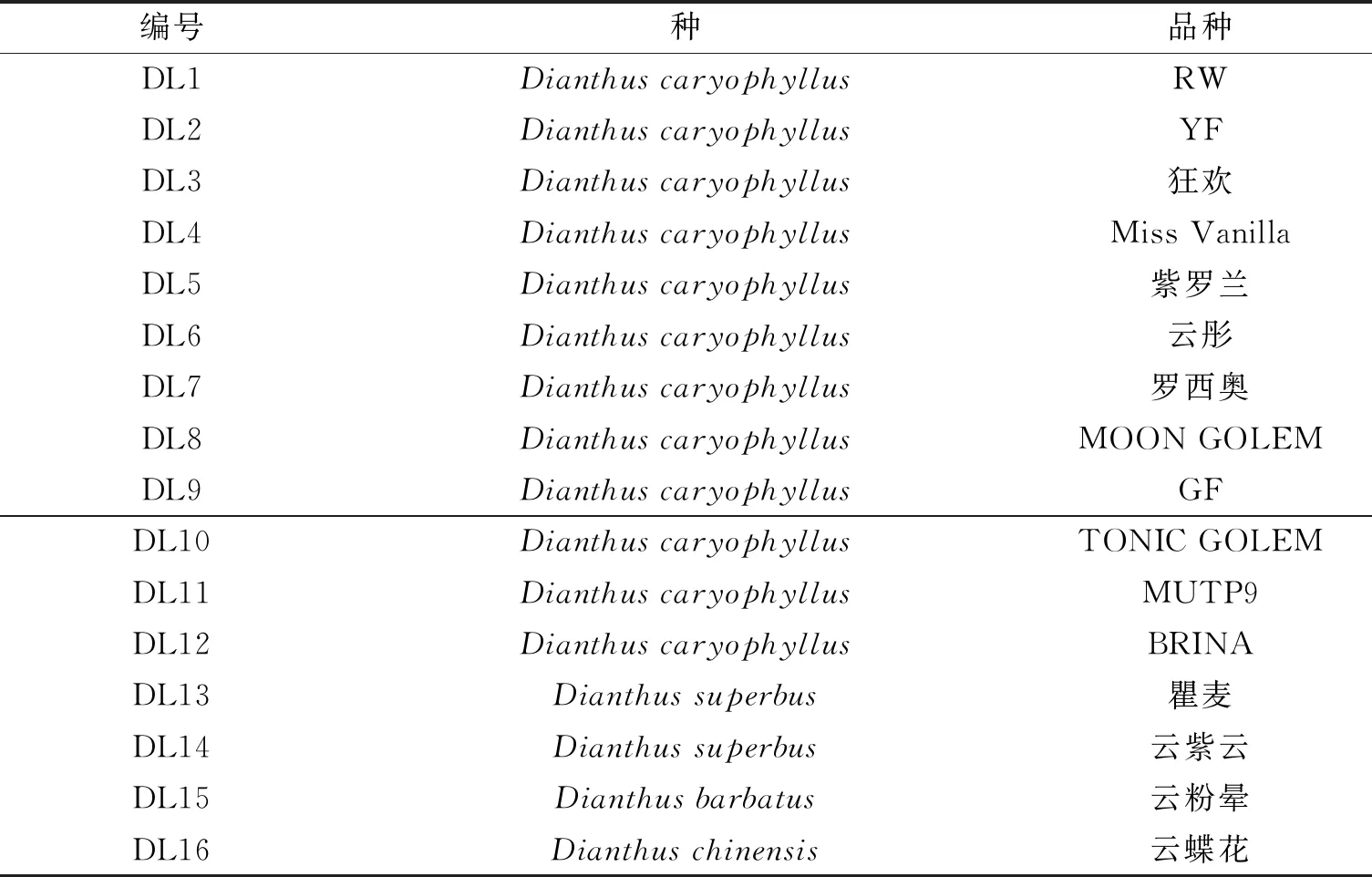
表1 石竹的不同品种信息

A,RW; B,YF; C,狂欢; D,Miss Vanilla; E,紫罗兰;F,云彤;G,罗西奥; H,MOON GOLEM; I,GF; J,TONIC GOLEM;K,MUTP9;L,BRINA;M,瞿麦;N,云紫云;O,云粉晕;P,云蝶花

图2 ‘BRINA’花的不同发育时期
1.3 试验方法1.3.1 色谱条件
经查阅并参考相关文献[11-13],最终确定的色谱条件如下:色谱柱为Agilent ZORBAX SB-C18(250 mm× 4.6 mm,5 μm)柱;流动相:A相:1.5%磷酸、40%乙腈、50%冰乙酸,B相:1.5%磷酸水溶液,洗脱条件:A相从10%~40%进行梯度洗脱,共30 min,检测波长为267 nm,柱温为30 ℃,流速为0.8 mL/min,进样量为10 μL。
1.3.2 对照品溶液的制备
精密称取山奈酚三糖苷对照品20 mg,置于10 mL 棕色量瓶中,加甲醇溶解,定容,制成浓度为2 g/L的对照品溶液。
1.3.3 供试品溶液的制备
取石竹的新鲜花瓣,用液氮冷冻干燥并迅速研磨粉碎,精密称取2.0 g放入10 mL溶剂(甲醇90%:冰乙酸10%)中,摇匀,室温浸提48 h后,补重,离心,取上清液,用0.22 μm微孔滤膜过滤,即得供试品溶液。
1.3.4 专属性试验
取对照品溶液、供试品溶液、空白对照溶液(甲醇90%:冰乙酸10%),按‘1.3.1’项色谱条件进行测定。
1.3.5 标准曲线的制作
取2 g/L的对照品溶液,用甲醇稀释成系列不同浓度的对照品溶液,按‘1.3.1’项色谱条件进样测定,得到标准曲线方程。
1.4 方法学考察试验1.4.1 精密度试验
取0.5 g/L对照品溶液适量,按‘1.3.1’项下色谱条件连续进样测定6次,记录峰面积,计算出相对标准偏差(RSD)值。
1.4.2 稳定性试验
取石竹花‘BRINA’供试品溶液适量,按‘1.3.1’项下色谱条件,分别于0、2、4、6、8、10、12、24 h进样测定,合计考察8次记录峰面积的值。并根据峰面积计算出RSD值。
1.4.3 重复性试验
精确称取‘BRINA’供试品2.0 g共6份,按‘1.3.3’项下方法制备供试品溶液,按‘1.3.1’项下色谱条件进样测定,记录峰面积,并根据数据计算出相关的RSD值。
1.4.4 加样回收率试验
共取9份新鲜‘BRINA’供试品,每份精密称取1.0 g,每3份为一组,每组分别根据样品中所含目标成分含量的50%、100%、150%精密添加低、中、高3个水平的对照品,按‘1.3.3’项下方法制备供试品溶液,按‘1.3.1’项下色谱条件进样测定,记录峰面积,计算加样回收率及RSD值。
1.5 石竹中山奈酚三糖苷的含量测定1.5.1 石竹不同品种山奈酚三糖苷含量测定
精密称取16种不同石竹鲜花样品,按‘1.3.3’项下方法制备样品溶液,按‘1.3.1’项下色谱条件进样测定,并记录峰面积的值,代入标准曲线方程,得到山奈酚三糖苷的含量。
1.5.2 ‘BRINA’花不同发育时期山奈酚三糖苷含量测定
精密称取‘BRINA’样品不同发育时期各3份,按‘1.3.3’项下方法制备样品溶液,按‘1.3.1’项下色谱条件进样测定,记录峰面积的值,代入标准曲线方程,得到山奈酚三糖苷的含量。
1.5.3 ‘BRINA’不同部位山奈酚三糖苷含量测定
精密称取‘BRINA’样品花瓣、花萼、叶、茎不同部位各3份,按‘1.3.3’项下方法制备样品溶液,按‘1.3.1’项下色谱条件进样测定,记录峰面积的值,代入标准曲线方程,得到山奈酚三糖苷的含量。
2 结果与分析
2.1 专属性考察结果
按‘1.3.4’测得的HPLC色谱图见图3。由图3可知,在相同的保留时间对照品和供试品均有峰出现,且空白对照溶液对山奈酚三糖苷的测定没有干扰。
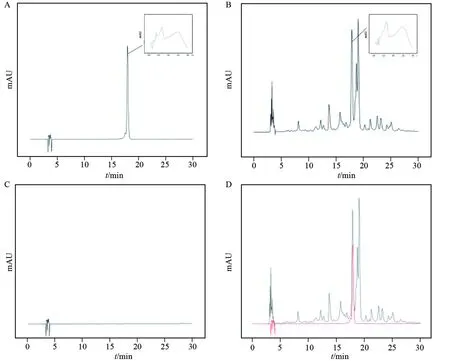
A,对照品溶液; B,石竹样品溶液; C,空白对照溶液; D,对照品与样品叠加图
2.2 山奈酚三糖苷的标准曲线
按照‘1.3.5’试验方法,以对照品溶液的浓度(g/L)为横坐标,峰面积为纵坐标,进行线性回归,结果见表2。并绘制出相应的标准曲线见图4,得出回归方程:山奈酚三糖苷为y=16 840.332 00x+84.737 89,R2=0.999 95,表明对照品在0.063~2.000 g/L的浓度范围内显示出良好的线性关系。

图4 山奈酚三糖苷的标准曲线
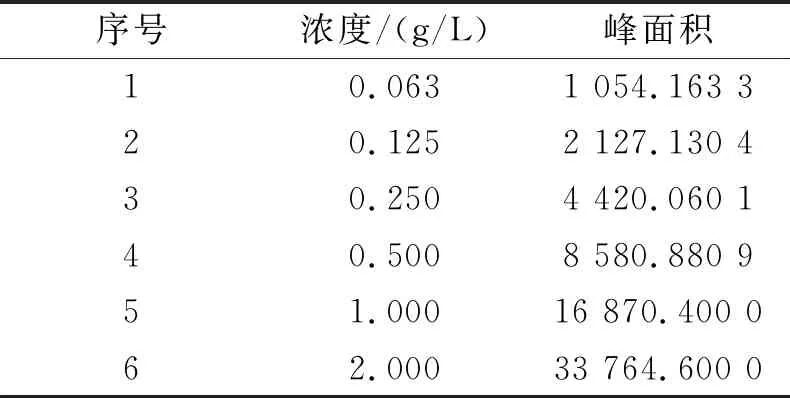
表2 山奈酚三糖苷标准曲线试验结果
2.3 方法学考察结果2.3.1 精密度试验
连续进样测定6次,根据试验结果计算出RSD值为0.48%,见表3。RSD<2%,表明仪器精密度良好。

表3 山奈酚三糖苷的精密度试验结果
2.3.2 稳定性试验
根据8次不同时间进样的峰面积计算出RSD值为1.36%,见表4。RSD<2%,表明供试品溶液在24 h内稳定性良好。

表4 山奈酚三糖苷稳定性测试结果
2.3.3 重复性试验
根据6份相同处理方法的供试品的数据,计算出相关的RSD值为1.29%,见表5。RSD<2%,表明该方法重复性良好。

表5 山奈酚三糖苷的重复性测试结果
2.3.4 加样回收率试验
根据峰面积,分别计算1∶0.5、1∶1、1∶1.5三组的加样回收率为101.22%、102.20%和101.24%,RSD值为0.55%,结果见表6。根据试验结果表明RSD<2%,说明该方法准确度良好。
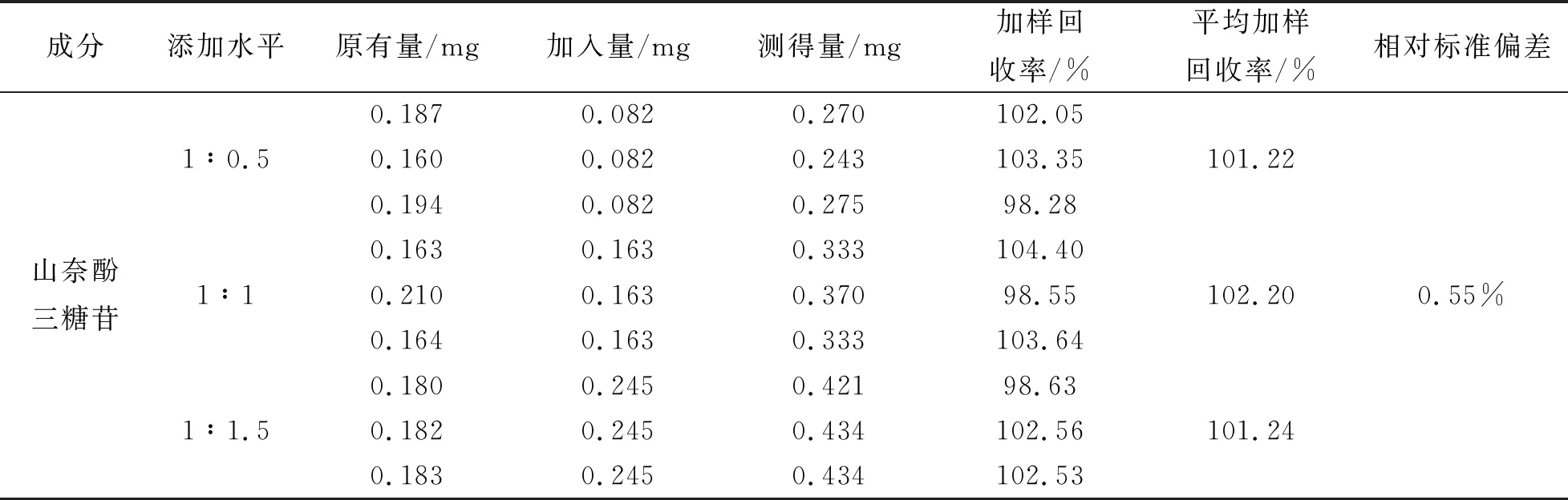
表6 山奈酚三糖苷加样回收率测试结果
2.4 石竹中山奈酚三糖苷的含量测定结果2.4.1不同品种的含量测定
根据数据计算出各个供试品的含量,结果见表7和图5。其中,用abcd等小写字母标注显著性差异的方法:首先将全部平均数从大到小依次排列,然后在最大的平均数上标上字母a;并将该平均数与以下各平均数相比,凡相差不显著的,都标上字母a,直至某一个与之相差显著的平均数,标记字母b;再以该标有b的该平均数为标准,与上方各个比它大的平均数比较,凡不显著的也一律标以字母b;再以标有b的最大平均数为标准,与以下各未标记的平均数比,凡不显著的继续标以字母b,直至遇到某一个与其差异显著的平均数标记c,以此类推。从图5和表7可以看出,以‘云粉晕’样品中山奈酚三糖苷成分的含量最高为3.866 mg/g,‘瞿麦’的含量次之为3.169 mg/g,“狂欢”的含量最低为0.274 mg/g。‘云粉晕’、‘瞿麦’、‘紫罗兰’、‘GF’、‘BRINA’5个品种的含量显著高于其他11个品种。

表7 不同品种花中山奈酚三糖苷的含量测定(n=3)
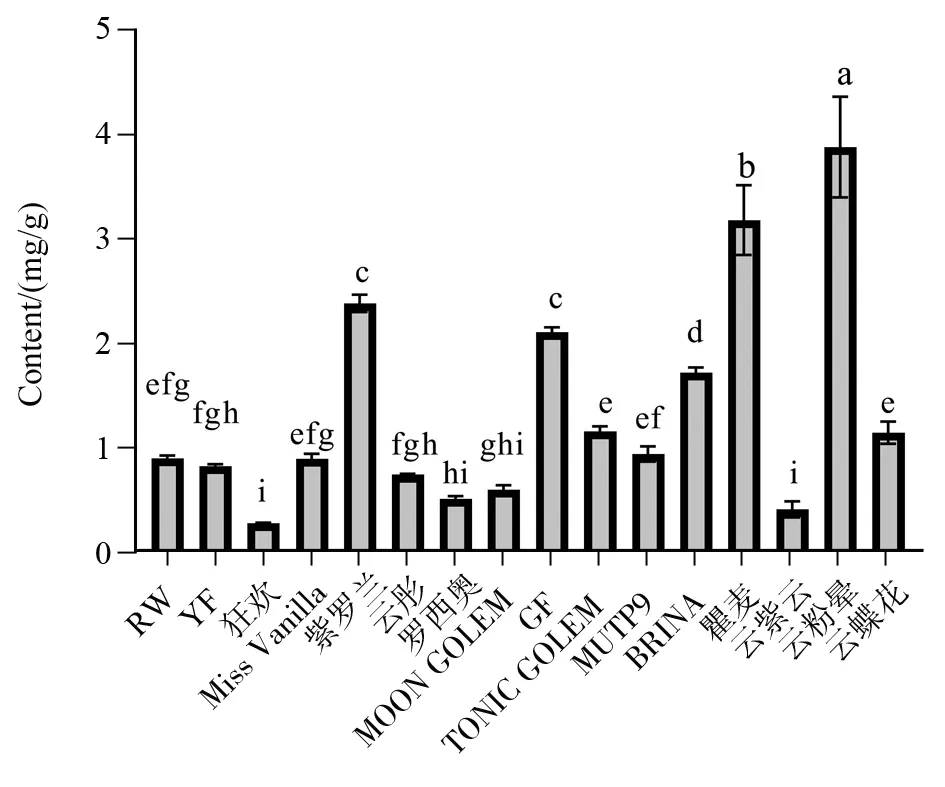
注:图中不同小写字母表示差异显著(P<0.05);图中相同小写字母表示差异不显著(P>0.05)
2.4.2 ‘BRINA’花不同发育时期的含量测定
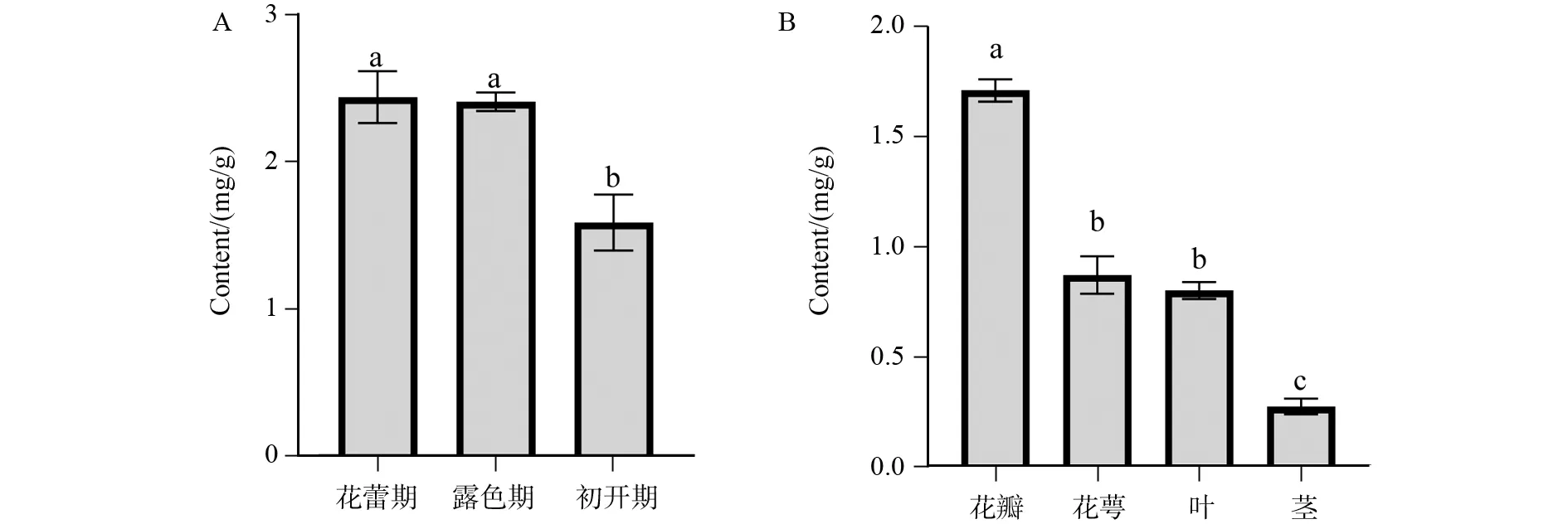
根据数据计算出各个供试品的含量,结果见表8和图6(A)。BRINA-花蕾期(2~2.5 cm)含量最高,BRINA-初开期(3~4 cm)含量最低,可以看出随着花的开放程度,山奈酚三糖苷的含量呈下降趋势。

表8 ‘BRINA’不同时期的山奈酚三糖苷的含量测定(n=3)
2.4.3 ‘BRINA’不同部位的含量测定
根据数据计算出各个供试品的含量,结果见表9和图6(B),花瓣>花萼>叶>茎,花瓣的含量最高,茎含量最低。
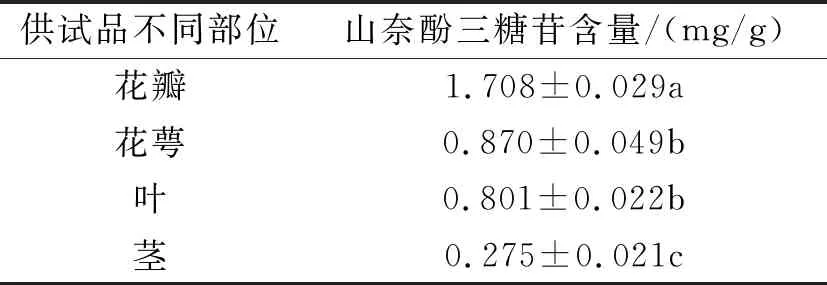
表9 ‘BRINA’不同部位的山奈酚三糖苷的含量测定(n=3)
注:图中不同小写字母表示差异显著(P<0.05);图中相同小写字母表示差异不显著(P>0.05)
3 讨论
3.1 供试品溶液制备方法及色谱条件的筛选
采用HPLC法测定了不同石竹植物中的山奈酚三糖苷的含量。供试品溶液制备考察了浸提法、超声提取法对含量的影响,最后确定为浸提法,操作简单,耗能少,且提取率较高。全波长扫描显示267 nm处有最大吸收峰,柱温在30 ℃时分离效果较好且节能,通过参考文献[11-13]及多次预实验,最后确定的色谱条件为:A通道流动相:1.5%磷酸、40%乙腈、50%冰乙酸,B通道流动相:1.5%磷酸水溶液,A通道从10%~40%进行梯度洗脱。检测波长为267 nm, 柱温为30 ℃,流速为0.8 mL/min,进样量为10 μL。方法学考察结果表明所用方法准确可靠、重复性好、待测成分不受干扰,可用于石竹中山奈酚三糖苷的含量测定。
3.2 指标成分的选择
山奈酚三糖苷是石竹的活性成分之一[14],属于黄酮醇类化合物。黄酮醇是植物中含量最丰富的类黄酮,通常以单核、二糖苷、三糖苷的形式出现[15]。作为重要的次生代谢物质,黄酮醇广泛存在于植物各种组织及不同的生长发育阶段,参与植物生长发育以及植物应对环境胁迫反应[16]。另外,黄酮醇对人体也有很大的益处,具有抗过敏、抗炎、抗肿瘤等功能。其化学成分含量及药理活性的研究,可以为含有黄酮醇类的植物提供更高的价值。
3.3 不同石竹中山奈酚三糖苷含量的差异
利用该方法测定并比较了不同品种石竹花中山奈酚三糖苷的含量,测定结果显示石竹16个品种中均含有山奈酚三糖苷成分,但是不同品种中含量有所差异,以‘云粉晕’样品中山奈酚三糖苷成分的含量最高,‘瞿麦’的含量次之,‘云紫云’和‘狂欢’的含量最低。其他品种之间含量差异较小。‘云粉晕’、‘瞿麦’、‘紫罗兰’、‘GF’、‘BRINA’5个品种的含量显著高于其他11个品种。大体上可以看出Dianthusbarbatus种含量较高,Dianthussuperbus其次,Dianthuscaryophyllus种含量略低。通过不同颜色含量的对比,本研究未发现山奈酚三糖苷的含量与花色有关。
其次又测定了‘BRINA’花不同发育时期的含量,结果显示花蕾期(2~2.5 cm)含量最高,露色期(2.5~3 cm)含量次之,初开期(3~4 cm)的含量最低。可以看出随着花的开放程度,山奈酚三糖苷的含量呈下降趋势,且花蕾期、露色期与初开期之间有显著性差异。最后又测定了‘BRINA’品种不同部位的含量,结果显示不同组织中活性物质分布存在显著差异,山奈酚三糖苷具体含量为花瓣>花萼>叶>茎。随着石竹多元化的功能性产品开发,可以依据不同品种活性成分含量的差异,培育并栽培推广专用型的石竹品种,也可以根据目标化合物选择合适的收获时间以及采收植物的不同部位。使石竹具有更广泛的市场前景。
4 结论
黄酮醇类物质是石竹的主要活性成分,具有广泛的的药理作用。对治疗疾病和维持人体健康有很大的益处。建立了一种简便的、重复性、稳定性、回收率较好的测定石竹中山奈酚三糖苷的方法。测定结果表明,山奈酚三糖苷的积累在不同品种、不同部位以及不同发育时期上都有明显的差异。随着花的开放程度,山奈酚三糖苷的含量呈下降趋势。试验结果为进一步开发利用石竹植物资源提供实验基础和依据。
