结直肠癌组织中高迁移率蛋白族1与血管内皮生长因子、微血管密度的相关性研究
2022-12-09王宝良陈铁良吴家剑杨立群董智刚
王宝良, 张 玲, 陈铁良, 吴家剑, 杨立群, 董智刚
(河北省唐山市协和医院, 1. 病理科, 2. 普通外科, 3. 麻醉科, 河北 唐山, 063000;4. 河北省唐山市丰南区医院 普通外科, 河北 唐山, 063300;5. 华北理工大学附属医院 普通外科, 河北 唐山, 063000)
结直肠癌又称大肠癌,包括结肠癌和直肠癌,是消化道最常见的恶性肿瘤,具有较高的发病率和病死率。调查[1]显示,不良的生活习惯和不合理的饮食结构可能会破坏肠道微生物稳态,增加结直肠癌的发生风险。相关研究[2]称,淋巴结转移的发生可能会促进结直肠癌的复发,而20%~25%的结直肠癌患者可能在首次确诊时即被发现有转移。因此,有效控制淋巴结转移才能降低结直肠癌的复发风险。淋巴结转移过程可能与病灶及其周围血管生成有关,且新生血管是癌细胞转移的条件之一,故控制病灶及其周围血管生成可以有效抑制癌症发展[3]。研究[4-5]显示,血管内皮生长因子(VEGF)可促进血管生成,微血管密度(MVD)可对血管生成程度进行可视化观察,两者或可作为诊断血管生成的重要指标。此外,血管生成和癌细胞浸润迁移的微环境中还伴有一定的炎症反应,例如高迁移率蛋白族1(HMGB1)作为一种炎性介质可能也参与了血管生成过程。本研究观察结直肠癌患者癌组织中HMGB1、VEGF和MVD表达情况,并探讨HMGB1与VEGF、MVD的相关性,以期为临床诊治结直肠癌提供一定参考。
1 对象与方法
1.1 研究对象
选择2020年1月—2021年11月唐山市协和医院收治的89例结直肠癌患者作为研究对象。纳入标准: ① 经病理学检验确诊结肠癌或直肠癌者; ② 参照《世界卫生组织消化系统肿瘤分类(2019年版)》[6], 肿瘤分型为腺癌者; ③ 参照美国癌症联合会TNM分期系统(第8版)[7], 癌症分期为ⅡB~ⅢC期者; ④ 预计生存期>1年,美国东部肿瘤协作组(ECOG)体力状况评分≤2分,卡氏功能状态评分(KPS)≥60分者; ⑤ 对本研究知情同意者。排除标准: ① 有其他部位肿瘤史、肿瘤家族史者; ② 近期接受结直肠癌系统性治疗者; ③ 近期服用影响免疫系统和凝血造血系统的药物者; ④ 有严重实质性组织器官功能损伤或凝血造血功能障碍者; ⑤ 合并认知障碍或精神性疾病者。
1.2 主要材料与仪器
HMGB1一抗为兔多克隆HMGB1抗体,购于上海碧云天生物技术有限公司,货号AF0180; VEGF一抗为鼠单克隆VEGF抗体, MVD可用CD34阳性表达情况表示, CD34一抗为鼠单克隆抗体,VEGF、CD34抗体均购于北京中杉金桥生物技术有限公司,货号分别为ZM-0265、ZM-0046。二抗、链霉亲和素-生物素复合物及显色剂为二步法通用试剂盒(小鼠/兔超敏聚合物法检测系统),购于北京中杉金桥生物技术有限公司,货号PV-8000D。牛血清白蛋白购于北京中杉金桥生物技术有限公司,货号ZLI-9027。主要仪器包括脱水机(型号EXCELSIORES, 赛默飞)、包埋机(型号Arcadia H,徕卡)、手动轮转式石蜡切片机(型号RM2245,徕卡)、展片机(型号ZPJ-IA, 爱华)、烤片机(型号KPJ-IA, 爱华)和生物显微镜(型号BX53, 奥林巴斯)。
1.3 组织染色方法
取结直肠癌患者手术切除的癌组织及癌旁组织,用10%中性甲醛固定,石蜡包埋,切成厚度为4 μm的多张切片。在同源组织切片中随机选取1张作为阴性对照,使用二甲苯和梯度乙醇(100%乙醇5 min, 100%乙醇5 min, 90%乙醇 5 min, 80%乙醇 3 min, 70%乙醇 2 min)对所有切片进行脱蜡,用清水冲洗2次后,加入乙二胺四乙酸(EDTA)缓冲溶液(pH值8.0)中,高压锅修复抗原,暴露抗原位点,用磷酸盐缓冲溶液冲洗2次, 5 min/次,用免疫组化笔画出染色范围,使用牛血清白蛋白封闭切片中非特异性的抗原位点,加入一抗,阴性对照切片不加抗体,与其他阳性对照切片一同放置于4 ℃环境下过夜。切片用磷酸盐缓冲溶液冲洗3次, 5 min/次,加入二抗, 37 ℃下孵育30 min, 重复磷酸盐缓冲溶液冲洗操作,加入链霉亲和素-生物素复合物(用磷酸盐缓冲溶液稀释100倍),再重复磷酸盐缓冲溶液冲洗操作,加入显色剂,清水冲洗后用苏木素复染30 s, 最后与脱蜡过程相反操作逆浓度梯度脱水,用中性树胶封片。
1.4 染色观察方法
① HMGB1和VEGF的染色观察: HMGB1主要分布于细胞核, VEGF主要分布于细胞核和细胞质,染色程度可分为无色(0分)、淡棕色(1分)、棕色(2分)、棕褐色(3分),染色范围可分为<5%(0分)、5%~<20%(1分)、20%~<50%(2分)、≥50%(3分),阳性评分=染色程度评分+染色范围评分[8], 评分越高表示阳性程度越高。② MVD的染色观察: CD34分布于细胞质,细胞质内出现棕黄色颗粒即为阳性。先在低倍镜下寻找到新生血管最密集区,然后切换至200倍视野,选取5个视野,按照MVD计数标准(明显着色的单个内皮细胞或细胞丛,或管腔直径小于50 μm的管状结构,均计数为1条微血管)对微血管染色数目进行计数,取平均值作为该切片样本的MVD结果[9]。
1.5 统计学处理

2 结 果
2.1 结直肠癌患者癌组织与癌旁组织中HMGB1、VEGF和MVD表达情况比较
根据是否发生淋巴结转移,将89例结直肠癌患者分为转移组32例和未转移组57例。2组患者癌组织中的HMGB1阳性评分、VEGF阳性评分和MVD均高于癌旁组织,差异有统计学意义(P<0.05); 转移组患者癌组织、癌旁组织中的HMGB1阳性评分、VEGF阳性评分和MVD均高于未转移组,差异有统计学意义(P<0.05)。见表1。
表1 2组患者癌组织与癌旁组织中HMGB1、VEGF和MVD表达情况比较
2.2 最佳截断值
ROC曲线结果显示,癌组织中HMGB1、VEGF和MVD诊断淋巴结转移的最佳截断值分别为阳性评分4.5分、阳性评分3.5分和平均每个200倍视野32.5条,即HMGB1阳性评分>4.5分、VEGF阳性评分>3.5分、MVD平均每个200倍视野>32.5条可视为高表达, HMGB1阳性评分≤4.5分、VEGF阳性评分≤3.5分、MVD平均每个200倍视野≤32.5条可视为低表达。见表2。
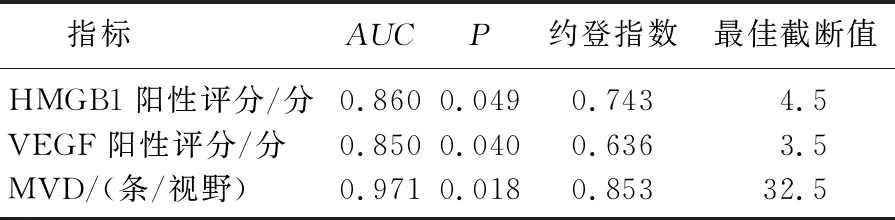
表2 癌组织中HMGB1、VEGF和MVD诊断结直肠癌患者淋巴结转移的最佳截断值
2.3 单因素分析
根据癌组织中VEGF阳性表达情况,将89例结直肠癌患者分为VEGF高表达组(阳性评分>3.5分)50例和VEGF低表达组(阳性评分≤3.5分)39例; 根据癌组织中MVD, 将89例结直肠癌患者分为MVD高表达组(平均每个200倍视野>32.5条)32例和MVD低表达组(平均每个200倍视野≤32.5条)57例。VEGF高表达组与VEGF低表达组、MVD高表达组与MVD低表达组在性别、年龄、体质量指数、病程、肿瘤最大直径、肿瘤部位、肿瘤分型方面比较,差异均无统计学意义(P>0.05); VEGF高表达组、MVD高表达组淋巴结转移者占比、HMGB1高表达者占比均分别高于VEGF低表达组、MVD低表达组,差异有统计学意义(P<0.05)。见表3。
表3 结直肠癌患者VEGF、MVD表达情况的单因素分析
2.4 癌组织中HMGB1与VEGF、MVD的相关性分析
相关性分析结果显示,结直肠癌患者癌组织中HMGB1阳性评分与VEGF阳性评分、MVD呈正相关(r=0.470、0.594,P<0.001)。
2.5 癌组织中HMGB1与VEGF、MVD的回归性分析
以癌组织中HMGB1阳性评分为因变量,以癌组织中VEGF阳性评分和MVD为自变量,分别建立癌组织中HMGB1与VEGF、MVD的线性回归方程。方程为yVEGF=2.459+0.516xHMGB1和yMVD=-17.365+13.502xHMGB1, 即HMGB1阳性评分每增加1分, VEGF阳性评分将增加0.516分, MVD将增加13.502条/视野。见表4。
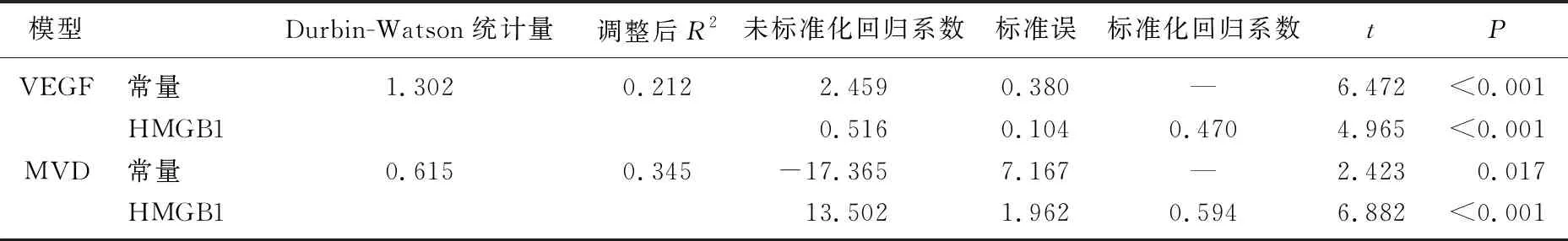
表4 结直肠癌患者癌组织中HMGB1与VEGF、MVD的回归性分析
3 讨 论
结直肠癌淋巴结转移可能导致肿瘤发展或疾病复发,其转移过程伴随着血管生成和炎性反应[10]。HMGB1是一种结构相对保守的核蛋白,在炎症反应中发挥促炎性介质的作用,其还可作为一种促血管生成因子,促进新血管生成。相关研究[11]称,结直肠癌患者癌组织中HMGB1升高会激活内皮细胞VEGF, 从而促进血管生成。另有研究[12]报道,高浓度HMGB1对缺血性疾病实验动物模型具有较好的治疗效果,提示HMGB1可以刺激内皮细胞释放VEGF等血管生成因子,并增强内皮细胞增殖和迁移能力,有效促进动脉血管生成。内皮细胞是血管内壁的主要结构,在血管生成和淋巴结转移中发挥重要作用[13]。癌症患者体内HMGB1过表达可能活化病灶及其周围内皮细胞,导致周围血管生成和淋巴结转移。
本研究结果显示,转移组患者癌组织与癌旁组织中的HMGB1阳性评分、VEGF阳性评分和MVD均高于未转移组,且转移组、未转移组患者癌组织中的HMGB1阳性评分、VEGF阳性评分和MVD均高于癌旁组织,差异有统计学意义(P<0.05)。分析可能原因,癌细胞在原发灶增殖后进入淋巴管和血管中,附着于内皮细胞游走至近端或远端,实现淋巴结转移,同时癌细胞具有较强的营养掠夺能力和侵袭能力,而新血管生成能在一定程度上增加癌细胞增殖分化所需的营养供给。
本研究中, ROC曲线分析结果显示,癌组织中HMGB1、VEGF和MVD诊断淋巴结转移的最佳截断值分别为阳性评分4.5分、阳性评分3.5分和平均每个200倍视野32.5条; VEGF高表达组、MVD高表达组淋巴结转移者占比、HMGB1高表达者占比均分别高于VEGF低表达组、MVD低表达组,差异有统计学意义(P<0.05); 癌组织中HMGB1阳性评分与VEGF阳性评分、MVD呈正相关,线性回归方程为yVEGF=2.459+0.516xHMGB1和yMVD=-17.365+13.502xHMGB1。HMGB1与血管生成相关指标VEGF、MVD均显著相关,进一步说明HMGB1表达可能影响结直肠癌患者病灶及其周围新血管的生成,促进淋巴结转移。HMGB1在胞外能激活细胞外信号调节激酶和信号通路,促进内皮细胞生长、增殖和新血管生成,在胞内能与内皮细胞溶酶体融合,诱导内皮糖蛋白释放而推动细胞增殖,促进血管生成。血管生成情况可用MVD值进行量化[14], MVD较高的恶性肿瘤患者癌组织中HMGB1呈高表达,其中结直肠癌患者体内HMGB1和VEGF均呈高表达状态。VEGF具有促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移与增殖和血管形成等作用,而HMGB1具有一定程度的促血管生成作用,这类促血管生成因子可促进结直肠癌病灶及其周围血管生成,增加淋巴结转移的发生风险。另外,随着炎症与免疫环境的失衡,结直肠癌肿瘤间质中出现活化M2型巨噬细胞,该类型细胞活化可能会诱导癌组织周围正常细胞发生上皮间质转化,促进癌细胞侵袭、浸润和肿瘤血管生成。恶性肿瘤动物模型研究[15]显示, HMGB1过表达会诱导巨噬细胞从M1型转化为M2型,而后者也会释放HMGB1, 进一步加剧炎症反应。同时,过度炎症反应还会诱导内皮细胞释放VEGF等促血管生成因子,进一步促进血管生成。因此, HMGB1过表达可能促进炎症反应,加速血管生成,推动淋巴结转移。
综上所述,结直肠癌患者癌组织中HMGB1、VEGF、MVD均呈高表达状态,且HMGB1表达与 VEGF、MVD显著相关。临床医师通过HMGB1检测结果可在一定程度上评估结直肠癌患者肿瘤部位血管新生情况,可有效预防淋巴结转移。
