2型糖尿病合并高尿酸血症患者微血管病变研究
2022-12-09李卓席黄成虎胡永梅彭彩碧
李卓席, 黄成虎, 胡永梅, 彭彩碧
(1. 重庆医科大学附属璧山医院 内分泌科, 重庆, 402760;2. 重庆市璧山区妇幼保健院 内分泌科, 重庆, 402760)
2型糖尿病(T2DM)患者常合并多种慢性并发症,可分为大血管病变、神经病变与微血管病变3大类,其中微血管病变具有特殊的病理生理变化且已有明确的诊断标准,主要包括糖尿病性肾病(DKD)、糖尿病视网膜病变(DR)、糖尿病周围血管病变(PAD)等[1]。尿酸是嘌呤代谢的终产物,主要经肾脏排出,血尿酸(SUA)升高是T2DM发生的危险因素之一,故临床中常见T2DM合并高尿酸血症(HUA)患者[2]。研究[3]表明, SUA升高与糖尿病微血管病变的发生和发展具有密切关系。T2DM患者合并HUA时,其微血管病变发生风险将进一步升高。本研究探讨T2DM合并HUA患者发生微血管病变的影响因素,以期为此类患者的健康管理提供参考依据。
1 资料与方法
1.1 一般资料
选取2019年1月—2021年12月重庆市璧山区人民医院内分泌科收治的102例T2DM合并HUA患者作为研究对象。纳入标准: ① 符合《中国2型糖尿病防治指南(2020年版)》[4]中T2DM诊断标准者; ② 符合《中国高尿酸血症相关疾病诊疗多学科专家共识》[5]中HUA诊断标准者: ③ 年龄>18岁者; ④ 具有完整临床资料者。排除标准: ① 临床确诊1型糖尿病、妊娠期糖尿病或其他特殊类型糖尿病者; ② 合并糖尿病相关急性并发症者; ③ 合并感染性疾病、严重肝功能障碍、恶性肿瘤及心脑血管疾病者; ④ 入组前3个月内服用过影响尿酸代谢的药物者; ⑤ 原发性或继发性肾脏病、肾结石患者; ⑥ 既往有痛风病史者; ⑦ 入组前6个月内有大型手术史或严重外伤者; ⑧ 合并精神类疾病、认知功能障碍及其他可能影响临床试验配合度的疾病者。本研究获得医院医学伦理学委员会审核批准,所有患者和(或)家属均知情同意,且签署知情同意书。
1.2 方法
1.2.1 一般资料收集: 从医院病历管理系统中调取并统计患者的基本信息,包括性别、年龄、病程、吸烟史(>1支/d, 持续1年以上为有吸烟史)、饮酒史(近3个月内饮酒量≥50 g/月为有饮酒史)、既往病史(高血压病等)。
1.2.2 体格指标测量: 入院当日采用身高-体质量测量仪对患者脱鞋直立身高、体质量进行测量,计算体质量指数(BMI), BMI=体质量(kg)/身高(m)2, 并测量腰臀比(WHR)。嘱患者安静坐位休息10~30 min后,使用电子血压计测量其收缩压(SBP)和舒张压(DBP)。
1.2.3 生化指标检测: 抽取患者入院当日或次日清晨空腹时(空腹8~10 h)静脉血,采用葡萄糖氧化酶法测定空腹血糖(FBG)水平,采用糖化血红蛋白(HbA1c)分析仪测定HbA1c含量,采用克曼5800全自动生化分析仪检测血清甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、SUA、血肌酐(Scr)和血尿素氮(BUN)含量。采用肾脏病膳食改良试验(MDRD)公式计算估算肾小球滤过率(eGFR), eGFR[mL/(min·1.73 m3)]=175×Scr1.234×年龄0.179×(女性×0.79)。
1.2.4 微血管病变诊断: ① DR, 由眼科专业医师采用日本Topcom TRC-50DX眼底彩色机进行彩色眼底像拍摄,结合眼底镜检查,并由至少2名专业人员阅片后诊断; ② DKD, 2次24 h尿微量白蛋白(ACR)≥30 mg; ③ PAD, 存在温度觉、振动觉、压力觉异常,伴踝反射消失,神经电生理检查显示神经传导速度减慢,同时排除其他原因所致神经病变。
1.3 统计学分析

2 结 果
2.1 微血管病变发生情况
102例患者中, 59例发生微血管病变(发生率为57.84%), 其中DKD 21例、DR 25例、PAD 13例。根据是否发生微血管病变,将102例T2DM合并HUA患者分为微血管病变组59例和非微血管病变组43例。
2.2 微血管病变与非微血管病变组临床资料比较
微血管病变组的年龄、BMI、WHR、合并高血压病者占比和SBP、FBG、HbA1c、TG、LDL-C、SUA水平均高于非微血管病变组,糖尿病病程长于非微血管病变组, eGFR低于非微血管病变组,差异有统计学意义(P<0.05); 2组患者性别构成、吸烟史、饮酒史、DBP、TC、HDL-C、BUN和Scr比较,差异无统计学意义(P>0.05)。见表1。
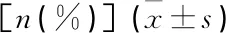
表1 微血管病变组与非微血管病变组临床资料比较
2.3 T2DM合并HUA患者发生微血管病变的影响因素分析
以T2DM合并HUA患者是否发生微血管病变为因变量(是=1, 否=0), 以单因素分析中差异具有统计学意义的指标为自变量并赋值(高血压: 无=0, 有=1; 年龄、BMI、WHR、SBP、FBG、HbA1c、TG、LDL-C、SUA、BUN、Scr和eGFR均为连续变量,取实际值),进行多因素Logistic回归分析。结果显示,WHR、高血压病、糖尿病病程、SBP、HbA1c、SUA和LDL-C均为T2DM合并HUA患者发生微血管病变的独立影响因素(P<0.05)。见表2。
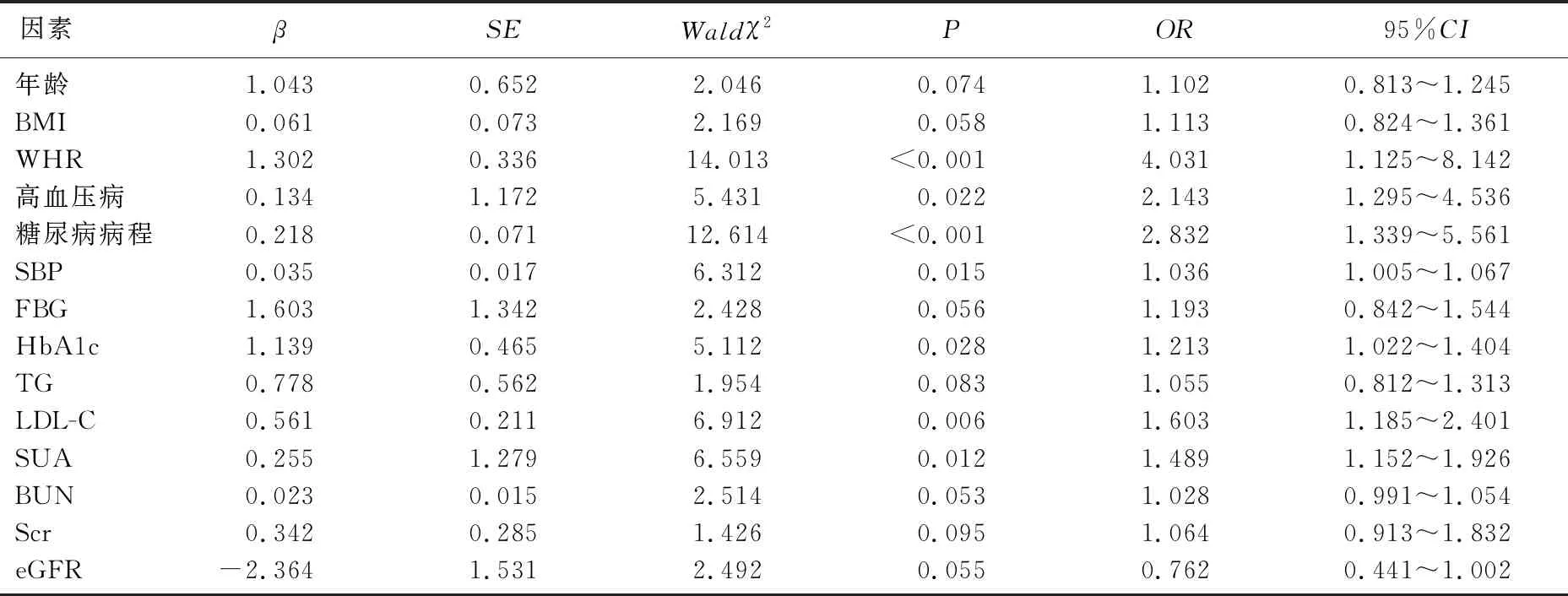
表2 T2DM合并HUA患者发生微血管病变影响因素的多因素Logistic回归分析
3 讨 论
微血管病变是T2DM患者常见并发症类型之一,且以肾脏、视网膜、周围血管等病变较为多见[6]。糖尿病微血管病变的发病机制目前仍未阐明,但学术界普遍认为是多种因素共同作用的结果。研究[7]显示, HUA作为一种嘌呤代谢障碍性疾病,与T2DM等多种代谢性疾病关系密切,且HUA可导致包含冠心病、DKD等在内的血管病变发病风险升高。因此,进一步探究T2DM合并HUA患者发生微血管病变的危险因素,对于制订此类患者的疾病管理措施意义重大。
本研究中, T2DM合并HUA患者微血管病变发生率高达57.84%, 其中DR、DKD的发生率分别为24.51%、20.59%, 均处于较高水平。既往研究[8-9]证实,年龄大、BMI高、糖尿病病程长、糖脂代谢指标异常、SUA水平高等均是T2DM患者发生微血管病变的危险因素。本研究结果也显示,微血管病变组患者的年龄、BMI、WHR、糖尿病病程和SBP、FBG、HbA1c、TG、LDL-C、SUA水平显著高于或长于非微血管病变组患者,而eGFR显著低于非微血管病变组患者。由此提示,上述因素可增加T2DM合并HUA患者发生微血管病变的风险。
本研究多因素Logistic回归分析显示,年龄与微血管病变并无显著关系,这可能是因为T2DM多见于中老年人,而本组患者整体年龄较大(平均年龄为60岁左右),加之存在其他混杂因素,造成年龄的影响有限。BMI是反映肥胖的常用指标,既往研究[10]发现,随着BMI的升高, T2DM患者发生DR等并发症的风险也越高。本研究多因素Logistic回归分析显示, BMI与微血管病变并无显著关系,但WHR是发生微血管病变的独立影响因素,这可能是由于BMI不足以全面反映肥胖情况,而WHR更有利于评估腹型肥胖。作为机体代谢紊乱的关键环节之一,腹型肥胖也是T2DM患者发生各类慢性并发症的高危因素,但其潜在机制目前尚未完全阐明[11]。相关研究[12]显示,腹型肥胖患者往往伴有炎症因子水平升高、氧化应激反应等,可能直接或间接损害微血管内皮细胞,进而增加大血管和微血管病变的发生风险。
高血压本身可引起视网膜及肾血管等病变,可能是由于血压升高可增加视网膜血流量及肾血流量等,造成微血管内皮损伤,增加微血管病变发生风险,而控制血压可降低糖尿病患者发生血管并发症的风险[13]。本研究结果显示,合并高血压病和SBP水平高均是T2DM合并HUA患者发生微血管病变的独立危险因素。高血压已被证实与HUA存在密切关系, SUA每升高10 mg/L, 高血压发生风险可升高23%左右[14]。因此,T2DM合并HUA患者具有高血压基础时,可能进一步加速DKD、DR等的发生与发展,故积极控制T2DM患者的血压及HUA在微血管病变防治中具有重要作用。
不同于其他微血管病变,DKD等糖尿病相关性血管病变具有特殊性,例如糖脂代谢紊乱等会较大程度地影响病情的发生与发展[15]。临床研究[16]发现, T2DM患者合并HUA时的代谢综合征更明显,这可能也是导致其微血管病变发生风险较高的原因之一。本研究多因素Logistic回归分析显示, FBG与微血管病变无显著关系,但HbA1c是微血管病变的独立影响因素。考虑原因, HbA1c可反映患者近3个月的平均血糖状态,相较于FBG能够更好地评价血糖控制水平,故其超过一定阈值后意味着血糖控制不理想,发生微血管病变的风险较高。研究[17]显示, T2DM患者的HbA1c水平在6.5%~7.0%范围时, HbA1c越高则微血管事件发生风险越高,当HbA1c水平>7.0%时,其主要与大血管事件发生风险及病死率有关。总之,严密监测患者的HbA1c水平变化对早期预测微血管病变具有积极意义。
研究[18]显示, TG、TC等血脂指标异常升高是T2MD患者合并微血管病变的重要原因。但本研究Logistic回归分析并未发现TG与微血管病变有显著关系,不排除样本较小等因素的影响。本研究发现LDL-C是微血管病变的独立影响因素,原因可能是LDL-C尤其是氧化型LDL-C水平升高往往可促进活性氧(ROS)的生成而在DKD、DR等的发病机制中发挥作用[15]。
SUA是一种强抗氧化剂,高水平SUA可能促进氧化应激反应,导致ROS生成和释放增多,进而激活白细胞介素等炎症因子,引发微血管内皮细胞受损[19]。高水平SUA引起的血管内皮功能损伤可影响新生血管的形成,进一步增加微血管病变发生风险。同时,SUA作为重要的代谢组分之一,其异常与糖脂代谢紊乱有着密不可分的关系,高水平SUA可能加重机体代谢紊乱程度,进而增加微血管病变的发生风险[20]。此外,尿酸可抑制胰岛素受体底物1及Akt胰岛素信号的转导,增加ROS等而加重胰岛素抵抗[21]。相关研究[22]表明, T2DM患者的SUA水平与血糖水平及胰岛素抵抗呈显著正相关,故T2DM合并HUA患者的糖代谢紊乱及胰岛素抵抗往往更显著,并发症发生风险也可能随之升高。本研究Logistic回归分析亦显示SUA是影响T2DM合并HUA患者发生微血管病变的独立危险因素,但未发现Scr、BUN及eGFR与微血管病变有显著关系,考虑原因为本研究中微血管病变包含DKD、DR、PAD, 而肾功能对后两者的影响及机制尚不明确,今后需进一步扩大样本量针对不同类型的微血管病变进行危险因素分析。
综上所述, T2DM合并HUA患者具有较高的微血管病变发生风险,而WHR、糖尿病病程、合并高血压病和SBP、HbA1c、LDL-C、SUA水平均为患者发生微血管病变的独立影响因素。因此,加强对T2DM合并HUA患者的综合管理,如改变生活方式、积极控制体质量及血压、严格控制血糖和血脂、监控SUA等,对于微血管病变的防治意义重大。但本研究样本量较小,且未单独区分不同类型微血管病变的危险因素,未来还需增加样本量、细化分析各类微血管病变发生的危险因素,从而为微血管病变的早期预测、预防、识别与干预提供可靠依据。
