灵芝多糖调控抗氧化因子表达抑制乳腺癌恶性表型研究
2022-12-08潘云霞焦卓亚刘俊卿陈峰远
潘云霞,焦卓亚,彭 灿,宋 航, 3,刘俊卿,陈峰远, 3*
灵芝多糖调控抗氧化因子表达抑制乳腺癌恶性表型研究
潘云霞1,焦卓亚1,彭 灿2, 4, 5,宋 航1, 3,刘俊卿1,陈峰远1, 3*
1. 安徽中医药大学中西医结合学院,安徽 合肥 230012 2. 安徽中医药大学药学院,安徽 合肥 230012 3. 安徽省中医药科学院中西医结合研究所,安徽 合肥 230012 4. 药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012 5. 省部共建安徽道地中药材品质提升协同创新中心,安徽 合肥 230012
研究灵芝多糖对乳腺癌MCF-7、MDA-MB-231细胞凋亡的影响及作用机制。MCF-7和MDA-MB-231细胞分别给予灵芝多糖(25、50、75 mg/mL)干预后,MTS法检测灵芝多糖对乳腺癌细胞增殖的影响;TUNEL染色及流式细胞术探测灵芝多糖对乳腺癌细胞凋亡的影响;采用流式细胞术检测细胞内活性氧(reactive oxygen species,ROS)水平;检测细胞内谷胱甘肽(glutathione,GSH)水平;采用qRT-PCR技术检测抗氧化相关基因谷氨酸-半胱氨酸连接酶调节亚基(glutamate-cysteine ligase regulatory subunit,)、谷氨酸半胱氨酸连接酶催化亚基(glutamate-cysteine ligase catalytic subunit,)、人硫氧还蛋白还原酶1(human thioredoxin reductase 1,)、苹果酸酶1(malic enzyme 1,)、硫氧还蛋白(thioredoxin,)mRNA表达;采用Western blotting检测GCLM、TXNRD1蛋白表达。给予灵芝多糖干预后,MCF-7、MDA-MB-231细胞活性明显降低(<0.01),凋亡率显著升高(<0.05、0.01),细胞内ROS水平显著升高(<0.05、0.01),GSH水平明显下降(<0.01);抗氧化因子mRNA及蛋白表达水平显著下调(<0.05、0.01)。灵芝多糖能够通过抑制GCLM等抗氧化基因表达诱导ROS生成,促进乳腺癌细胞凋亡,进而抑制乳腺癌恶性进展。
灵芝多糖;乳腺癌;活性氧;谷胱甘肽;谷氨酸-半胱氨酸连接酶调节亚基
灵芝是一种多孔菌科真菌的子实体,为我国传统著名中药,被誉为“仙草”。其味甘,性平,归心、肺、肝、肾经,具有益气活血、扶正补虚之功效。灵芝主要活性成分为三萜类和多糖类化合物,此外还含有核苷酸、生物碱、甾醇、脂肪酸、多肽以及微量元素等。灵芝多糖具有免疫调节、抗肿瘤、抗氧化、抗炎、神经保护作用等多种药理活性[1]。灵芝多糖可通过提高机体免疫力、抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤细胞转移等多种调控机制发挥抗肿瘤的功效[2]。
乳腺癌在《神农本草经》普济方中称为乳岩、石痈、翻花等[3]。中医认为气滞血瘀、痰凝毒结为乳腺癌发病之本,因此灵芝益气活血、扶正补虚治法符合乳腺癌根本治法。2020年乳腺癌新发病例数高达226万,超过肺癌,已成为全球发病率最高的恶性肿瘤[4]。尽管医疗水平的提升延长患者的生存时间,但是治疗引起的性功能障碍和疼痛等一系列问题仍造成患者生活质量下降。此外晚期乳腺癌患者5年生存率仅为20%。因此深入了解乳腺癌发生发展及转移的分子机制,为乳腺癌治疗、药物研发和诊断监测提供科学依据和新思路,具有重要的临床意义。
活性氧(reactive oxygen species,ROS)生成与乳腺癌发生发展以及转移等密切相关。研究发现,低水平的ROS可通过诱导基因突变、激活多条信号通路促进肿瘤发生发展[5];而高浓度的ROS堆积可导致线粒体功能损伤,诱导肿瘤细胞凋亡[6]。与正常细胞相比,肿瘤细胞内ROS水平增加,因此肿瘤细胞对异常增高的ROS更为敏感。冬凌草甲素[7]、松萝酸[8]等可通过诱导ROS生成诱导乳腺癌细胞凋亡。但灵芝多糖调控乳腺癌细胞氧化应激的功能及作用机制并不明确。因此本研究以人乳腺癌MCF-7和MDA-MB-231细胞株为研究对象,采用流式细胞术、Western blotting、qRT-PCR等分子生物学技术考察灵芝多糖在乳腺癌氧化应激中的调控功能及其作用机制。
1 材料
1.1 细胞
MCF-7和MDA-MB-231细胞(批号分别为SCSP-5043、SCSP-531)购自中国科学院上海生命科学研究院细胞资源中心。
1.2 药品与试剂
胎牛血清(批号04-001-1ACS)、RPMI 1640培养基(批号2134234)购自以色列BI公司;DMEM培养基(批号SH30022.01)购自Hyclone公司;青霉素-链霉素(批号C0222)、Annexin V-FITC试剂盒(批号C1062M)、谷胱甘肽(glutathione,GSH)检测试剂盒(批号S0052);RIPA裂解液购自上海碧云天生物技术有限公司;灵芝多糖(批号BCSW210324-1,质量分数为80%)购自西安百川生物科技有限公司;MTS细胞增殖试剂盒(批号G3580)购自Progema公司;4%多聚甲醛(批号1912A05)、化学发光试剂盒(批号BL520A)购自Biosharp公司;TUNEL染色试剂盒(批号7E521C1);逆转录试剂盒(批号R232-01)购自南京诺唯赞生物科技股份有限公司;H2DCFDA试剂(批号D399)购自美国Thermo Fisher Scientific公司;SYBR(批号MPC2201032)购自武汉赛维尔生物科技有限公司;Trizol(批号15596026)、ProLong™ Diamond抗淬灭封片剂(含DAPI,批号P36971)购自Invitrogen公司;谷氨酸-半胱氨酸连接酶调节亚基(glutamate-cysteine ligase regulatory subunit,)、谷氨酸半胱氨酸连接酶催化亚基(glutamate-cysteine ligase catalytic subunit,)、人硫氧还蛋白还原酶1(human thioredoxin reductase 1,)、苹果酸酶1(malic enzyme 1,)、硫氧还蛋白(thioredoxin,)、引物由生工生物工程(上海)股份有限公司合成;β-actin抗体(批号3700S)、二抗(批号14709S)购自美国CST公司;GCLM抗体(批号EPR6667)、TXNRD抗体(批号EPNCIR129)购自英国Abcam公司。
1.3 仪器
HF160W型恒温培养箱(上海力申科学仪器有限公司);318C+型酶标仪(上海赣闽分析仪器有限公司);DMi8型倒置荧光显微镜(德国Leica公司);FACSCelesta流式细胞仪(美国BD公司);1645070型电泳仪(美国Bio-Rad公司);Light Cycler96实时荧光定量PCR仪(瑞士Roche公司)。
2 方法
2.1 细胞培养
MCF-7、MDA-MB-231细胞分别用含10%胎牛血清、1%青霉素-链霉素的DMEM或RPMI 1640培养基,于37 ℃、5% CO2的培养箱中培养,取对数生长期细胞用于后续实验。
2.2 细胞增殖实验
取对数生长期的MCF-7、MDA-MB-231细胞分别以5×103个/mL接种于96孔板,100 μL/孔,置于37℃、5% CO2培养箱培养过夜。灵芝多糖用DMEM培养基分别配制成20、40、80、120 mg/mL的溶液,对照组加入不含药物的培养基,培养24 h。弃去培养基,PBS清洗后,每孔加入100 μL 1×MTS试剂,于培养箱中孵育2 h,采用酶标仪测定490 nm处的吸光度()值,计算半数抑制浓度(half inhibitory concentration,IC50),筛选后续实验剂量。
2.3 TUNEL染色检测细胞凋亡
在24孔板内放入细胞爬片,MCF-7、MDA-MB-231细胞分别以5×104个/孔接种于24孔板,置于培养箱中培养过夜。分别加入不同浓度(25、50、75 mg/mL)的灵芝多糖,另设置对照组加入不含药物的培养基,培养24 h后,弃去培养基,PBS清洗,加入4%多聚甲醛,室温静置20 min,PBS清洗2次,每次5 min。随后每孔加入0.2 mL 0.5% Triton-X100,室温静置10 min,PBS清洗2次,每次5 min,采用TUNEL染色试剂盒对细胞进行染色,PBS清洗2次,每次5 min。取出爬片,以抗淬灭封片剂封片,于荧光倒置显微镜下观察并拍照,使用LAS AF Lite软件处理,计算凋亡率。
凋亡率=TUNEL阳性细胞/DAPI阳性细胞
2.4 流式细胞术检测细胞凋亡
MCF-7、MDA-MB-231细胞分别以3×105个/孔接种于12孔板中,置于培养箱中培养过夜。按“2.3”项下方法进行分组和给药,培养24 h后,弃去培养基,PBS清洗后,加入不含EDTA的胰酶进行消化,待消化完全后,加入培养基终止消化,收集细胞,细胞计数后取5×104个细胞,加入195 μL Annexin V-FITC结合液重悬细胞并置于流式管中,加入5 μL Annexin V-FITC,轻轻混匀,加入10 μL 碘化丙啶(PI),轻轻混匀,避光冰浴20 min,随后上机检测,采用FlowJo软件分析细胞凋亡情况。
2.5 流式细胞术检测细胞内ROS水平
MCF-7、MDA-MB-231细胞分别以3×105个/孔接种于12孔板中,培养过夜。按“2.3”项下方法进行分组和给药,培养24 h后,弃去培养基,PBS清洗2次,加入500 μL培养基(含0.2 μL H2DCFDA),置于培养箱中避光培养30 min。胰酶消化后收集细胞,PBS重悬后,随后上机检测,采用FlowJo软件分析细胞内ROS水平。
2.6 细胞内GSH水平检测
MCF-7、MDA-MB-231细胞分别以3×105个/孔接种于12孔板,置于培养箱中培养过夜。按“2.3”项下方法进行分组和给药,培养24 h后,弃去培养基,PBS清洗,胰酶消化后收集细胞,细胞计数。按试剂盒说明书测定细胞内GSH水平。
2.7 qRT-PCR检测GCLM、GCLC、TXNRD1、ME1和TXN mRNA表达
MCF-7、MDA-MB-231细胞分别以3×105个/孔接种于12孔板,置于培养箱中培养过夜。按“2.3”项下方法进行分组和给药,培养24 h后,弃去培养基,PBS清洗后,按照试剂盒说明书提取细胞总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。

表1 引物序列
2.8 Western blotting检测TXNRD1和GCLM蛋白表达
MCF-7、MDA-MB-231细胞分别以3×105个/孔接种于12孔板,置于培养箱中培养过夜。按“2.3”项下方法进行分组和给药,培养24 h后,弃去培养基,PBS清洗后,用细胞刮刮取细胞,4 ℃、3600 r/min离心5 min,弃去PBS。加入RIPA裂解液,于冰上裂解细胞30 min;4 ℃、12 000 r/min离心15 min,取上清,采用BCA法进行蛋白定量。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中封闭1 h,分别加入β-actin抗体(1∶5000)、GCLM抗体(1∶1500)、TXNRD抗体(1∶1500),4 ℃摇床孵育过夜;以TBST缓冲液洗涤3次,每次10 min,加入二抗(1∶10 000),室温孵育1 h后,TBST洗膜3次,每次10 min。加入化学发光试剂显影,采用Image J软件分析条带灰度值。
2.9 统计学分析
3 结果
3.1 灵芝多糖抑制乳腺癌细胞增殖
MCF-7细胞IC50为45.17 mg/mL,MDA-MB-231细胞IC50为55.74 mg/mL,2种细胞的IC50接近50 mg/mL,因此取50 mg/mL作为后续实验的基础。将IC50的50%、100%、150%作为实验的低、中、高剂量,即分别以25、50、75 mg/mL灵芝多糖进行后续研究。如图1-A、B所示,灵芝多糖显著抑制乳腺癌细胞增殖(<0.01)。如图1-C、D所示,灵芝多糖显著诱导乳腺癌细胞凋亡(<0.01)。流式细胞术检测结果(图2)显示,给予灵芝多糖后,乳腺癌细胞的早期凋亡率和晚期凋亡率明显升高(<0.05、0.01),且呈剂量相关性。
3.2 灵芝多糖诱导乳腺癌细胞内ROS生成
如图3所示,灵芝多糖显著诱导乳腺癌细胞内ROS生成(<0.05、0.01),表明灵芝多糖可能通过诱导乳腺癌细胞ROS生成促进细胞凋亡。
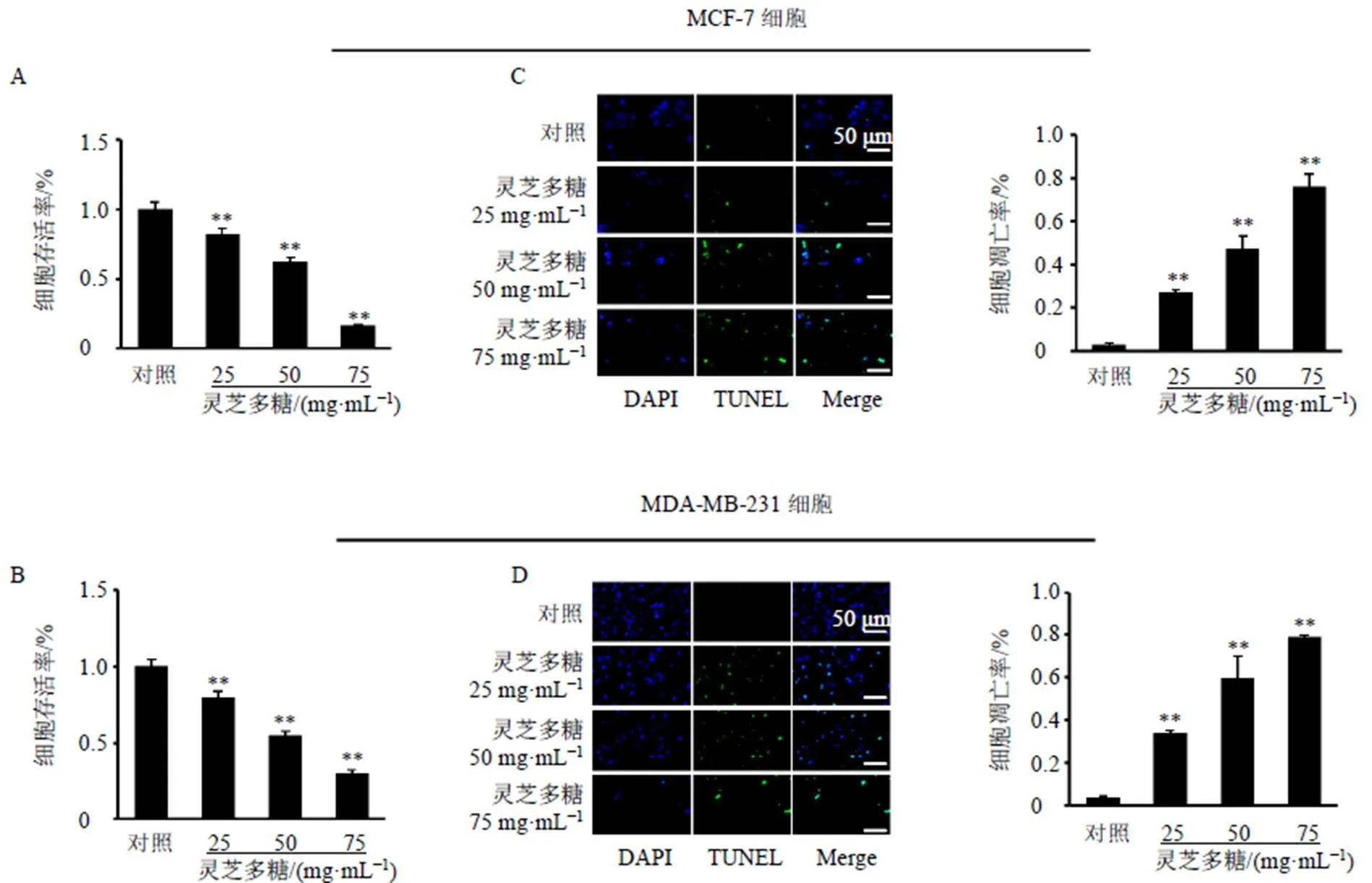
与对照组比较:*P<0.05 **P<0.01,下图同
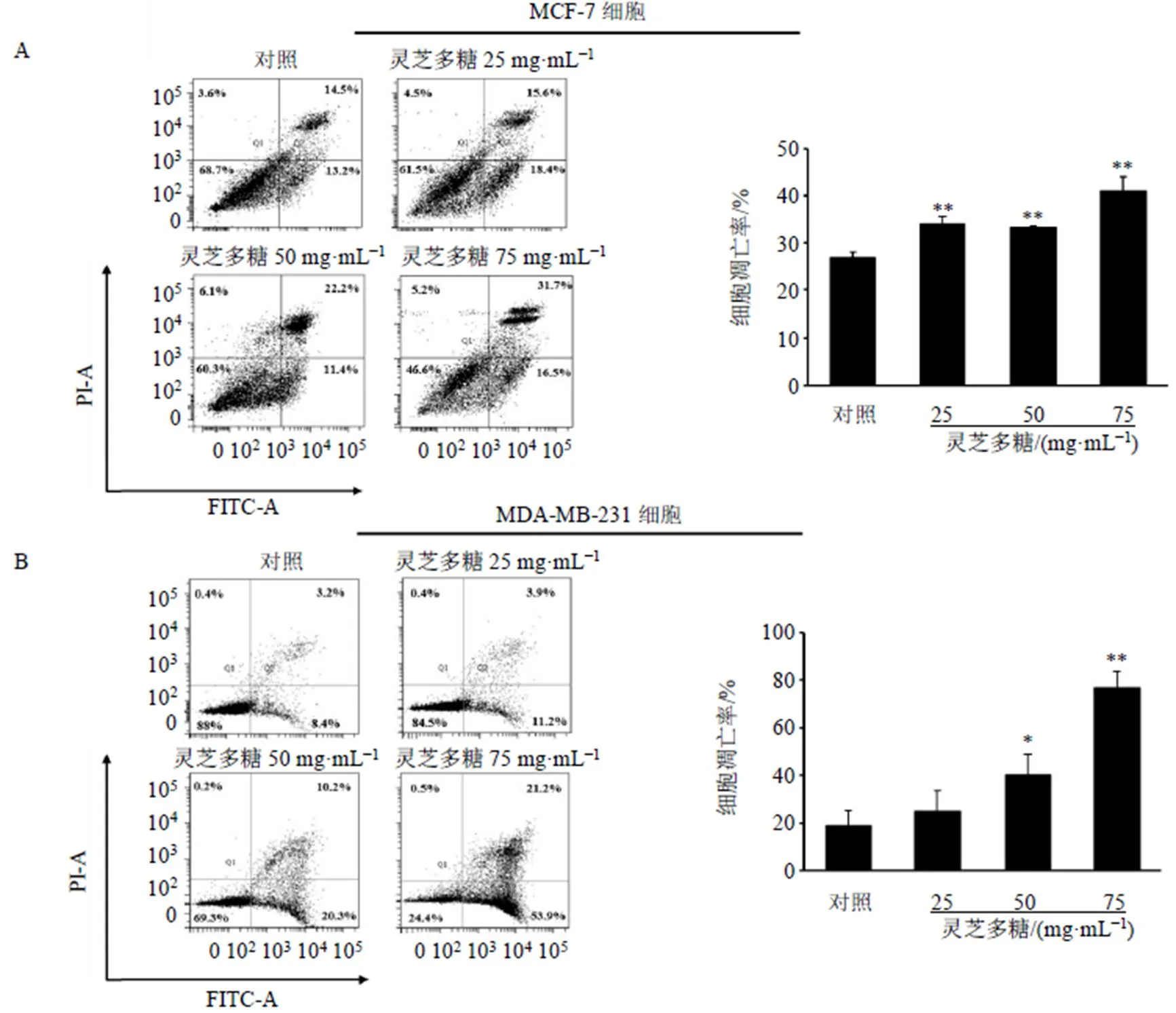
图2 灵芝多糖促进MCF-7 (A) 和MDA-MB-231 (B) 细胞凋亡(, n = 3)
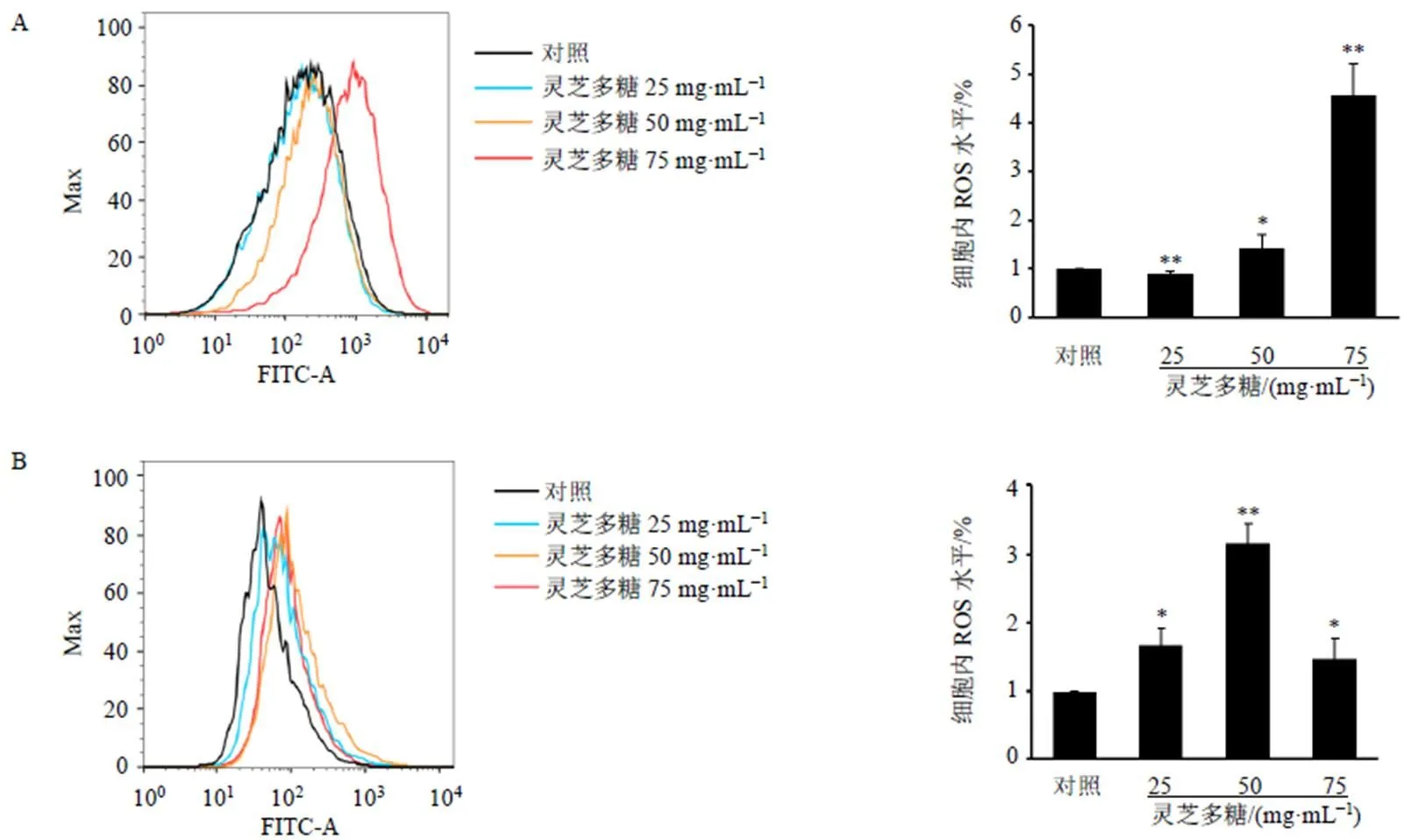
图3 灵芝多糖诱导MCF-7 (A) 和MDA-MB-231 (B) 细胞内ROS生成(, n = 3)
3.3 灵芝多糖抑制乳腺癌细胞内GSH水平
GSH是广泛存在于生物体内的生物活性非蛋白硫醇化合物。研究表明,肿瘤细胞GSH水平升高可及时清除过多的ROS,避免细胞发生凋亡[9]。推测灵芝多糖是否通过抑制GSH合成诱导乳腺癌细胞ROS生成。如图4所示,灵芝多糖显著抑制乳腺癌细胞内GSH合成(<0.01)。
3.4 灵芝多糖抑制抗氧化因子基因和蛋白表达
为了进一步探究灵芝多糖抑制GSH合成的作用机制,对MCF-7和MDA-MB-231细胞抗氧化因子的基因及蛋白表达进行检测。如图5、6所示,灵芝多糖显著抑制MCF-7及MDA-MB-231细胞、、和mRNA表达(<0.05、0.01),显著抑制MCF-7细胞mRNA表达(<0.05),而灵芝多糖高剂量组MDA-MB-231细胞中mRNA表达显著上调(<0.01)。Western blotting实验也证实灵芝多糖可显著抑制GSH合成关键酶GCLM蛋白表达(<0.05、0.01)。TXNRD可以通过活性中心二硫醇可逆氧化成二硫化物,作为氧化还原反应中的氢供体,发挥抗氧化功能。结果显示,灵芝多糖可显著抑制TXNRD蛋白表达(<0.01)。
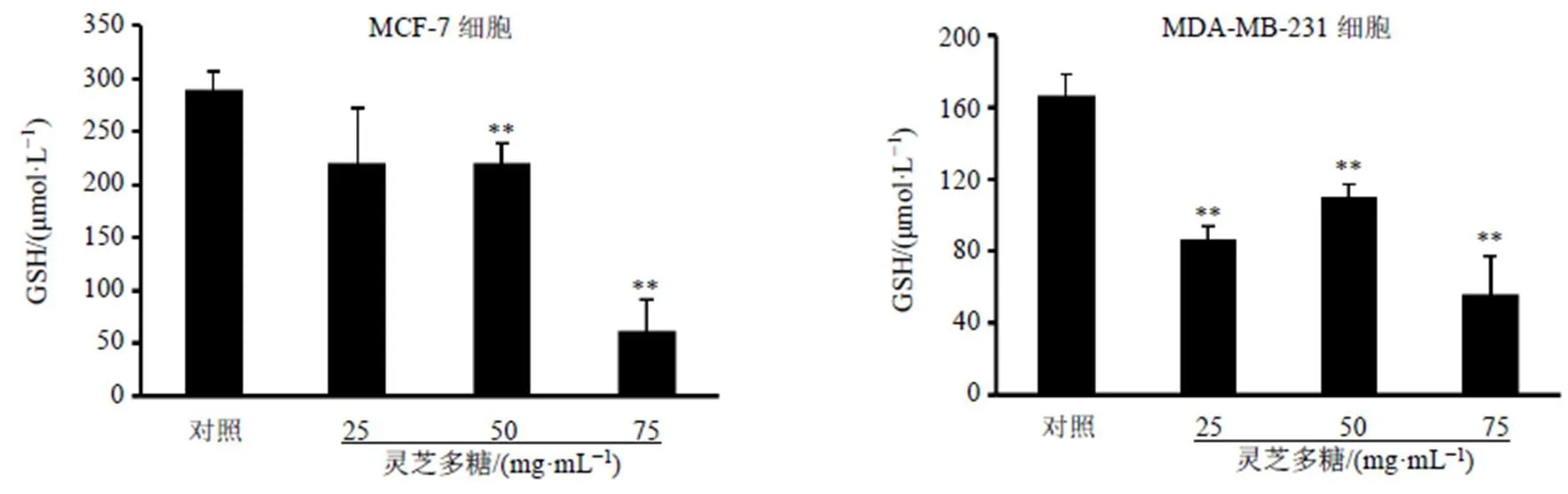
图4 灵芝多糖抑制MCF-7和MDA-MB-231细胞内GSH合成(, n = 3)
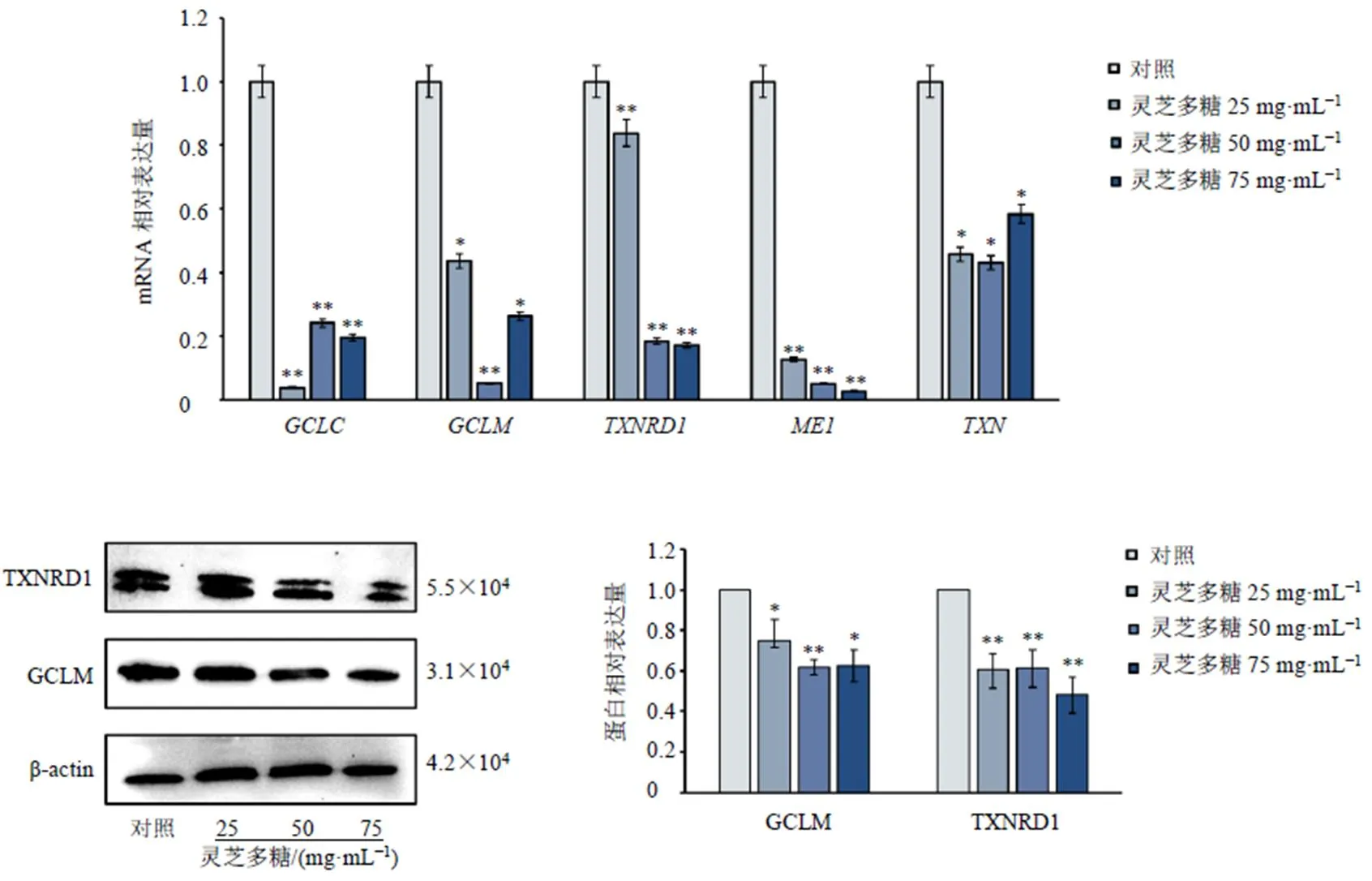
图5 灵芝多糖抑制MCF-7细胞抗氧化相关因子表达(, n = 3)
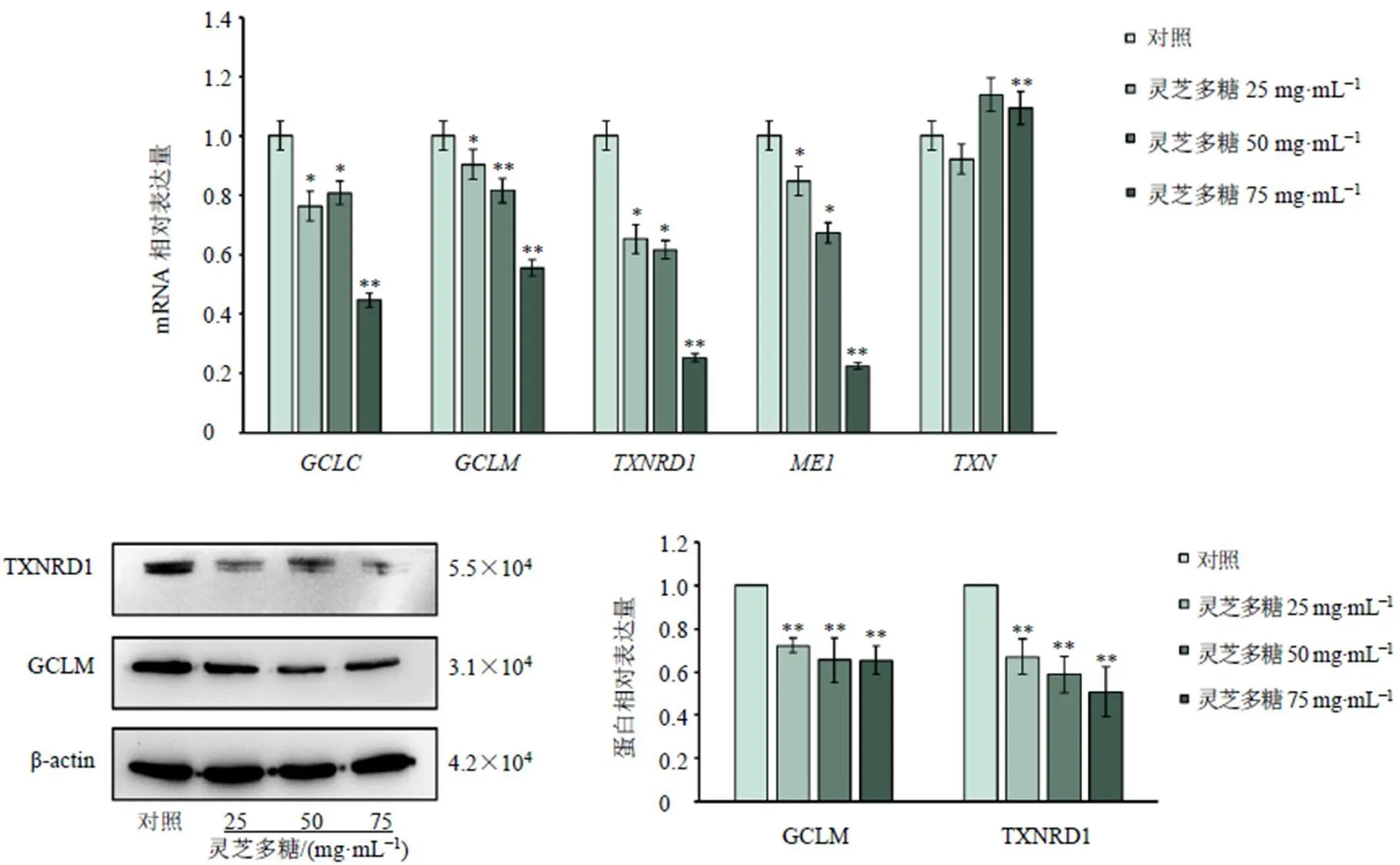
图6 灵芝多糖抑制MDA-MB-231细胞抗氧化相关因子表达(, n = 3)
4 讨论
2020年我国乳腺癌新发病例约33.2万,发病病例高居全球第1位;死亡人数约为11.7万,位居女性恶性肿瘤死亡首位[10]。在过去10年,乳腺癌的预防、诊断和治疗方面取得了重大进展[11]。目前乳腺癌的治疗选择包括手术干预、放疗、新化疗和辅助化疗、激素疗法或分子靶向疗法,可根据患者的身体状况和癌症状态,制定个性化治疗方案[12]。尽管这些治疗延长了患者的生存周期,但是晚期乳腺癌患者死亡率高。与此同时,三阴性乳腺癌具有恶性度高、侵袭性强、预后差等特征,患者对内分泌治疗和靶向治疗不敏感。因此进一步研究乳腺癌恶性进展分子机制,寻求一种不良反应小的辅助治疗方法具有重要意义。
灵芝被誉为“仙草”“瑞草”,是我国传统著名中药。灵芝具有增强机体免疫力、抗炎、抗肿瘤等多种药理作用[13],灵芝多糖是灵芝的主要成分,可抑制结肠癌[14]、肺癌[15]、前列腺癌[16]、肝癌[17]等多种恶性肿瘤发生发展。研究显示,灵芝多糖通过诱导表达抑制调节性T细胞功能,进而抑制肝癌发生发展[17];灵芝多糖可通过改善肠道菌群,激活腹膜巨噬细胞吞噬功能,促进自噬体形成抑制结肠癌恶性进展[14];灵芝水提物通过抑制尿激酶型纤溶酶原激活物(urokinase type plasminogen activator,uPA)、核因子-κB(nuclear factor-κB,NF-κB)活性,抑制MDA-MB-231细胞增殖与迁移[18];灵芝孢子多糖与紫杉醇联合用药可通过调控肿瘤代谢、增强机体免疫力、改善肠道菌群失调,从而显示出更好的抗乳腺癌活性[19]。本研究通过MTS增殖法、TUNEL染色及Annexin V-FITC双染确定灵芝多糖可抑制乳腺癌细胞增殖并诱导乳腺癌细胞凋亡。
ROS是细胞线粒体电子传递链产生的性质活泼的含氧物质。因线粒体功能障碍、代谢改变、基因突变,癌细胞中ROS产量明显增加[20]。适度提高ROS的水平可激活p38有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)、Janus激酶(Janus kinase,JAK)/信号转导及转录激活因子(signal transducer and activator of transcription,STAT)等多条信号通路促进肿瘤细胞增殖[21],可通过抑制缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)蛋白降解促进肿瘤细胞侵袭[22]。然而,过度的ROS积累可导致大分子物质氧化损伤,从而引起细胞死亡[23]。补骨脂乙素、冬凌草甲素等能够通过诱导乳腺癌细胞内ROS升高诱导细胞凋亡,抑制细胞增殖,进而发挥抗肿瘤作用[7,24]。灵芝提取物可通过促进前列腺癌PC-3细胞ROS生成诱导前列腺癌细胞凋亡[16]。本研究以H2DCFDA为细胞内ROS探针,发现灵芝多糖可升高MCF-7及MDA-MB-231细胞内ROS水平。MCF-7细胞中,灵芝多糖高剂量组ROS水平最高;而MDA-MB-231细胞中,灵芝多糖中剂量组ROS水平最高,其原因可能为①凋亡影响:流式结果中,对于MCF-7细胞,灵芝多糖高剂量组细胞凋亡率约为41%;而对于MDA-MB-231细胞,灵芝多糖高剂量组细胞凋亡率约为76.7%;相较于MCF-7细胞,灵芝多糖高剂量组MDA-MB-231细胞凋亡率更高。H2DCFDA为探针检测ROS主要针对活细胞,由于灵芝多糖高剂量组MDA-MB-231细胞凋亡率过高,因此灵芝多糖中剂量组MDA-MB-231细胞内ROS水平最高。②细胞背景不同:MCF-7细胞是雌激素受体阳性乳腺癌细胞(ER+,野生型p53),MDA-MB-231细胞是三阴性乳腺癌细胞(ER−,突变型p53),由于细胞背景及代谢不同,也可能导致此差异。
由于肿瘤细胞具有高负荷的ROS特征,其细胞进化出多种防御机制降低ROS的不利影响,其中一种重要机制是激活抗氧化系统。抗氧化系统主要有2类,第1类是抗氧化酶类,包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等,第2类是含巯基的小分子蛋白质,包括硫氧还蛋白(thioredoxin,Trx)和GSH等。GSH是一种由-谷氨酸、-半胱氨酸和甘氨酸组成的三肽。GSH是由半胱氨酸、谷氨酸和甘氨酸在胞质中通过两步反应合成,第1步反应是由GCLC和催化亚基GCLM催化下形成γ-谷氨酰半胱氨酸;第二步反应是谷胱甘肽合成酶将甘氨酸添加到γ-谷氨酰半胱氨酸中并产生GSH。其中GCLM是GSH合成关键限速酶[25]。研究显示,HIF-1可在缺氧条件下激活GCL表达和促进GSH合成,从而促进化疗后乳腺癌干细胞增殖[26]。本研究发现灵芝多糖可抑制MCF-7及MDA-MB-231细胞内GSH生成,推测灵芝多糖通过抑制GSH生成诱导乳腺癌细胞ROS生成。结果显示,MDA-MB-231细胞中,灵芝多糖中剂量组GSH水平高于低剂量组,推测可能是由于癌细胞除合成GSH等含巯基的小分子物质,还可通过表达抗氧化酶消除ROS所带来的不利影响,因此低剂量的灵芝多糖在MDA-MB-231细胞中可能通过其他保护机制减少氧化应激损伤。MDA-MB-231细胞中,灵芝多糖中剂量组、等mRNA与蛋白表达水平均高于高剂量组;GCLM与GCLC为谷胱甘肽生物合成过程的限速酶,因此灵芝多糖中剂量组细胞内GSH水平显著高于高剂量组。
作为GSH合成关键限速酶的修饰亚基,GCLM在肿瘤发生发展有着重要作用。GCLM缺失导致乳腺癌小鼠模型中的肿瘤延迟发病[25];此外,GCLM高表达与非小细胞肺癌的治疗抗性有关[27]。Western blotting及qRT-PCR结果显示,灵芝多糖可通过抑制TXNRD1、GCLM多种抗氧化因子表达抑制GSH生成,进而诱导细胞内ROS生成。推测灵芝多糖可能够通过抑制多种抗氧化基因表达诱导ROS生成,从而诱导乳腺癌细胞凋亡,进而抑制乳腺癌恶性进展(图7)。
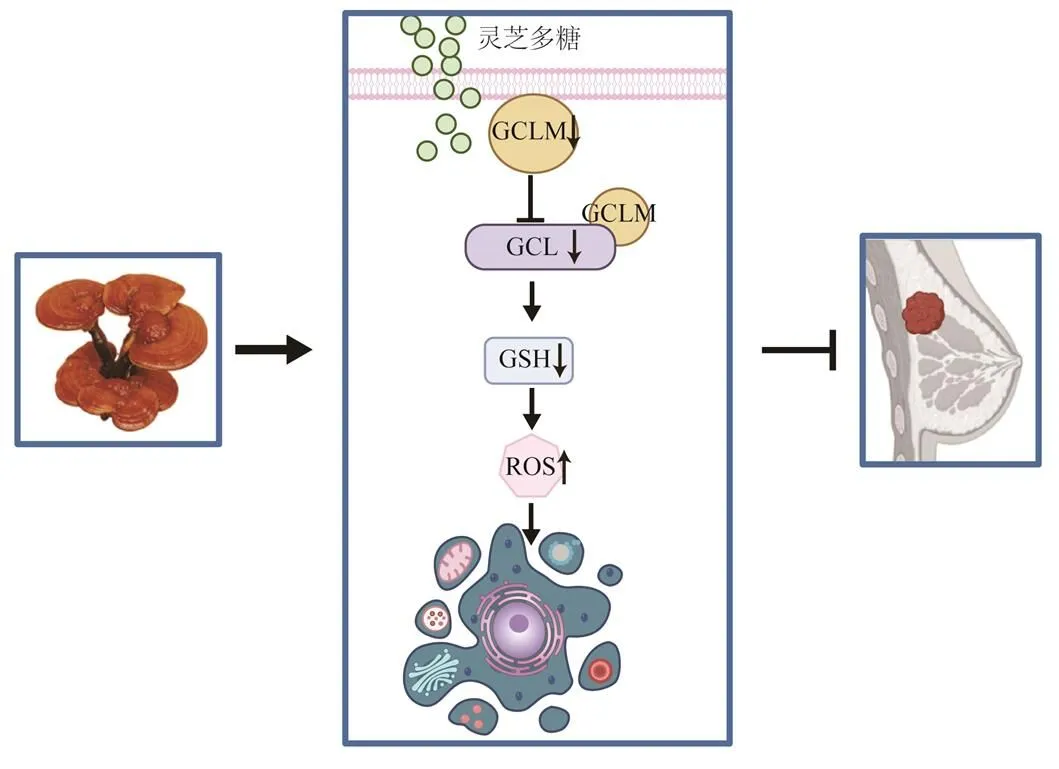
图7 灵芝多糖诱导乳腺癌细胞凋亡的作用机制
综上所述,本研究初步探讨了灵芝多糖在乳腺癌氧化应激中的功能及其相关分子机制,验证了灵芝多糖通过抑制GCLM抑制GSH合成,从而诱导ROS在细胞内大量累积,最终诱导乳腺癌MDA-MB-231及MCF-7细胞凋亡。
利益冲突 所有作者均声明不存在利益冲突
[1] 谢溢坤, 张静, 余茜, 等. 灵芝多糖类成分及其生物活性研究进展 [J]. 中草药, 2021, 52(17): 5414-5429.
[2] Ahmad M F.: A rational pharmacological approach to surmount cancer [J]., 2020, 260: 113047.
[3] 宋·陈自明原著, 明·薛已校注, 许润三注释. 《校注妇人良方》注释 [M]. 南昌: 江西人民出版社, 1983: 449-450.
[4] Sung H, Ferlay J, Siegel R L,. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2021, 71(3): 209-249.
[5] Cheung E C, Vousden K H. The role of ROS in tumour development and progression [J]., 2022, 22(5): 280-297.
[6] Gorrini C, Harris I S, Mak T W. Modulation of oxidative stress as an anticancer strategy [J]., 2013, 12(12): 931-947.
[7] Zhao Y, Xiao W W, Peng W Q,. Oridonin-loaded nanoparticles inhibit breast cancer progression through regulation of ROS-related Nrf2 signaling pathway [J]., 2021, 9: 600579.
[8] 左舒婷. 松萝酸通过ROS诱导乳腺癌细胞凋亡机制的实验研究 [D]. 长春: 吉林大学, 2016.
[9] Niu B Y, Liao K X, Zhou Y X,. Application of glutathione depletion in cancer therapy: Enhanced ROS-based therapy, ferroptosis, and chemotherapy [J]., 2021, 277: 121110.
[10] 闵淑慧, 胡依, 郭芮绮, 等. 1990—2019年中国女性乳腺癌疾病负担及变化趋势分析 [J]. 现代预防医学, 2021, 48(16): 2941-2945.
[11] DiNardo D, McNeil M A. Update in breast cancer screening, prevention, and treatment [J]., 2021, 30(8): 1074-1077.
[12] Fan L, Strasser-Weippl K, Li J J,. Breast cancer in China [J]., 2014, 15(7): e279-e289.
[13] 方雅玲, 张玉琴, 吴长辉, 等. 灵芝孢子油、破壁灵芝孢子粉及灵芝孢子提取物对小鼠急性胃溃疡的保护作用[J]. 药物评价研究, 2022, 45(2): 308-313.
[14] Guo C L, Guo D D, Fang L,.polysaccharide modulates gut microbiota and immune cell function to inhibit inflammation and tumorigenesis in colon [J]., 2021, 267: 118231.
[15] Hsu W H, Qiu W L, Tsao S M,. Effects of WSG, a polysaccharide from, on suppressing cell growth and mobility of lung cancer [J]., 2020, 165(Pt A): 1604-1613.
[16] Wu K K, Na K, Chen D,. Effects of non-steroidal anti-inflammatory drug-activated gene-1 onpolysaccharides-induced apoptosis of human prostate cancer PC-3 cells [J]., 2018, 53(6): 2356-2368.
[17] Li A M, Shuai X Y, Jia Z J,.polysaccharide extract inhibits hepatocellular carcinoma growth by downregulating regulatory T cells accumulation and function by inducing microRNA-125b [J]., 2015, 13: 100.
[18] Sliva D, Labarrere C, Slivova V,.suppresses motility of highly invasive breast and prostate cancer cells [J]., 2002, 298(4): 603-612.
[19] Li D, Gao L, Li M X,. Polysaccharide from spore ofameliorates paclitaxel-induced intestinal barrier injury: Apoptosis inhibition by reversing microtubule polymerization [J]., 2020, 130: 110539.
[20] Moloney J N, Cotter T G. ROS signalling in the biology of cancer [J]., 2018, 80: 50-64.
[21] Shi Y, Xu S F, Ngoi N Y L,. PRL-3 dephosphorylates p38 MAPK to promote cell survival under stress [J]., 2021, 177: 72-87.
[22] Wang Y W, Qi H, Liu Y,. The double-edged roles of ROS in cancer prevention and therapy [J]., 2021, 11(10): 4839-4857.
[23] 牟伊, 文帅, 高新星, 等. 基于活性氧调控的抗肿瘤药物研究进展 [J]. 药学学报, 2020, 55(7): 1453-1465.
[24] 张玉心, 高美佳, 朱美林, 等. 补骨脂乙素通过多途径诱导人乳腺癌MCF-7细胞死亡 [J]. 南方医科大学学报, 2022, 42(6): 878-885.
[25] Lu S C. Regulation of glutathione synthesis [J]., 2009, 30(1/2): 42-59.
[26] Lu H Q, Samanta D, Xiang L S,. Chemotherapy triggers HIF-1-dependent glutathione synthesis and copper chelation that induces the breast cancer stem cell phenotype [J]., 2015, 112(33): E4600-E4609.
[27] Fujimori S, Abe Y, Nishi M,. The subunits of glutamate cysteine ligase enhance cisplatin resistance in human non-small cell lung cancer xenografts[J]., 2004, 25(2): 413-418.
polysaccharide inhibits malignant phenotype of breast cancer via regulation of antioxidant factor expressions
PAN Yun-xia1, JIAO Zhuo-ya1, PENG Can2, 4, 5, SONG Hang1, 3, LIU Jun-qing1, CHEN Feng-yuan1, 3
1. School of Integrated Chinese and Western Medicine, Anhui University of Chinese Medicine, Hefei 230012, China 2. School of Pharmacy, Anhui University of Chinese Medicine, Hefei 230012, China 3. Institute of Integrated Chinese and Western Medicine, Anhui Academy of Chinese Medicine, Hefei 230012, China 4. Anhui Province Key Laboratory of Pharmaceutical Preparation Technology and Application, Hefei 230012, China 5. MOE-Anhui Joint Collaborative Innovation Center for Quality Improvement of Anhui Genuine Chinese Medicinal Materials, Hefei 230012, China
To study the effect and mechanism ofpolysaccharide (GLP) on apoptosis of MCF-7 and MDA-MB-231 breast cancer cells.MCF-7 cells and MDA-MB-231 cells were treated with GLP (25, 50, 75 mg/mL), MTS method was used to detect the effect of GLP on the proliferation of breast cancer cells; TUNEL staining and flow cytometry were used to detect the effect of GLP on apoptosis of breast cancer cells; The level of reactive oxygen species (ROS) in cells was detected by flow cytometry; The intracellular glutathione (GSH) level was detected; The mRNA expressions of antioxidant related genes glutamate cysteine ligase regulatory subunit (), glutamate cysteine ligase catalytic subunit (), human thioredoxin reductase 1 (), malic enzyme 1 () and thioredoxin () were detected by qRT-PCR technique; Western blotting was used to detect the expressions of GCLM and TXNRD1 proteins.After GLP intervention, activities of MCF-7 and MDA MB-231 cells were significantly decreased (< 0.01), apoptosis rate was increased (< 0.05, 0.01), intracellular ROS level was increased (< 0.05, 0.01), and GSH level was decreased (< 0.01); mRNA and protein expressions of antioxidant factors were significantly decreased (< 0.05, 0.01).GLP can induce ROS production by inhibiting the expression of antioxidant genes such as GCLM, promote the apoptosis of breast cancer cells, and then inhibit the malignant progress of breast cancer.
polysaccharide; breast cancer; reactive oxygen species; glutathione; glutamate-cysteine ligase regulatory subunit
R285.5
A
0253 - 2670(2022)23 - 7440 - 09
10.7501/j.issn.0253-2670.2022.23.014
2022-08-26
安徽省教育厅重点研究项目(KJ2021A0603);安徽省留学回国人员创新创业扶持计划(2020LXC009);安徽中医药大学青年科技英才培育项目(2021qnyc03);安徽省重点实验室开放课题(KFZZ202205);安徽高校协同创新项目(GXXT-2020-025);安徽省科技重大专项(202103a07020001);大学生创新创业训练计划(S202110369084)
潘云霞(1996—),女,硕士研究生,研究方向为中医药防治肿瘤。Tel: 15855192321 E-mail: yunxiapan@sina.com
通信作者:陈峰远(1989—),女,硕士生导师,副教授,研究方向为中医药防治肿瘤。Tel: 19810698616 E-mail: isobellachen@163.com
[责任编辑 李亚楠]
