黄芩水煎液中化学成分的定性及定量研究
2022-12-08高文雅周严严李明利王琳娜赵海誉边宝林王宏洁杨伟鹏
高文雅,李 涛, 2#,周严严,李明利,王琳娜,赵海誉,边宝林,王宏洁,冯 雪,杨伟鹏*,司 南*
黄芩水煎液中化学成分的定性及定量研究
高文雅1,李 涛1, 2#,周严严1,李明利1,王琳娜1,赵海誉1,边宝林1,王宏洁1,冯 雪1,杨伟鹏1*,司 南1*
1. 中国中医科学院中药研究所,北京 100700 2. 中国中医科学院医学实验中心,北京 100700
分析黄芩水煎液中的化学成分,并对其中的主要成分进行定量研究,为黄芩质量标准的建立和进一步研究提供参考依据。定性分析采用UHPLC LTQ-Orbitrap MS技术,0.1%甲酸水-乙腈为流动相,梯度洗脱,分析化合物的精确相对分子质量及碎片离子信息。通过对照品对比、分析化合物质谱裂解碎片推测未知物。定量分析采用HPLC-UV技术,1%乙酸水溶液-乙腈为流动相,梯度洗脱,测定10批黄芩中主要成分含量。从黄芩水煎液中分析鉴定了86种化合物,含65个黄酮、11个有机酸、7个氨基酸、2个苯乙醇苷、1个其他类化合物。对黄芩中黄芩苷、汉黄芩苷、千层纸素A-7--β--葡萄糖醛酸苷、黄芩素、汉黄芩素及千层纸素A进行了含量测定,结果表明黄芩不同批次之间的黄酮类成分含量有一定差异,但6个黄酮的总量相对稳定(18.09%~25.33%,RSD为9.95%)。全面分析了黄芩水煎液的化学成分,并建立了6个黄酮成分的定量分析方法,可为黄芩的质量控制和质量标准建立提供数据参考。
黄芩水煎液;UHPLC LTQ-Orbitrap MS;黄酮;多成分定量分析;黄芩苷;汉黄芩苷;千层纸素A-7--β--葡萄糖醛酸苷;黄芩素;汉黄芩素;千层纸素A
黄芩为唇形科植物黄芩Georgi的干燥根。出自东汉《神农本草经》,具有清热燥湿、泻火解毒、止血、安胎等功效[1]。黄芩在中医临床治疗中的应用十分广泛,涵盖了153种中医疾病,主要涉及肺热咳嗽、痞满、泻痢、胎动不安等[2]。目前已从黄芩中分离鉴定出百余种化合物,主要包括黄酮及其苷类、萜类及挥发油等,这些化合物有解热、抗炎、抗微生物、抗肿瘤、抗氧化等药理作用,对消化系统、心血管系统、神经系统等疾病具有一定的治疗作用[3]。黄芩醇提液中的化学成分的研究较多[4],研究表明不同极性溶剂提取时所含的化学成分不尽相同。黄芩在临床上主要以水煎液入药,目前针对黄芩水煎液的研究较少,其化学组成仍不明晰。另一方面,在2018年公布的《古代经典名方目录(第一批)》中,其中有15首经典名方含有黄芩,均为水煎剂形式入药。因此,对黄芩水煎液含有的化学成分进行定性和定量研究十分必要。
本研究采用超高效液相色谱串联静电场轨道阱质谱(UHPLC LTQ-Orbitrap-MS)对黄芩水煎液的化学成分进行全面分析和表征,采用高效液相色谱技术对10批黄芩样品中主要黄酮类成分进行含量测定,以上研究将为黄芩的质量控制和质量标准建立提供数据参考,也将为含黄芩经典名方的开发提供技术支撑。
1 材料
1.1 仪器
在线Dionex Ultimate 3000超高效液相色谱系统:含自动进样器、柱温箱、在线真空脱气机、低压四元梯度泵、光电二极管阵列(PDA)检测器以及LTQ Orbitrap velos pro质谱仪(ESI源);Xcalibur 2.1工作站(美国Thermo-Fisher公司);KQ-250B型数控超声波清洗器(昆山市超声仪器有限公司);CP423C型电子天平(奥斯豪仪器上海有限公司);Thermo Scientific Heraeus Multifuge X1R型高速离心机(美国Thermo公司);Synthesis A7 TM型超纯水系统(美国Millipore公司);旋转蒸发仪(上海爱朗仪器有限公司)。岛津LC-20A型液相分析仪,LC-20AT泵、SIL-20A型样品室、CTO-20A型柱温箱、SPD-20A型检测器(日本岛津公司);电热恒温水浴箱(北京市长风仪器仪表公司);三和松石粉碎机(SHIWUJIGONGJI公司,日本)。
1.2 药物与试剂
10批黄芩饮片购自北京市各大药房,均为主产地药材,详细信息见表1,经中国中医科学院中药研究所李先端研究员鉴定为唇形科植物黄芩Georgi的干燥根,样品标本保存于中国中医科学院中药研究所。
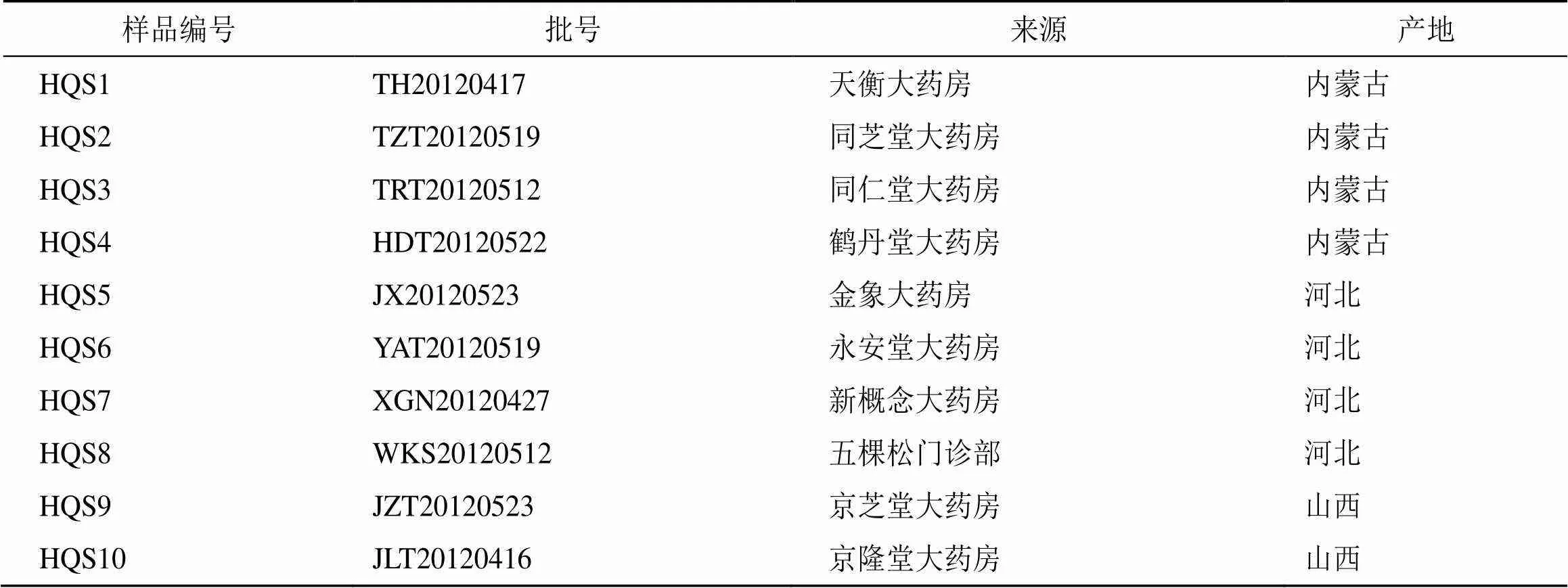
表1 黄芩样品信息
对照品黄芩苷(批号ZL20100805)、黄芩素(批号ZL20111009)、汉黄芩苷(批号ZL20101228)、汉黄芩素(批号ZL20110205)、千层纸素A-7--β--葡萄糖醛酸苷(批号ZL20110820)、千层纸素A(批号ZL20110125)购自南京泽朗医药有限公司,质量分数均大于98%。毛蕊花糖苷(批号111845- 201604)、绿原酸(批号110753-201817)购自中国食品药品检定研究院。野黄芩苷(批号SH19112702)、夏佛塔苷(批号SH20092506)、咖啡酸(批号SH17122804)、原儿茶酸(批号SH20052804)、购自北京赛百草科技有限公司,质量分数均大于98%;精氨酸购自北京百灵威科技有限公司,质量分数为97%。
色谱级甲醇、乙腈及质谱级甲酸购自赛默飞世尔生物化学制品(北京)有限公司;屈臣氏蒸馏水;其他化学品和溶剂均为分析纯。
2 方法
2.1 鉴定条件
2.1.1 色谱条件 采用Waters ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm)色谱柱。流动相为乙腈(A)和0.1%甲酸水(B),梯度洗脱0~5 min,5%~20% A;5~30 min,20%~30% A;30~40 min,30%~95% A。体积流量0.30 mL/min;柱温35 ℃;进样量2 μL。
2.1.2 质谱条件 电喷雾离子源(ESI),正、负离子模式下分别扫描。分别用超高纯氦气(He)和高纯氮气N2作为碰撞气体和雾化气体。正离子模式下的参数条件设置为:毛细管温度350 ℃;鞘气N2体积流量413.7 kPa;辅助气N2体积流量68.95 kPa;负离子的参数条件设置为:毛细管温度:350 ℃;鞘气N2体积流量275.8 kPa;辅助气N2体积流量68.95 kPa;质谱质量轴校准采用外标法(质量误差小于1×10−5)。一级质谱在FT模式下进行全扫描(分辨率R为30 000,扫描范围/50~1500),二级及三级质谱采用数据依赖性扫描,采用动态离子排除模式获得更多化合物信息(优化的参数条件设置为:repeat duration,30 s;exclusion list size,50;exclusion duration,180 s)。数据采集和分析采用Xcalibur 3.0,Metworks 1.3,Mass Frontier 7.0软件。
2.2 定量条件
采用Dikma Diamonsil C18(250 mm×4.6 mm,5mm)色谱柱,流动相为乙腈(A)-1%乙酸水(B)溶液,梯度洗脱:0~13 min,17% A;13~15 min,17%~20% A;15~50 min,20%~30% A;50~62 min,30%~40%A;62~70 min,40%~44% A;70~80 min,44%~100% A。检测波长276 nm;体积流量1.0 mL/min;柱温35 ℃;进样量10mL。
2.3 对照品溶液的制备
2.3.1 质谱鉴定对照品溶液制备 称取各对照品适量置于10 mL量瓶中,加入50%甲醇,充分溶解后定容。摇匀后经0.22 μm微孔滤膜滤过,即得。
2.3.2 含量测定对照品溶液制备 称取对照品适量,加甲醇溶解后定容,制成含黄芩苷、汉黄芩苷、千层纸素A-7--β--葡萄糖醛酸苷、黄芩素、汉黄芩素和千层纸素A混合对照品溶液,质量浓度分别为2.074、1.200、0.750、0.270、0.072 0、0.027 2 g/L,冷藏备用。
2.4 黄芩水煎液的制备
2.4.1 质谱鉴定样品溶液制备 黄芩药材经适当粉碎后,过筛(40目),加10倍水,浸泡30 min,武火加热至沸腾后,文火煎煮60 min,滤过,取上清液,浓缩,75 ℃减压干燥至干,粉碎,得黄芩水煎液减压干燥粉。称取0.50 g减压干燥粉末于50 mL锥形瓶中,加入50%甲醇10 mL,摇匀后超声10 min,经0.22 μm微孔滤膜滤过,得质谱鉴定样品溶液。
2.4.2 含量测定样品溶液制备 称取0.50 g黄芩饮片样品粉末,置锥形瓶中,加入75%乙醇50 mL,震摇,称定质量,80 ℃水浴中热浸30 min,15 min震摇1次,取出后置水浴中放至室温,再称定质量,补足减失质量,摇匀,上清液用0.22mm微孔滤膜滤过,取续滤液,得含量测定样品溶液。
3 结果与分析
根据测得的精确相对分子质量,应用质谱处理软件在规定的误差范围内(−5×10−6~5×10−6)计算可能的元素组成,根据各成分峰的二级质谱碎片信息与对照品或文献进行比对,对色谱峰进行定性分析。共鉴定推断出86种化合物,含65个黄酮、11个有机酸、7个氨基酸、2个苯乙醇苷、1个其他类化合物。其中,14个成分通过与对照品比较保留时间、一级质谱和多级质谱信息得到确证。正离子模式下鉴定7个氨基酸化合物,负离子鉴定79个化合物,见图1和表2。
3.1 黄酮类成分鉴定
3.1.1 黄酮碳苷类 黄酮碳苷是糖基与黄酮母核直接以C-C键相连的黄酮苷,结合位点主要在黄酮的C6、C8,黄酮碳苷在负离子模式下会连续丢失糖基片段。如六碳糖0-2开裂丢失C4H8O4(120)、0-3开裂丢失C3H6O3(90)、1-5开裂丢失C5H10O4(134);五碳糖0-2开裂丢失C3H6O3(90)、0-3开裂丢失C2H4O2(60)、1-5开裂丢失C4H8O3(104)。糖基0-2开裂后的碎片离子常形成基峰。化合物19在正负离子模式下均有很好的响应,在对照品指认下准确无误的确定为夏佛塔苷(图2)。负离子模式下保留时间为6.66 min的一级质谱中出现相对分子质量为/563.137 1(C26H27O14,误差−4.35×10−6)的准分子离子峰。二级质谱中出现由于六碳糖的0-2开裂丢失的C4H8O4(120)中性片段而产生质量数为/443.101 1(C22H19O10)的基峰离子,同时可见六碳糖0-3开裂丢失C3H6O3(90)片段生成的碎片离子/473.111 7(C23H21O11),五碳糖0-3开裂丢失C2H4O2(60)片段后产生的碎片离子/503.1228(C24H23O12)。碎片离子/413.090 4(C21H17O9,[M-H-C2H4O2-C3H6O3]−)、/383.079 6(C20H15O8,[M-H-C4H8O4-C2H4O2]−)、/353.068 9(C19H13O7,[M-H-C4H8O4-C3H6O3]−)均是由于中性丢失糖基片段而生成。碎片离子/353丢失羰基CO生成碎片峰/325.073 4(C18H13O6)、碎片离子/325进一步丢失羰基CO生成碎片峰/297.078 4(C17H13O5)。[M-H]−峰脱去1分子H2O后生成碎片峰/545.133(C26H25O13)[5]。
化合物21(R=7.65 min)、27(R=8.31 min)一级质谱中产生相同的准分子离子峰/547.143 4(C26H27O13,[M-H]−,误差−2.17×10−6)和/547.143 1(C26H27O13,[M-H]−,误差−2.83×10−6),二级质谱中可见以丢失C2H4O2(60)、C3H6O3(90)、C4H8O4(120)、H2O(18)、CO(28)为特征的碎片离子,据此判断二者均为含有1分子六碳糖和1分子五碳糖的黄酮碳苷类成分。化合物21产生的碎片离子/457.117 1(C23H21O10,[M-H-C3H6O3]−)相对丰度最大,而化合物27产生的碎片离子/427.106 8(C22H19O9,[M-H-C4H8O4]−)相对丰度最大,除此以外二者其余碎片离子均相同。据报道C6位的糖基更容易发生CID裂解,糖基片段的0/2裂解更容易产生,MS/MS质谱图见图3。因此推测化合物21的C6位连有1分子五碳糖,化合物27的C6位连有1分子六碳糖。与文献报道一致[4-7],因此推测化合物21和27分别为6--阿拉伯糖基-8--葡萄糖基白杨素和6--葡萄糖基-8--阿拉伯糖基白杨素。
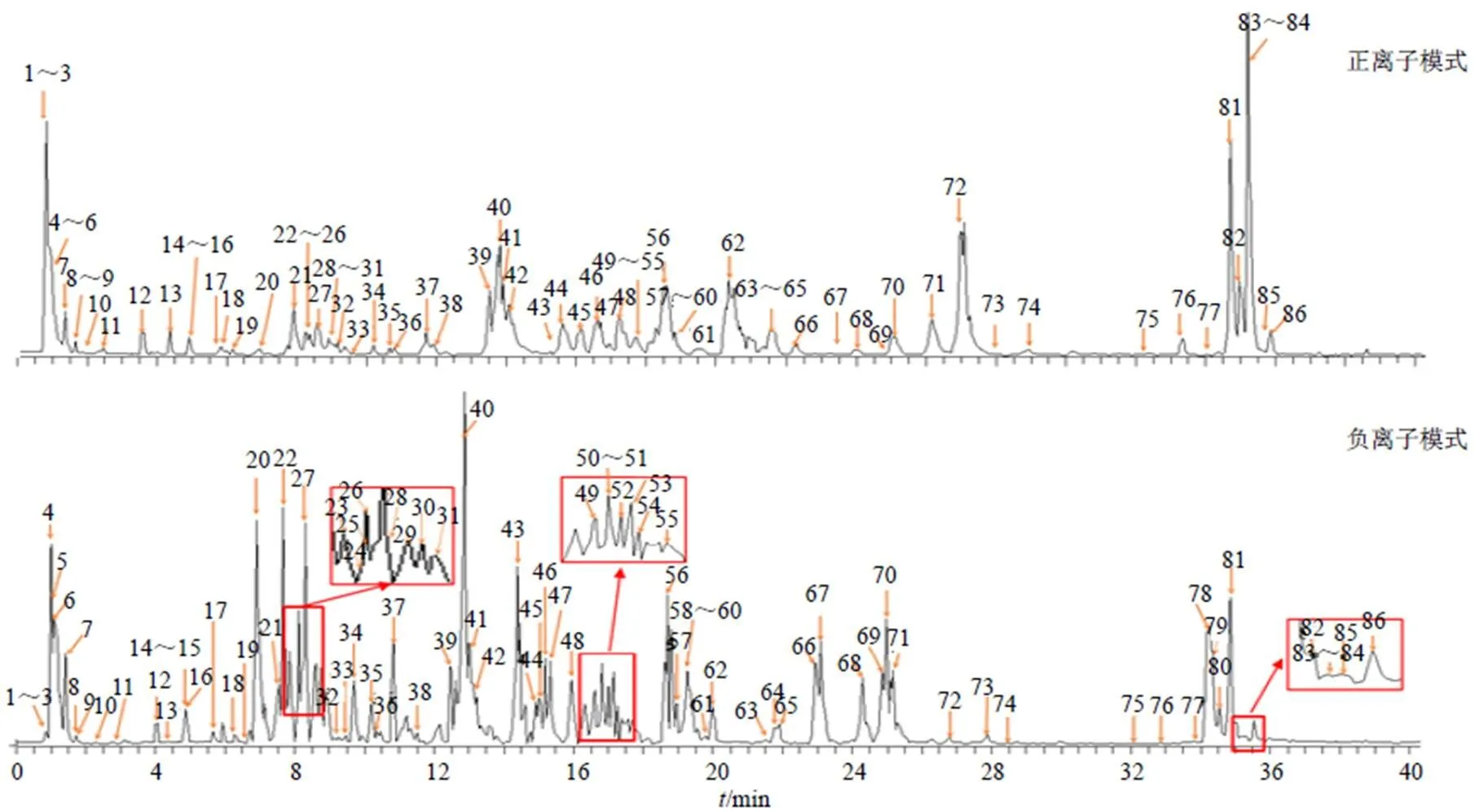
图1 黄芩水煎液在正和负离子模式下UHPLC-LTQ-Orbitrap-MS的BPC图
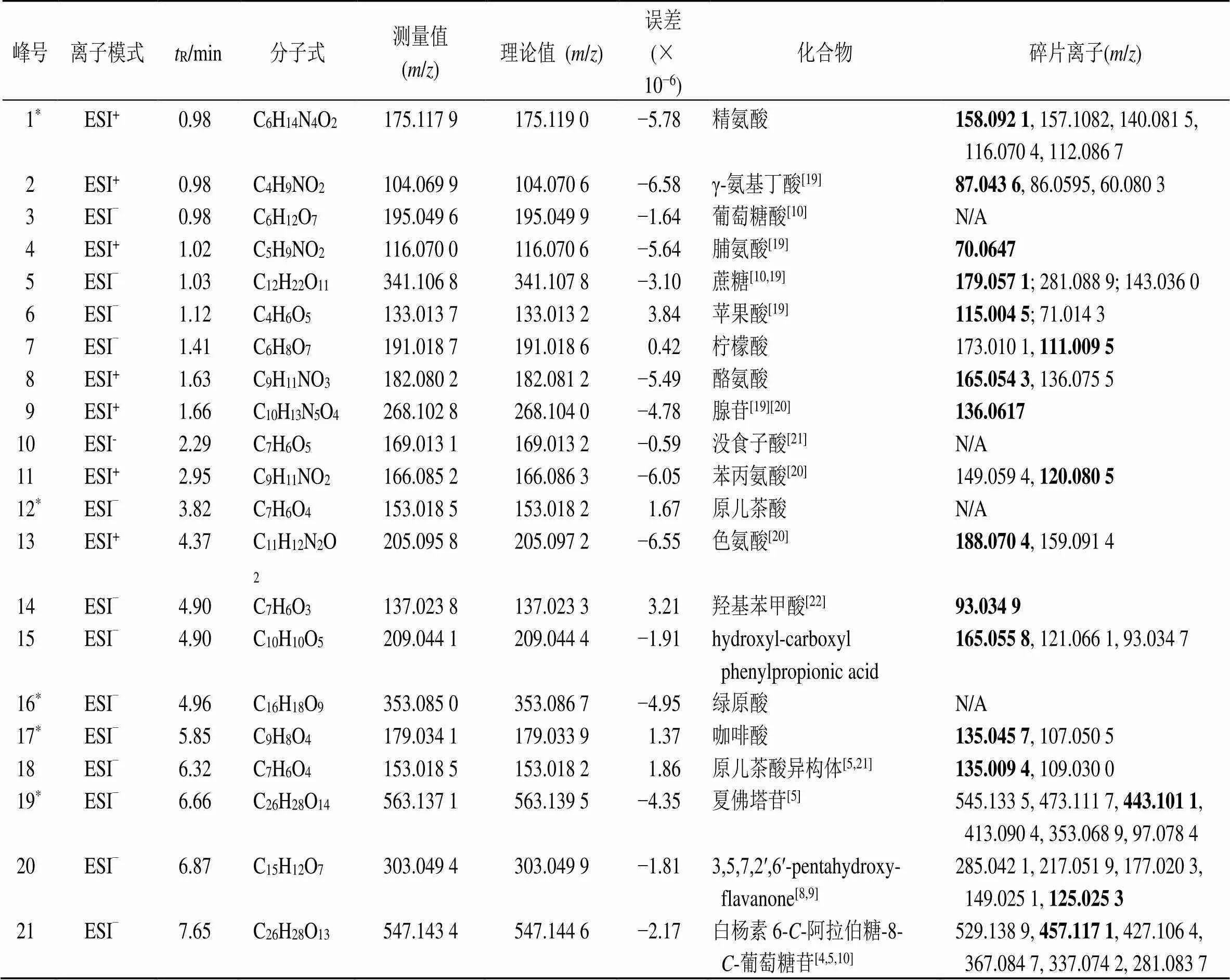
表2 黄芩水煎液中化学成分的鉴定
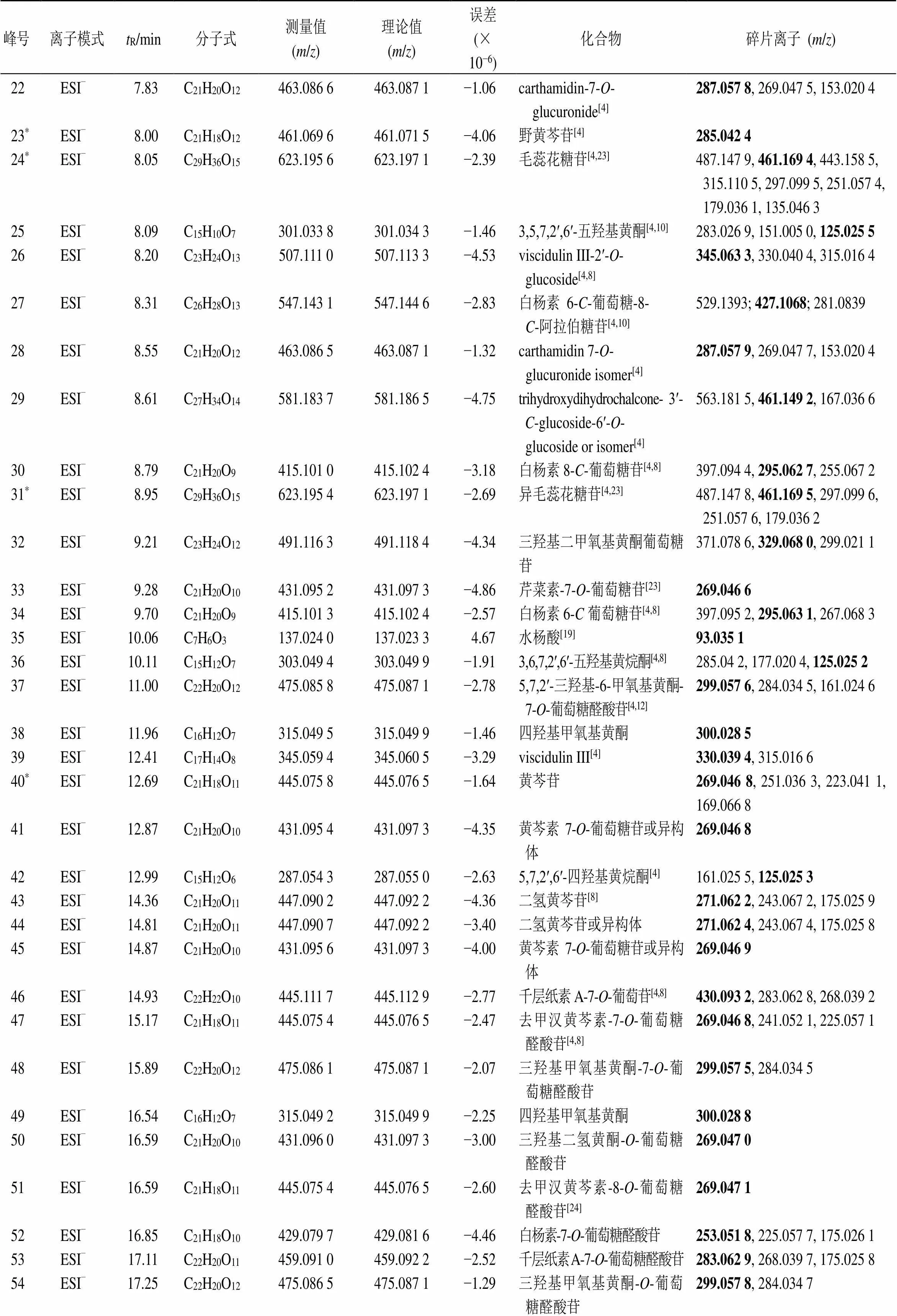
续表2
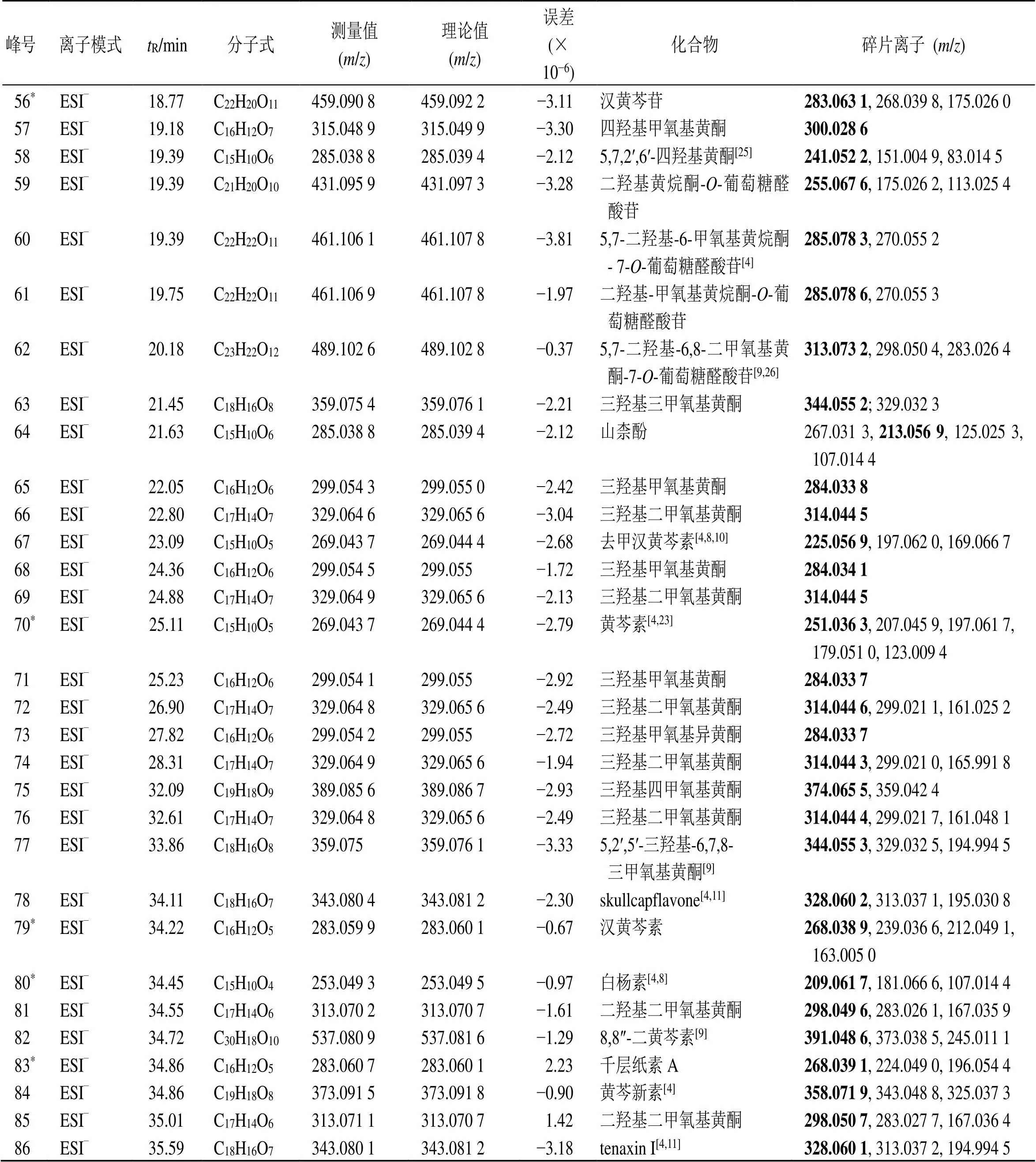
续表2
*经对照品比对的化合物,加粗峰表示基峰
*confirmed by control substance, the black bold/values in MS/MS represented the base peaks
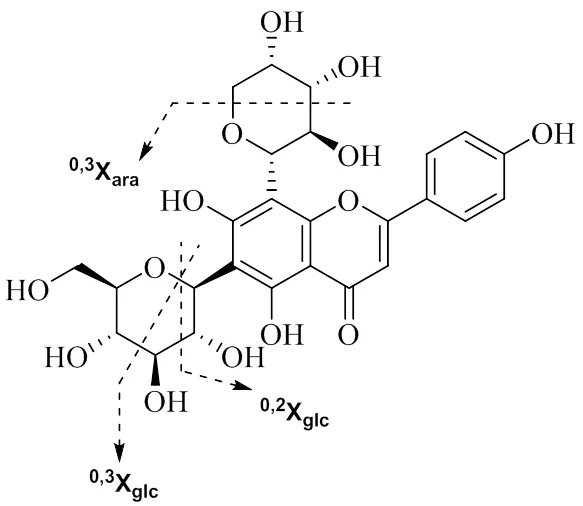
图2 化合物19 (夏佛塔苷)的可能裂解途径
化合物30(R=8.79 min)、34(R=9.7 min)一级质谱中出现相同的准分子离子峰/415.101 0(C21H19O9,误差−3.18×10−6)和/415.101 3(C21H19O9,误差−2.57×10−6),二级质谱中出现显著的由于中性丢失C4H8O4(120)片段产生的二级碎片离子/295.062 7(C17H11O5),同时可见丢失C3H6O3(90)而生成的碎片离子/325.073 3(C18H13O6),由上述裂解情况可推知化合物30和34均为连接1分子六碳糖的黄酮碳苷类化合物。碎片离子/295失去1分子CO生成/267.067 5(C16H11O4)。化合物30和34互为同分异构体,与文献报道[4,8]一致,推测2个分子分别为8--葡萄糖基白杨素、6--葡萄糖基白杨素。
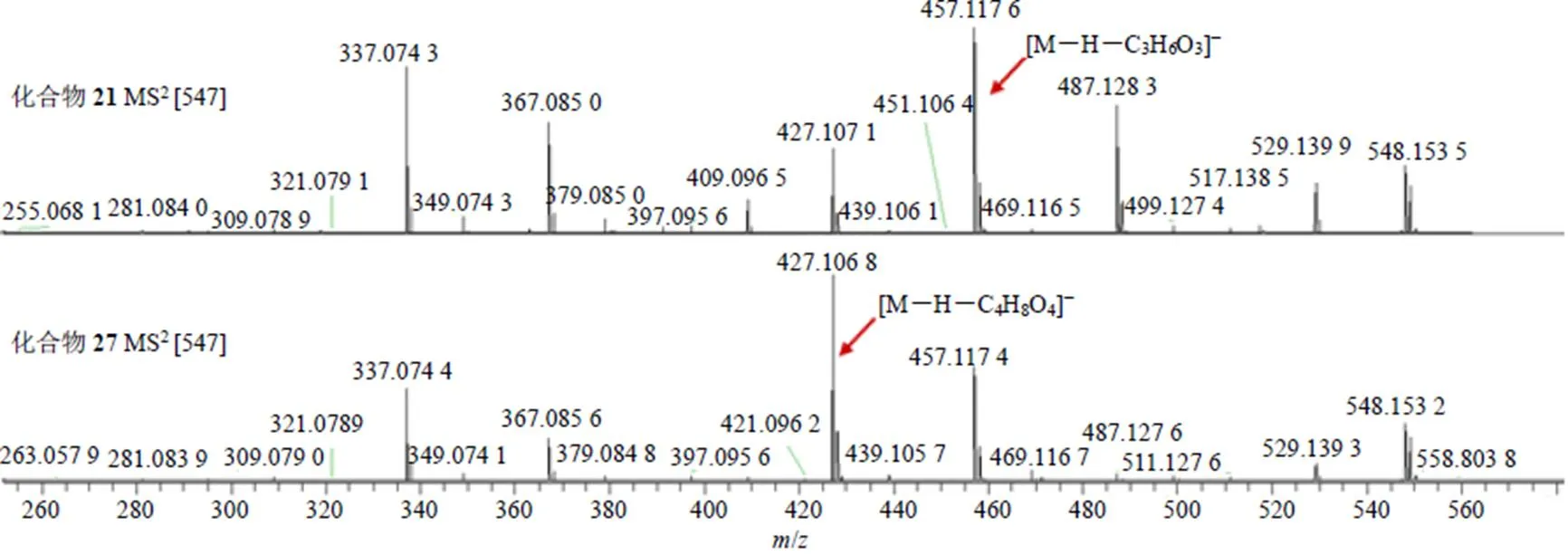
图3 化合物21和27的MS/MS质谱图
3.1.2 二氢黄酮类 化合物20(R=6.87 min)、36(R=10.11 min)的准分子离子峰为/303.049 4(C15H11O7,误差−1.81×10−6/−1.91×10−6),二级质谱中可见因C环开裂形成的基峰离子/125.024 6(C6H5O3),推测是由于在C环发生1/4裂解,1,4A-部分生成的碎片离子,同时推断A环部分有两个羟基取代,根据分子式判断其为五羟基二氢黄酮。二级质谱中可见CO、H2O、CO2中性小分子的丢失,二者产生相同的碎片离子/285.042 1(C15H9O6)、/275.057 6(C14H11O6)、/259.062 7(C14H11O5)。碎片离子/177.020 3(C9H5O4)可能由于C2-1′键断裂失去B环部分形成,再失去1分子CO生成碎片离子/149.025 1(C8H5O3)。查阅相关文献[4,9],根据出峰前后顺序,化合物20、36分别推测为3,5,7,2′,6′-pentahydroxyflavanone和3,6,7,2′,6′- pentahydroxyflavanone。
化合物22(R=7.83 min)和28(R=8.55 min)在一级质谱中可见丰度很高的[M-H]−峰/463.086 6(C21H19O12,误差−1.06×10−6)和/463.086 5(C21H19O12,误差−1.32×10−6)。二者裂解行为相同。二级质谱中明显可见中性丢失C6H8O6(176)而生成的碎片离子/287.057 8(C15H11O6),推测结构中连有1分子葡萄糖醛酸。碎片离子/269.046 4(C15H9O5)是由/287失去1分子H2O生成,推测存在邻二羟基结构;并可见碎片离子/153.019 8(C7H5O4),推测是由于C环裂解后生成。根据相关文献报道[4],化合物22、28为carthamidin- 7--glucuronide或其同分异构体。
负离子模式下,化合物43(R=14.36 min)、44(R=14.81 min)的裂解行为与黄芩苷相似,准分子离子峰分别为/447.090 2(C21H19O11,误差−4.36×10−6)、/447.090 7(C21H19O11,误差−3.4×10−6)和碎片离子均比黄芩苷的碎片多2个H原子。生成的苷元/271.062 2(C15H11O5)推断为三羟基二氢黄酮。结合相关文献报道,将化合物43、44推导为二氢黄芩苷或其异构体。化合物42(R=14.36 min),准分子离子峰为/287.054 3(C15H12O6,误差−2.63×10−6),经对比分子式不饱和度判断为四羟基二氢黄酮。二级质谱中可见C环裂解后的碎片离子/161.025 5(C9H5O3)和/125.025 3(C6H5O3)推测分别是由1,4A-部分和1,4B-部分生成A环和B环分别有2分子羟基取代。根据相关文献报道[4],推测化合物42为5,7,2′,6′- tetrahydroxyflavanone。
3.1.3 黄酮类 在负离子模式下,化合物70(R=25.11 min)在对照品指认下准确无误的确定为黄芩素,黄芩素是5,6,7-三羟基黄酮,正负离子模式下均有响应,负离子模式下响应更好。一级质谱中出现相对分子质量为/269.043 7(C15H9O5,[M-H]−,误差−2.79×10−6)的准分子离子峰。二级质谱中出现显著的二级碎片离子/251.036 3(C15H7O4),这是由于存在的邻二羟基结构脱去1分子H2O(18)而生成。碎片离子/241.051 9(C14H9O4)、/225.056 5(C14H9O3)分别是[M-H]−失去CO、CO2而生成。质量数为/251的离子失去CO、CO2分别生成碎片离子/223.041 1(C14H7O3)、/207.045 9(C14H7O2)。离子/241失去1分子CO2生成碎片离子/197.061 7(C13H9O2),进一步失去1分子CO生成碎片离子/169.066 7(C12H9O)。准分子离子在C环发生裂解,1,3A-部分生成碎片离子/166.999 4(C7H3O5),0,4A-部分生成碎片离子/123.009 4(C6H3O3),1,4A-部分生成碎片离子/139.004 3(C6H3O4)。在负离子模式下可能的裂解途径见图4。
化合物79(R=34.22 min)在对照品指认下准确无误的确定为汉黄芩素,汉黄芩素是5,7-二羟基- 8-甲氧基黄酮,一级质谱中可见准分子离子峰/283.059 9(C16H11O5,[M-H]−,误差−0.67×10−6)。二级质谱中出现明显的基峰离子/268.038 9(C15H8O5),这是因甲氧键断裂失去1分子CH3(15)而产生的,该离子失去CHO、CO、CO2等小分子后生成碎片离子/239.036 6(C14H7O4)、/224.049 1(C14H8O3)、/212.049 1(C13H8O3)、/196.054 5(C13H8O2)、/184.054 4(C12H8O2)。质量数为/268的离子经裂解0,2A-部分生成碎片离子/163.005 0(C8H3O4)。化合物83与汉黄芩素的准分子离子峰、碎片离子均相同,根据出峰先后顺序及对照品比对确认化合物83为千层纸素A。
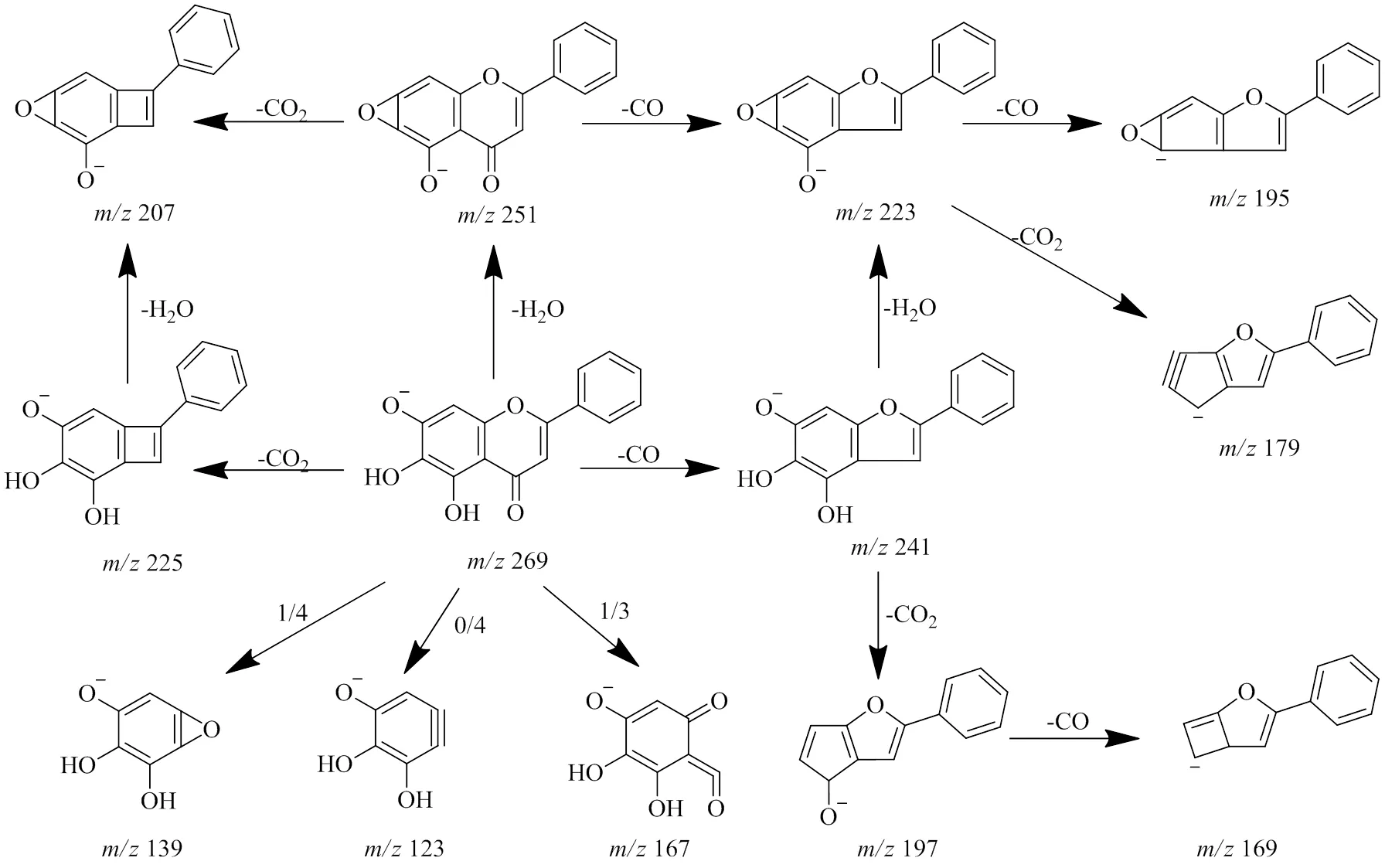
图4 化合物70 (黄芩素)在负离子模式下可能的裂解途径
化合物25(R=8.09 min)一级质谱中可见准分子离子峰/301.033 8(C15H9O7,误差−1.46×10−6),二级质谱中可见发生环开裂反应而生成的碎片离子。在C环发生1/4裂解1,4A-部分生成的碎片离子/125.025 5(C6H5O3),发生1/3裂解1,3A-部分生成的碎片离子/151.005 0(C7H3O4),C2-1′键断裂生成的碎片离子/193.015 2(C9H5O5)。碎片离子/283.026 9(C15H7O6)、/273.042 1(C14H9O6)、/257.047 2(C14H9O5)、/229.052 1(C13H9O4)、/215.036 2(C12H7O4)是由于丢失CO、H2O、CO2、C3O2中性小分子而生成。根据分子式判断是五羟基黄酮,根据裂解情况推测A环有2个羟基取代,C3连有羟基,B环有2个羟基取代,查阅相关文献报道[10],推断其为3,5,7,2′,6′- pentahydroxyflavone。
化合物78、86,在正负离子模式下均有响应。在负离子模式下,二者保留时间分别在34.11、35.59 min,准分子离子峰为/343.080 4(C18H15O7,误差−2.3×10−6)和343.080 1(C18H15O7,误差−3.18×10−6。根据分子式和不饱和度判断,二者均为二羟基三甲氧基黄酮类化合物。失去CH3、CO2、H2O等小分子生成碎片离子/328、313、295、285、269。区别在于化合物78经裂解后,1,3A-部分生成碎片离子/195.030 8(C9H7O5,[M-H-C9H8O2]−)再失去1分子CH3后生成碎片离子/180.007 3(C8H4O5);化合物86经裂解1,3A-部分生成碎片离子/209.010 1(C9H5O6,[M-H-CH3-C8H7O]−),由此推知化合物78的A环上有1个羟基、2个甲氧基取代,C环上有1个羟基、1个甲氧基取代;化合物86的A环上有1个羟基、3个甲氧基取代,C环上有1个羟基取代。根据相关文献报道[11],推测化合物78、86分别是skullcapflavone、5,2′-dihydroxy- 6,7,8-trimethoxyflavone(tenaxin I)。
化合物26(R=8.2 min)的准分子离子峰为/507.111 0(C23H23O13,误差−4.53×10−6)。糖苷键断裂失去C6H10O5(162)生成苷元离子/345.063 3(C17H13O8),Y0-失去1分子CH3生成碎片离子/330.040 4(C16H10O8),失去2分子CH3生成碎片离子/315.016 4(C15H7O8),苷元对比分子式判断为四羟基二甲氧基黄酮,据文献报道[8],推断化合物26为viscidulin III-2′--β--glucoside。
化合物46(R=14.93 min),一级质谱中可见准分子离子峰/445.111 7(C22H21O10,[M-H]−,误差−2.77×10−6)。二级质谱中可见显著的丢失1分子CH3生成的基峰离子/430.093 2(C21H18O10),糖苷键断裂失去C6H10O5(162)生成的苷元离子峰/283.062 8(C16H11O5)也较为明显,同时可见Y0-失去1分子CH3生成的碎片离子/268.039 2(C15H8O5),对比苷元分子式判断为二羟基一甲氧基黄酮,化合物46苷元裂解碎片与千层纸素A一致推测其为千层纸素A葡萄糖苷。
化合物53(R=33.89 min)、56(R=35.26 min)在对照品指认下准确无误的确定为千层纸素A-7--葡萄糖醛酸苷和汉黄芩苷。一级质谱中出现相同的准分子离子峰/459.091 0(C22H19O11,[M-H]−,误差−2.52×10−6),/459.090 8(C22H19O11,[M-H]−,误差−3.11×10−6)。二者裂解行为相同,糖苷键断裂脱去葡萄糖醛酸基(176)生成苷元离子/283.062 9(C16H11O5),苷元失去CH3生成碎片离子/268.039 7(C15H8O5)。化合物37(R=11 min)的准分子离子为/475.085 8(C22H19O12,[M-H]−,误差−2.78×10−6),糖苷键断裂脱去葡萄糖醛酸基(176)生成苷元离子/299.057 6(C16H11O6),而后失去1分子CH3生成碎片离子/284.034 5(C15H8O6),应为三羟基一甲氧基黄酮醛酸苷。化合物37的苷元离子经裂解,0,4B-部分生成碎片离子/161.024 6(C9H5O3),由此推知B环上连有1分子羟基,推测化合物37为5,7,2′-三羟基- 6-甲氧基黄酮-7--葡萄糖醛酸苷[4,12]。
化合物52(R=16.5 min)的准分子离子峰为/429.079 7(C21H17O10,[M-H]−,误差−4.46×10−6),失去葡萄糖醛酸基(176)生成苷元离子/253.051 8(C15H9O4)。苷元离子产生的碎片离子/225.057 7(C14H9O3)、/209.061 9(C14H9O2)、/181.066 7(C13H9O)、/165.071 6(C13H9)与白杨素碎片相同,据此可推测化合物52是白杨素的葡萄糖醛酸苷,且与葡萄糖醛酸基的结合位点只有5、7位,由于5位羟基会与4位羰基形成氢键不利于成苷,故7位成苷的可能性大。化合物52推导为白杨素-7--葡萄糖醛酸苷[9]。
化合物64(R=21.63 min)一级质谱中的准分子离子峰相同为/285.038 7(C15H9O6,[M-H]−)。二级质谱中的碎片离子/257.047 1(C14H9O5)、/241.051 8(C14H9O4)、/229.051 5(C13H9O4)、/213.056 9(C13H9O3)、/199.041 0(C12H7O3)、/185.061 6(C12H9O2)、/171.046 2(C11H7O2)是失去CO、CO2和H2O小分子生成,同时可见经RDA裂解后1, 3A-部分生成的碎片离子/151.003 9(C7H3O4)。1, 4A-部分生成的碎片离子/125.025 3(C6H5O3)推测化合物64为山柰酚(3,5,7,4′-四羟基黄酮)。
3.1.4 双黄酮类化合物 双黄酮化合物C环会发生开裂并且会发生各种小分子中性丢失,裂解途径和黄酮的裂解相似。化合物82(R=34.72 min)的准分子离子峰为/537.080 9(C30H17O10,[M-H]−,误差−1.29×10−6)。C环发生0/4裂解,失去1分子C9H6O2(146)生成碎片离子/391.048 6(C21H11O8),再失去1分子C9H6O2(146)生成碎片离子/245.011 1(C12H5O6)。可能的裂解途径见图5,查阅相关文献报道[9],推断化合物82为8,8″-bibaicalein。
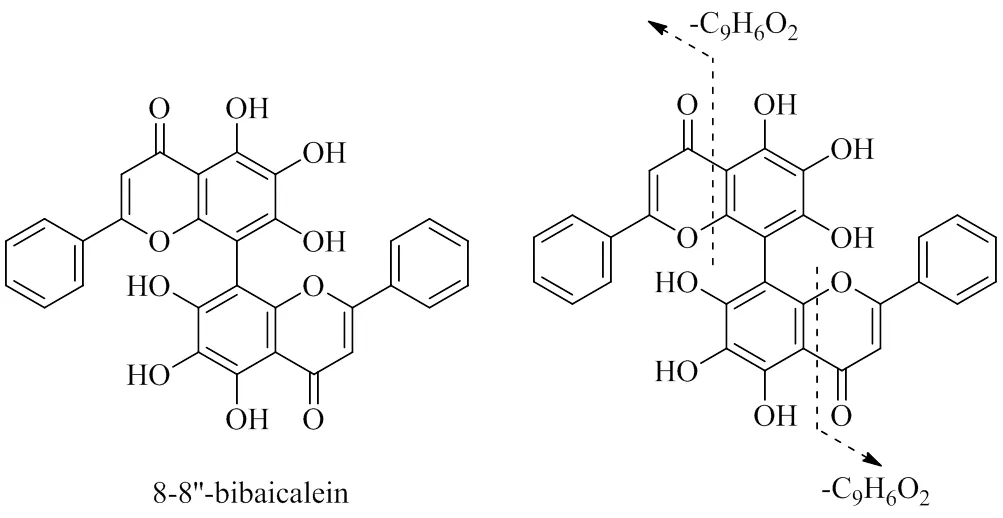
图5 化合物82 (8,8″-bibaicalein) 在负离子模式下可能的裂解途径
3.2 有机酸类成分鉴定
3.2.1 脂肪酸类 负离子模式下,化合物6(R=1.12 min)、7(R=1.41 min)的准分子离子峰分别为/133.013 7(C7H11O6,误差3.84×10−6)、/191.018 7(C6H7O7,误差0.42×10−6)。在二级质谱中可见化合物6明显失去H2O形成的基峰离子/115.004 5(C4H3O4),并且也检测到由/115再丢失1分子CO2而生成的碎片离子/71.014 3(C3H3O2);化合物7丢失1分子H2O生成碎片离子/173.010 1(C6H5O6);丢失2分子H2O和1分子CO2后产生基峰碎片/111.009 5(C5H3O3)。根据相关文献报道[11]推测化合物6、7分别为苹果酸、柠檬酸。
3.2.2 酚酸类 负离子扫描模式下,化合物17(R=5.85 min)在一级质谱中的准分子离子峰[M-H]−为/179.034 1(C9H7O4,误差1.37×10−6),二级质谱中出现显著的由于失去1分子CO2生成的/135.045 7(C8H7O2)的基峰离子,并可见碎片离子/135失去1分子CO而生成的碎片离子/107.050 5(C7H7O)。经对照品对比保留时间和碎片,确定化合物17为咖啡酸(3,4-二羟基肉桂酸)。化合物14(R=4.9 min)准分子离子峰为/137.023 8(C7H6O3,[M-H]−),二级质谱中出现丢失1分子CO2生成的质量数为/93.034 9(C6H5O)的基峰离子。化合物35(R=10.06 min)准分子离子及碎片离子与化合物14相同,但在色谱行为上保留较强,结合分子式和不饱和度,推测化合物14为羟基苯甲酸、35为水杨酸。化合物15(R=4.9 min)的准分子离子峰为/209.044 1(C10H9O5,[M-H]−,误差1.91×10−6),二级质谱中明显可见失去CO2的碎片离子/165.055 8(C9H9O3),/165再失去1分子CO2生成碎片离子/121.066 1(C8H9O)并可见失去C2H4的碎片离子/93.034 7(C6H5O),推测其为hydroxyl-carboxyl phenylpropionic acid。
3.3 其他类成分鉴定
化合物24(R=8.05 min)、31(R=8.95 min)经对照品比对确定为毛蕊花糖苷和异毛蕊花糖苷,二者为一对同分异构体,裂解模式一致。负离子模式下保留时间分别在8.05、8.95 min出现质量数为/623.195 6(C29H35O15,[M-H]−,误差−2.39×10−6)和/623.195 4(C29H35O15,[M-H]−,误差−2.69×10−6)的准分子离子峰。二级质谱中出现丰度最高的碎片离子/461.169 4(C20H29O12)是由于酯键断裂失去1分子咖啡酰基(C9H6O3,162)生成,同时可见糖苷键断裂失去1分子鼠李糖(C6H10O4,146)的碎片离子/477.141 7(C23H25O11),失去1分子3,4二羟基苯乙基(C8H8O2,136)而生成的碎片离子/487.147 9(C21H27O13)以及糖苷键断裂后的咖啡酰氧基部分的碎片离子/179.036 1(C9H7O4)。/461失去1分子H2O(18)生成碎片离子/443.158 7(C20H27O11),失去1分子鼠李糖生成碎片离子/315.110 7(C14H19O8),/315失去1分子H2O生成碎片离子/297.099 6(C14H17O7)。咖啡酰氧基部分/179失去CO2生成碎片离子/135.046 3(C8H7O2)[13]。推测化合物24可能的裂解途径见图6。
3.4 定量测定
3.4.1 线性范围及定量限 将混合对照品溶液用甲醇倍比稀释,精密吸取上述稀释液及母液各10mL进样,按“2.1”项下方法测定。分别以峰面积为纵坐标(),以进样浓度为横坐标()绘制工作曲线,各成分色谱保留时间,回归方程、相关系数、线性范围及定量限(LOQ)、检出限(LOD)等信息见表3。色谱图见图7。
3.4.2 精密度试验 精密吸取混合对照品溶液,按“2.2”项下方法进行含量测定,连续进样6次,结果6个成分峰面积的RSD在0.48%~4.93%,表明仪器的精密度良好。
3.4.3 重复性试验 取同一批次样品(JX20120523),平行称取6份,按“2.2”和“2.4.2”项下方法进行含量测定,结果6个成分质量分数的RSD在1.81%~5%,表明方法的重复性良好。
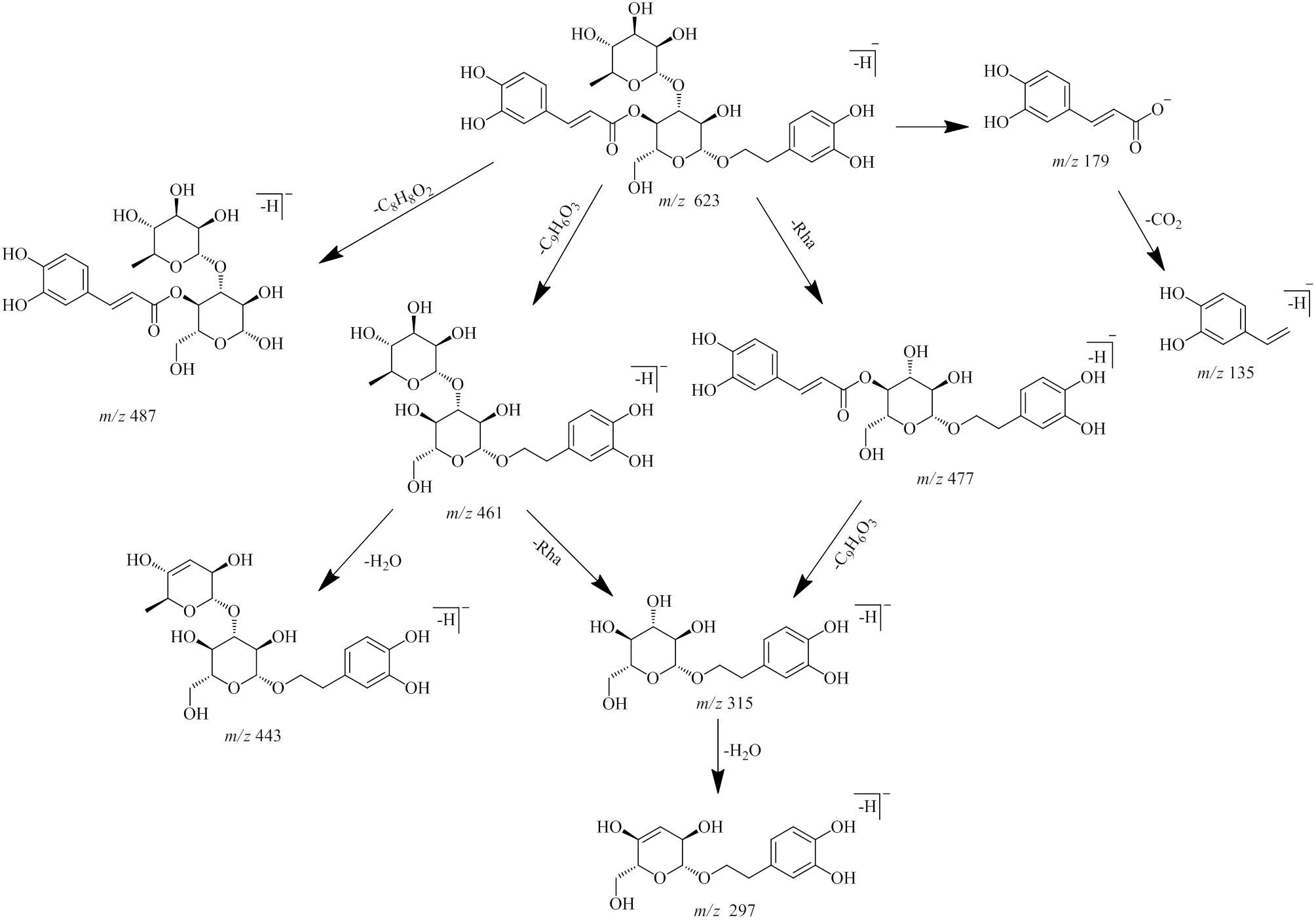
图6 化合物24 (毛蕊花糖苷) 在负离子模式下可能的裂解途径

表3 6种被测成分的色谱保留时间、线性回归方程、相关系数、线性范围和LOD、LOQ
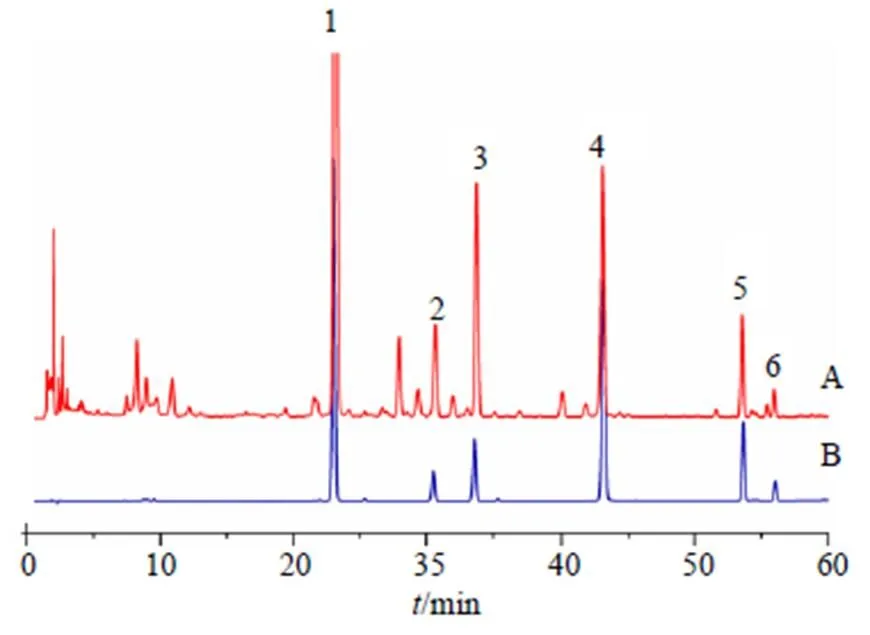
1-黄芩苷 2-千层纸素A-7-O-β-D-葡萄糖醛酸苷 3-汉黄芩苷 4-黄芩素 5-汉黄芩素 6-千层纸素A
3.4.4 稳定性试验 取同一批次样品(JX20120523),按“2.4.2”项下方法制备,分别在制备后0、3、6、9、 12 h进行测定,结果6个成分质量分数的RSD在0.21%~2.91%,表明各成分稳定性良好。
3.4.5 加样回收率试验 取同一批次已测定的供试品,平行称取6份,加入质量浓度相近的混合对照品,按“2.2”和“2.4.2”项下方法进行含量测定,结果6个成分的加样回收率在90%~101%,RSD在2.55%~5.00%。表明提取方法的准确性良好。
3.4.6 样品测定 取10批次黄芩饮片,按“2.4.2”项下方法制备黄芩供试品溶液,每批次样品平行制备3份,按“2.2”项下方法测定6个成分的含量,计算各成分的质量分数及RSD,结果见表4。
黄芩样品中的6个成分在含量上差异性较大,黄芩苷的质量分数最高为17.85%(HQS-8),千层纸素A的质量分数最低为0.17%(HQS-7);同一个成分的含量在样品中也有很大的差异性,如黄芩素的含量最低的为0.91%(HQS-4),最高为3.54%(HQS-3),含量差异近4倍,RSD为49.04%。所测黄芩样品中的6个成分在化学类别上可分为黄酮苷和黄酮苷元,其中3种黄酮苷成分的总量(均值为19.64%)明显大于3种黄酮苷元成分的总量(均值为2.96%);10批黄芩样品在含量上的差异性,3种黄酮苷元(RSD为47.46%)较3种黄酮苷(RSD为17.62%)更为明显,但6个黄酮成分总量的变异性比黄酮苷和苷元都要小得多(均值为22.60%,RSD为9.95%)。
4 讨论
UHPLC技术具有超高效、超高分离度的特点,在中药复杂体系的分离上显示出巨大的优势。MS技术可提供丰富的化合物结构信息,具有高特异性和高灵敏性。伴随技术日益发展,多种分离方法和质谱仪器的联用使化学成分结构解析及微量成分的体内体外定量分析成为可能。LC-MS技术同时具有强大的分离能力和结构鉴定的优势,可通过对已知同类化合物的质谱裂解规律的总结,再参考未知成分的保留时间(极性)及多级碎片等信息,实现对未知化合物的结构进行合理推测。本实验中使用UHPLC LTQ-Orbitrap-MS,线性离子阱可以实现多级质谱功能,静电场轨道阱可提供高分辨的质谱信息[14]。液质联用的正负离子互补技术是鉴定中药复杂体系的可靠手段。使用数据依赖性扫描得到高质量的碎片离子信息,采用质谱动态离子排除模式获得共流出低含量化合物的质谱信息,在高分离度、高灵敏度的条件下得到复方中所含化合物的精确分子量及碎片离子信息[15]。
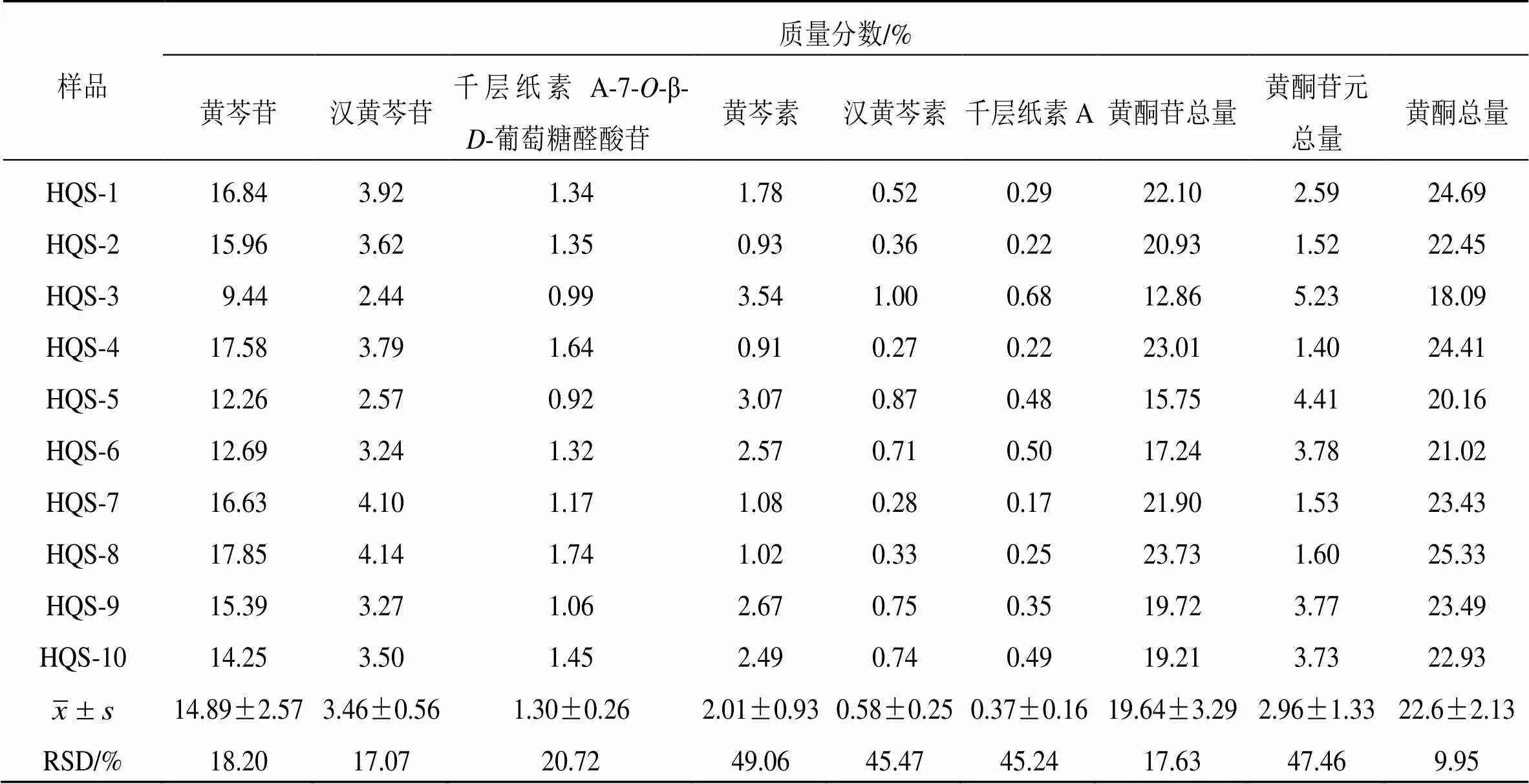
表4 10批黄芩中6个成分的质量分数分析(n= 3)
黄芩是重要的清热中药,在2018年国家中医药管理局会同国家药品监督管理局制定并公布的《古代经典名方目录(第一批)》中,包含黄芩的经典名方有15首。其中,汉代名方2首(半夏泻心汤、甘草泻心汤),唐代名方1首(小续命汤),宋代名方2首(清心莲子饮、甘露饮),金代名方2首(当归六黄汤、大秦艽汤),明代名方5首(清金化痰汤、桑白皮汤、保阴煎、清肺汤、达原饮),清代名方3首(二冬汤、宣郁通经汤、凉血地黄汤)。含黄芩的经典名方均为水煎剂形式入药,因此本研究主要分析黄芩水煎液含有的化学成分。宋伟峰等[16]采用高效液相色谱串联质谱分析鉴定了21个黄芩水煎液成分,但黄芩水煎液的化学组成仍不明晰。本研究采用UHPLC LTQ-Orbitrap-MS,使用数据依赖性扫描及质谱动态离子排除模式,快速鉴定了黄芩水煎液中的65个黄酮类化合物、11个有机酸、7个氨基酸、2个苯乙醇苷、1个其他类化合物。黄芩含有的黄酮类成分具有较强的生物活性,有明显的抗菌抗炎抗病毒抗感染作用,并对氧化应激、炎症通路等均有影响[17-18]。因此进一步采用HPLC-UV技术对10批黄芩样品的6个主要的黄酮类成分进行了含量测定。
含量测定实验中比较了Aglient Zorbax SB-C18和Dikma Diamonsil C18色谱柱,甲醇-水、乙腈-水、乙腈-0.1%乙酸溶液、乙腈-0.5%乙酸溶液、乙腈-1%乙酸溶液及乙腈-2%乙酸溶液等不同流动相的洗脱效果,结果使用Dikma Diamonsil C18色谱柱,流动相为乙腈-1%乙酸溶液的梯度洗脱方法时,色谱峰均能达到基线分离,主要成分如黄芩苷、黄芩素等色谱峰的分离度均大于1.5。千层纸素A色谱峰的分离度为1.0,由于千层纸素A含量和其他成分相比较低(质量分数平均为0.37%),对黄酮总量的结果影响较小,因此未做进一步优化。考察了甲醇、75%甲醇、50%甲醇、乙醇、75%乙醇、50%乙醇和纯水对黄芩的提取效果,结果表明75%乙醇提取时,各成分的峰面积最大,所以本研究中定量实验部分的提取溶剂为75%乙醇。比较了室温冷浸60、120、180、240 min,80 ℃水浴热浸30、60、90、120 min,以及室温水浴超声20、40、60、80、100、120 min对黄芩的提取效果,结果冷浸法180 min,热浸法30 min和超声法60 min后各时间点峰面积基本不再变化,说明样品各方法在此时间点已提取彻底,3个方法相比,热浸法效果最优,效率也高,所以本实验定量选择在80 ℃水浴中热浸30 min,提取溶剂为75%乙醇的提取方法。
含量测定结果表明黄芩不同批次之间黄酮类成分的含量有一定差异,但6个黄酮的总量相对稳定(质量分数18.09%~25.33%,RSD为9.95%)。已证实黄芩中的黄酮类成分具有类似的生物活性[17-18];这些黄酮类成分的苷和苷元在植物和动物体内、外可以相互转化[27];并且也有文献表明不同产地黄芩中黄芩苷、黄芩素、汉黄芩素和千层纸素A等成分的含量有一定差异性[28],因此相比现行药典中黄芩质量标准中单个指标含量测定的要求(含黄芩苷不得少于8.0%),如果对黄芩中黄芩苷、汉黄芩苷、千层纸素A-7--β--葡萄糖醛酸苷,3种黄酮苷的总量(12.86%~23.73%)或者黄芩苷、汉黄芩苷、千层纸素A-7--β--葡萄糖醛酸苷、黄芩素、汉黄芩素和千层纸素A6个黄酮的总量(18.09%~25.33%)加以控制或许对黄芩的质量评价和控制更有意义,这仍需要进一步证实。
总之,本研究建立的方法可以简便、快速地对黄芩水煎液的化学成分进行定性及定量研究,结果将为黄芩的质量控制和质量标准建立提供数据参考,并且对黄芩的标准汤剂、配方颗粒及含黄芩的经典名方的开发具有一定的指引作用。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S]. 一部. 2020: 314.
[2] 贾蔷, 申丹, 唐仕欢, 等. 含黄芩中成药用药规律分析 [J]. 中国中药杂志, 2014, 39(4): 634-639.
[3] 郑勇凤, 王佳婧, 傅超美, 等. 黄芩的化学成分与药理作用研究进展 [J]. 中成药, 2016, 38(1): 141-147.
[4] Qiao X, Li R, Song W,. A targeted strategy to analyze untargeted mass spectral data: Rapid chemical profiling ofusing ultra-high performance liquid chromatography coupled with hybrid quadrupole orbitrap mass spectrometry and key ion filtering [J]., 2016, 1441: 83-95.
[5] Wang S F, Chen L L, Leng J,. Fragment ion diagnostic strategies for the comprehensive identification of chemical profile of Gui-Zhi-Tang by integrating high-resolution MS, multiple-stage MS and UV information [J]., 2014, 98: 22-35.
[6] Li Q M, van den Heuvel H, Delorenzo O,. Mass spectral characterization of C-glycosidic flavonoids isolated from a medicinal plant () [J]., 1991, 562(1/2): 435-446.
[7] 谢彤, 徐建亚, 沈存思, 等. 基于UPLC/LTQ-Orbitrap- MS的黄芩中黄酮碳苷的结构表征及同分异构体的区分 [J]. 中草药, 2015, 46(22): 3318-3325.
[8] Zhang L, Zhang R W, Li Q,. Development of the fingerprints for the quality evaluation of scutellariaeby HPLC-DAD and LC-MS-MS [J]., 2007, 66(1/2): 13-20.
[9] Shang X F, He X R, He X Y,. The genusan ethnopharmacological and phytochemical review [J]., 2010, 128(2): 279-313.
[10] 姜丹. 黄岑道地性的遗传和化学物质基础研究 [D]. 北京: 北京中医药大学, 2018.
[11] Gao W Y, Si N, Li M L,. The integrated study on the chemical profiling andcourse to explore the bioactive constituents and potential targets of Chinese classical formula Qingxin Lianzi Yin Decoction by UHPLC-MS and network pharmacology approaches [J]., 2021, 272: 113917.
[12] 刘大伟, 闫广利, 方圆, 等. UPLC-ESI-TOF/MS应用于黄芩化学成分的快速分析 [J]. 中医药信息, 2012, 29(4): 20-24.
[13] Su D, Li W, Xu Q M,. New metabolites of acteoside identified by ultra-performance liquid chromatography/ quadrupole-time-of-flight MS(E) in rat plasma, urine, and feces [J]., 2016, 112: 45-55.
[14] 李欣, 唐力英, 许静, 等. 基于UPLC-LTQ-Orbitrap高分辨质谱的中药瓜蒌化学成分分析 [J]. 中国实验方剂学杂志, 2019, 25(1): 201-210.
[15] 王莹, 杜静. 液质联用技术在中药复方研究中的应用 [J]. 浙江中西医结合杂志, 2015, 25(8): 799-800.
[16] 何秋毅, 宋伟峰, 马斌, 等. 高效液相色谱串联质谱分析黄芩水煎液的有效成分 [J]. 中国药物经济学, 2012, 7(5): 28-30.
[17] 张沂, 穆杰, 高伟华, 等. 基于网络药理学从系统层面探讨黄芩苷治疗肺纤维化的效应机制研究[J]. 世界中医药, 2020, 15(10): 1373-1380.
[18] Xiao J B, Muzashvili T S, Georgiev M I. Advances in the biotechnological glycosylation of valuable flavonoids [J]., 2014, 32(6): 1145-1156.
[19] 闫峻, 赵春芳, 李伯平, 等. 板蓝根化学成分及抗氧化活性的研究 [J]. 质谱学报, 2017, 38(2): 248-255.
[20] 黄海英, 康俊丽, 余亚辉, 等. 基于UPLC-Q-Orbitrap MS法分析补肺益肾方的化学成分 [J]. 分析测试学报, 2019, 38(1): 1-13.
[21] 赵利娟, 高文雅, 顾欣如, 等. 蒲地蓝消炎口服液化学成分鉴定及归属研究 [J]. 中国中药杂志, 2019, 44(8): 1573-1587.
[22] 庞溢媛, 薛立英, 郑艳红, 等. 基于UHPLC-MS/MS代谢组学技术的不同采收期黄芩质量比较研究 [J]. 药学学报, 2017, 52(12): 1903-1909.
[23] Zou D X, Wang J F, Zhang B,. Analysis of chemical constituents in Wuzi-Yanzong-Wan by UPLC-ESI-LTQ- orbitrap-MS [J]., 2015, 20(12): 21373-21404.
[24] Yung-Qi W, Matsuzaki K, Takahashi K,. Studies of the constituents ofspecies. I. The flavonoid glucuronides of “bo ye Huang chin”,JUZ [J]., 1988, 36(8): 3206-3209.
[25] Tomimori T, Miyaichi Y, Kizu H. On the flavonoid constituents from the roots ofGeorgi. I [J]., 1982, 102(4): 388-391.
[26] 胡英还, 许文倩, 秦雪梅, 等. UHPLC-Q Exactive轨道肼高分辨质谱在线快速识别黄芪建中汤的化学成分 [J]. 药学学报, 2017, 52(6): 964-970.
[27] 沈安, 吴璐, 朱卫丰. 黄芩中黄芩苷与黄芩素的体内外转化研究进展 [J]. 江西中医药, 2017, 48(9): 71-74.
[28] 刘金欣, 孟繁蕴, 张胜海, 等. UPLC同时测定黄芩中黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、千层纸素A [J]. 中草药, 2014, 45(10): 1477-1480.
Qualitative and quantitative study on chemical constituents indecoction
GAO Wen-ya1, LI Tao1, 2, ZHOU Yan-yan1, LI Ming-li1, WANG Lin-na1, ZHAO Hai-yu1, BIAN Bao-lin1, WANG Hong-jie1, FENG Xue1, YANG Wei-peng1, SI Nan1
1. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China 2. Experimental Research Center, China Academy of Chinese Medical Sciences, Beijing 100700, China
The chemical components were qualitatively analyzed and the main components were quantitatively studied indecoction, which provided the basis for the establishment of quality standard and further study.UHPLC LTQ-Orbitrap MS was used to analyze the chemical composition with 0.1% formic acid-acetonitrile as mobile phase. The precise molecular weight and fragment ion information of the compounds were analyzed. The unknown components were identified unambiguously by comparing with the retention time and mass spectrometric data of reference standards or tentatively deduced by their CID pathways referring to previous literatures. HPLC-UV was used to build multicomponent quantitative analysis with 1% acetic acid-acetonitrile as mobile phase. The ten batches of samples were evaluated by the similarity analysis.A total of 86 compounds were identified or tentatively characterized, containing 65 flavonoids, 11 organic acids, seven amino acids, two phenylethanol glycosides and one other compound fromdecoction. The content of six flavonoids (Baicalin, wogonoside, oroxylin A-7--β--glycoside, baicalein, wogonin and oroxylin A) was determined. The results showed that there were some differences in the content of flavonoids between different batches of, but the total amount of six flavonoids was relatively stable (18.09%—25.33%, RSD of 9.95%).This study provides a comprehensive analysis of the chemical composition and builds multicomponent quantitative analysis method ofdecoction, which provides a scientific basis for the quality control and further refinement of quality control standards for.
decoction; UHPLC-LTQ-Orbitrap MS; flavonoids; multiple-component quantitative analysis; baicalin; wogonoside; oroxylin A-7--β--glycoside; baicalein; wogonin; oroxylin A
R284.1
A
0253 - 2670(2022)23 - 0 - 14
10.7501/j.issn.0253-2670.2022.23.
2022-04-12
中国中医科学院科技创新工程项目(CI2021A04405,Cl2021A04502);中央级公益性科研院所基本科研业务费专项(JJPY2022003,ZZ2019008,ZZ14-YQ-041);国家中医药管理局青年岐黄学者项目;杭州市钱江特聘专家项目(2020)
高文雅,满族,博士生,主要从事中药活性物质基础及生物学表征研究工作。E-mail: gaowenya0215@163.com
通信作者:杨伟鹏,研究员,主要从事中药药理及新药研究。Tel/Fax: (010) 64029529 E-mail: yangweipeng@icmm.ac.cn
司 南,副研究员,从事中药化学与分析研究工作,Tel: (010)84041249 E-mail: nsi@icmm.ac.cn
并列第一作者李 涛,副研究员,主要从事中药药效物质基础及药代动力学研究。E-mail: hndxlitao@163.com
[责任编辑 王文倩]
