加味玉屏风及其多糖对小鼠免疫功能的影响
2022-12-07李宏雅魏彦明买占海张晓松武凡琳赵年寿华永丽姚万玲袁子文
李宏雅,纪 鹏,魏彦明,买占海,张晓松,周 轲,武凡琳,赵年寿,华永丽,姚万玲,袁子文
(甘肃农业大学动物医学院,甘肃兰州 730070)
近些年来,呼吸系统疾病是畜禽高发的三大类疾病之一,多反复发病,且病死率较高。病因主要为畜禽抵抗力差外加病邪入侵。中兽医理论认为,此类疾病应属于“气虚”,主要因肺气虚或脾肺气虚、卫表不固、外邪乘虚而入所致。其防治法则为益肺健脾、扶正祛邪。针对此类疾病,提升畜禽免疫力甚为重要。玉屏风是主治畜禽气虚自汗的经典名方[1],能够增强细胞免疫和体液免疫功能、降低炎性因子水平、提高抗变态反应能力[2],四君子散是主治脾胃气虚证的经典名方[1],有研究表明加味四君子汤能提高机体免疫功能、造血功能与抗应激能力[3]。基于五行理论“培土生金”法将两者合用遵循了“未病先防,既病防变”“正气存内,邪不可干”等中兽医预防疾病理念。合方是方剂加减变化重要形式之一[4],而方剂精简又是中兽药现代发展的重要理念。依据中兽药创新思路,参考前期研究结果[5],形成自拟组方加味玉屏风(Jiawei Yupingfeng,JWYPF)。多糖是中药中发挥免疫增强作用的重要活性成分,一直是中药活性成分研究的热点之一。本试验旨在研究加味玉屏风和加味玉屏风多糖(Jiawei Yupingfeng polysaccharides,JWYPF-P)对小鼠免疫抑制的干预效果,以期为加味玉屏风在畜禽养殖业中的临床应用提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 90只4周龄SPF级雄性昆明小鼠,体重20 g±2 g,购自兰州兽医研究所实验动物中心,合格证号[SCXK(甘)2020-0002],昼夜各半循环照明,自由饮食饮水,适应性喂养7 d后开始试验。动物试验获得甘肃农业大学伦理委员会批准。
1.1.2 药材与试剂 黄芪、炒白术、党参、炙甘草等加味玉屏风组方药材,购自兰州市黄河药材批发市场,经甘肃农业大学动物医学院中兽医教研室魏彦明教授鉴定。黄芪多糖(Lol#G2028113),Shanghai Macklin Biochemical Co.Ltd公司产品;注射用环磷酰胺,德国Baxter公司产品;小鼠sIgA、IgG、IgM ELISA试剂盒(Lot06/2021),上海酶联生物科技有限公司产品;CD3+-PE、CD4+-FITC、CD8+-APC单克隆抗体,美国Biolegend公司产品。
1.1.3 主要仪器 ZHT-Ⅰ型自动恒温电热套,山东省鄄城县永兴仪器厂产品;RE-6000旋转蒸发仪,上海亚荣生化仪器厂产品;血常规分析仪,Boule Medical AB公司产品;Spectra Max Plus384酶标仪,美谷分子仪器有限公司产品;轮转式切片机、石蜡包埋机、自动组织脱水机,徕卡显微系统上海有限公司产品;流式细胞仪,美国BD公司产品。
1.2 方法
1.2.1 JWYPF及其粗多糖的制备 按照自拟加味玉屏风的组成比例配制成JWYPF,并按前期优化试验方法制备多糖:料液比1∶10,回流提取1.5 h后过滤,滤渣加10倍蒸馏水回流提取1 h,合并滤液,浓缩,冷冻干燥,得JWYPF干浸膏;取浓缩液加入3倍体积无水乙醇,静置12 h后离心20 min取沉淀,冷冻干燥,制得JWYPF粗多糖。
1.2.2 JWYPF-P纯化 取1.2.1所得JWYPF粗多糖,参照文献[6]报道的方法对JWYPF粗多糖进行除蛋白。参照文献[7]报道的方法对JWYPF粗多糖进行脱色,即得JWYPF精制多糖。
1.2.3 免疫抑制小鼠模型的建立 小鼠腹腔注射环磷酰胺(cyclophosphamide,CTX)80 mg/kg,连续3 d,建立免疫抑制模型。若小鼠出现精神沉郁,食欲减退,被毛粗乱,且血常规检测显示模型小鼠白细胞、淋巴细胞、红细胞及血小板数目明显降低,说明建模成功。
1.2.4 动物分组及给药 将90只小鼠随机分为空白对照组、模型组、阳性对照组、JWYPF-P低、中、高剂量组(0.125、0.250、0.500 mg/g)、JWYPF低、中、高剂量组(0.815、1.63、3.26 mg/g),每组10只。空白对照组和模型组灌服生理盐水,阳性对照组(100 mg/kg)给予黄芪多糖[8],低、中、高剂量组分别给予相应药物,1次/d,连续8 d,第5~第7天,除空白对照组注射生理盐水外,其余各组腹腔注射CTX(80 mg/kg)制备免疫抑制小鼠模型。
1.2.5 动物处理与样本采集
1.2.5.1 一般体征观察 观察试验期间小鼠精神状态,并记录体重,给药结束后,采血并对小鼠胸腺和脾脏称重,计算脏器指数(脏器指数=脏器质量/体质量)。
1.2.5.2 血常规检查 检测小鼠血液中白细胞(WBC)、淋巴细胞(LYM)、单核细胞(MON)、中性粒细胞(GRA)、红细胞(RBC)、血小板(PLT)等指标。
1.2.5.3 免疫球蛋白测定 用ELISA试剂盒检测各组小鼠血清中的sIgA、IgG、IgM含量。
1.2.5.4 病理组织学检查 取胸腺、脾脏于100 mL/L福尔马林溶液中固定,采用梯度乙醇脱水,石蜡包埋,苏木精-伊红(HE)染色后镜下观察。
1.2.5.5 脾脏CD3+、CD4+、CD8+T细胞的检测 无菌条件下分离脾脏,制备脾脏单细胞悬液,在含1×106个细胞体系中染色,加入CD16/32(1∶200)封闭抗体,依次加入PE-CD3、APC-CD8、FITC-CD4抗体,避光孵育30 min。用PBS洗涤,离心后弃去上清,加入PBS重悬细胞后,用流式细胞仪检测。

2 结果
2.1 一般体征观察
与空白对照组相比,第5天开始造模后,模型组小鼠表现精神沉闷、被毛凌乱,采食量下降,小鼠的体重明显下降。与模型组相比,JWYPF-P给药组和JWYPF给药组小鼠精神状态及被毛凌乱有所缓解,体重下降趋势变缓(图1)。
2.2 胸腺、脾脏脏器指数变化
与空白对照组相比,模型组小鼠胸腺指数、脾脏指数均明显降低(P<0.01),表明小鼠免疫抑制模型建立成功。与模型组相比,JWYPF和JWYPF-P给药组小鼠胸腺指数均有升高,其中JWYPF-P高剂量组显著升高(P<0.01);JWYPF给药组脾脏指数明显升高(P<0.05或P<0.01)(表1)。
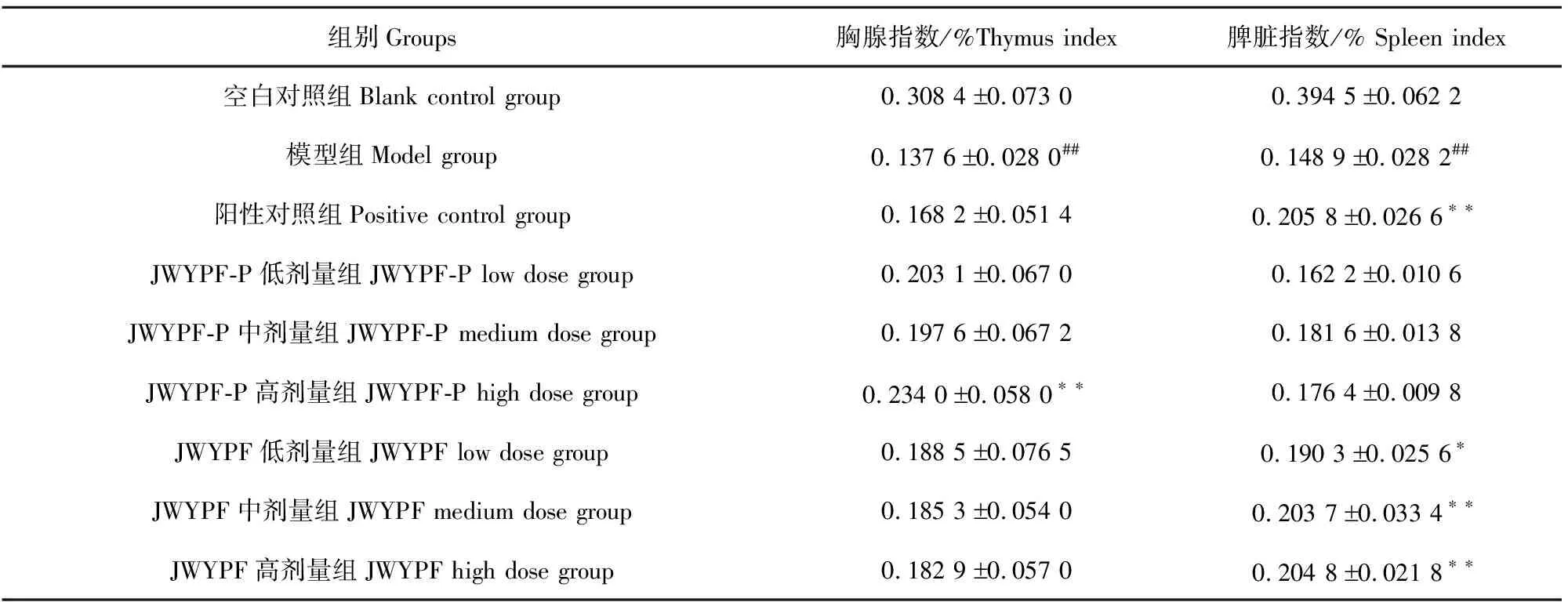
表1 各组小鼠胸腺、脾脏脏器指数比较
2.3 血常规指标变化
与空白对照组相比,模型组小鼠血液中的WBC、LYM、MON、GRA、RBC、PLT均明显降低(P<0.01或P<0.05),结合前期一般体征变化分析,表明小鼠免疫抑制模型建立成功。与模型组相比,JWYPF和JWYPF-P给药组的WBC、LYM、MON、GRA、PLT升高,其中JWYPF-P中剂量组WBC、LYM、MON、GRA明显升高(P<0.05或P<0.01);JWYPF低剂量和JWYPF-P低、中剂量组RBC明显升高(P<0.05或P<0.01);JWYPF-P中剂量和JWYPF中、高剂量组PLT明显升高(P<0.05或P<0.01)(图2)。
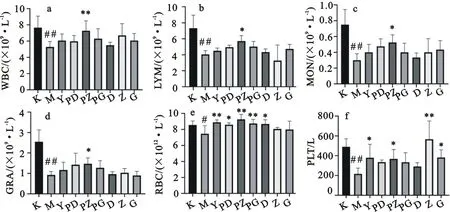
a.WBC;b.LYM;c.MON;d.GRA;e.RBC;f.PLT;K.空白对照组;M.模型组;Y.阳性对照组;PD.JWYPF-P低剂量组;PZ.JWYPF-P中剂量组;PG.JWYPF-P高剂量组;D.JWYPF低剂量组;Z.JWYPF中剂量组;G.JWYPF高剂量组;与空白对照组相比,# P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01
2.4 血清sIgA、IgG、IgM水平变化
与空白对照组相比,模型组的小鼠血清中sIgA、IgG、IgM降低,其中IgG极显著下降(P<0.01),表明小鼠免疫抑制模型建立成功。与模型组比较,JWYPF-P中剂量组sIgA显著升高(P<0.05),JWYPF给药组与JWYPF-P高剂量sIgA恢复至正常水平,但差异不显著(P>0.05);JWYPF和JWYPF-P各剂量组IgG明显提高(P<0.01);JWYPF-P各剂量组以及JWYPF高剂量组IgM明显升高(P<0.01),表明JWYPF及其多糖均能恢复降低的免疫球蛋白水平,JWYPF-P的效果优于JWYPF(表2)。
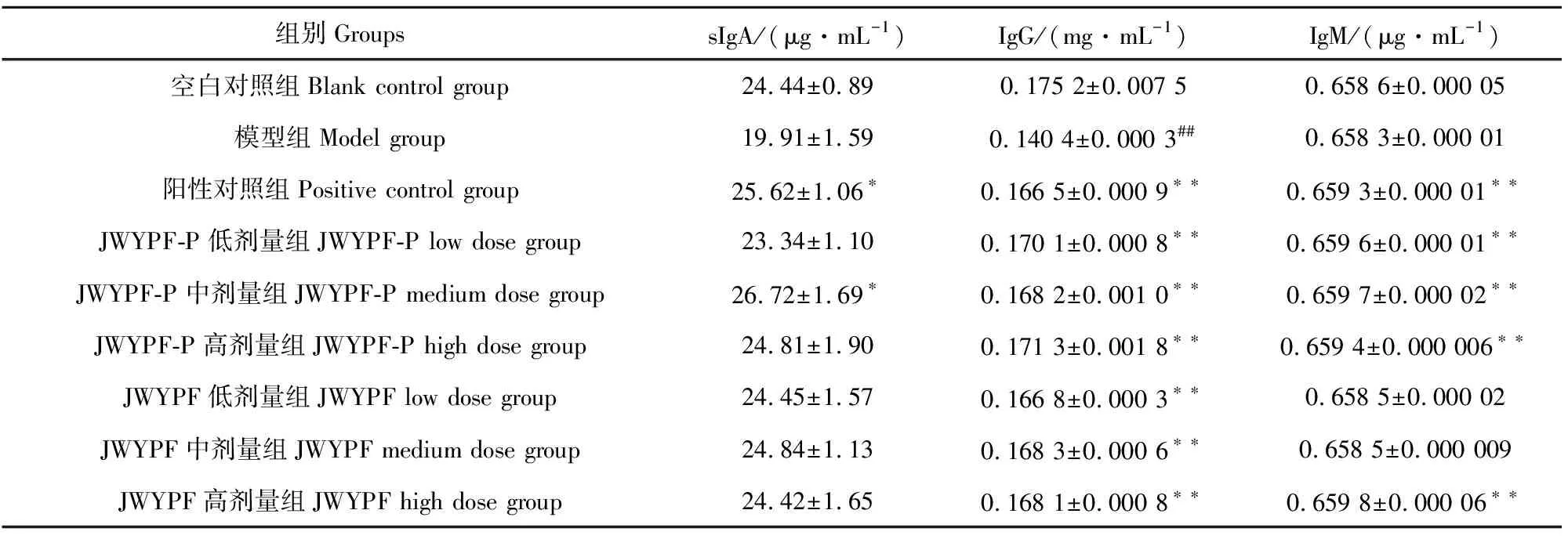
表2 各组小鼠血清中免疫球蛋白sIgA、IgG、IgM水平的比较
2.5 脾脏、胸腺的病理组织学变化
与空白对照组相比,模型组小鼠脾脏组织中淋巴细胞稀疏,间质纤维大量增生,脾脏组织中动脉周围淋巴鞘变薄以及脾小结减少,白髓和红髓间界限模糊;经JWYPF及其多糖干预后,上述病变均有一定缓解,表现为间质纤维增生减少,动脉周围淋巴鞘增厚,脾小结增多等(图3)。相比于空白对照组,模型组胸腺组织皮质、髓质界限模糊,小梁消失,皮质区淋巴细胞减少,胸腺小体减少;经JWYPF及其多糖干预后,上述病理损伤得到不同程度的缓解,皮质、髓质分界明显清晰,胸腺小体增加,且JWYPF及其多糖具有量效关系(图4)。

a.空白对照组;b.模型组;c.阳性对照组;d.JWYPF-P低剂量组;e.JWYPF-P中剂量组;f.JWYPF-P高剂量组;g.JWYPF低剂量组;h.JWYPF中剂量组;i.JWYPF高剂量组;RP.红髓;WP.白髓;←.动脉周围淋巴鞘

a.空白对照组;b.模型组;c.阳性对照组;d.JWYPF-P低剂量组;e.JWYPF-P中剂量组;f.JWYPF-P高剂量组;g.JWYPF低剂量组;h.JWYPF中剂量组;i.JWYPF高剂量组;C.皮质;M.髓质;←.胸腺小体
2.6 脾脏CD3+、CD4+T细胞数量比例与CD4+/CD8+比值的变化
与空白对照组相比,模型组的CD3+T细胞数量比例极显著降低(P<0.01),CD4+T细胞的数量比例以及CD4+/CD8+比值降低(P>0.05);与模型组相比,阳性对照组以及JWYPF-P高剂量组CD3+T细胞数量比例均显著升高(P<0.05),而JWYPF高剂量组增高但无显著差异(P>0.05);CD4+T细胞数量比例也增高,其中JWYPF-P高剂量组显著升高(P<0.05);CD4+/CD8+比值JWYPF-P高剂量组极显著升高(P<0.01)(表3)。

表3 各组小鼠脾脏CD3+、CD4+T细胞数量比例与CD4+/CD8+比值比较
3 讨论
环磷酰胺是目前常用的建立免疫抑制模型的免疫抑制剂,研究发现环磷酰胺是通过抑制骨髓造血干/祖细胞,引起白细胞减少症,从而导致动物免疫功能受到抑制[9-10],其作用范围广泛,对细胞免疫、体液免疫均有抑制作用。CTX经灌胃和腹腔注射均可建立小鼠免疫抑制模型,但后者操作简便、周期短、特异性高。因此,本研究选用连续3 d腹腔注射80 mg/kg CTX建立小鼠免疫抑制模型,结果显示,造模后小鼠外周血中白细胞数量明显下降,白细胞分型数量比例发生紊乱,胸腺指数和脾脏指数显著下降,小鼠脾脏中CD3+、CD4+T细胞数量比例显著降低,证实经CTX建模后,小鼠整体免疫水平下降,这与以往研究报道相符[11-12]。
白细胞是机体免疫系统的重要组成部分,检测白细胞的数量和比例是评估免疫功能高低的有效指标[13]。胸腺和脾脏中含有大量淋巴细胞和巨噬细胞,因此胸腺指数、脾脏指数被作为衡量机体免疫功能强弱的重要指标。T淋巴细胞主要分为辅助性T淋巴细胞(CD3+、CD4+)和细胞毒性T淋巴细胞(CD3+、CD8+),有研究发现CD4+/CD8+T细胞比值处于动态平衡状态,可以反映动物机体的细胞免疫水平[14]。本研究结果显示,与模型组相比,JW-YPF及其多糖给药组小鼠体重、胸腺及脾脏指数均有所升高,小鼠的WBC、LYM、MON、PLT的数量也有提升,病理损伤缓解,提示提前用JWYPF及其多糖干预小鼠对CTX所致的免疫抑制有一定的缓解作用。经药物干预后,CD3+、CD4+T细胞数量比例、CD4+/CD8+T细胞比值均有提高,提示其可能通过提高机体细胞免疫水平来对抗CTX所致的损伤,这与前期的相关报道一致[15-16]。
slgA、IgG与IgM是反映机体体液免疫水平的主要指标。slgA又称分泌型免疫球蛋白,是肠黏膜表面的免疫屏障。IgG是血清中免疫球蛋白的主要成分,占比约70%,是介导体液免疫的主要抗体。IgM在体内产生最早,持续时间较短,在抗感染免疫早期起重要作用。本研究发现,JWYPF及其多糖均可显著提高免疫抑制小鼠血清中IgG、IgM水平,但对sIgA水平影响不显著,这与冯丹等[8]报道一致。且JWYPF-P不同剂量干预免疫抑制小鼠体液免疫功能效果优于JWYPF,表明JWYPF-P的效果优于JWYPF。
综上所述,JWYPF及其多糖均能缓解环磷酰胺诱导的免疫抑制,且JWYPF-P的效果优于JWYPF。其机制可能是通过增加WBC数量,提升脾脏中CD3+、CD4+T细胞数量比例以及血清中sIgA、IgG、IgM含量,增强小鼠的免疫功能。本研究结果为加味玉屏风在畜禽养殖业中的临床应用提供了理论依据。
