牛结节性皮肤病病毒p32蛋白膜外区可溶性表达及多克隆抗体制备
2022-12-07黄敏霞吕殿红温肖会翟少伦罗胜军周秀蓉贾春玲魏文康1
黄敏霞,翟 颀,吕殿红,温肖会,翟少伦,罗胜军,周秀蓉,贾春玲*,魏文康1,,3*
(1.仲恺农业工程学院动物科技学院,广东广州 510225;2.广东省农业科学院动物卫生研究所/广东省畜禽疫病防治研究重点实验室/农业农村部兽用药物与诊断技术广东科学观测实验站,广东广州 510640;3.广东省农业科学院农业生物基因研究中心,广东广州 510640)
牛结节性皮肤病(Lumpy skin disease,LSD)是由牛结节性皮肤病病毒(Lumpy skin disease virus,LSDV)感染自然宿主牛引起发热、浅表淋巴结肿大和皮肤结节广泛分布等临床特征的一种病毒性传染病,被世界动物卫生组织(World Organization for Animal Health,WOAH)列为必须通报的动物传染病[1]。我国农业农村部将其定为二类动物疫病。LSD造成牛的皮肤损伤,降低皮张利用率和产肉率,甚至引起母牛产奶量下降,流产和不孕,以及公牛不育,从而给养牛业造成不可估量的经济损失[2]。LSD主要由节肢动物传播,有明显季节性,传播范围广,还能在牛群中通过直接或间接接触传播,具有高发病率、低病死率的特点[3-5]。2019年8月,我国第一次在靠近哈萨克斯坦和俄罗斯边境的新疆伊犁地区确诊LSD[6],此后LSD疫情在不到一年里时间里从中国最西北部的新疆蔓延到最东南部的台湾省,波及数十个省份,对我国养牛业造成巨大威胁[7-8]。
LSDV是一种有囊膜的双链线性DNA病毒,基因组约为151 kb,有156个开放阅读框(opening reading frame,ORF),属于痘病毒科(Poxviridae)山羊痘病毒属(Capripoxvirus,CaPV),CaPV包括山羊痘病毒(Goatpox virus,GTPV)和绵羊痘病毒(Sheeppox virus,SPPV),LSDV几乎囊括了GTPV和SPPV所有基因,存在交叉中和抗体,三者在血清学上无法区分[9-11]。其中p32蛋白是位于LSDV囊膜表面的一种主要结构蛋白,分子质量为35.5 ku,含有主要的抗原表位,免疫原性强,能在病毒感染的初期刺激宿主产生抗体阻止病毒扩散,但该抗体无法阻止病毒在攻毒部位的复制[12-14]。p32蛋白在LSDV的致病性、诊断和防控中具有重要意义[15]。
建立以p32蛋白为抗原的酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)方法,是进行LSDV血清学监测的重要前提,但目前相关的研究较少[16],主要由于p32蛋白难以表达、表达量不高或纯度不够,难以形成基于CaPV p32蛋白的商品化的ELISA试剂盒,国内尚未有获得批准文号的相关诊断试剂[17]。本研究利用pCold Ⅰ载体构建了LSDV p32蛋白膜外区的原核表达质粒,在对可溶性表达的重组蛋白进行纯化后,免疫昆明(Kunming,KM)小鼠制备了多克隆抗体,解决了p32蛋白难以表达或表达量不够等问题,同时为LSDV血清学诊断方法的建立及亚单位疫苗的研制奠定了基础。
1 材料与方法
1.1 材料
1.1.1 样品来源 LSDV感染的牛皮肤组织样品,采集自广西壮族自治区百色市公布LSDV疫情的牛群。
1.1.2 主要试剂 羊痘病毒、牛结节性皮肤病病毒核酸双重荧光PCR检测试剂盒,郑州中道生物技术有限公司产品;pCold Ⅰ载体、无缝克隆试剂盒,宝生物工程(大连)有限公司产品;大肠埃希氏菌表达菌BL21(DE3)pLysS,北京全式金生物技术有限公司产品;His标签蛋白质纯化试剂盒,苏州海狸生物医学工程有限公司产品;His标签小鼠单克隆抗体、HRP标记山羊抗小鼠IgG(H+L)、DAB显色试剂盒,碧云天生物技术有限公司产品。MONTANIDElM ISA 206VG佐剂,Seppic(上海)特殊化学品有限公司产品。引物合成与片段测序均由生工生物工程(上海)股份有限公司完成。
1.1.3 主要仪器 qTOWER3荧光定量PCR仪,德国耶拿分析仪器股份有限公司产品;T100梯度PCR仪,伯乐生命医学产品(上海)有限公司产品;紫外分光光度计,赛默飞世尔(苏州)仪器有限公司产品;THZ-C-1台式冷冻恒温振荡器,太仓市实验设备厂产品;JY92-Ⅱ超声波细胞粉碎机,宁波新芝生物科技股份有限公司产品;摇床,美国赛洛捷克(SCILOGEX)公司产品;旋转混匀仪,大龙兴创实验仪器股份公司产品。
1.1.4 实验动物 4周龄SPF级KM雌性小鼠,购自广东省医学实验动物中心。
1.2 方法
1.2.1 样品检测与P32基因扩增 在生物安全柜中取部分LSDV感染的牛皮肤组织样品向其中加入适量生理盐水,制成约100 mg/mL 的组织匀浆,经65 ℃ 水浴30 min灭活处理,反复冻融3次,8 000 r/min离心2 min后弃沉淀,将上清液进行DNA提取。利用羊痘病毒、牛结节性皮肤病病毒核酸双重荧光PCR检测试剂盒进行检测,阳性对照和阴性对照均为试剂盒所提供,同时设山羊痘疫苗为对照组。
将部分LSDV感染的牛皮肤组织剪切成细小的碎片,加入适量含1 mmol/L PMSF的蛋白裂解液,研磨充分后在冰上进行裂解,10 000 r/min离心5 min,收集上清蛋白于-80 ℃保存备用。
参考中国首例LSDV毒株LSDV/Xinjiang/2019(GenBank登录号:MN598005)的序列,利用Primer 5.0软件设计1对引物P32-F1和P32-R1(表1),扩增序列包含P32蛋白的的ORF序列,模板为样品上清液DNA,胶回收后,连接至pClone007克隆载体,转化大肠埃希氏菌DH5α感受态细胞,经菌液PCR鉴定正确的菌液送至生物公司进行测序,并用Blast分析测序结果中的ORF序列,将测序正确的菌液进行质粒提取,该质粒命名为pClone-P32,并上传序列到GenBank。
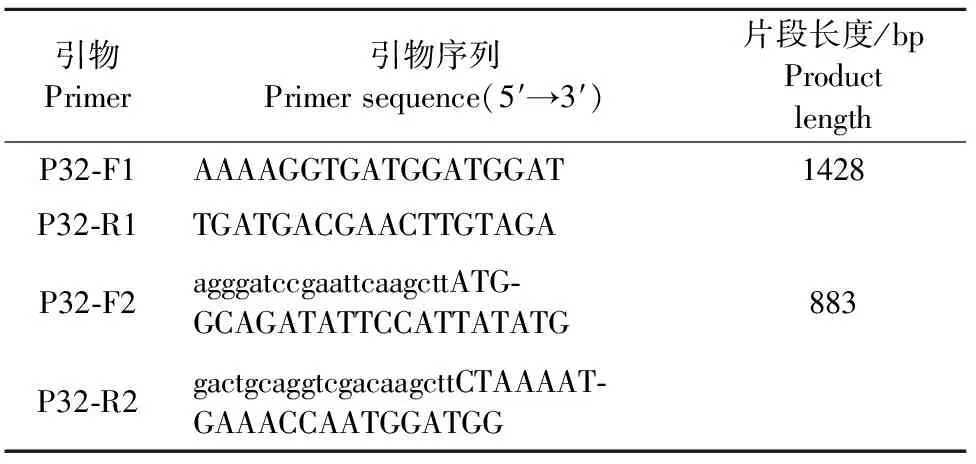
表1 PCR引物序列
1.2.2 pCold I-P32重组表达质粒的构建 根据同源重组原理,利用SnapGene 3.1.1软件设计1对特异性引物P32-F2和P32-R2(在上、下游引物分别引入一段与表达载体pCold Ⅰ同源的序列,表1),以上述1.2.1质粒pClone-P32为模板,PCR扩增p32蛋白膜外区,胶回收后,利用无缝克隆试剂盒与经过Hind Ⅲ单酶切得到的线性pCold Ⅰ载体进行连接,反应体系(10 μL)如下:5× InFusion HD Premix 2 μL,PCR扩增片段1 μL,线性pCold Ⅰ载体7 μL。连接体系转化大肠埃希氏菌DH5α感受态细胞,挑取单菌落送测序,同时提取质粒进行Hind Ⅲ单酶切鉴定,将测序及单酶切鉴定正确的阳性重组表达质粒命名为pCold I-P32。
1.2.3 p32蛋白的表达与纯化 将鉴定正确的重组表达质粒pCold Ⅰ-P32和空载体质粒pCold Ⅰ分别转化大肠埃希氏菌BL21(DE3)pLysS表达菌,挑取单个菌落接种于含有氨苄青霉素的LB培养基中进行37 ℃摇床过夜培养,次日将菌液按照1∶100的比例接种于含有氨苄青霉素的新鲜LB培养基中培养,当菌液的OD 600 nm值达到0.6时(培养大约3.5 h),加入IPTG使其终浓度为0.1 mmol/L,置于低温摇床15 ℃诱导培养24 h,8 000 r/min离心15 min收集菌体沉淀,并用含10 mmol/L咪唑和含蛋白酶抑制剂的Binding buffer溶解沉淀,然后超声破菌,8 000 r/min离心15 min后分别收集上清液和沉淀,进行SDS-PAGE分析重组蛋白的可溶性。
根据His标签蛋白纯化试剂盒对收集的蛋白上清液进行纯化,将样品与钴离子(Co2+)螯合的磁珠在室温旋转混合30 min,依次用含有20、40、80、100、200、400 mmol/L咪唑的缓冲溶液洗涤去杂蛋白或洗脱目的蛋白,每一步均收集洗涤或洗脱后的液体,进行SDS-PAGE分析纯化效果。
将纯化的p32截短蛋白进行SDS-PAGE,400 mA 20 min转移至PVDF膜上,将膜置于50 g/L脱脂奶粉中37 ℃封闭2 h,PBST洗涤3次后加入1∶500稀释的His标签小鼠单克隆抗体,4 ℃孵育过夜,PBST洗涤3次后,以HRP标记的山羊抗小鼠IgG(H+L)为二抗,1∶1 000稀释,37 ℃孵育1 h,洗涤后用DAB试剂盒显色。
1.2.4 制备重组蛋白多克隆抗体与Western blot检测 将预热至31 ℃的纯化蛋白与ISA 206 VG佐剂等体积混合,通过抗原乳化接头乳化成水包油包水(W/O/W)的双相油乳剂。按照50 μg/只的剂量多点皮下注射免疫小鼠;2周后进行第2次免疫;最后收集小鼠血清,置-20 ℃保存。
取1.2.1保存的牛感染LSDV的病变皮肤组织蛋白上清液进行SDS-PAGE电泳,转PVDF膜,50 g/L脱脂乳37 ℃封闭2 h,PBST洗涤3次,加入1∶100稀释的免疫小鼠血清4 ℃孵育过夜,对照组是以1∶100稀释的免疫前小鼠血清孵育,PBST洗涤3次,加入1∶1 000稀释的HRP标记的山羊抗小鼠IgG(H+L),37 ℃孵育1 h,PBST洗涤3次,DAB试剂盒显色。
2 结果
2.1 样品检测与P32蛋白扩增
根据样品核酸检测结果,阴性与阳性对照均正常(图1A和图1B),样品判定为LSDV阳性。
PCR产物在凝胶上显示为大小约1 400 bp左右的条带,符合预期结果(图1C)。通过DNA Star软件从测序正确的序列中获取一段大小为969 bp的ORF序列,经Blast分析确定该序列为LSDVP32基因序列,上传GenBank后登录号为OM046584,与我国LSDV/Xingjiang/2019的同源性达到100%。

A.FAM通道扩增曲线;B.VIC通道扩增曲线;1.待检核酸样品;2.山羊痘疫苗核酸样品;3.阳性对照;C.P32扩增产物的电泳分析; M.DNA标准DL 2 000;4.P32扩增产物
2.2 pCold Ⅰ-P32重组表达质粒的鉴定
重组表达质粒pCold Ⅰ-P32经Hind Ⅲ单酶切后出现两条带,大小分别为5 000 bp和900 bp左右(图2)。测序结果表明,P32基因以正确的阅读框架与原核表达载体pCold Ⅰ连接,pCold Ⅰ-P32重组表达质粒构建成功。
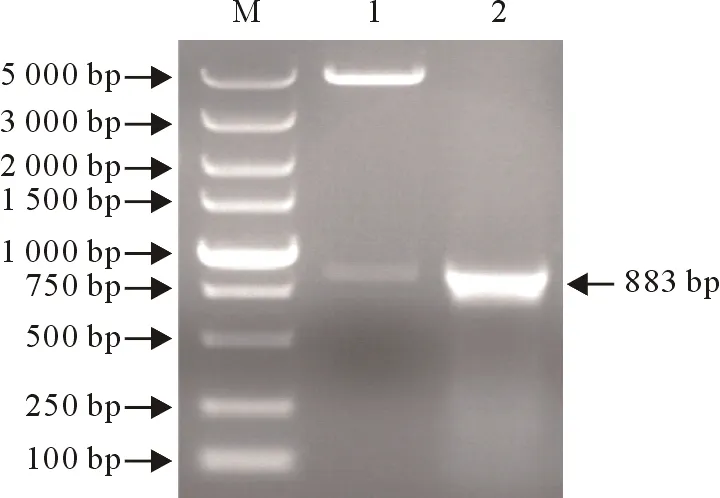
M.DNA标准DL 5 000;1.重组菌株PCR扩增产物;2.重组表达质粒pCold Ⅰ-P32单酶切产物
2.3 p32蛋白的表达与纯化
SDS-PAGE分析表明重组菌株表达的蛋白与理论值相符,分子质量为34.4 ku,且重组蛋白能以上清和包涵体2种方式同时表达(图3A)。
SDS-PAGE分析目的蛋白纯化效果(图3B),显示Co2+亲和层析纯化效果较好,目标蛋白最佳的咪唑洗脱浓度为200 mmol/L,获得的条带单一且颜色较深。Western blot检测纯化的目的蛋白能被His标签小鼠单克隆抗体特异性识别(图3C),说明表达的p32截短蛋白具有较好的反应原性。

M.蛋白分子质量标准;A.SDS-PAGE分析重组蛋白的可溶性;1.pCold I空载体诱导菌全蛋白;2.pCold Ⅰ-P32未诱导菌全蛋白;3.pCold Ⅰ-P32诱导菌的沉淀蛋白;4.pCold Ⅰ-P32诱导菌的上清蛋白;B.SDS-PAGE分析纯化结果; 5~10.20、40、80、100、200、400 mmol/L咪唑的缓冲溶液依次洗涤的杂蛋白或洗脱的目的蛋白;C.重组蛋白的Western blot鉴定结果;11.pCold I空载体诱导菌全蛋白;12.纯化的重组蛋白
2.4 多克隆抗体的特异性分析
经Western blot检测,从LSDV感染的牛病变皮肤组织中提取的天然蛋白可以被制备的小鼠多克隆抗体特异性识别,显色条带为p32全长蛋白,大小为35.5 ku(图4)。
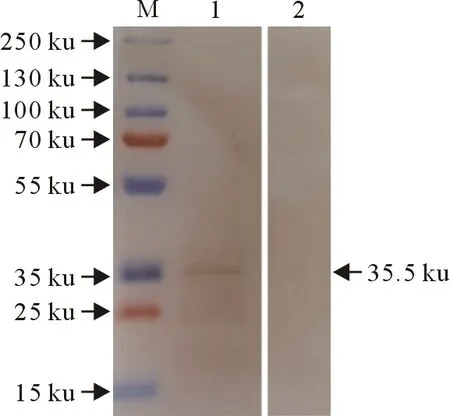
M.蛋白分子质量标准;1.抗LSDV p32小鼠多克隆抗体;2.免疫前小鼠血清
3 讨论
自2019年在我国新疆确诊LSD以来,该病已波及我国数十个省份,传播速度非常快,对我国养牛业造成巨大威胁[7]。p32蛋白是位于LSDV囊膜表面的一种主要结构蛋白,含有主要的抗原决定簇,其抗体能中和LSDV。但是关于LSDV的p32蛋白相关研究在国内较少。
p32蛋白是CaPV所共有的一种主要结构蛋白,属内核苷酸同源性介于88.3%~99.8%[18]。针对GTPV和SPPV的p32蛋白研究相对较多,许多学者发现p32全长蛋白难以表达或表达量较低,郭巍等[19]尝试用昆虫细胞表达和大肠埃希氏菌表达完整p32蛋白均未获得成功,而陈轶霞等[17]和Ebrahimi-Jam M H等[20]虽然成功表达了p32全长蛋白,但表达量不理想。因此许多学者尝试表达p32截短蛋白,但表达的截短p32重组蛋白大都以包涵体形式存在,宋书婷等[21]表达了p32膜外区,结果重组蛋白以包涵体形式存在,表达量很低,且不易纯化。
基于p32全长蛋白难以表达,本研究尝试以可溶性形式表达LSDV p32蛋白的膜外区。从LSDV核酸样品中PCR扩增得到P32全长基因,经Blast分析可得该基因与我国LSDV/Xingjiang/2019的一致性达到100%。根据陈思睿[18]分析的LSDV/Xingjiang/2019毒株p32蛋白结构可知,该蛋白为跨膜蛋白,共有322个氨基酸,其中1-280位氨基酸在膜外侧,281-303位氨基酸是跨膜结构域,304-322位氨基酸在膜内侧,且C端的跨膜区为疏水区。为了便于P32基因的高效表达,本研究在克隆P32基因时,去除了对细胞有毒性的3’端跨膜区及膜内区,保留了膜外区,将其连接至原核表达载体pCold Ⅰ。pCold载体利用大肠埃希氏菌的冷休克基因,在低温诱导下使截短p32蛋白能以可溶性形式得到高效表达,解决了基因表达困难或表达的蛋白质不可溶等问题,同时低温条件下大肠埃希氏菌暂时停止生长,大部分杂蛋白的表达量降低,能很好减轻纯化蛋白的工作难度。
许多学者研究已证实p32蛋白截短表达没有破坏p32蛋白抗原决定簇,仍然使免疫小鼠产生免疫应答[22-23],这与本研究Western blot鉴定结果相符。本研究用纯化的截短p32蛋白免疫小鼠后获得的多克隆抗体能特异性识别感染LSDV牛皮肤组织的天然蛋白,说明本研究获得的多克隆抗体可以应用于检测LSDV抗原。本研究解决了p32蛋白难以表达等问题,获得了纯度较高的p32截短蛋白及其鼠源多克隆抗体,为进一步建立LSDV血清学诊断方法和基因工程亚单位疫苗的研制奠定了基础,有利于加强我国的LSD防控工作。
