NaCl限域调控的电极材料及在超级电容器中的应用
2022-12-06卫武涛单常伟郭子婕徐甲强张久俊米立伟
卫武涛单常伟郭子婕徐甲强张久俊米立伟
(1.上海大学理学院可持续能源研究院,上海 200444;2.中原工学院先进材料研究中心河南省功能盐材料重点实验室,河南 郑州 451191)
能源是经济发展的根本保障,是人类生存和可持续发展的必需物质[1].目前,随着世界经济快速发展和人类对生活的高质量追求,不可再生化石能源已被快速消耗并同时造成了日益严重的环境污染[2-4].因此,提高现有化石能源的有效利用率和开发可替代的可持续清洁能源(如太阳能、风能、水落差能等)已成为当今经济和社会可持续发展的必由之路[5-6].但这些能源产生的电能是与气候、环境等不可控因素密切相关的间歇电能,不易被使用.因此,以二次电池、超级电容器、燃料电池为代表的电化学能源技术已被公认为是可靠的、高效的、实用性强的新型能源技术.
随着人类对便携式电子设备和电动汽车动力系统要求的不断提升,包括电池和超级电容器在内的电化学储能设备便发挥了重要作用.电化学储能设备通常是基于电极与电解液离子之间的可逆电化学反应或者电极对电解液离子的可逆吸脱附来实现电化学能量的存储和释放的[7-8],通常由正极、负极、隔膜和电解液组成.在充电过程中,外部电压驱动电极发生电化学反应或吸附带电荷相反的离子;在放电过程中,电极发生逆向电化学反应或释放吸附的离子产生流经外电路的电子而产生能量[9-10].电化学储能设备可以根据电极和机理的不同分为铅酸电池、镍镉电池、镍氢电池、锂离子电池、钠离子电池、锌空气电池、钠硫电池和超级电容器等.在众多储能技术中,电化学储能技术具有高效、通用性和灵活性好等优点.例如,锂离子电池具有高电压、自放电低、循环寿命长等优点,是目前最重要、应用最广的可充电电池[11];超级电容器由于具有快速充放电能力、长循环寿命和高功率密度等优异的储能能力而受到越来越多的关注,在电动汽车领域有着广泛的应用前景[9-10].
众所周知,电化学储能设备的性能、适用场合、安全性等重要指标均与电极材料和电解液有关[12-15].随着材料设计策略、合成技术和表征方法的发展,电极材料及设备的性能得到了迅速提升.但目前已报道的大部分电极材料均受自身离子或电子导电性较差的影响,导致其实测比容量远远低于理论比容量,也就是电极材料的利用率较低.因此,同时提升电极材料自身离子和电子导电性被公认是设计组装高性能电化学储能设备的关键所在.随着电极材料自身离子和电子导电性的提升,同样可以优化因电化学极化和浓差极化引起的倍率性能问题,并改善在充放电过程中电极材料内外形变不均引起的微观结构衰败问题.而若要调控制备出具有高离子和电子导电性的电极材料,就需要对电极材料的微纳米结构和晶体结构进行可控设计,但这具有挑战性.
1 超级电容器
1.1 超级电容器性能概述
在众多电化学储能设备中,超级电容器作为一种新兴的电化学储能设备,同时具有传统电容器和电池的优点[9-10].超级电容器的能量密度高于传统电容器2∼3个数量级,功率密度可达电池的10倍以上(见图1),循环次数远远大于目前在用电池[16].因此,超级电容器已成为同时拥有高功率密度和长寿命的电化学储能设备,受到了越来越多的关注.
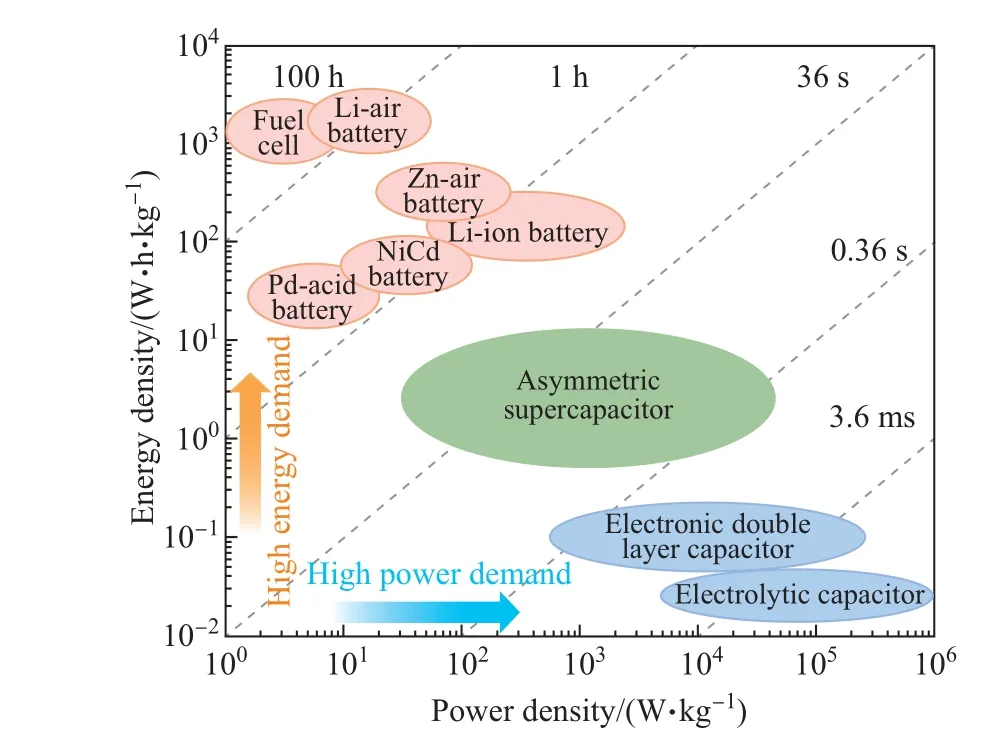
图1 不同电化学储能设备的能量密度和功率密度对比[16]Fig.1 Comparison of energy density and power density of different electrochemical energy storage devices[16]
1.2 超级电容器分类及工作原理
超级电容器根据储能机制不同可以分为双电层电容器和赝电容电容器[9-10,17-18].双电层电容器是一种在外加电压作用下使电极带有相应的电荷,通过静电相互作用使带有相反电荷的电解液离子吸附在电极表面,形成由电荷和离子构成的双电层,从而达到储能功效的电化学储能设备[17].在放电过程中,电解液离子从电极表面脱附,电荷经外电路传输,从而实现对外能量的输出[17].双电层超级电容器充放电机理如图2所示.很明显,双电层超级电容器充放电过程主要为电解液离子在电极表面的吸脱附过程,不产生任何电极/电解液界面的电子跨越,也就是说该过程为物理静电吸附过程,并且双电层的形成可以在瞬间完成.这些特性使双电层超级电容器具有快充快放和长循环寿命的特性,但其比容量与电极材料表面能吸附的电解液离子数量密切相关,在很大程度上取决于电极材料的表面特征,如对电极液的浸润性、比表面积、孔径分布等.因此,具有较大比表面积和较低密度的碳材料便成为双电层超级电容器最理想的电极材料.但仅靠表面吸附电解液离子进行储能的本质决定了双电层超级电容器的比容量不够理想.
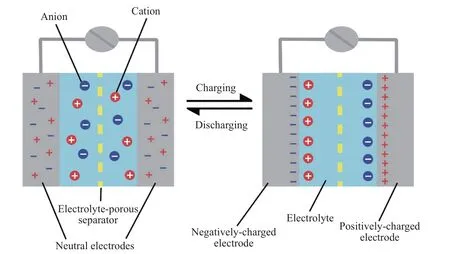
图2 双电层超级电容器的充放电机理[17]Fig.2 Charging and discharging mechanism of double-layer supercapacitor[17]
赝电容超级电容器的电荷存储一般是通过电极材料表面或近表面的快速可逆氧化还原反应进行的(见图3),且氧化还原反应会改变电极材料表面层的价态[17].过渡金属的多价态特性使得其化合物成为赝电容超级电容器电极材料的最佳选择.由过渡金属化合物电荷存储机制可以发现,只有位于块体材料表面或近表面的少部分电极材料才是有效的活性材料,这就导致大部分电极材料无法参与可逆氧化还原反应,也就没有容量贡献.于是,大部分已报道电极材料的实测比容量远远低于理论比容量.此外,表面或近表面的有效活性材料在充放电过程中会发生结构形变,而位于块体材料内部的非活性材料则不会出现结构形变,这就使得二者具有不同的形变程度,在充放电过程中表面或近表面的活性材料会从块体电极材料表面逐渐脱落,导致电极材料的结构坍塌,造成循环稳定性不如双电层电容器.
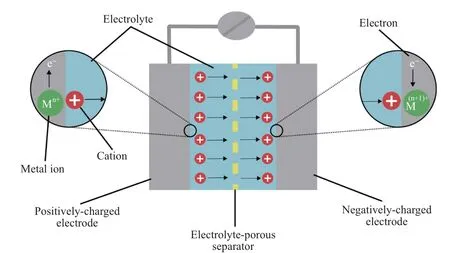
图3 赝电容超级电容器的机理示意图[17]Fig.3 Mechanism diagram of pseudocapacitance supercapacitor[17]
由此可见,双电层超级电容器和赝电容超级电容器各有优缺点.因此,为了进一步设计出具有高综合性能的超级电容器,一般是通过对碳材料进行官能团修饰以提高其电解液浸润性,同时也赋予其一定的可逆氧化还原活性;或通过微纳米可控构筑技术来提高赝电容电极材料的比表面积,并同时提升电极材料利用率和结构稳定性.这些科研努力已经有效促进了超级电容器性能的长足提升.
1.3 超级电容器的结构组成及电极材料的发展概况
超级电容器的形状和尺寸会因应用场景而有所区别,但作为电化学储能设备,其结构与其他电化学储能设备相似,在通常情况下主要由正极、负极、电解液和隔膜组成,如图2和3所示[9-10,17].正极和负极作为超级电容器的“心脏”,通过对电解液离子的吸附或与电解液离子发生可逆氧化还原反应来实现超级电容器的电荷存储.而正极和负极的电化学性能主要是由电极材料的属性所决定,其物相组成、可逆氧化还原活性、微纳米结构、比表面积等均与电化学性能密切相关.电解液作为超级电容器的“血液”,连通着正极和负极,并为正极和负极提供所需的离子.电解液的分解电压决定了超级电容器的工作电压窗口,其熔点、沸点、热稳定性、不可燃性及挥发性决定了超级电容器的适用环境温度和安全性.隔膜作为离子的导体和电子的绝缘体,可允许电解液离子通过,同时将正极和负极隔开,防止内部发生短路.由此可见,电解液、电极材料及二者之间的匹配性是决定超级电容器比容量、工作电压窗口、能量密度、功率密度、循环寿命、安全性和适用环境温度的关键所在.
超级电容器的电荷存储行为与所使用的电极材料密切相关[9-10].因此,关于超级电容器的大部分研究工作都致力于开发高容量、性能优异的新型电极材料.而优异的电极材料应同时具备高的比表面积、良好的电解液浸润性、卓越的结构稳定性、适宜的热稳定性、优异的化学稳定性等特点,同时还应满足低制备成本和环境友好等方面的市场需求.经过几十年的努力,目前已报道的超级电容器电极材料种类非常丰富,主要包括碳材料、过渡金属化合物、导电聚合物以及它们的复合材料等.
碳材料在超级电容器中主要应用在双电层超级电容器的正负极及部分赝电容超级电容器的负极.由于碳材料的电荷存储主要依赖于对电解液离子的吸附量,因此碳材料的比表面积、孔隙率和官能团是提升超级电容器能量密度的重要因素.目前已报道的碳材料有活性炭、石墨烯、碳纳米管、生物质碳、碳气凝胶以及石墨烯泡沫等[19-20].为了促进碳材料在超级电容器中的商业化应用,相关研发工作主要是通过调控制备策略来提升比表面积,以进一步提高比容量;通过官能团修饰来提升电解液浸润性,以提高活性比表面积占比;通过N、P等杂原子掺杂来引入缺陷,以获得更多的高活性位点;通过优化制备方法和采用廉价的原料来降低碳材料的制备成本,以进一步提高碳材料的性价比.
过渡金属化合物主要用于赝电容超级电容器中,主要依赖具有多价态的过渡金属离子与电解液离子之间的可逆氧化还原反应来储存电荷.所涉及的过渡金属包括镍、钴、锰、铁、铜、钌、钒等;所涉及的化合物为氧化物、硫族化合物、氢氧化物、氮化物等[21-23].而赝电容超级电容器在储能过程中,可逆氧化还原反应仅发生在电极材料的表面或近表面,这就导致大部分过渡金属化合物电极材料的实测比容量远低于理论比容量,并且循环寿命也远不及双电层超级电容器.为了进一步提升这类电极材料的电化学性能,相关研发工作主要通过设计不同制备策略来提升比表面积,从而增加暴露在电解液中活性金属中心的数量,以达到提高电极材料利用率的目的;通过优化不同结构单元的组装方式来增加单元间的相互作用力,从而限制充放电过程中的结构形变,最终提升电极材料的循环寿命;通过离子置换或共沉淀策略来引入有益的金属离子,从而发挥不同金属离子之间的电子相互作用,实现优势互补和协同效应.
导电聚合物具有成本低、掺杂态电导率高、电压窗口高、孔隙率高、可逆容量高、化学修饰可调等优点,被认为是超级电容器的理想电极材料之一[24-26].导电聚合物虽然也是通过氧化还原反应来储存电荷,但与过渡金属化合物存在较大差异.在氧化反应过程中,电解液离子从电解液中转移到聚合物的主链上;在还原反应过程中,电解液离子又从聚合物主链上返回电解液中.这些氧化还原反应发生在导电聚合物的整体,而不仅仅是表面或近表面.并且,在充放电过程中导电聚合物结构不会因相变等因素而发生改变,使得这一过程具有高度可逆性.目前,聚苯胺、聚吡咯、聚噻吩均已被广泛作为电极材料.然而,在氧化还原反应过程中,电解液离子的插层/脱层过程容易引起导电聚合物进行重复的肿胀和收缩,这往往会破坏导电聚合物的机械性能,从而引起电化学性能的衰减,进而影响其作为电极材料的性能.
综上可知,碳材料和过渡金属化合物的电荷存储过程仅仅发生在电极材料的表面或近表面;而导电聚合物因其主链具有良好的电子导电性,同时电解液离子可以在链与链之间进行传输,进而导致电荷存储发生在整个导电聚合物的体相中.因此,只有同时能接触集流体和电解液的电极材料才能成为真正的活性材料,这就要求电极材料要同时具有良好的电子导电性和离子导电性.通过对比三类电极材料的结构可以发现,碳材料虽然具有良好的电子导电性,但电解液离子无法在其内部传输,进而决定了电解液离子只能吸附在碳材料的表面;过渡金属化合物的电子导电性远不如碳材料,并且大部分过渡金属化合物同样具有密堆积的晶体结构,这也是导致其有效利用率低的主要原因,也决定了其实测比容量远远低于理论比容量的必然结果.为此,已有研究人员提出通过优化电极材料晶体结构和元素组成来提升电极材料自身离子导电性和电子导电性,或将具有优异离子导电性和电子导电性的电极材料进行纳米级复合,实现二者彼此为对方提供离子或电子的传输通道,从而获得具有高离子和电子导电性的复合电极材料.
2 NaCl在电极材料微观结构中的调控策略
在储能器件中,电极材料作为储能器件的“心脏”,决定了储能器件的性能.电解液离子在电极材料内部或晶格中进行可逆吸附和解析,或与电极材料发生可逆氧化还原反应来实现化学能与电能的转化,从而实现能量存储[9-10,27-29].近年来,众多研究人员一直致力于发展低成本、通用、绿色的微纳米电极材料构筑策略[30-32].NaCl具有高溶解度、廉价、优异的热稳定性和化学稳定性.NaCl的溶解再结晶技术可被直接用作模板来构建微纳米材料,如三维类石墨烯的大孔Fe-N-C催化剂[33]、Au纳米线阵列[34]、N掺杂碳空心立方体双功能电催化剂[35]、Co/N共掺杂碳纳米片电催化剂[36]、二维过渡金属卤族化合物[37]等,这些材料在电催化领域已经表现出很好的性能.传统的硬模板、软模板技术通常都需要高温碳化、强酸、强碱或有机溶剂超声辅助溶解等策略来去除模板,而将NaCl作为模板,只需要用水溶解即可去除模板,并且溶解后的NaCl可以通过再结晶技术进行回收,能够明显简化模板去除过程,提高模板法的适应性,同时还可以降低模板法制备微纳米材料的成本.基于这些优点,NaCl模板法作为一种有效且新颖的储能电极材料优化策略,被用于构筑具有特殊微纳米结构的电极材料,包括超级电容器电极材料[38-41].
除此之外,NaCl具有清晰的熔点(801◦C)和沸点(1 465◦C),并表现出优异的热稳定性,可以在高温下实现熔融态,因此被认为是熔盐法的理想熔盐剂[42-46].NaCl基熔盐法有如下优点:①可以将固固反应转化为固液反应或液液反应,能够降低反应所需温度,并缩短反应所需时间;②能够实现反应原料在原子尺度上的混合,从而提高产品的纯度和结晶度;③在冷却过程中,逐渐凝固的熔盐可以渗透在产品之间,从而预防产品团聚,使得产品具有良好的分散性;④由于NaCl熔点和沸点相差较大,使得熔盐温度调节范围比较大,适用范围广.基于上述优点,NaCl基熔盐法已逐渐扩展到微纳米材料制备领域,特别是制备具有多孔或空心结构、或以纳米片或纳米线作为结构单元构建的分等级结构的微纳米电极材料[47-51].
基于NaCl独特的物理化学特性,下面将主要介绍NaCl基模板法和NaCl基熔盐法在电极材料合成中对电极材料微观结构的调控作用,以及对电化学储能器件包括超级电容器性能的影响.
2.1 NaCl基模板策略
对于微纳米材料的可控构建,模板法被认为是利用空间限域精确控制微纳米材料尺寸、形貌和微观结构的有效策略[52],所制备的微纳米材料具有良好的分散性.根据所选模板自身特性和限域能力,模板法通常被分为硬模板法和软模板法[53-54].硬模板法主要利用由共价键维持的具有特定刚性结构的材料(如分子筛、二氧化硅、聚苯乙烯微球、聚合物、多孔氧化铝膜、碳纳米管等)作为模板来构筑微纳米颗粒、微纳米棒、微纳米管、空心球或多孔的微纳米材料等[55-56].首先,通过化学或电化学反应将目标材料原位生长在硬模板的内外表面;然后,通过高温煅烧或利用酸、碱、有机试剂溶解等手段来去除硬模板,得到微观结构新颖的微纳米材料.软模板法主要通过引导或调节自由前驱体在分子间作用力或空间限域的作用下进行规律性组装,从而控制自由前驱体的组成、结构形态、大小、排列取向等,最终实现微纳米材料的可控构建[55,57-58].常用的软模板剂主要有表面活性剂、微乳液液滴等,通常用有机溶剂去除.目前通用的模板法虽然有很多优点,但模板剂的去除条件却限制了大规模应用.例如,高温煅烧法去除模板得到的材料一般是耐高温的金属氮化物、氧化物或碳化物;利用酸、碱或有机溶剂刻蚀来去除模板所得到的材料必须在相应的溶剂中才能稳定存在.因此,能够工业化的模板剂应同时满足廉价、易去除和通用等特性.NaCl在水、甘油等溶剂中具有很高的溶解度,是一种典型的离子化合物.NaCl晶体表面的负离子和阳离子可以吸引相对离子在其表面构建目标材料.以NaCl作为模板时,在室温下用水、甘油等环境友好溶剂即可轻松去除NaCl模板.NaCl模板又可以通过再结晶得到再利用.因此,NaCl被认为是一种很有应用前途的模板材料.目前,以NaCl为模板的研究基本上是基于NaCl的溶解特性,通过对NaCl的溶解和再结晶来调控微纳米材料的微观结构和形貌[47-51,53].
NaCl的密度为2.165 g·cm−3,远远大于大多数溶剂的密度.在常规液相环境下制备微纳米材料时,再结晶的NaCl倾向于沉积在底部,导致目标材料的微观组织和形貌均匀性较差.为了抑制NaCl的沉积,可将冷冻干燥技术与NaCl模板法相结合,以提升所制备材料的均匀性[37,40](见图4).该策略主要是将最终反应体系快速冷却到凝固状态,从而有效抑制了NaCl的析出;然后,在冻干过程中实现再结晶NaCl与目标物料在微纳米尺度上的均匀混合;最后,通过简单的水洗去除NaCl模板,得到形貌和微观结构均匀的微纳米材料.根据该设计思路,利用冷冻干燥技术和NaCl模板策略已制备出了多孔层状MoP/C复合材料.众所周知,NaCl水溶液的冰点很低,甚至低于−20◦C,因此在制备过程中,最终的反应溶液在冷冻干燥前需在冰箱中固化一夜[59].为了缩短冻结时间,研究人员还借助液氮的低温特性,将液氮倒入反应体系中,实现反应体系的快速冻结,利用NaCl作为双功能及用水可去除的模板剂,以聚乙烯吡咯烷酮作为碳源,成功合成了三维石墨烯的大孔Fe-N-C催化剂.通过调整NaCl/聚乙烯吡咯烷酮质量比可以控制聚乙烯吡咯烷酮壳的厚度[33].在适当的NaCl/聚乙烯吡咯烷酮质量比例下,也可以制备出封闭或部分开放壳层的空心碳.上述研究成果为NaCl模板法制备形貌和微观结构均匀的微纳米材料提供了新的策略.
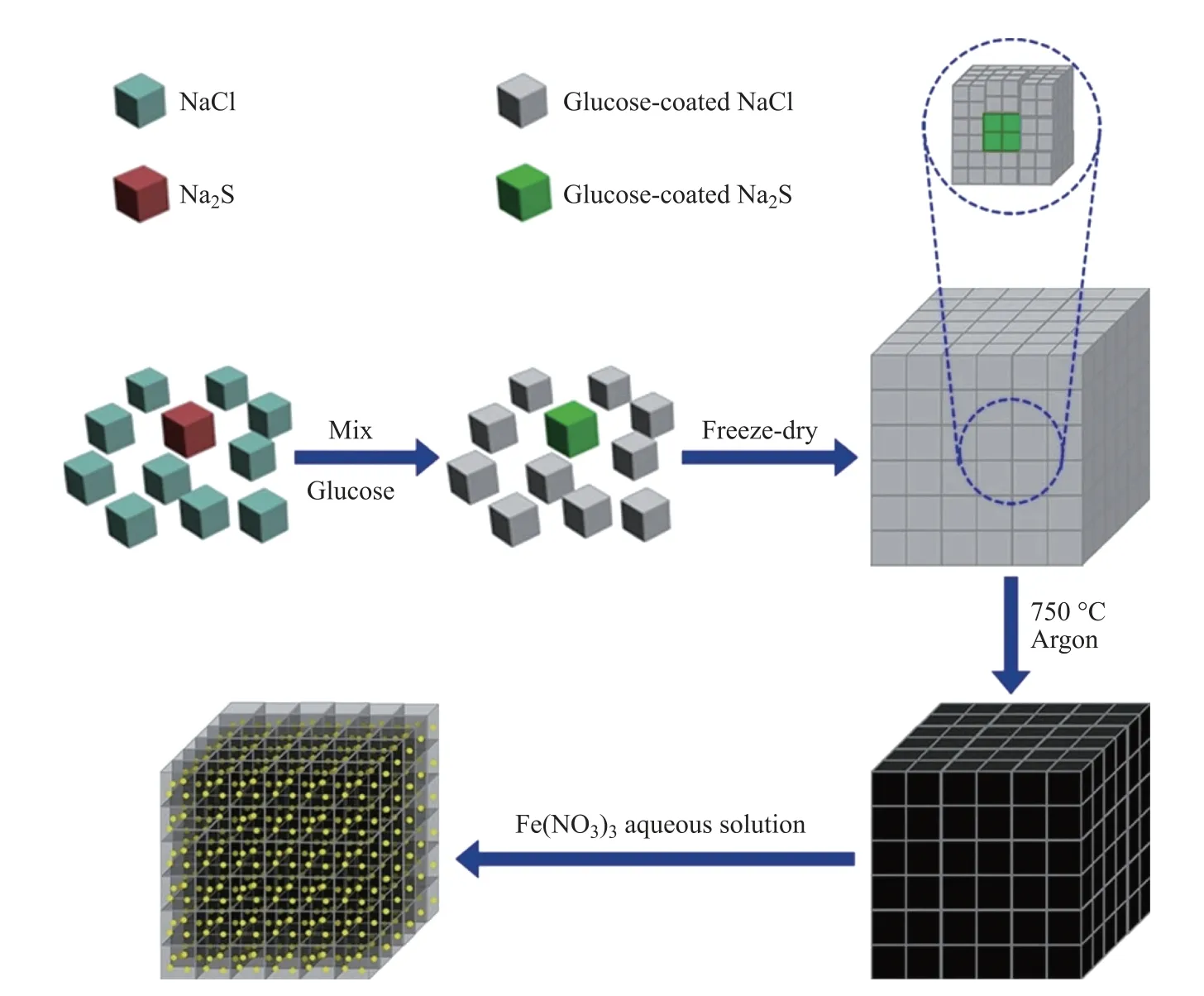
图4 基于NaCl模板法设计构筑3DS@PGC材料的示意图[60]Fig.4 Schematic diagram of design and construction of 3DS@PGC materials based on NaCl template method[60]
为了实现单独、柔性和透明石墨烯纸(flexible transparent graphene paper,FFT-GP)的开发,研究人员使用棱柱状石墨烯(prism-like graphene,PLG)构建块,基于NaCl的重结晶能力和优异的热稳定性,通过NaCl模板法成功制备了FFT-GP,构筑机理如图5所示.①将中心为大块NaCl多晶体的Si衬底放入腔内;②整体NaCl逐渐熔化,NaCl离子扩散到混合等离子体中,石墨烯基层在硅衬底上迅速形成;③施加直流偏压,使NaCl完全坍塌,并在石墨烯基层膜上形成薄的湿层;④关闭直流偏压,随着湿氯化钠层重结晶成晶粒,棱柱状石墨烯(PLG)开始形成;⑤最终产品FFT-GP在Si基板上形成涂层[61].基于FFT-GP测定的超级电容器的电容比基于层压/褶皱超薄石墨烯薄膜的超级电容器的电容大近1 000倍,比已有报道的基于纯碳材料的透明和柔性超级电容器的电容至少大10倍.为了评价透明超级电容器的电化学性能,研究人员通过循环伏安和恒流充放电测试考察了FFT-GP基超级电容器在正常、拉伸和弯曲状态下的电化学性能,相关测试结果如图6所示[61].由图可见,FFT-GP基超级电容器在正常状态下扫速从50 mV·s−1提升到2 000 mV·s−1的过程中,循环伏安曲线一直呈现出标准的矩形,证明了其具有优异的双电层电容特性(见图6(a)),这一点被恒流充放电曲线呈现出的标准三角形再一次印证(见图6(b)).该超级电容器在0.02 mA·cm−2电流密度下,比容量高达3.3 mF·cm−2(见图6(c)).在随后的拉伸和弯曲测试中,该超级电容器的比容量、阻抗及循环稳定性几乎不受影响(见图6(d)∼(g)).两个FFT-GP基超级电容器串联之后容量得到提升(见图6(h)),可以带动智能手机正常工作,并展示出良好的通透性(见图6(h)).这一研究结果进一步证明了采用NaCl基模板法是制备柔软的石墨烯复合电极材料的有效策略.

图5 以NaCl为模板的气相沉积法制备柔性透明石墨烯纸(FFT-GP)[61]Fig.5 Flexible transparent graphene paper(FFT-GP)prepared by vapor deposition using NaCl as template[61]
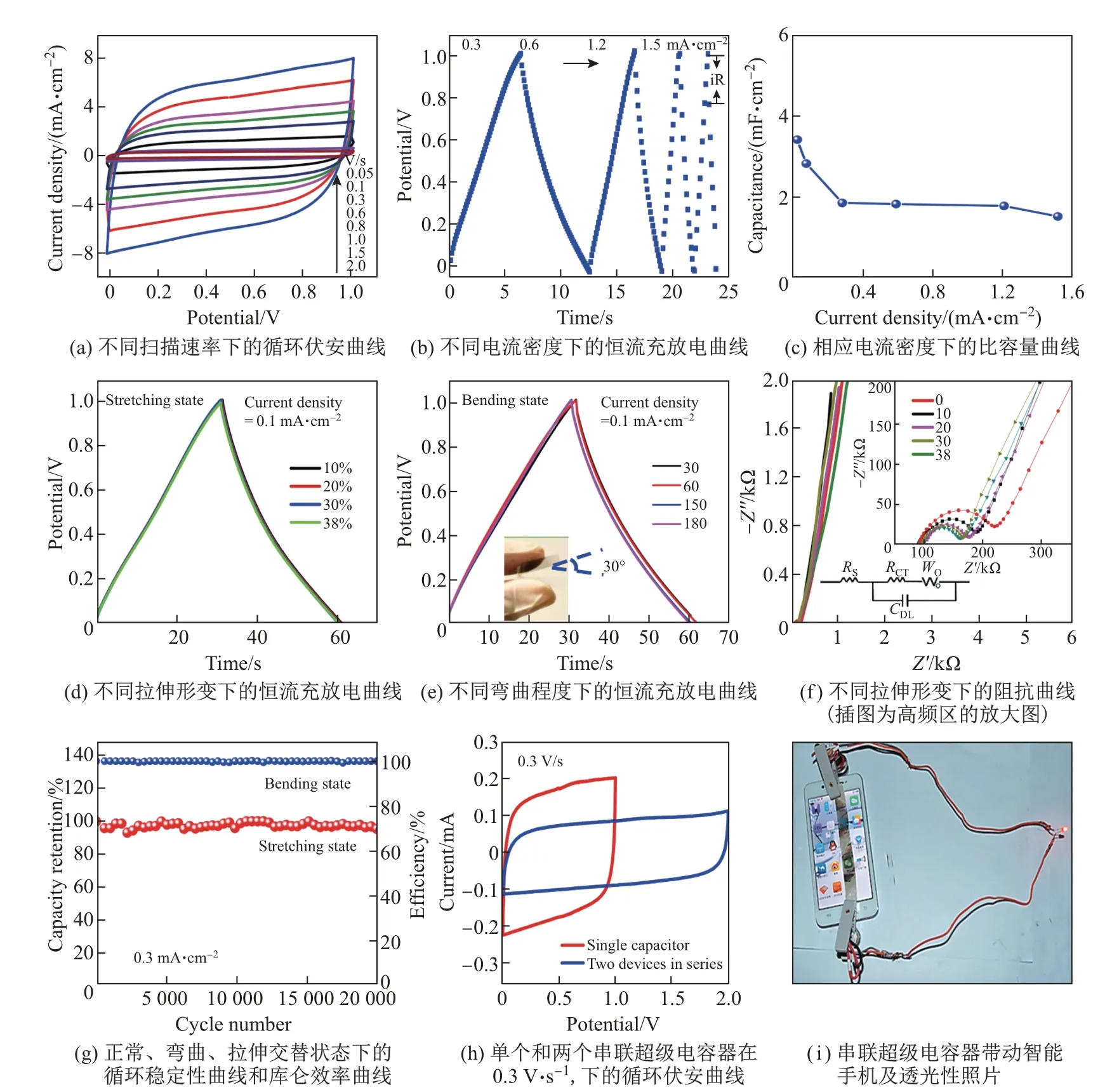
图6 FFT-GP在正常、拉伸和弯曲状态下的电化学性能[61]Fig.6 Electrochemical performance of FFT-GP in the releasing,stretching and bending states[61]
在NaCl基模板法中,几乎都是先将NaCl溶解到反应体系中,使Na+和Cl−均匀分散在反应体系中,以结晶过程中新形成的NaCl作为模板来制备微纳米材料.因此,几乎所有的NaCl基模板法都是以NaCl作为原料之一.但实际上,只要体系中有足够的Na+和Cl−,在随后的再结晶中就会形成NaCl晶体,从而实现NaCl模板法.于是,研究人员又利用木质素磺酸钠与1-烯丙基-3-甲基咪唑氯之间简单的离子交换反应,得到了一种富含Na+和Cl−的新型聚合物离子液体;然后,以该混合物溶液为前驱体,通过冷冻干燥和直接碳化使重结晶的NaCl和氮掺杂的碳复合在一起,而后经过水洗便得到了氮掺杂的多孔碳材料.相关可控构筑机理如图7所示[62],将原材料中的Na+和Cl−经重结晶得到的NaCl晶体作为模板,使所得材料具有独特的孔洞结构;同时,NaCl晶体又作为活化剂,提高了所得碳材料的石墨化程度.通过调整原料比例,多孔碳材料中的氮含量可以提高到4.68%.根据不同的碳化温度,所制得氮掺杂多孔碳的比表面积可以从83 m2·g−1逐渐提升到502 m2·g−1.在以该氮掺杂多孔碳为活性材料组装的对称超级电容器中,在0.1 A·g−1电流密度下,碳材料比容量可以达到230 F·g−1.该超级电容器在功率密度为25 W·kg−1时的能量密度为7.99 W·h·kg−1;在2 A·g−1电流密度下,经过20 000圈循环后比容量保持率高达90.3%.该研究成果再一次验证了含有足够Na+和Cl−的反应体系也可以实现NaCl模板法制备多孔微纳米材料.
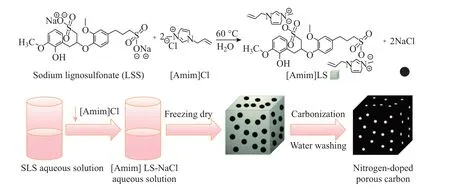
图7 以木质素磺酸钠和1-烯丙基-3-甲基咪唑氯为原料制备氮掺杂多孔碳的合成示意图[62]Fig.7 Schematic diagram of synthesis of nitrogen-doped porous carbon using sodium lignosulfonate and 1-allyl-3-methylimidazolium chloride as raw materials[62]
借助冷冻干燥技术实现再结晶NaCl与目标材料在反应溶液中的均匀分布,可成功构建系列具有多孔结构的微纳米材料.但NaCl水溶液极低的凝固点对冷冻干燥技术造成了很大困难.在冻结含有NaCl和目标物质的溶液时,隔夜冻结和液氮辅助冻结是两种最常见的策略,但这些策略使得简单、低成本的NaCl模板法比较耗时或带来很大的安全风险.并且,在冻干过程中,冻结的溶液会缓慢解冻,从而对最终微纳米材料的结构均匀性产生影响.回顾NaCl模板法与冷冻干燥技术结合的初衷,不难看出其主要是通过快速冻结使溶液体系快速凝固,保持各组分的均匀分布,从而抑制再结晶NaCl的沉降,以提高所制备材料的结构均匀性.
为了达到同样的效果,溶胶-凝胶技术可以使液相体系在反应过程中失去流动性,也被认为是一种合适的策略.研究人员以黄原胶和大豆蛋白为溶胶凝胶剂,以质量比为25∶1的NaCl和NaOH为混合模板剂,设计和制备出了具有高超级电容器性能的三维富氮多孔碳气凝胶(three-dimensional nitrogen-rich porous carbon aerogel,3D NPCA),呈现出蜂窝状的三维网状结构[63],合成过程如图8所示.详细的形貌表征揭示出该碳气凝胶由具有分等级多孔结构且相互连接的碳纳米片所组成,这一特殊结构有效提升了碳材料的电子和离子传输能力.3D NPCA的比表面积可以高达1 438 m2·g−1,氮含量也达到了6%.体系中的NaCl不仅有利于提升所得碳材料的石墨化程度,并且和NaOH一起对碳材料进行造孔,其中NaOH对微孔的形成起重要作用.高含量的掺杂氮可以提供额外的赝电容,从而进一步优化碳材料的电化学性能.在三电极测试中,该碳气凝胶在0.5 A·g−1电流密度下,比容量为264.3 F·g−1.基于该碳气凝胶组装的对称超级电容器的能量密度能够达到12.4 W·h·kg−1,在3 A·g−1电流密度下循环10 000圈后,比容量保持率高达98.6%[63].这一研究提出了将溶胶-凝胶技术和NaCl模板法相结合,协同构筑多孔微纳米电极材料的新策略,是对NaCl模板法的进一步推广和优化;同时,基于单一NaCl模板法设计开发了NaCl基混合模板法,并考察了不同模板剂的作用,进一步拓展了NaCl基模板法的应用领域.
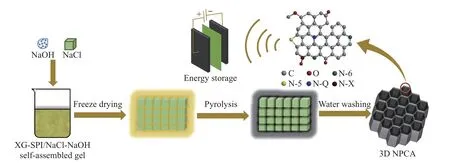
图8 三维富氮分等级多孔碳气凝胶(3D NPCA)合成过程[63]Fig.8 Synthesis process of three-dimensional nitrogen-rich hierarchical porous carbon aerogel(3D NPCA)[63]
以上概述了在冷冻干燥技术或溶胶-凝胶技术的辅助下,利用NaCl基模板法合成具有多孔结构的微纳米电极材料的基本原理和技术路线.上述研究促进了NaCl基模板法成为优化电极材料微观结构的通用策略.但由于NaCl溶液的冰点极低,使得冻结过程非常困难,对直接冷冻干燥技术带来困难;而采用高温碳化技术去除凝胶形成过程中会引入聚合物,只能制备碳、金属氧化物及其复合电极材料.因此,NaCl基模板法还需要进一步优化,才能成为一种通用且实用的微纳米材料制备技术.
2.2 NaCl基熔盐策略
熔盐法是最初用于晶体生长而发展起来的一种无机材料合成方法[64-69].自1973年Arendt利用熔盐法合成了BaFe12O19和SrFe12O19以来,熔盐法逐渐成为制备无机微纳米材料的重要方法[70].熔盐法通常是使用一种或多种低熔点的盐作为反应介质.为了保证合成反应在高温熔融状态下进行,所选用的熔盐需要具有固定的熔点.待反应结束后,利用合适的溶剂将熔盐去除,过滤洗涤后便可得到目标产物.因此,熔盐法通常具有以下优点:①在高温熔盐液体介质中可以实现原子级反应;②反应物在熔盐中可以快速扩散,从而大大缩短反应时间;③熔盐的存在可以防止产物的团聚,从而使得目标材料通常都呈现出良好的分散性[71-73].
基于上述优点,近年来熔盐法在无机材料合成中得到了广泛应用.例如,研究人员 以NaNO3为 熔 盐,在350◦C下 制 备 了Na0.55Mn2O4·1.5H2O和Na2W4O13;以KNO3为熔 盐,在380◦C下 制备了K0.27MnO2·0.54H2O、Cu2(OH)3NO3和Zn5(OH)8(NO3)2·2H2O;以LiNO3为熔盐,在420◦C下合成了Li2WO4.在熔盐反应过程中,研究人员还设计将阳离子(Na+、K+、Li+)和阴离子(NO3−)作为插层离子,在产物结晶的过程中插入晶体结构内部,实现了大规模、超薄的二维金属氧化物和氢氧化物的制备[74].除此之外,研究人员还以碱金属氯化物、硝酸盐或氢氧化物为熔盐,先后制备了、Mo掺杂的W18O49纳米线[76]、、硫掺杂的硬碳[51]、Co2Mo3O8六边形纳米片[51]、纳米/亚微米/微米CuO[78]、过渡金属硫族化物纳米片(MoS2、WS2、MoSe2和WSe2)[79]、石墨烯[80]、超薄及多孔的SnO2/C纳米复合材料[81]、等.同时,这些材料在光催化、超级电容器、钾离子电池、锂离子电池及镁离子电池等领域展示出优异的性能.上述研究为熔盐法制备具有特定形貌的微纳米材料积累了丰富的经验.在众多熔盐中,碱金属硝酸盐具有较低的熔点(几乎都在350◦C以下),这为低能耗下的熔盐法提供了可能性.但碱金属硝酸盐的热稳定差,在高温下容易分解;且熔点和沸点相差不大,导致熔盐温度的调节区间有限.而碱金属氢氧化物具有很强的碱性,其熔融状态对常规容器具有很强的腐蚀性,因此不太适合作为熔盐来制备微纳米材料.碱金属氯化物具有优异的热稳定性和较大的熔沸点差,其熔融后呈中性,这使得碱金属氯化物成为最受欢迎的熔融盐,尤其是丰富而廉价的NaCl.近年来,研究人员采用NaCl基熔盐法制备了一系列电极材料,并对熔盐工艺进行了优化,不仅丰富了电极材料家族,也为其他微纳米材料的制备提供了借鉴.
过渡金属具有多价态,使得其化合物成为一直活跃在储能领域的电极材料.例如,锰的氧化物不仅表现出多种氧化态,并且具有较高的理论比容量,在超级电容器和锂离子电池领域均显示出巨大的储能应用潜力.此外,锰氧化物材料成本低、储量丰富、合成路线比较环保,使得其在实际应用中具有明显优势.为此,研究人员以醋酸锰为锰源,以NaCl为熔盐,利用干木耳的吸水膨胀特性,将适量的Mn2+、Na+和Cl−封装在湿木耳的孔洞中,得到了木质素水凝胶;然后,以该水凝胶为前驱体,在800◦C的煅烧过程中,由于醋酸锰的存在使得NaCl实现熔融态.在高温下,具有良好流动性的熔盐能够进一步热解木耳,从而实现NaCl、MnO和生物炭的均匀复合,并使得NaCl和MnO晶体均匀分散.进一步通过水洗,可以完全去除复合材料中的NaCl晶体,最终制得具有分等级结构的MnO@生物炭(biocarbon,BC)复合材料[83].该材料的制备如图9所示.MnO@BC的比表面积达到了139.6 m2·g−1,将其用作超级电容器电极材料时,在三电极体系中,在2、4、6、8、10、14和20 mA·cm−2的电流密度下,比容量分别为693、634、553、539、532、512和508 F·g−1;在20 mA·cm−2下循环5 000圈后,比容量保持率达到了94%[83].同时,MnO@BC作为锂离子电池电极材料时,也具有较高的可逆比容量、卓越的倍率性能和长循环稳定性[83].该研究成功利用NaCl基熔盐法调控制备了具有分等级多孔结构的过渡金属氧化物基电极材料[83].

图9 NaCl基熔盐法协助制备分等级多孔MnO@BC复合材料[83]Fig.9 NaCl-based molten-salt-assisted synthesis of hierarchical porous MnO@BC composite[83]
由于NaCl的熔点为801◦C,以单一NaCl作为熔盐时,熔盐温度一般都在900◦C以上,甚至高达1 200◦C,如此高的反应温度不仅能耗高,而且对容器和高温炉的要求也非常高.根据拉乌尔定量,在合适的混合物中,两种固体混合物熔化所需温度通常都低于任一单一组分的熔点,这种共晶温度被称为共晶点[84-85].根据共晶点理论,可将其他盐与NaCl混合来降低熔盐所需温度.当等摩尔量的NaCl和KCl混合时,共晶点温度为658◦C.基于这一共晶点温度,研究人员以豆粕和NaH2PO4为原料,以质量比为1∶1的NaCl和KCl为熔盐,在750◦C的空气气氛下直接热解制备了N、O、P共掺杂的分等级多孔碳(hierarchical porous carbons,HPCs)材料.该材料具有相互连通的蜂窝状大孔,以及大量的中孔和微孔,合成机理如图10所示.相互交织的多孔结构使得该材料比表面积高达483 m2·g−1[86].以1 mol·L−1H2SO4为电解液评估该材料电容特性,结果表明在0.2 A·g−1电流密度下,所制得的HPCs材料比容量为360 F·g−1.基于该HPCs材料组装的对称超级电容器能量密度可以达到10 W·h·kg−1;在1 A·g−1下循环10 000圈后,比容量保持率为90.5%[86].
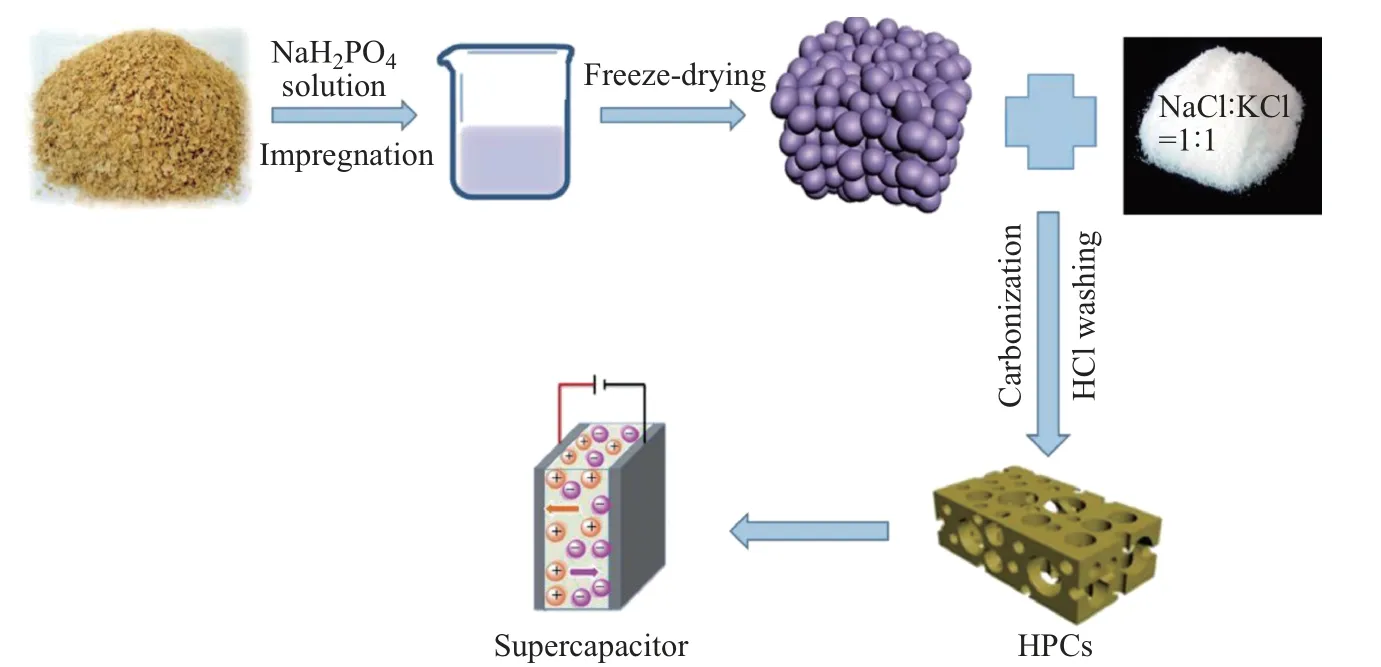
图10 N、O、P共掺杂分等级多孔碳制备[86]Fig.10 Preparation of N,O,P co-doped HPCs[86]
虽然NaCl和KCl的熔盐组合体系能显著降低NaCl基熔盐法所需温度,但由于KCl也具有高的熔点(770◦C),导致NaCl和KCl的共晶点温度仍保持在600◦C以上.为了继续降低NaCl基熔盐法所需温度,研究人员注意到AlCl3的熔点仅为194◦C,于是将NaCl和AlCl3作为混合熔盐,在300◦C条件下获得了完全熔融的熔盐体系;并在Ar-H2(5%)还原气氛中,通过NaCl-AlCl3基熔盐法,将球形和柱状的SiO2/C复合材料还原为微纳米中空的Si材料.将该材料用作锂离子电池电极材料时,在0.5、1、2、4、6和8 A·g−1电流密度下,比容量可以达到2 179、1 988、1 798、1 505、1 204和974 mA·h·g−1;在8 A·g−1电流密度下循环1 100圈后,比容量保持率高达80%[87].由此可见,NaCl和AlCl3混合熔盐策略显著降低了NaCl基熔盐法所需温度,并可以实现多孔微纳米电极材料的制备.然而,这一研究所需熔盐温度明显高于AlCl3的熔点.根据共晶点理论,NaCl和AlCl3混合熔盐体系所需温度还可以更低.为了验证这一点,研究人员将NaCl和AlCl3的摩尔比分别为1∶1.4、1∶1.6、1∶1.8、1∶2.0的混合物加热到150◦C,发现所有混合物都融化成透明的黄色液体[88].同时,该策略开发了液态氯铝酸钠电解液,可进一步作为电解液与金属铝和石墨烯组装铝离子电池.虽然该研究采用熔盐作为电解质,但其结果为低温熔盐法提供了参考,也为开发高温熔盐电解液开辟了新的研究方向.
在将具有良好热稳定性的NaCl、KCl、AlCl3作为熔盐研究的启示下,研究人员设计出了同时含有3种熔盐的混合熔盐体系以进一步降低熔盐的熔点.在该熔盐体系中NaCl、KCl和AlCl3的质量比为1∶1∶5,在150◦C下可以完全熔融,并呈现出非常好的流动性.研究人员进一步以该熔盐体系作为熔盐电解液,通过电镀技术,在泡沫镍上镀上了一薄层的金属钴和金属铝合金;再经过磷化和电活性过程,成功将具有多孔结构的NiCoP材料原位生长在泡沫镍(nickel foam,NF)上,其活性材料负载量可以达到10.1 mg·cm−2[89].NiCoP/NF材料的制备如图11所示.在三电极测试中,在0.99 A·g−1电流密度下,比容量达到1 279.2 C·g−1.以所制备的NiCoP/NF为工作电极组装的非对称超级电容器在124.2 W·kg−1的功率密度下,能量密度能够达到45.5 W·h·kg−1;在100 mA·cm−2电流密度下循环10 000圈后,比容量保持率为92.86%[89].这一研究不仅开发了多组分低熔点的混合熔盐体系,还进一步实现了将熔盐作为新型电解液在电镀领域的应用.
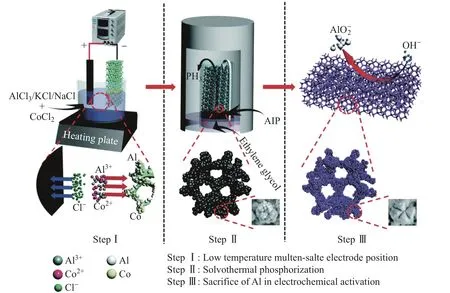
图11 NiCoP/NF材料合成过程[89]Fig.11 NiCoP/NF material synthesis process[89]
以上概述了NaCl基熔盐法的起源及其在微纳米材料制备中的应用进展,详细回顾了单一NaCl熔盐法及NaCl基混合熔盐法的发展历程.根据共晶点理论,发展出了降低NaCl基熔盐法所需温度的策略.上述研究说明NaCl基熔盐法在提高电极材料性能、降低制备成本和调节电极材料方面具有独特的优势,开发的NaCl基熔盐电解液为组装耐超高温储能器件提供了新途径.
前文所提到的NaCl在电极材料中的调控策略如表1所示.
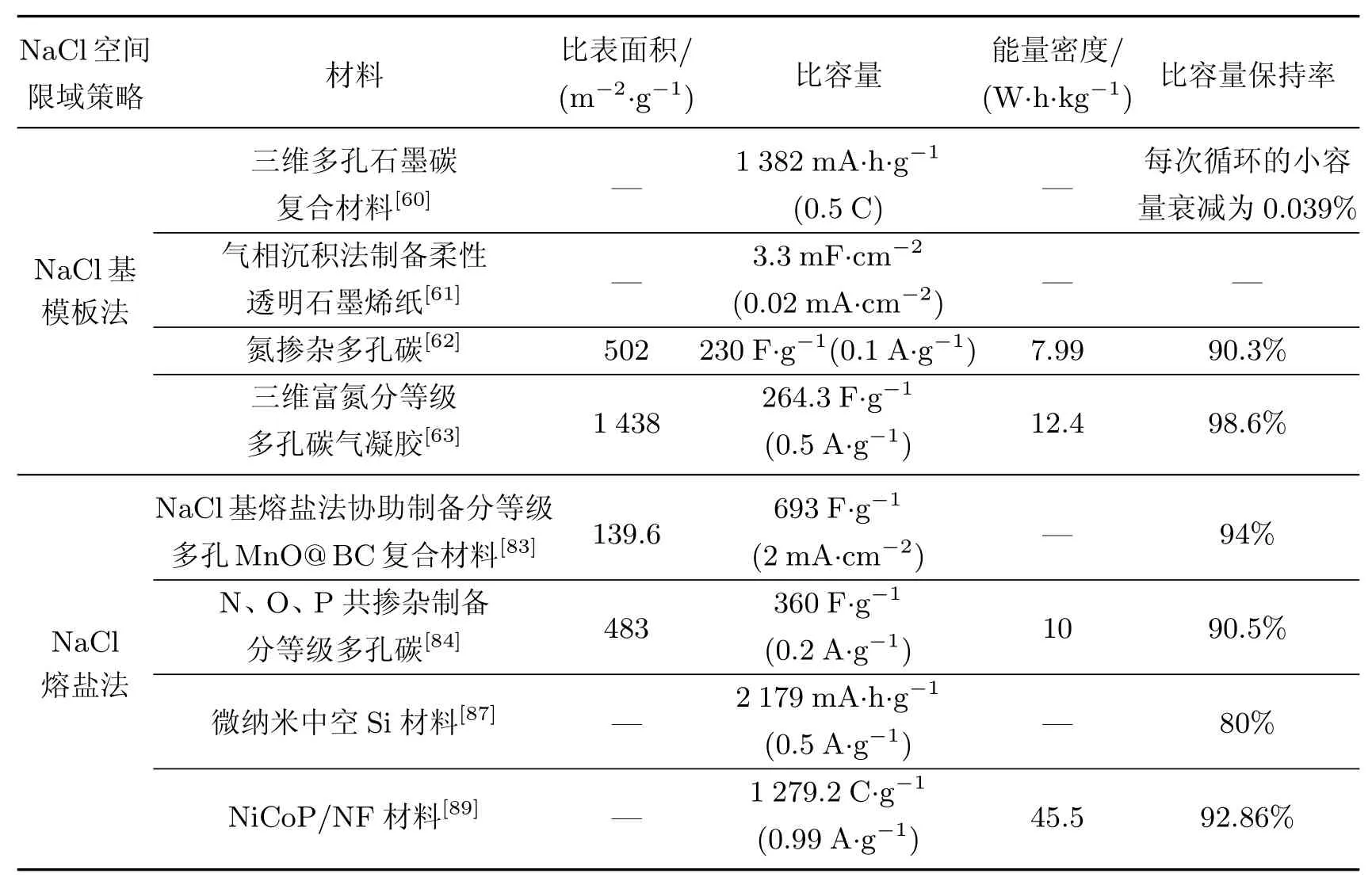
表1 NaCl在电极材料中的调控策略Table 1 Regulation strategy of NaCl in electrode materials
综上,NaCl基模板法和熔盐法可以制备多孔电极材料、优化电极材料的结晶性、分散性和反应过程,并进一步丰富电极材料的物相组成,不仅可以简化制备方法,在一定程度上又提高了电极材料的性能,降低了成本,因此在制备超级电容器电极材料中有很大的应用前景.
3 结论与展望
相关研究利用NaCl在水中的高溶解度,借助冷冻干燥、溶胶-凝胶技术,通过重结晶方法,将NaCl作为绿色、易去除的模板,可控制备了系列电化学储能所用电极材料,为制备多孔微纳米材料提供了新策略;由于NaCl具有优异热稳定性和化学稳定性,熔沸点相差大,熔融之后可以提供高温液相反应环境,已被成功用作熔盐材料,可控制备了系列具有均一、独特形貌和结构的微纳米材料,在新型储能器件中展示出优异的储能性能;并在拉乌尔定律指导下,通过混合熔盐策略,将1 000◦C左右的NaCl熔盐温度降低到150◦C,大幅降低了熔盐法的能耗,使大规模推广成为可能.虽然,相关研究已经证明了NaCl在电化学储能方面的应用前景,但距离大规模应用还面临诸多困难和挑战,在很多方面还需要改善和加强.
(1)在NaCl的选用方面,NaCl作为典型的离子化合物,易溶于水和甘油,在电极材料的制备方法上有更多可能;NaCl较为稳定,不易与其他物质反应,在实验调控时更加方便;NaCl廉价易得,适合大规模使用,对于电化学储能的发展有更大的意义.
(2)在NaCl模板法制备电极材料方面,由于NaCl溶液凝固点低,导致冷冻干燥前预冷冻困难,并且水的凝固点随压强的降低而升高,这也为冷冻干燥过程带来困难;溶胶-凝胶法虽然可以不经过冷冻阻止NaCl的沉降,但胶体的去除一般要通过高温碳化来处理,导致该方法仅适用于热稳定性较好的电极材料的制备.因此开发简单、通用的NaCl模板法将是未来的研究热点.此外,利用Cl−与相关过渡金属的配位作用改变材料的优势生长方向,诱导制备具有特定形貌的电极材料也具有重要的研究意义.
(3)在NaCl熔盐法制备电极材料方面,高温单一熔盐法能够快速实现高结晶电极材料的制备,但是能耗较高;低温混合熔盐法虽然降低了能耗,但同时也降低了原料的反应活性并影响了原料在熔盐中的存在状态,影响电极材料的物相、结晶性、结构,最终影响电极材料的电化学储能性能.因此,除了通过混合熔盐法降低能耗之外,还要详细研究熔融液的物理化学性质,完善不同熔盐组成的相图,探索熔融液中离子与原料之间的作用关系及熔盐条件下原料的存在状态,将熔盐条件与原料反应所需条件相匹配,为可控设计具有特定组成和结构的电极材料提供理论和经验支撑.
