Wip1通过P-gp介导人多发性骨髓瘤细胞卡非佐米耐药作用研究
2022-12-06王金乐李祥平陈斌斌孙宏迪谢炳寿
王金乐,朱 星,李祥平,蓉 夏,爱 丹,陈斌斌,孙宏迪,谢炳寿*
0 引言
多发性骨髓瘤(Multiple myeloma,MM)是一种比较常见的血液系统恶性肿瘤。通常情况下,MM患者骨髓浆细胞异常增生,并伴有单克隆免疫球蛋白或轻链(M蛋白)过度生成[1]。MM患者早期无明显症状,随着时间的推移,逐渐出现贫血、溶骨性损害、高钙血症、肾脏损伤、感染等[2-3]。卡非佐米(Carfilzomib,CFZ)是临床用于治疗多发性骨髓瘤的第2代蛋白酶体抑制剂,主要抑制20S蛋白酶体的糜蛋白酶[4]。相较第1代蛋白酶体抑制剂,CFZ不可逆共价结合蛋白酶体的催化β5亚组和免疫蛋白酶体β5i(LMP7)亚组,具有更好的药效,但CFZ应用一段时间后仍然会出现获得性耐药[5-6]。因此,如何解决MM对CFZ耐药具有重要临床意义。
野生型P53诱导的磷酸酶1(Wild type p53-induced phosphatase 1,Wip1 )是由PPM1D基因编码的一种丝氨酸-苏氨酸蛋白磷酸酶[7]。Wip1在多种恶性肿瘤中高表达,并与化疗耐药有关。研究显示,Wip1基因沉默可增强人结肠癌细胞的化学敏感性[8]。还有研究显示,miRNA-16 通过靶向Wip1和Bcl-2使耐药乳腺癌细胞对阿霉素敏感[9]。但在MM中,Wip1是否参与介导CFZ耐药尚不明确,有待于进一步研究。本研究以MM细胞RPMI 8226作为研究对象,转染法过表达Wip1,观察Wip1在MM对CFZ耐药中的作用并对其机制进行探讨,为临床治疗多发性骨髓瘤细胞耐药提供理论支持。
1 材料
1.1 细胞 人多发性骨髓瘤细胞RPMI 8226购自北纳生物/河南省工业微生物菌种工程技术研究中心。
1.2 试剂 RIPA裂解液、蛋白酶抑制剂、5×蛋白上样缓冲液、四甲基偶氮唑蓝(MTT)及二甲基亚砜(DMSO)购自上海碧云天公司;Wip1过表达试剂盒购自上海吉玛生物公司;Wip1抗体购自美国Santa公司;P-gp抗体购自美国CST公司;GAPDH、山羊抗鼠IgG/PE二抗、山羊抗鼠IgG-HRP二抗、山羊抗兔IgG-HRP二抗购自上海爱必信公司;Annexin V-FITC/PI 细胞凋亡检测试剂盒购自上海锐赛生物;ECL化学发光液购自北京索莱宝公司。
1.3 实验仪器 Allegra 64R 高速冷冻离心机(美国贝克曼公司产品);电泳仪、转膜仪及电源(美国Bio-rad公司产品);E-Gel Imager凝胶成像系统(美国Thermo Fisher Scientific公司产品);MF53-N倒置荧光显微镜(广州明美光电公司产品);Accuri C6 Plus流式细胞仪(美国BD公司产品)。
2 方法
2.1 细胞培养 人多发性骨髓瘤细胞RPMI 8226以90% RPMI-1640+10% FBS+1%青-链霉素制备的培养基培养。细胞培养时置于37 ℃、5%CO2的细胞培养箱中。
2.2 质粒转染法过表达Wip1 使用包含Wip1基因的质粒 pEX-3载体进行转染。收集生长至对数期的RPMI 8226细胞,以5×105个/孔接种于6孔板中。次日,将过表达质粒和空载质粒溶于200 μl RPMI-1640培养基中,同时制备2份含5% lipo2000的RPMI-1640培养基各200 μl。将含质粒的培养基与含lipo2000的培养基混合放置20 min。取出细胞,PBS洗后加入2 ml无血清RPMI-1640培养基,将混合液分别加入各孔中。转染Wip1过表达质粒的细胞设为Wip1组,转染空载质粒的细胞设为NC组,同时以未转染细胞设为Control组。转染8 h后将细胞培养基更换为含10%FBS的培养基继续培养。以蛋白印记实验验证Wip1蛋白表达。
2.3 MTT法检测细胞增殖能力 收集生长至对数期的Control组、NC组及Wip1组的RPMI 8226细胞,以6 000个/孔接种于96孔板中。次日,以0.001、0.01、0.1、1、100 μM CFZ处理细胞48 h,同时以溶剂(DMSO)处理细胞设为对照孔。各处理组均设5个复孔。48 h时取出细胞,将提前融化的MTT以20 μl/孔加入各孔细胞,置于培养箱继续培养4 h。取出细胞,慢慢吸取培养液,各孔加入100 μl DMSO,在酶标仪490 nm处测量吸光度值,计算细胞增殖率。
2.4 流式细胞术检测细胞凋亡 收集Control组、NC组及Wip1组的RPMI 8226细胞,1 200转/min离心4 min,用PBS重悬细胞,1 200转/min离心4 min。弃去上清,加入1×binding buffer重悬细胞,1 200转/min离心4 min,去除上清,重复该步骤1次。各加入100 μl 1×binding buffer重悬各组细胞,各加入5 μl AnnexinⅤ和PI染色液,混匀后避光孵育15 min。将细胞悬液以1 200转/min离心4 min,弃去上清液,加入500 μl PBS重悬细胞,于流式细胞仪检测细胞凋亡。
2.5 蛋白印记实验检测细胞Wip1和P-gp蛋白表达水平 将Control组、NC组及Wip1组的细胞取出,收集各细胞于5 ml离心管中,1 200转/min离心4 min,弃去上清,再次1 200转/min离心4 min,弃去上清,尽量吸干水分,加入80 μl RIPA细胞裂解液。将细胞置于冰上裂解10 min,后收集于1.5 ml EP管于超低温离心机以12 000转/min离心20 min。收集上清液,用BCA蛋白定量试剂盒进行定量,以蛋白上样缓冲液制备蛋白样品。蛋白样品进行SDS-PAGE凝胶电泳,而后将凝胶上分离的蛋白转印至PVDF膜上,5%牛血清白蛋白封闭2 h。PVDF膜于4 ℃孵育GAPDH(1∶2 000),Wip1(1∶1 000)和P-gp(1∶1 000)抗体过夜。次日吸出一抗,TBST洗3遍,常温孵育抗兔/鼠IgG-HRP二抗1 h。TBST洗3遍,PVDF膜用ECL发光液于凝胶成像仪下曝光。Wip1和P-gp蛋白表达以GAPDH作为内参,并以Control组作为对照进行归一化处理。
2.6 免疫荧光实验检测P-gp蛋白表达 在六孔板中放入无菌盖玻片,将Control组、NC组及Wip1组的细胞各以2×105个/孔接种于六孔板中。次日,向六孔板中加入4%多聚甲醛固定细胞,用PBS轻轻洗去固定液,加入山羊血清封闭30 min,吸水纸吸去封闭液。将盖玻片细胞面向上放在载玻片上,滴加P-gp抗体(1∶100)。载玻片置于湿盒中,于4 ℃孵育过夜。第2天,PBST洗去一抗,滴加荧光二抗(1∶50)孵育1 h,PBST轻轻清洗。而后滴加含DAPI的抗荧光淬灭剂孵育5 min,于荧光显微镜下拍照观察。
3 结果
3.1 Wip1蛋白在Wip1过表达RPMI 8226细胞中表达上调 蛋白印记结果显示,Control组和NC组的Wip1蛋白表达无明显差异。与NC组相比,Wip1组Wip1蛋白表达显著上调(P<0.01),提示Wip1过表达RPMI 8226细胞构建成功。见图1。
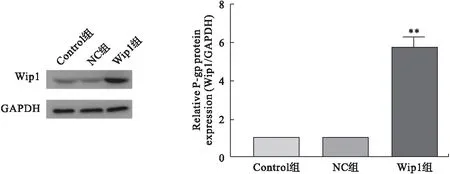
图1 Wip1过表达RPMI 8226细胞验证(n=3)
3.2 Wip1过表达增强RPMI 8226细胞抵抗CFZ MTT结果显示,Control组和NC组RPMI 8226细胞增殖曲线相类似,无明显差异。与NC组相比,Wip1组在0.01~100 μM CFZ处理后细胞增殖率均显著升高(P<0.01)。经计算,CFZ对Control组、NC组及Wip1组细胞的IC50分别为(1.08±0.09)μM、(1.10±0.11)μM、(10.25±1.23)μM。与NC组相比,Wip1组细胞IC50显著升高(P<0.01)。见图2。
3.3 Wip1过表达抵抗CFZ诱导的RPMI 8226细胞凋亡 流式细胞术结果显示,Control+CFZ组、NC+CFZ组、Wip1+CFZ组细胞凋亡率分别为39.26%±3.59%、40.21%±4.16%、16.26%±2.21%。Control+CFZ组和NC+CFZ组细胞凋亡率差异无统计学意义。与NC+CFZ组相比,Wip1+CFZ组细胞凋亡显著降低(P<0.01)。见图3。

图2 CFZ处理后各组细胞的增殖率变化(n=6)

图3 CFZ处理后各组细胞凋亡的代表图(n=3)
3.4 Wip1过表达对P-gp蛋白表达的影响 蛋白印记结果显示,Control组和NC组间P-gp蛋白表达无明显差异。与NC组相比,Wip1组P-gp蛋白表达显著上调(P<0.01)。见图4。

图4 各组细胞P-gp蛋白表达变化(n=3)
3.5 Wip1过表达诱导P-gp蛋白表达上调 免疫荧光结果显示,Control组、NC组及Wip1组P-gp荧光强度分别为23.1±2.8、25.2±3.3、303.5±26.7。Control组和NC组细胞P-gp荧光强度无明显差异。与NC组相比,Wip1组细胞P-gp荧光强度明显升高(P<0.01)。见图5。
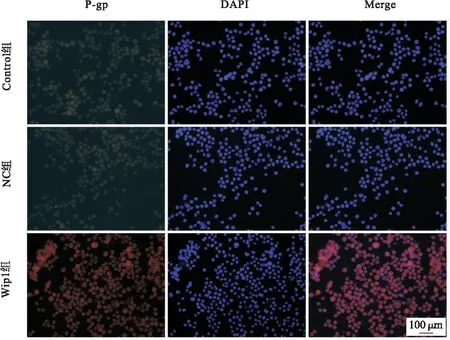
图5 各组细胞P-gp蛋白荧光变化(100×,n=3)
4 讨论
CFZ作为第2代蛋白酶体抑制剂,对MM拥有较好的疗效。但CFZ治疗一段时间后,MM患者依然会出现获得性耐药,最终导致治疗失败。因此,如何解决MM对CFZ耐药具有重要的临床意义。
Wip1作为一种应激反应性磷酸酶,在应激信号转导中起关键作用。Wip1最初被确定为基因毒性应激后p53诱导的基因[7,10]。随着研究的深入,发现Wip1不仅是p53的靶标,还与多种转录调节因子(如雌激素受体-α和NF-κB)之间存在相互作用[7,10]。Wip1还能通过使p38 MAPK和ATM等蛋白质去磷酸化和失活来抑制应激反应,从而抑制衰老、细胞凋亡、DNA 修复和炎性细胞因子的产生[7,10]。
目前研究已证实,Wip1在多种恶性肿瘤中过度表达并发挥促癌作用。研究显示,Wip1通过抑制非小细胞肺癌p38 MAPK 从而促进癌细胞干细胞特性的维持[11]。还有研究显示,Wip1能与KPNA2协同通过p53依赖性方式调节结直肠癌的细胞增殖和迁移[12]。研究报道,Wip1可能通过调节P53和P16蛋白表达参与肾癌细胞增殖、凋亡、迁移和侵袭等生物学过程[13]。最近的研究显示,Wip1在肺癌和乳腺癌化疗耐药中发挥作用,可促进细胞对化疗药物的抵抗[8-9,14]。本研究以MM细胞RPMI 8226作为研究对象,质粒转染法成功过表达Wip1。进一步研究发现,Wip1过表达显著增强RPMI 8226细胞抵抗CFZ诱导的细胞增殖抑制和凋亡。提示Wip1可能参与RPMI 8226细胞CFZ耐药。
P-糖蛋白(P-gp)是一种分子量170 KD的跨膜糖蛋白,为ATP 结合盒转运体家族中重要的外排转运体。通常情况下,为了降低药物对细胞的损伤,P-gp与药物结合,在ATP供能的条件下将细胞内药物泵出胞外,从而使细胞产生耐药性。本研究蛋白印记实验发现,RPMI 8226细胞外源性过表达Wip1能够明显诱导P-gp蛋白表达上调。同时,免疫荧光实验也得到了类似结果。提示Wip1参与RPMI 8226细胞CFZ耐药可能与上调P-gp蛋白表达有关。
耐药作为恶性肿瘤临床治疗的攻坚难题,一直没有得到理想解决。P-gp在过去几十年的研究中一直被认为是肿瘤细胞耐药的重要因素。本研究发现,Wip1作为上游调控蛋白可诱导P-gp蛋白表达,进而参与MM细胞CFZ耐药。因此,针对Wip1进行干预,可能是解决MM细胞CFZ耐药的潜在方法。
