啶虫脒对睾丸间质细胞的毒性作用
2022-12-06宋月清柴琳青马明月毛亚萍
马 跃,刘 芙,宋月清,柴琳青,王 鑫,袁 宁,马明月*,毛亚萍*
0 引言
啶虫脒(Acetamiprid,ACE)是烟碱型乙酰胆碱受体的选择性激动剂,是应用最广泛的新烟碱类杀虫剂(Neonicotinoids,NEOs)之一[1]。NEOs在环境中的广泛分布导致了人群的广泛暴露,流行病学调查显示,由于不同地区的饮食模式和杀虫剂应用不同,亚洲人群的尿中NEOs水平显著高于美国和欧洲,其中N-去甲基啶虫脒、5-羟基吡虫啉和烯烃吡虫啉在检测到的NEOs中占主导地位[2]。NEOs的长期累积暴露可对人类健康产生不良影响。近年来,NEOs对非靶向哺乳动物的生殖毒性已引起人们的重点关注。多项研究报道了NEOs对雄性生殖系统的损害,导致啮齿类动物的睾丸重量下降,睾酮浓度及精子数量、活力显著降低,以及精子受精能力降低等[3-5]。但目前关于ACE等NEOs对生殖系统毒性作用的研究较少,相关机制并不明确。本研究以ACE为研究对象,采用睾丸间质细胞TM3,探究ACE的生殖细胞毒性作用,为进一步的机制研究提供线索和理论基础。
1 材料与方法
1.1 材料
1.1.1 细胞 小鼠TM3细胞购自中国科学院上海生科院细胞资源中心。
1.1.2 试剂与仪器 ACE(纯度≥98%)(MedChemExpress,中国),DMEM-F12培养基(GIBCO,美国),胎牛血清(FBS)(GIBCO,美国),PBS、100 U/ml青霉素-100 μg/ml链霉素(双抗)(Hyclone,美国),CCK-8 Cell Counting Kit、Annexin V-FITC/PI Apoptosis Detection Kit (诺唯赞,中国),Trizol(生工生物,中国),PrimeScriptTMRT reagent Kit(Perfect Real Time)、TB Green®Premix Ex TaqTM(Tli RNaseH Plus)(TaKaRa,日本)。CO2培养箱、Nanodrop 核酸浓度测定仪、低温高速离心机(Thermo,美国),倒置显微镜(Olympus,日本),7500 Fast 实时荧光定量 PCR 仪(Applied Biosystems,美国),多功能酶标仪(Molecular Device,美国)。
1.2 方法
1.2.1 ACE处理TM3细胞 应用DMEM-F12培养基(含10% FBS和1%双抗)于37 ℃、5%CO2培养箱中培养TM3细胞。称取一定重量的ACE,用DMSO溶解,逐滴加入DMEM-F12培养基中(DMSO终浓度不超过0.5%),配制的ACE浓度从1、10、100、1 000 μmol/L至1、2、4、6、8、10、12 mmol/L逐步提高浓度进行摸索。弃去TM3细胞旧培养基,加不同浓度ACE溶液(含5%FBS和1%双抗)处理,检测相关指标。
1.2.2 TM3细胞活力检测 以适宜细胞量接种96孔板,待细胞量至70%~80%,加入1、2、4、6、8、10、12 mmol/L ACE处理24 h和48 h,每孔加入10 μl CCK8溶液,混匀后在培养箱中继续培养1~2 h,利用酶标仪于450 nm波长处测OD值,计算细胞存活率和IC50。根据24 h IC50设定后续实验的ACE浓度。
1.2.3 TM3细胞凋亡率检测 采用流式细胞术检测细胞凋亡率。以适宜细胞量接种6孔板,待细胞量至70%~80%,加入0、2、4、6、8 mmol/L ACE处理24 h。用不含EDTA的胰酶消化、收集细胞。用预冷PBS洗2次。将细胞重悬于100 μl 1×Binding Buffer中,加入5 μl Annexin V-FITC和 5 μl PI Staining Solution,混匀,室温避光孵育10 min。同时设不加PI和Annexin V-FITC的阴性对照,以及PI和Annexin V-FITC单染的对照。加入400 μl 1×Binding Buffer,混匀,流式细胞仪检测。细胞凋亡率(%)=Q2+Q3,即晚期细胞凋亡率和早期细胞凋亡率之和。
1.2.4 mRNA相对表达量检测 以适宜细胞量接种6孔板,待细胞量至70%~80%,加入0、2、4、6、8 mmol/L ACE处理24 h。用Trizol 法提取总RNA,并应用Nanodrop 进行RNA浓度和质量检测。利用PrimeScriptTMRT reagent Kit(Perfect Real Time)进行反转录,合成cDNA,用TB Green®Premix Ex TaqTM(Tli RNaseH Plus)进行实时荧光定量PCR(qPCR)分析。所用基因qPCR引物见表1。
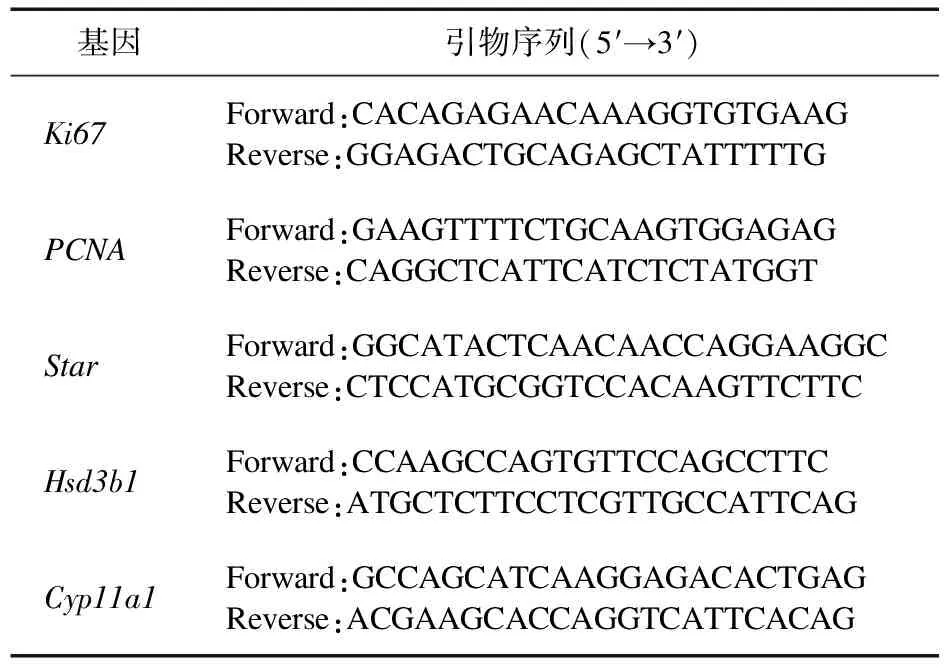
表1 基因qPCR引物序列
2 结果
2.1 ACE对TM3细胞活力的影响 在进行ACE染毒浓度摸索中,发现ACE浓度达8 mmol/L时,可对TM3细胞活力产生明显影响。以1、2、4、6、8、10、12 mmol/L ACE处理TM3细胞24 h和48 h。结果发现,细胞活力在4、6、8、10、12 mmol/L随ACE浓度升高而下降,且在8、10、12 mmol/L组,48 h细胞活力显著低于24 h(P<0.01),表明ACE可抑制TM3细胞活力,且呈浓度和时间依赖性。见图1。计算24 h IC50为7.20 mmol/L,故后续ACE染毒浓度选择为0、2、4、6、8 mmol/L。
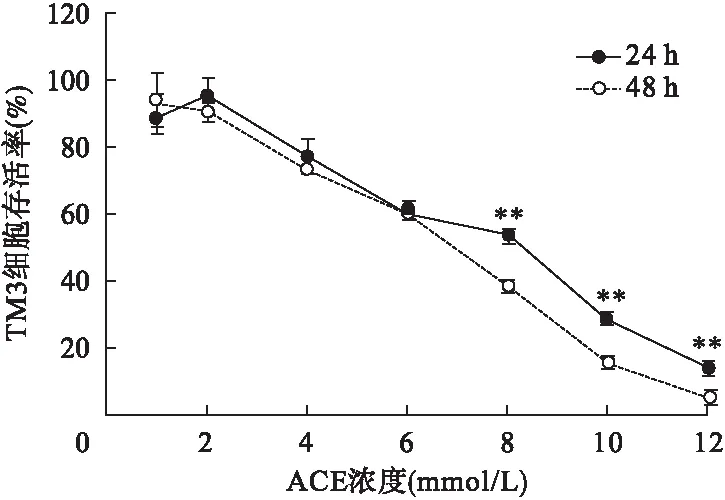
图1 ACE对TM3细胞活力的影响
2.2 ACE对TM3细胞增殖相关基因表达的影响 以0、2、4、6、8 mmol/L ACE处理TM3细胞24 h,qPCR检测细胞增殖指数PCNA和Ki67的表达。结果发现,与0 mmol/L组相比,6、8 mmol/L组PCNAmRNA表达显著下降(P<0.01),4、6、8 mmol/L组Ki67mRNA表达下降(P<0.05),表明ACE可抑制TM3细胞增殖相关基因的表达。见图2。
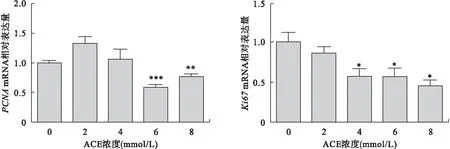
图2 ACE对TM3细胞PCNA和Ki67表达的影响
2.3 ACE对TM3细胞凋亡的影响 以0、2、4、6、8 mmol/L ACE处理TM3细胞24 h,流式细胞术检测细胞凋亡率。结果发现,TM3细胞凋亡率随ACE浓度升高而增加,且6、8 mmol/L组与0 mmol/L组相比,差异有统计学意义(P<0.05)。见图3。
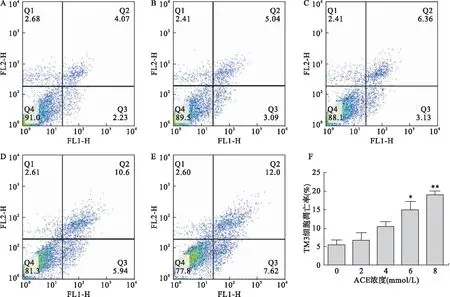
图3 ACE对TM3细胞凋亡的影响
2.4 ACE对睾酮合成酶基因表达的影响 以0、2、4、6、8 mmol/L ACE处理TM3细胞24 h,qPCR检测睾酮合成酶基因Star、Hsd3b1、Cyp11a1mRNA基因的表达。结果发现,与0 mmol/L组相比,6、8 mmol/L组的Star和Hsd3b1mRNA表达差异有统计学意义(P<0.05),Cyp11a1mRNA在所有剂量组的表达均高于0 mmol/L组(P<0.01),表明ACE可以上调Star、Hsd3b1、Cyp11a1基因的表达。见图4。
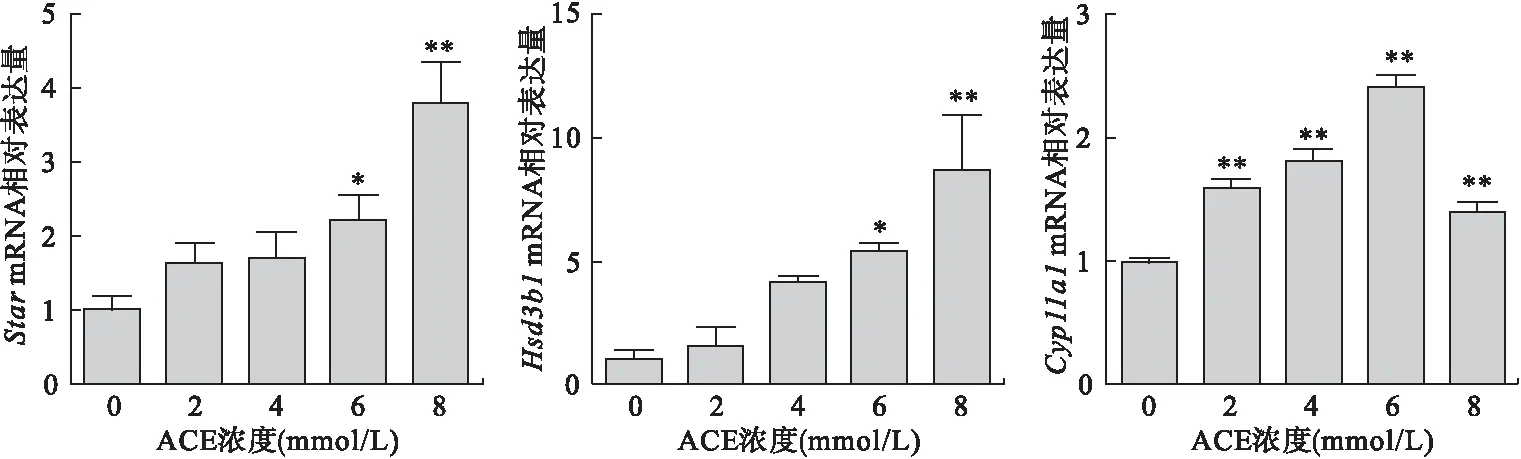
图4 ACE对TM3细胞睾酮合成酶基因表达的影响
3 讨论
ACE可选择性作用于昆虫中枢神经系统的烟碱型乙酰胆碱受体,发挥杀虫作用,其在全球范围内被广泛用于保护农作物和宠物免受虫害侵害,已经成为销售量增长最快的一类杀虫剂[6]。流行病学调查显示,ACE和吡虫啉等在人群中检出率较高,农民、农药经营者及儿童均是高暴露人群[7-8]。尽管与传统杀虫剂相比,ACE被认为对哺乳动物毒性较低,但已有研究表明,ACE暴露可对哺乳动物甚至人类造成潜在危险[9-11]。
近年来,越来越多的研究利用动物模型探究ACE对人类及哺乳动物的生殖功能损害,但相关机制并不明确。因此,本研究在体外探究ACE对TM3细胞的毒性作用。因目前未见ACE对TM3细胞毒性作用的报道,我们探索了ACE处理TM3细胞24 h时的IC50(7.2 mmol/L),据此,ACE暴露浓度选择为0、2、4、6、8 mmol/L。ACE暴露浓度较高,可能是由于ACE对TM3毒性较低,或者是由于其在DMEM-F12培养基中溶解度较低而导致暴露浓度高。细胞活力检测结果发现,ACE暴露可导致TM3细胞活力在高浓度组呈时间和浓度依赖性降低,而在2 mmol/L组细胞存活力略微上升,这可能是由于ACE的非单调剂量-效应。非单调剂量-效应在环境内分泌干扰物的毒性研究中广泛存在[12-13]。进一步对细胞增殖指数基因表达检测发现,PCNA和Ki67mRNA表达均显著下调,表明ACE暴露可通过抑制细胞增殖,导致细胞活力降低。细胞凋亡率检测结果发现,ACE暴露可导致TM3细胞凋亡率呈浓度依赖性升高,表明ACE暴露还可通过促进细胞凋亡,导致细胞活力降低。重要的是,在6、8 mmol/L组细胞存活率已降至50%左右,但细胞凋亡率却低于20%,推测ACE可能主要通过抑制细胞增殖来影响细胞活力,相关机制还需进一步探究。ACE在体外抑制细胞增殖和促进细胞凋亡的结果,与动物实验研究结果相一致。Arcan等[14]研究发现,高剂量ACE[25、35 mg/(kg·d)]暴露对雄性生殖系统有一定的毒性作用,可导致雄性大鼠睾丸组织细胞凋亡增加,而PCNA阳性细胞数明显下降。Terayama等[15]探究了ACE对幼鼠睾丸的影响,ACE染毒180 d,发现小鼠体重下降,精子数量降低,并导致增殖相关基因Ki67和Top2a表达降低。因此,ACE对生殖细胞增殖的影响可能是ACE生殖毒性的重要机制,值得进一步探究。
睾丸间质细胞是合成睾酮的重要场所,睾酮合成过程需要多种代谢酶的参与,首先由StAR调控胆固醇由线粒体外膜转运至线粒体内膜,位于线粒体内膜的P450scc催化胆固醇转变成为孕烯醇酮,在3β-HSD、17α-羟化酶、17,20-碳链裂解酶、17β-HSD等的系列催化作用下转变成睾酮。本研究对StAR、P450scc和3β-HSD的编码基因Star、Hsd3b1、Cyp11a1表达的检测结果发现,ACE暴露可导致TM3细胞Star、Hsd3b1、Cyp11a1基因表达上调。这与动物实验研究结果并不一致。多项动物实验研究报道,ACE暴露可导致睾丸组织中睾酮合成关键酶基因Star、Cyp11a1、Cyp17a1和Hsd17b1等的mRNA表达显著降低[15-16]。体内外结果的不一致性可能与ACE代谢有关,在体内,ACE可以代谢为N-去甲基啶虫脒,该代谢产物可能在ACE致生殖毒性机制中发挥重要作用。但一项对143例18~40岁的男性农业工人的调查研究发现,尿液中N-去甲基啶虫脒水平与雄烯二酮水平呈正相关,吡虫啉水平与睾酮、脱氢皮质酮和脱氢表雄酮水平呈正相关,推测NEOs具有潜在的促类固醇生成活性[17]。这与本文研究结果相一致。因此,ACE等NEOs对哺乳动物睾酮合成的影响还需深入研究。
综上所述,ACE暴露可通过抑制细胞增殖和促进细胞凋亡导致细胞活力降低,同时,ACE可通过上调Star、Hsd3b1、Cyp11a1基因表达影响睾酮合成过程。但相关机制还需要进一步研究,以期为ACE致生殖毒性的预防和早期干预提供科学依据。
