基于叶绿素荧光成像及荧光参数分布特征的叶片光合异质性定量分析
2022-12-06胡文海肖宜安
胡文海 肖宜安
(1. 井冈山大学生命科学学院,吉安 343009;2. 江西省生物多样性与生态工程重点实验室,吉安 343009)
光合作用是植物受外界影响最为敏感的生理过程,叶片光合作用表现出高度的空间异质性[1],并且叶片光合作用的异质性受到叶片发育程度、环境因子和病虫害等因素的影响[2-5]。叶绿素荧光分析技术以其快速无损伤、高灵敏度等优势,成为研究植物光合作用的主要手段。目前,叶绿素荧光分析技术可分为调制式和非调制式两大类[6]。最初的叶绿素荧光测量仪器主要是微光纤点式荧光仪(例如,德国Walz 公司的Dual-PAM 系统荧光仪和英国Hansatech 公司的FMS 系统荧光仪等),只能测定叶片局部某一点的叶绿素荧光值,提供了叶片一个特定位置的荧光信息。由于叶片存在光合异质性,叶片水平方向上不同部位的光合能力和叶绿素荧光值并不一致[1]。因此,测定叶片局部荧光值的方法虽然能在一定程度上反映叶片的光合性能,但并不能代表叶片的整体情况,无法正确地评估全叶的光合特性[5]。
随着叶绿素荧光成像仪器的出现,叶绿素荧光成像技术克服了传统的点式荧光仪有限点测量的缺陷,可以获得植物全叶的叶绿素荧光信号,从而得以分析荧光强度在叶片的分布情况,为叶片光合异质性的研究提供了更方便快捷的应用[2,7]。德国Walz 公司研制的ImagingPAM 系列成像系统为叶绿素荧光成像技术的应用提供了良好的测量仪器,目前有关叶绿素荧光成像研究的文献大多为采用该系列仪器。然而,研究者利用荧光成像技术开展的研究并未完全挖掘出叶片叶绿素荧光成像所获取的信息。首先,大多数研究直接利用软件获得局部AOI(Area of Interest)的荧光值,并不能代表叶片整体情况;其次,研究者大多采用荧光参数平均值进行分析,不能反映叶片光合异质性。
目前,利用叶绿素荧光成像技术研究叶片光合异质性主要有以下4种方法:①通过比较叶片不同部位代表荧光值大小的颜色差异,定性判断叶片光合特性的异质性[5,8],这种方法只能定性比较而无法定量分析;②利用ImagingPAM 叶绿素荧光成像系统的操作软件ImagingWin的Transect功能,获取荧光成像图横断面,并利用变异系数(CV)表示异质性程度[9],这种方法只能观察到横断面范围内的荧光异质性,并不是全叶比较,且不能进行不同叶片间的比较;③对叶片不同部位分别选择同等大小的AOI,通过比较不同部位AOI的荧光值来比较分析叶片荧光异质性[2,5],这种方法由于AOI选择的局限性,无法做到对全叶异质性的定量分析;④通过开发图像提取分析技术[10-12],对原始荧光成像图进行再分析,实现荧光参数值的空间分布和数值的定量分析,这种方法由于具有较强的图形处理专业性而较少为广大研究者所采用。
事实上,ImagingPAM 荧光成像记录了荧光成像图中所有像素点的各荧光参数荧光值(荧光参数荧光值指的是某荧光参数的荧光数值,其记录范围为0~1),通过操作软件ImagingWin 可以获取各荧光参数的每个荧光值所占面积,通过比较其面积占叶片总面积的比例,可以定量分析叶片光合异质性,并进行不同叶片光合性能的差异比较。遗憾的是,我们未能检索到相关分析方法的文献。本研究基于ImagingPAM 荧光成像技术(以德国Walz 公司生产的MAXI-IMAGING-PAM 为研究仪器)就植物叶片光合异质性定量分析方法作一探讨,并进行验证。
1 与异质性定量分析相关的ImagingWin软件功能
MAXI-IMAGING-PAM 的成像面积为10 cm×13 cm,共有640×480(即307200)个像素点,成像窗口(Image 窗口)内每一个像素点所包含的荧光信息均被记录下来。由于叶片并未完全覆盖仪器成像窗口,并且叶片上可能存在因病虫害或环境胁迫而产生的坏死组织,因此荧光成像图包含空白区域、叶片中能激发荧光的活体区域和不能激发荧光的坏死区域。在荧光参数异质性定量分析中,通过ImagingWin v2.47 软件中的AOI 选择和Report 功能估算叶片总面积、活体组织面积和坏死组织面积等参数。其次,利用ImagingWin 软件中的Analysis 功能获取该荧光参数所有荧光值在叶片上所占面积情况。
1.1 AOI功能
研究者可通过AOI 功能选择叶片中的研究区域,通过Report 功能将AOI 区域内的荧光信息输出。仪器提供了3 种AOI 区域选择方案:①Circle(圆形),区域大小可自主调整;②Rectangle(矩形),区域大小可自主调整;③Polygon(多边形),通过连续设置多边形点连接成任意形状。在成像窗口选择NIR 图像类型,采用Polygon 方式沿着叶片边缘选择AOI 区域,使之与样本叶片边缘尽量重合,可获得全叶AOI区域。
1.2 Report功能
利用Report 功能可导出AOI 范围内PSⅡ最大光化学效率Fv/Fm、Y(Ⅱ)、Y(NPQ)、Y(NO)、非光化学猝灭(NPQ/4)、光化学猝灭(qP)等荧光参数平均值和各荧光参数Size 值。Size 值为AOI 中各荧光参数的像素值,配合Options 菜单中选择或不选择Mean over AOI 功能,分别获得以下2种类型的Size数值。
①Options 菜单中选择Mean over AOI 功能后,通过Report 导出的荧光值为AOI 范围内所有区域(包括叶片中能够激发出荧光的活体组织和不能激发出荧光的坏死组织)荧光参数的荧光平均值。该状态下各荧光参数的Size 值是一致的,为AOI总面积,即包含叶片内活体组织和坏死组织在内的AOI总面积像素值。
②Options 菜单不选择Mean over AOI 功能,通过Report 导出的荧光值为AOI 范围内能激发出荧光的活体组织的各荧光参数的荧光平均值;而各荧光参数Size 值则为AOI 范围内该荧光参数能够激发出荧光的活体组织的像素值,其中Fv/Fm参数的Size 值最大,可估算为AOI 中能激发出荧光的活体组织面积,即活体面积。
1.3 Analysis功能
在成像窗口选择Analysis功能,通过设置某荧光参数的荧光值下限(Low)和上限(High),可读取Red Pixel Assessment 中的Number 值(像素值)和Area值(单位为mm2的面积值),这2个值代表了该荧光参数荧光值在Low-High 区间的总面积,其软件设置的相邻两个值之间的最小精度为0.004(少数为0.003)。为了与Report导出的Size值相统一,统一采用Number 值进行分析。利用Analysis 功能,可以读取该参数荧光值在所测叶片中分布相关的面积数据。
1.4 几个面积参数的定义和估算
根据上述软件功能,采用Polygon 方式在NIR图像类型下,沿着叶片边缘选择AOI 区域,使之与样本叶片边缘尽量重合,获得全叶AOI 区域。充分考虑叶片中未被选择进AOI 区域的能够激发荧光的活体部分面积,并基于叶片边缘未被选择进入AOI 区域且不产生荧光的坏死组织叶面积可忽略不计的假设,定义并估算以下几个面积参数:
①成像窗口总面积(STotal):根据仪器说明书,STotal为307200(像素)。
②叶片中不能激发荧光的坏死面积(SLN):首先,利用Opions 菜单中选择Mean over AOI 选项,Report窗口读取Fv/Fm荧光参数Size值(SMOA+),该值即为AOI 总面积;然后再利用Opions 菜单中不选择Mean over AOI 选项,Report 窗口读取Fv/Fm荧光参数Size值(SMOA-),该值为AOI区域内能够激发荧光的活体面积;将AOI总面积(SMOA+)减去活体面积(SMOA-),即可得到坏死面积(SLN);即SLN=SMOA+-SMOA-。
③叶片中能激发荧光的活体面积(SFlu):考虑到上述Polygon 方式获取全叶AOI 时,叶片边缘可能会有未被选择进入AOI 区域的能够激发荧光的活体部分,为此采用Rectangle 或Polygon 方式将全叶整体完全选择进入AOI区域,Opions菜单中不选择Mean over AOI 选项,Report 窗口读取Fv/Fm荧光参数Size值即为SFlu。
(4)叶片面积(SLeaf):即叶片中能够激发荧光的活体面积(SFlu)与不能激发荧光的坏死面积(SLN)之和;SLeaf=SFlu+SLN=SFlu+SMOA+-SMOA-。
⑤成像窗口中非叶片的空白区域面积(SBlank):即成像窗口总面积(STotal)减去叶片面积(SLeaf);SBlank=STotal-SLeaf=307200-SLeaf=307200-(SFlu+SMOA+-SMOA-)。
⑥荧光参数荧光值在0~t区间内的总面积(Size of the fluorescence value range from 0 tot,St):即某参数荧光值在0~t区间内的总面积。利用Analysis 功能,将某参数荧光值下限(Low)设定为0,上限(High)设定为t,可获取一个Number 值,记为Nt;由于Analysis 分析是以成像窗口(包括无叶片区域)为对象开展的,且除Y(NO)外的其他荧光参数(例如Fv/Fm)成像窗口中无叶片区域的荧光值为0,因此这些参数的St=Nt-SBlank;Y(NO)参数成像窗口中无叶片区域的荧光值为1,因此Y(NO)的St=Nt,但S1=N1-SBlank。
⑦荧光参数荧光值在(t-α)~t区间内的面积(Size of the fluorescence value range from(t-α)tot,ΔSt):ΔSt=St-S(t-α),α值可根据研究的实际需要确定,如α可确定为仪器软件最小精度0.004,也可在不影响试验结果的前提下确定为0.04 以减少读取数据的工作量,本研究将对α值大小对试验结果的影响作一分析。
2 异质性参数的定义与计算方法
基于上述方法获取的面积参数,定义了以下几个异质性参数及其计算方法,研究者可依据研究需要自行定义其他异质性定量分析参数。
①变异系数(Coefficient of variation,CV):由上述⑦可以获取叶片各荧光参数从0~1 范围内的所有荧光值及其所占面积(即像素点数量),以全叶所有像素点的荧光参数荧光值为总样本计算该荧光参数的变异系数:

式中:σ为全叶所有荧光参数值的标准差,µ为所有荧光参数值的平均值。
②叶片坏死率(Proportion of leaf necrosis,PLN):叶片中不能激发荧光的坏死面积(SLN)占叶片面积(SLeaf)的比例。

③荧光参数荧光值的相对面积(Relative size of the fluorescence value,RSt):由于不同样本的叶片面积不一致,因此,将荧光参数荧光值在0~t区间内的面积(St)除以叶片面积(SLeaf)进行标准化处理,标准化后的相对面积可进行不同处理间叶片的直接比较。

④荧光参数荧光值在(t-α)~t区间内的面积占叶片面积的比例(Proportion of leaf size in the flu⁃orescence value range from(t-α)tot,PΔSt):

3 叶片光合异质性定量分析的应用
3.1 材料与方法
3.1.1 试验材料
试验于2020 年2 月在井冈山大学进行,选择生长于全光照环境下,栽培时间长于5年的常绿阔叶植物小叶榕(Ficus microcarpa)成年树为供试材料。于上午10:00 选择树冠外侧阳生叶和树冠内部的阴生叶,带枝剪下插入水中带回实验室进行叶绿素荧光成像测定。试验期间为连续晴天,夜间最低温度范围为1~3 ℃,日最高温度满园13~15 ℃,阳生叶环境午间最大光强约1 500 μmol·m-2·s-1,阴生叶环境光强约100~200 μmol·m-2·s-1。
3.1.2 试验方法
按照IMAGING-PAM 操作手册,采用调制式IMAGING-PAM 叶绿素荧光仪(Walz,德国)进行全叶叶绿素荧光成像测定。选取阳生叶和阴生叶各3片,置于IMAG-MAX/GS支架上,并用黑布遮光暗处理30 min,设置光化光(Actinic light)强度为281 μmol·m-2·s-1,选择Kinetics 模式,进行叶绿素荧光诱导曲线(持续260 s)的测定,并导出荧光成像源文件(pim 格式),利用ImagingWin v2.47 软件导出Fv/Fm、Y(Ⅱ)、Y(NPQ)、Y(NO)等荧光参数。经260 s光化光诱导,植物叶片荧光曲线已平滑,因此选择诱导曲线最后一次测得的荧光数据进行异质性定量分析。以Fv/Fm参数的分析为例来说明叶片荧光参数异质性定量分析的应用,其他荧光参数异质性分析方法与Fv/Fm类似。
3.1.3 数据统计
利用PASW Statistics18 数据分析软件进行试验数据的统计检验,采用独立样本t检验分析阳生叶和阴生叶之间的差异性,当P<0.05 时认为差异显著。所列数据均为平均值±标准误差,n=3。图表中不同字母表示在5%水平上阳生叶和阴生叶间具有显著性差异。
3.2 结果分析与讨论
3.2.1 叶片Fv/Fm的异质性
图1 是实验中其中一片阳生叶和阴生叶的Fv/Fm荧光成像图。由图1 可知,小叶榕同一叶片不同部位代表Fv/Fm值大小的颜色并不均匀,说明其荧光参数Fv/Fm具有异质性。相对阴生叶而言,阳生叶不同部位的颜色相差更大,且叶尖处存在坏死区域,无法检测出荧光。采用Circle方式获取的同一叶片颜色差异大的两个AOI区域和采用Poly⁃gon 方式获取全叶AOI 的Fv/Fm值,阳生叶全叶的Fv/Fm为0.617,叶脉两侧AOI 的Fv/Fm分别为0.675和0.593;阴生叶全叶和叶脉两侧AOI的Fv/Fm分别为0.692,0.663和0.702。由此可见,随机选择叶片某一部位设置AOI 所采集的荧光值并不能代表全叶的整体荧光特性。因此,有必要采用全叶作为AOI 来评价叶片的总体荧光特性,并且也需要有恰当的指标来定量分析叶片受伤害程度(如:致死程度与光抑制程度)和荧光特性的异质性。表1结果也显示,越冬期低温强光导致小叶榕阳生叶Fv/Fm异质性(CV=0.239)显著高于阴生叶(CV=0.076);采用ImagingWin 软件中最小精度间隔区间(α=0.004)和自定义间隔区间(α=0.02和0.04)所读取的数据,计算得出的CV值并没有明显差异。

表1 越冬期小叶榕阳生叶和阴生叶PSⅡ最大光化学效率(Fv/Fm)的变异系数(CV)Table 1 Coefficient of variation(CV)of the maximal PSⅡquantum yield(Fv/Fm)of sun-leaf and shadeleaf in F.microcarpa during overwintering
3.2.2 叶片Fv/Fm和坏死率
越冬期的小叶榕阳生叶全叶Fv/Fm为0.613,低于阴生叶的0.712,两者间存在显著差异(见图2)。通过荧光图像(见图1)我们可以发现阳生叶叶尖处有无法检测出荧光的坏死部分,而阴生叶则难以判断是否存在坏死部分。根据我们的方法计算得出,阳生叶的PLN为4.3%,明显高于阴生叶的0.2%(见图2)。这意味着越冬期低温强光对小叶榕阳生叶造成了破坏性伤害,而弱光环境下低温虽然也导致了光抑制的发生,但并未造成不可逆的伤害,并且光异质程度越大的叶片其光合异质性也越大。我们以前的研究结果也表明秋季夜间低温后次日强光照导致小叶榕叶片光合机构发生破坏性伤害,而遮阴条件下叶片仅发生可逆光抑制[13]。由于病虫害和重度非生物胁迫会导致叶片组织坏死,叶片坏死率可作为评价叶片受病虫害和非生物胁迫伤害程度的有效指标。

图1 越冬期小叶榕阳生叶和阴生叶PSⅡ最大光化学效率(Fv/Fm)的异质性Fig.1 The heterogeneity of the maximal PSⅡquantum yield(Fv/Fm)of sun-leaf and shade-leaf in F. microcarpa during overwintering

图2 越冬期小叶榕阳生叶和阴生叶的PSII 最大光化学效率(Fv/Fm)和坏死率(PLN)图中不同字母表示阳生叶和阴生叶之间差异显著(P<0.05);下同Fig.2 The maximal PSII quantum yield(Fv/Fm)and proportion of leaf necrosis(PLN)of sun-leaf and shade-leaf in F.microcarpa during overwintering Different letters indicate significant difference(sP<0.05)between sunleaf and shade-leaf;The same as below
3.2.3 叶片Fv/Fm荧光值的分布特征
为了更好地定量分析叶片Fv/Fm荧光值的分布特征,我们计算了叶片Fv/Fm荧光值的分布区间及其特征。图3 是标准化后的Fv/Fm荧光值相对面积图(RSt-Fv/Fm)。由图3 可知,阳生叶存在一定比例的Fv/Fm=0 区域面积(即叶片组织坏死),而阴生叶则基本上所有区域均能测到Fv/Fm荧光值。与阴生叶相比,阳生叶Fv/Fm荧光值变化区域范围相对较大,且主要分布在低值区域。这表明,冬季阳光照射导致阳生叶部分坏死和叶片光抑制程度的加剧,其异质性高于阴生叶。

图3 越冬期小叶榕阳生叶和阴生叶的相对面积(RSt)对PSⅡ最大光化学效率(Fv/Fm)的曲线(RSt-Fv/Fm)Fig.3 Curves of relative size(RSt)and the maximal PSⅡquantum yield(Fv/Fm)of sun-leaf and shade-leaf in F.microcarpa during overwintering(RSt-Fv/Fm)
我们采用α=0.004、0.02 和0.04,分别对Fv/Fm荧光值在(t-α)~t区间内的面积占叶片面积的比例作图(PΔSt-Fv/Fm,见图4)。由图4 可知,阳生叶PΔSt最大值(PΔStmax)的Fv/Fm荧光值均明显低于阴生叶,PΔSt发生明显变化的Fv/Fm起始值也显著低于阴生叶,但两者PΔSt趋于0的Fv/Fm最大值没有明显差异。这表明3 种精度间隔区间的PΔSt-Fv/Fm图均体现了阳生叶光抑制程度比阴生叶要高,其Fv/Fm异质性也大于阴生叶。但是,由于最小精度间隔区间(α=0.004)过小,导致部分相邻区间PΔSt呈现较大波动,不利于分析。而采用荧光值间距为0.02和0.04 的自定义间隔区间则有效地解决了这一问题,并且极大地减少了采集数据的工作量,因此,研究者可以根据实际需要确定荧光值的间隔区间(α)的大小。

图4 越冬期小叶榕阳生叶和阴生叶PSⅡ最大光化学效率(Fv/Fm)的分布比例Fig.4 Distribution proportion of leaf size in the maximal PSⅡquantum yield(Fv/Fm)of sun-leaf and shadeleaf in F.microcarpa during overwintering
根据制作PΔSt-Fv/Fm图的原始数据,对Fv/Fm荧光值的分布特性作了分析(见表2)。采用α=0.004、0.02 和0.04 三种间隔区间分析并未影响PΔStmax下Fv/Fm荧光值的大小,只影响了其所占面积的比例。但α=0.004 时,由于部分相邻区间ΔSt呈现波动导致PΔSt>1 呈现为非连续区间(见图4)。而采用α=0.02 和0.04 间隔区间则较好地解决了这个问题。并且在α=0.02 和0.04 间隔区间下,阳生叶PΔSt>1 连续区间的Fv/Fm起始值均为0.510,低于阴生叶的0.627;其Fv/Fm最大值除α=0.02 时阳生叶为0.745 外,其余的均为0.784;且所占叶片面积比例均高达90%以上。当α=0.02时,阳生叶PΔSt>10 呈现非连续区间;而当α=0.04时,阳生叶PΔSt>10 的连续区间为0.549~0.706,其所占面积为65.2%,阴生叶的连续区间则为0.667~0.784,所占面积为93.5%。因此,对于本研究而言,采用α=0.04,分析PΔSt>10 的Fv/Fm连续区间范围,能够较好地体现阳生叶和阴生叶Fv/Fm值的分布特征。
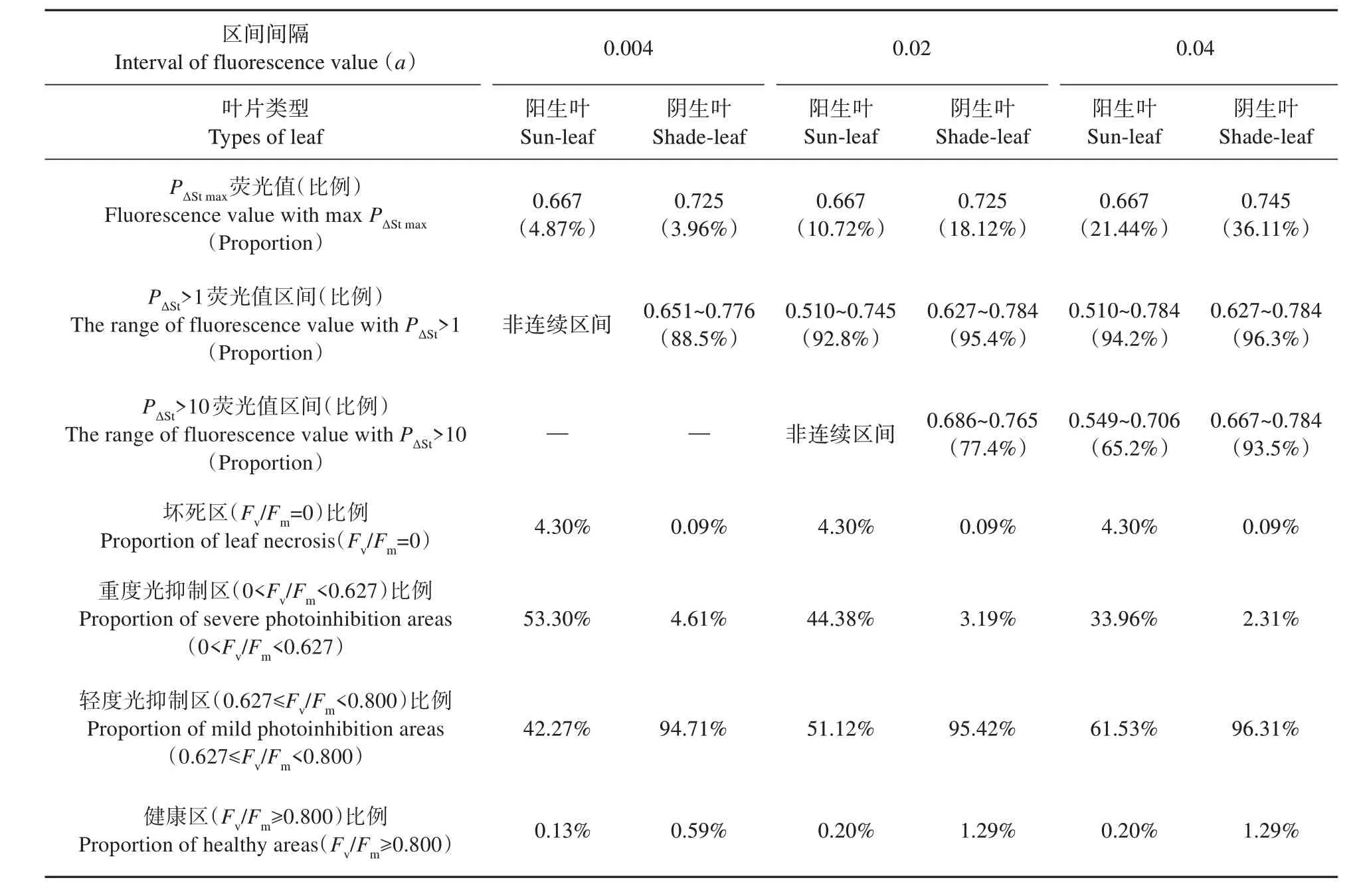
表2 越冬期小叶榕阳生叶和阴生叶PSⅡ最大光化学效率(Fv/Fm)的分布特性Table 2 Distribution characteristics of the maximal PSⅡquantum yield(Fv/Fm)of sun-leaf and shade-leaf in F. micro‐carpa during overwintering
Fv/Fm值的大小可以反映植物叶片受光抑制的程度,没有遭受环境胁迫的植物叶片Fv/Fm一般在0.80~0.85[14-15]。由于越冬期小叶榕的阴生叶光抑制程度较轻,本研究中阴生叶Fv/Fm荧光值主要分布在0.627~0.784(96.3%)。为此,我们定义Fv/Fm=0为坏死区,0 3.2.4 其他荧光参数异质性的定量分析 根据上述Fv/Fm异质性定量分析方法,我们对Y(Ⅱ)、Y(NPQ)、Y(NO)作了简单分析。结果表明,阳生叶Y(Ⅱ)的CV(1.128)虽然低于阴生叶的CV(3.015),但两者间并没有显著差异(P>0.05);阳生叶Y(NPQ)和Y(NO)的CV分别为0.362和0.413,均显著高于阴生叶的0.149和0.276(P<0.05)(见表3)。 表3 越冬期小叶榕阳生叶和阴生叶PSⅡ的实际光合效率(Y(Ⅱ))、调节性能量耗散的量子产额(Y(NPQ))和非调节性能量耗散的量子产额(Y(NO))α=0.04的变异系数(CV)和分布特性(n=3)Table 3 Coefficient of variation(CV)and distribution characteristics of effective PSⅡquantum yield(Y(Ⅱ)),quantum yield of regulated energy dissipation(Y(NPQ))and quantum yield of non-regulated energy dissipation(Y(NO))at α=0.04 for sun-leaf and shade-leaf in F.microcarpa during overwintering(n=3) 由图5 和表3 可知,越冬期小叶榕阳生叶和阴生叶的Y(Ⅱ)均较低,分别为0.141 和0.010,两者间具有显著差异(P<0.05)。虽然阳生叶Y(Ⅱ)的CV仅为阴生叶CV的37.4%,但两者间没有显著差异,究其原因与低温胁迫下阳生叶和阴生叶的Y(Ⅱ)均很低有关,因此,低温胁迫下Y(Ⅱ)的异质性并不是一个能够恰当评价叶片光合异质性的参数。进一步分析,阳生叶Y(Ⅱ)=0 的面积低于阴生叶,而PΔStmax荧光值、PΔSt>1和10的连续区间范围及其面积比例均明显高于阴生叶。这意味着虽然冬季低温显著抑制了小叶榕叶片的光化学能力,但处于强光环境下的阳生叶仍保持有一定的光化学能力,而弱光环境下的阴生叶光化学能力基本上被低温所抑制。 图5 越冬期小叶榕阳生叶和阴生叶的荧光参数荧光值,相对面积对荧光参数的曲线(RST-Parameter)和荧光参数的分布比例(PΔSt)对PSⅡ的实际光合效率(Y(Ⅱ))、调节性能量耗散的量子产额(Y(NPQ))和非调节性能量耗散的量子产额(Y(NO))的曲线Fig.5 Values of fluorescence parameters,curves of relative size and the fluorescence parameter(RST-Parameter),and distribution proportion of leaf size in the fluorescence parameter(PΔSt-Parameter)of sun-leaf and shade-leaf in F.microcarpa during overwintering.Fluorescence parameters include effective PSII quantum yield(Y(Ⅱ)),quantum yield of regulated energy dissipation(Y(NPQ))and quantum yield of non-regulated energy dissipation(Y(NO)) 相对阳生叶而言,阴生叶具有相对较高的Y(NPQ),PΔStmax荧光值、PΔSt>1 和10 的连续区间范围及其面积比例也显著高于阳生叶,且叶片中Y(NPQ)=0 的面积明显低于阳生叶。由此可见,相对阳生叶而言,小叶榕阴生叶具有较强的热耗散能力,这是阴生环境下小叶榕叶片仅发生可逆光抑制而非造成叶片光合机构破坏的重要机制。 由Y(NO)荧光值的分布特征可知,阳生叶有7.5% 的 叶 片 组 织Y(NO)=1,减 去 叶 片 坏 死 率4.3%,还有3.2%的叶片遭受强光胁迫并存在潜在的坏死风险。阳生叶Y(NO)的PΔStmax荧光值和PΔSt>10的连续区间范围均高于阴生叶;但是,两种叶片PΔSt>1 的连续区间范围均由0.235 起始,在低值区域重叠,这表明阳生叶也具有一定比例的叶片处于低激发压区域。由于越冬期阴生叶并未遭受强光伤害,因此,如阴生叶PΔSt>10 的上限值(0.314)为低风险区上限值,那么有24.6%的阳生叶Y(NO)处于低风险区(0~0.314),阴生叶则高达83.8%(数据未列出)。这表明越冬期强光虽然会导致小叶榕阳生叶严重的激发压积累存在严重伤害的潜在风险,但叶片中存在一定面积低激发压的低风险区;而处于低温弱光下的阴生叶则主要以低风险区为主,低温并未引起阴生叶光合机构严重伤害的风险。由此可见,种植于阴生环境下更有利于亚热带地区的小叶榕顺利越冬。 通过上述对小叶榕阳生叶和阴生叶荧光成像结果及相关荧光参数荧光值的异质性和分布特征分析,我们可以得出: ①荧光参数的变异系数(CV)可作为叶片光合异质性的定量指标,冬季低温强光导致小叶榕阳生叶的光合异质性高于阴生叶,表现为除Y(Ⅱ)外的其他荧光参数Fv/Fm、Y(NPQ)和Y(NO)的异质性均显著高于阴生叶。 ②荧光参数荧光值的分布比例曲线(PΔSt-Para)及其计算得出的相关分布特征值可定量分析荧光参数在叶片上的分布特征,并可进行不同叶片间的相互比较,从而有助于量化分析比较植物光合特性对环境的适应性。 ③冬季低温强光造成阳生叶部分组织坏死和处于重度光抑制胁迫,这意味着小叶榕作为冷敏感植物极易受到低温伤害,并不适宜亚热带地区栽培;但阳生叶仍有较大面积的叶组织处于轻度光抑制和低激发压状态,这可能是小叶榕能够在亚热带地区暖冬时顺利越冬的主要原因。冬季低温虽然造成弱光环境下的阴生叶较大面积的轻度光抑制,但阴生叶具有相对较高的热耗散能力,叶片基本未遭受坏死性伤害和重度光抑制,这表明亚热带地区的小叶榕种植在阴生环境下有利于越冬。 综上所述,基于叶绿素荧光成像技术从全叶水平上定量分析叶片叶绿素荧光参数荧光值的分布特征,可以定量分析叶片的荧光参数异质性,并实现不同叶片之间光合异质性的定量比较,在逆境胁迫下植物叶片光合异质性的研究中具有广泛的应用前景。

4 结论
