响应盐胁迫调控的露地菊miR398a的克隆及功能研究
2022-12-06岳莉然刘颖婕刘晨旭周蕴薇
岳莉然 刘颖婕 刘晨旭 周蕴薇
(1. 东北林业大学,哈尔滨 150040;2. 德州职业技术学院,德州 253000;3. 吉林农业大学,长春 130118)
植物microRNAs 是一类长度为20~24 nt 的非编码小RNA,能控制mRNA 降解或抑制其翻译,通常在转录后水平负调节基因表达来发挥作用[1]。miRNA 控制了多种生物和代谢途径中众多基因的表达,在植物生长发育和应对非生物胁迫中扮演着重要角色,尤其在植物响应盐胁迫的过程中起着关键作用[2]。例如:miR164 通过靶向NAC转录因子使其增加侧根数量来平衡植物对水分的吸收[3];miR393 通过提高种子萌发时的激素含量,从而提高种子的耐盐性[4];拟南芥(Arabidopsis thali⁃ana)中的miR171 和miR396 能够通过改变植株形态来抵御盐胁迫[5];过量表达osa-miR319a 能够增加水稻(Oryza sativa)的耐盐性[6];在高盐胁迫下,玉米(Zea mays)中上调表达的miR159 调控ABA信号调节过程,进而抵抗盐胁迫[7]。
miR398 是一类多数为21 nt 组成的miRNA[8],在 拟 南 芥 中miR398 家 族 包 括-a、-b 和-c 3 类 成员[9]。miR398 作为一种保守的miRNA 广泛存在于植物中,并在非生物胁迫中扮演着重要的角色[10]。在盐胁迫下,miR398 在拟南芥[11]、烟草(Ni⁃cotiana tabacum)[12]、番 茄(Lycopersicon esculen⁃tum)[13]等植物中均显著下调表达;热胁迫和SO2都能诱导miR398a 表达量降低[14-15]。miR398 通过降低靶基因的表达量来抵御活性氧的毒害,进而增强植物抵抗逆境胁迫的能力[16]。在拟南芥中,miR398 能通过剪切靶基因CSD转录出的mRNA降低植株耐热性[14];在臭氧、盐害等非生物胁迫下,拟南芥能够抑制miR398 的表达进而上调相应靶基因使其抵抗胁迫[17];miR398 与CSD的结合还可以控制生物体内铜元素水平的自我平衡[18]。
露地菊(Chrysanthemum×grandiflora)是在引种地被菊的基础上,经过天然杂交、卫星搭载后选育的一个新的地栽小菊品种群[19],因其抗性强、易管理、花繁茂等特点成为了秋季景观营造中非常重要的一类植物材料。本课题组前期通过对盐胁迫前后的露地菊‘纽9717’miRNAs 进行高通量测序,发现露地菊miR398 家族成员miR398a 呈现显著差异表达。为探究露地菊miR398a 在非生物胁迫过程中的功能和作用机制,本研究对miR398a前体和靶基因进行分析,克隆miR398a 前体并构建植物表达载体,获得过表达cgr-MIR398a 转基因拟南芥并对其进行功能验证。这为miR398a 在露地菊的表达特性及功能的研究奠定了理论基础。
1 材料与方法
1.1 试验材料
选用东北林业大学园林学院组培室培养的露地菊‘纽9717’植株,移栽后用60 mL 的200 mmol·L-1NaC1 溶液进行浇灌,以浇灌蒸馏水的植株为对照,处理12 h,用于检测基因的表达量变化。拟南芥为哥伦比亚野生型。
1.2 试剂
DNA 提取试剂盒、cDNA 反转录试剂盒和pMD18-T 载体购自TOYOBO 公司,DNA 提取试剂盒、胶回收试剂盒和质粒小提试剂盒购自OMEGA公司,大肠杆菌DH5α 购自维地生物公司,pBI121 MCS-GFP 载体、限制性内切酶和根瘤农杆菌为东北林业大学园林学院实验室保存。
1.3 试验方法
1.3.1 miRNA前体序列的扩增
以露地菊叶片为试验材料,从课题组前期测序所得露地菊sRNA 数据库中得到该miRNA 的前体cgr-MIR398a 序列及成熟体cgr-miR398a 序列。通过Premier 5.0 设计引物cgr-MIR398a-F、cgr-MIR398a-R(见表1),以露地菊叶片DNA 为模板进行PCR 并与pMD18-T载体连接,转化感受态细胞,送生物公司测序。

表1 PCR引物碱基序列Table 1 List of PCR primer sequences
1.3.2 生物信息学分析
利 用 在 线 软 件RNAfoldWebSever(http://rna.tbi.univie.ac.at/cgi-bin/RNAfold.cgi)进行miRNA 前体二级结构的预测,WebLOGO(http://weblogo.berkeley.edu/logo.cgi)对miRNA 成熟序列的碱基保守性进行分析。从公共数据库miRBase(22.1 版)(http://www.mirbase.org/)下载已登录的所有植物的miR398a 成熟序列及前体序列,用MEGA 6.0 软件Neighbor-Joining 法构建基于miRNA 前体的系统进化树。
1.3.3 靶基因预测
利用课题组前期测序所得露地菊降解组数据库原始数据,使用CleaveLand 4.0 程序[20]和AC⁃GT301-DGEv1.0程序(联川生物)预测cgr-MIR398a靶基因。根据植物miRNA/靶标配对标准[21],对列阵进行评分,绘制T-plot图。
1.3.4 实时荧光定量分析
采用RNA 试剂盒提取长势良好的露地菊叶、根和拟南芥叶片的总RNA,使用miRNA 反转录试剂盒(TaKaRa)进行反转录,利用miR398a 的成熟体cgr-miR398a-F 和试剂盒通用下游引物为上下游引物,以U6为内参基因(见表1)进行荧光定量试验。参照cDNA 反转录试剂盒,用NCBI 在线工具Primer-BLAST 设计靶基因的上下游引物,以CmEF1a基因[22]作为内参(见表1)进行荧光定量实验,所有试样重复3 次。蒸馏水作为对照,每个处理3 个生物学重复。参照2×TSINGKE Master qPCR Mix(SYBR Green Ⅰ,擎科)说明书,采用2-∆∆CT方法分析基因的相对表达量。
1.3.5 植物表达载体的构建和拟南芥的转化筛选
使用基因特异性引物cgr-MIR398aM-F 和cgr-MIR398aM-R 进行PCR 扩增,使用KpnⅠ和SalⅠ限制性内切酶双酶切,过夜转化,挑取单菌落扩大培养,送公司测序。将鉴定正确的重组载体pBI121-cgr-MIR398a-GFP 转入农杆菌。利用浸花法转化拟南芥,收获种子后用含50 mg·L-1Kana 的1/2 MS 培养基逐代筛选,直至获得cgr-MIR398a 过表达拟南芥纯合体植株。以pBI121载体的上下游引物PBI121-GFP-F 和PBI121-GFP-R(见表1)进行PCR验证,并对cgr-miR398a的表达量进行检测。
1.3.6 cgr-MIR398a 转基因拟南芥响应盐胁迫的表型及生理检测
将拟南芥野生型和T3 代纯合转基因种子消毒后,分别种于含0、75、100、150 mmol·L-1NaCl 的MS固体培养基中,冰箱内4 ℃春化3 d后置于植物培养箱中培养,以胚根伸出种皮作为发芽标准,计算培养7 d的发芽率。
将拟南芥野生型和T3 代纯合转基因种子消毒后接种于MS 固体培养基,冰箱内4 ℃春化3 d后置于植物培养箱中培养,长出2 片真叶后上盆,正常生长4 周后进行胁迫,处理组植株每2 d 浇灌200 mmol·L-1NaCl 溶液50 mL,对照组浇灌等量清水,取胁迫9 d 的拟南芥植株测定超氧化物歧化酶活性、过氧化物酶活性[23]、过氧化氢含量(分光法,苏州科铭)和超氧阴离子含量(分光法,苏州科铭)。进行3 次生物学重复,使用GraphPad prism 8.0进行多重分析。
2 结果与分析
2.1 露地菊miR398a前体克隆
以露地菊叶片DNA 为模板,使用前体序列cgr-MIR398a 上下游引物进行PCR 扩增,产物经电泳检测,结果表明在200 bp 左右的位置有一条特异性条带(见图1)。DNA 测序结果与预测所得露地菊miR398a前体序列一致。

图1 露地菊miR398a前体PCR扩增结果M.DL2000;1.cgr-MIR398aFig.1 PCR result of cgr-MIR398a in Chrysanthemum×grandiflora M.DL2000;1.cgr-MIR398a
2.2 植物miR398a前体的进化特性
对已知的22个物种及露地菊的miR398a前体序列构建进化树。裸子植物挪威云杉(Picea excel⁃sa)与双子叶植物甜橙(Citrus sinensis)聚集于同一分支,单子叶植物水稻和玉米分别与不同的双子叶植物聚成分支,这说明MIR398a 的进化特性与现有的植物形态学分类并不完全一致。露地菊cgr-MIR398a 与毛茛科的耧斗菜(Aquilegia coeru⁃lea)aqc-MIR398a 的相似度较高(见图2)。推测露地菊miR398a的进化特性与耧斗菜接近。
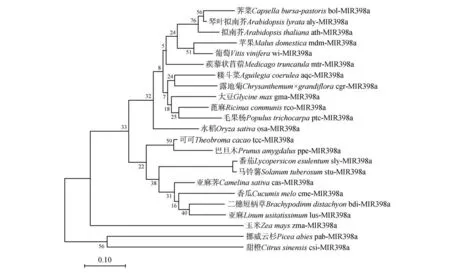
图2 基于miR398a前体序列构建的系统进化树Fig.2 Phylogenetic tree based on sequences of pre-miR398a
2.3 露地菊miR398a 前体二级结构预测及成熟序列保守性分析
利用RNAfold WebSever 对露地菊miR398a 前体序列进行二级结构预测,结果表明露地菊miR398a前体能形成典型的发卡结构,序列的结构最小自由能dG 值为-196.39 kJ·mol-1。其中miR398a的成熟体序列在茎部结构的5′端和3′端,且在最后一个碱基位置其保守性最低(见图3)。对已知miR398a成熟序列的碱基保守性进行分析,结果表明植物miR398a-3p端的成熟序列的碱基保守性较强且整体高于5p 端,miR398a-5p 只在第1、2、6 和13 位的碱基保守性较强且都偏好鸟嘌呤(G)(见图4)。
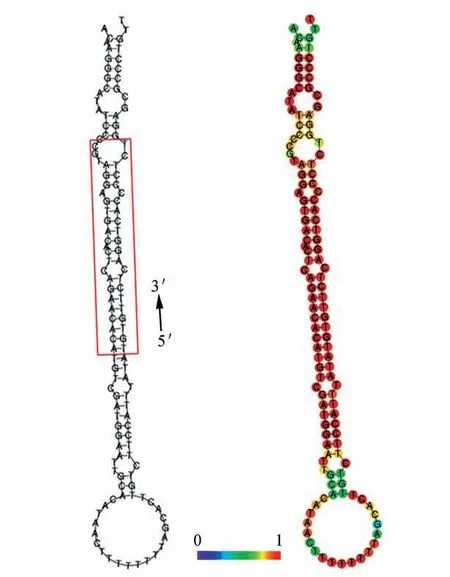
图3 露地菊miR398a前体二级结构及前体保守性示意图A.红色红框内为cgr-miR398a 的成熟体序列;B.不同颜色代表其保守性程度,红色表示保守程度最高,蓝色表示保守程度最低Fig.3 The pre-miR398a sequences and the conserved nucleotide sequence of pre-miR395a in Chrysanthemum×grandiflora A.Mature miR395a sequence is showed with the red square;B.Differ⁃ent colors represent the conservative degrees,and the red is the most conservative,the blue is the lest conservative
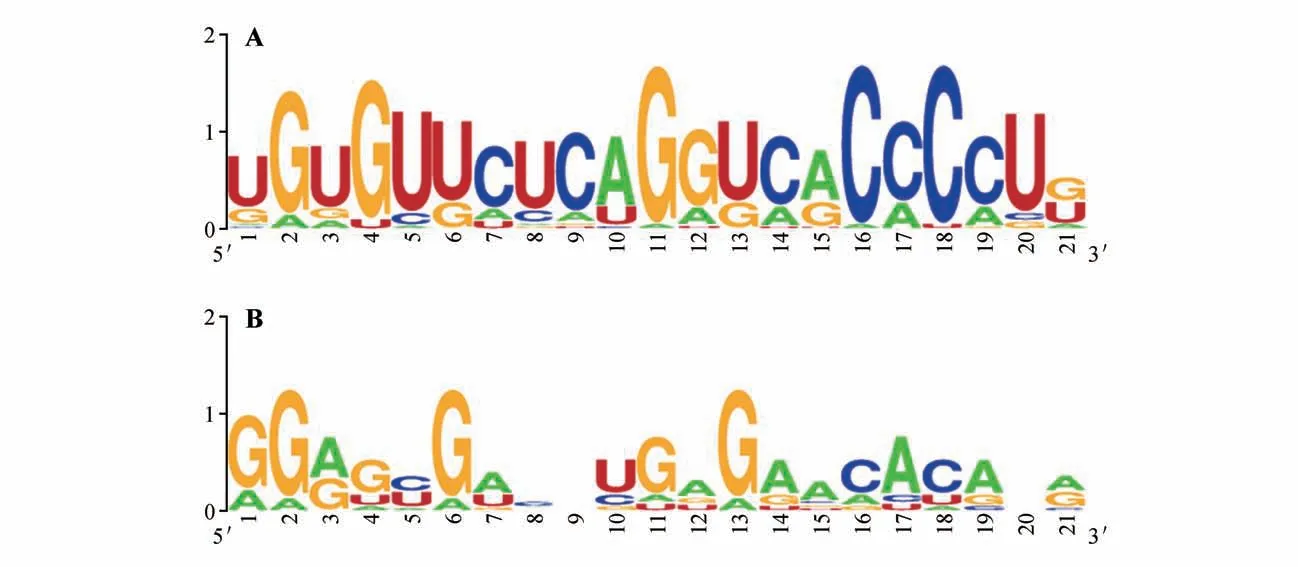
图4 miR398a-3p和miR398a-5p成熟序列碱基保守性A.miR398a-3p;B.miR398a-5pFig.4 Conservative analysis of nucleotides in miR398a-3p and miR398a-5p A.miR398a-3p;B.miR398a-5p
2.4 露地菊miR398a靶基因预测
利用露地菊根和叶降解组测序数据进行miR398a靶基因预测,结果表明在露地菊根和叶中共预测得到18 个靶基因,其中叶中有11 个靶基因,根中有12 个靶基因。有5 个靶基因在根和叶中被共同靶向,包括硫醇酶基因、铜-锌超氧化物歧化酶基因和铜伴侣蛋白基因等。在叶中单独检测到的靶基因有叶绿体酶2 基因、DNAJ 热激蛋白家族基因等;在根中被单独靶向的基因包括含有糖苷水解酶,含催化域蛋白、PH、RCC1和FYVE结构域的蛋白质1样异构体X3等(见表2)。miR398a在叶和根中的靶基因不完全一致,表明miR398a在植物不同组织中行使的功能存在差异。
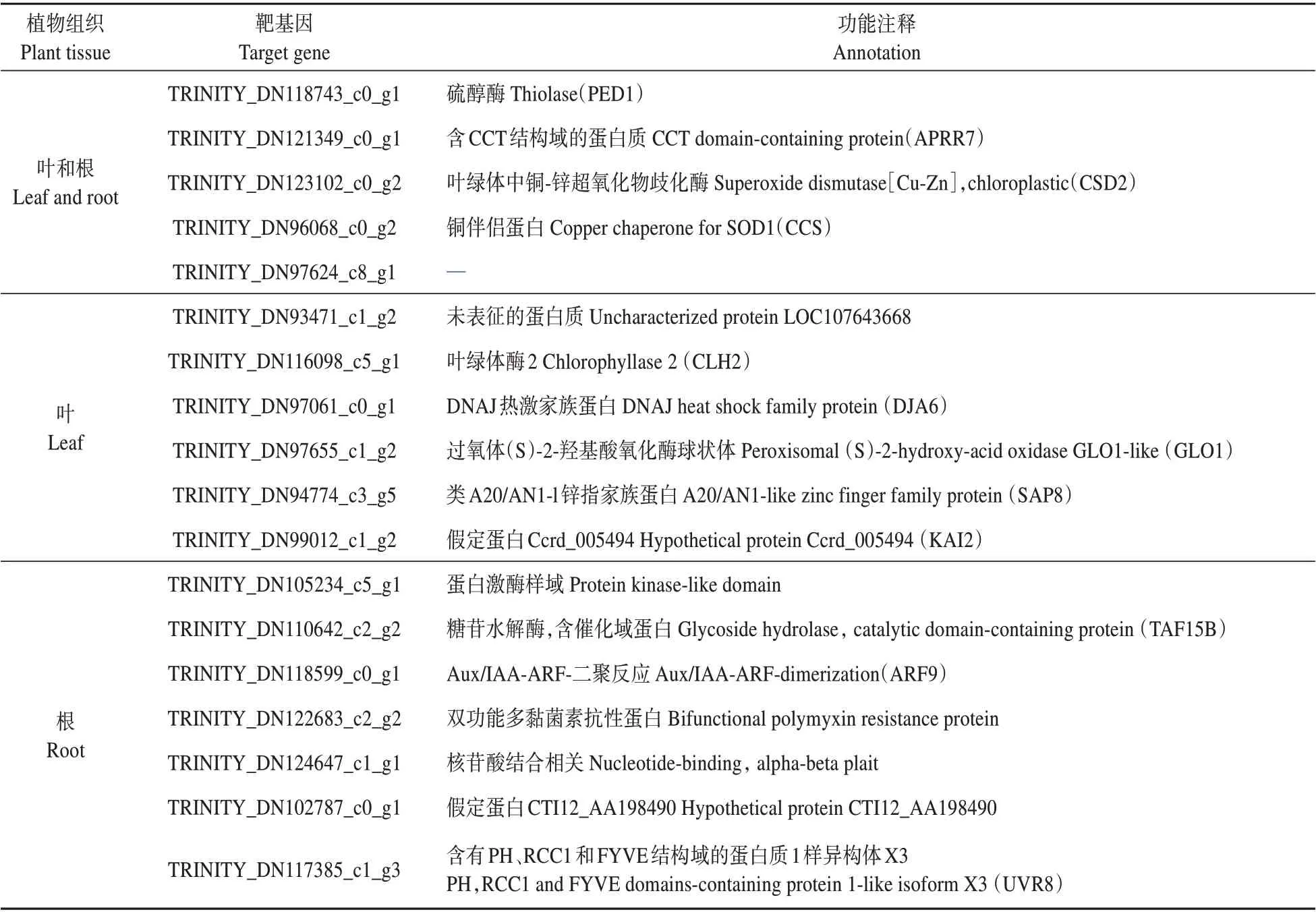
表2 露地菊miR398a靶基因预测Table 2 Target genes of cgr-miR398a of Chrysanthemum×grandiflora
2.5 露地菊在盐胁迫下miR398a 及靶基因在根和叶中的相对表达量
盐胁迫下,露地菊miR398a-3p 在根和叶中都显著下调,而叶中miR398a-5p 表达量在盐处理前后没有显著变化,但在根中变化显著(见图5:A~B)。选取罚分较低且T-plot 峰值较单一的靶基因(CSD2、CCS、SAP8)验证其盐胁迫前后的相对表达量。结果表明,CSD2、CCS、SAP8在盐胁迫下,在根和叶中都有不同程度的上调(见图5:C~E)。
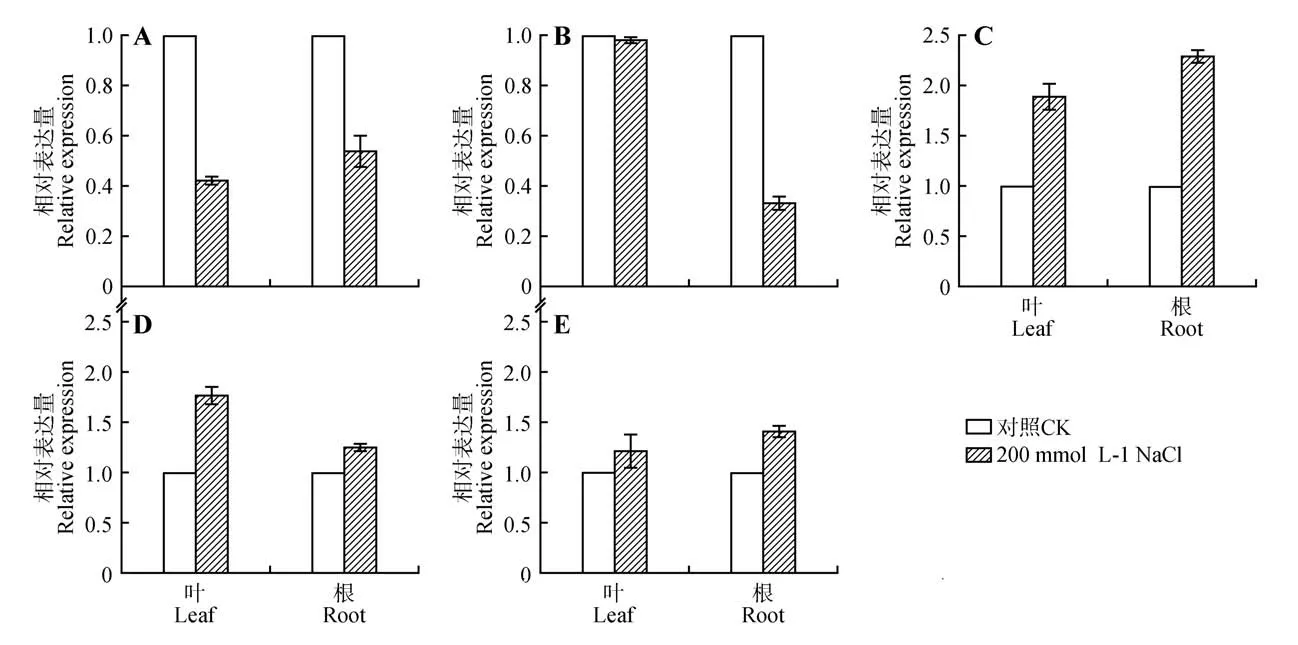
图5 在盐处理下露地菊的根和叶miR398a和靶基因的相对表达量A.miR398a-3p;B.miR398a-5p;C.CSD2(TRINITY_DN123102_c0_g2);D.CCS(TRINITY_DN96068_c0_g2);E.SAP8(TRINITY_DN94774_c3_g5)Fig.5 Relative expression levels of miR398a and target genes in leaf and root of Chrysanthemum×grandiflora under salt stress A.miR398a-3p;B.miR398a-5p;C.CSD2(TRINITY_DN123102_c0_g2);D.CCS(TRINITY_DN96068_c0_g2);E.SAP8(TRINITY_DN94774_c3_g5)
2.6 露地菊miR398a 植物表达载体的构建和农杆菌的转化
使用基因特异性引物扩增cgr-MIR398a,回收并连接至pMD18-T,将测序正确的质粒命名为pMD18-T-cgr-MIR398a。用KpnⅠ和SalⅠ限制性内切酶,对pMD18-T-cgr-MIR398a 质粒和pBI121 MCS-GFP(启动子为35 S)空载体质粒分别双酶切后,用T4 连接酶连接获得重组质粒,命名为pBI121-cgr-MIR398a-GFP。双酶切检测结果表明重组质粒被切开,目的片段长度在220 bp 左右(见图6A)。将重组质粒电转至农杆菌感受态细胞中,进行PCR 验证,目的条带符合通用引物长度,说明重组质粒已成功转入农杆菌中(见图6B)。
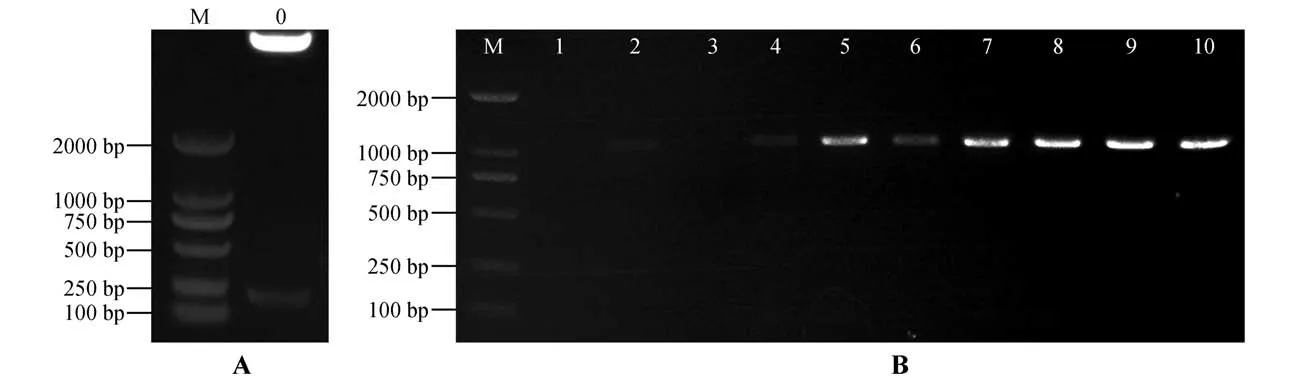
图6 pBI121-cgr-MIR398a-GFP双酶切鉴定(A)和农杆菌重组菌落PCR鉴定(B)M.DL2000 DNA Marker;0.pBI121-cgr-MIR398a-GFP;1.阴性对照;2、4~10.单菌落Fig.6 Double digestion of pBI121-cgr-MIR398a-GFP(A)and PCR identification of agrobacterium recombinant plas⁃mid(sB)M.DL2000 DNA Marker;0.pBI121-cgr-MIR398a-GFP;1.Negative control;2,4-10.Single colony
2.7 转cgr-MIR398a 基因拟南芥植株的鉴定及表达分析
经Kana 抗性培养基筛选,转基因阳性植株叶片为绿色且生长良好(见图7A)。PCR鉴定结果表明已成功转入外源cgr-MIR398a(见图7B)。对成熟cgr-miR398a 进行实时定量PCR 分析表明,cgr-MIR398a在转基因拟南芥叶片中表达量显著高于野生型。说明整合到拟南芥基因组中cgr-MIR398a经剪切可以加工成为成熟的cgr-miR398a(见图8A),转基因拟南芥中At2g28190(CSD2)和At1g12520(CCS)的相对表达量低于野生型(见图8B)。
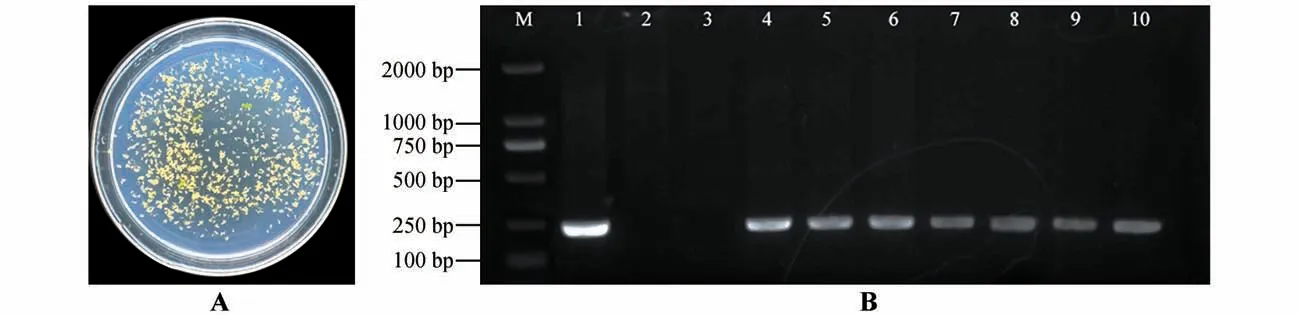
图7 过表达cgr-MIR398a拟南芥抗性筛选(A)与PCR验证(B)M.DL2000 DNA marker;1.重组质粒;2.野生型拟南芥;3.阴性对照;4~10.转基因植株Fig.7 Resistance screening(A)and PCR verification(B)of Arabidopsis thaliana overexpressing cgr-MIR398a M.DL2000 DNA marker;1.Recombinant plasmid;2.Wild-type Arabidopsis;3.Negative control;4-10.Transformed plant
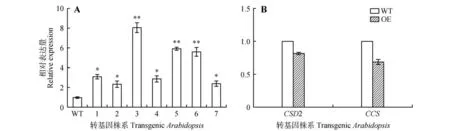
图8 转基因拟南芥miR398a及靶基因的表达水平WT.野生型;1~7,OE.转基因株系;*P<0.05;**P<0.01;***P<0.01;下同Fig.8 Expression analysis of miR398a and target genes in transgenic Arabidopsis WT.Control;1-7,OE.Transgenic Arabidopsis;*P<0.05;**P<0.01;***P<0.01;The same as below
2.8 过表达cgr-MIR398a 转基因拟南芥对盐胁迫的响应
2.8.1 盐胁迫对过表达cgr-MIR398a 转基因拟南芥种子萌发过程的影响
选取表达量高的3 个转基因株系分别命名为OE-1、OE-2、OE-3,对其进行表型和生理实验。结果表明,不含NaCl 的MS 培养基中,野生型WT 和转基因拟南芥种子的发芽率均为100%;随着盐浓度增加,种子发芽率呈现逐渐降低的趋势。100 mmol·L-1NaCl 处理下,OE-1、OE-2、OE-3 的发芽率与WT 相比均下降;150 mmol·L-1NaCl 处理时,WT的发芽率依旧能维持60%左右,而转cgr-MIR398a基因南芥发芽率仅为15%左右(见图9)。

图9 过表达cgr-MIR398a拟南芥在不同盐浓度处理下的发芽率WT.野生型株形;OE-1/2/3.转基因株系;下同Fig.9 Germination rates of Arabidopsis overexpressing cgr-MIR398a under different salt concentrations WT.Control;OE-1/2/3.Transgenic Arabidopsis;The same as below
2.8.2 盐胁迫对过表达cgr-MIR398a 转基因拟南芥表型的影响
对生长状况一致的拟南芥野生型和转基因植株进行盐胁迫处理。胁迫6 d 时野生型和转基因植株生长良好、叶片颜色鲜绿;胁迫9 d 时野生型叶片边缘轻微枯黄,转基因叶片变软并出现失水现象;胁迫12 d 时野生型叶片开始失水萎蔫,而转基因植株已经出现单株死亡现象(见图10)。因此,盐胁迫处理时转基因株系受盐害程度显著高于野生型。

图10 过表达cgr-MIR398a拟南芥在200 mmol·L-1 NaCl处理下的形态特征Fig.10 Morphological characteristics of Arabidopsis overexpressing cgr-MIR398a under 200 mmol·L-1 NaCl treatment
2.8.3 过表达cgr-MIR398a 转基因拟南芥盐胁迫后的生理指标检测
对生长状况一致的拟南芥野生型和转基因植株进行盐胁迫,9 d 后检测SOD、POD 酶活性和超氧阴离子(OFR)、过氧化氢(H2O2)含量。结果表明,胁迫后野生型和转基因拟南芥的SOD、POD 活性均增加,且野生型SOD、POD 活性均显著高于转基因拟南芥,(见图11:A~B)。OFR 和H2O2含量测定结果表明,在胁迫处理后,转基因拟南芥的OFR和H2O2含量均增加且高于野生型(见图11:C~D)。
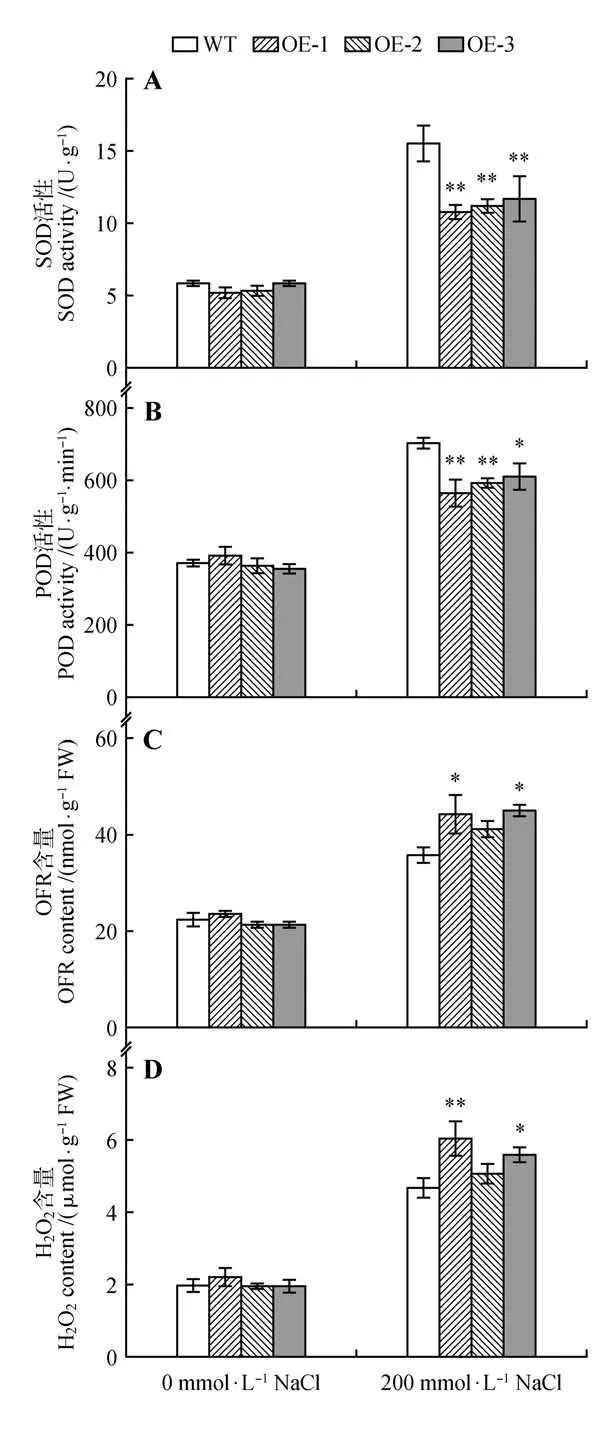
图11 转基因拟南芥盐胁迫后的生理指标检测Fig.11 Physiological indicators of transgenic Arabidopsis thaliana under salt stress
3 讨论
miRNA 普遍存在于植物体中,主要通过剪切靶基因或抑制靶基因蛋白翻译,对植物的生长发育、胁迫响应和信号转导等重要生理过程进行调控[24-25]。本研究对植物miR398a 成熟体序列进化分析得出miR398a 广泛存在于植物中且高度保守。露地菊miR398a 虽有少量碱基差异,但并不影响前体二级结构的形成,且miR398a 在进化过程中并没有改变其在CSD的mRNA 上的靶点[11],因此在非生物胁迫下cgr-miR398 具有与其他植物相似的调节作用。qRT-PCR 结果表明在盐胁迫下,露地菊的根和叶中miR398a 表达水平存在差异,可能是应对胁迫时植株不同部位表现出不同程度的响应[26]。相同组织部位下,露地菊miR398a的3′端和5′端的表达也存在差异,这与对紫花苜蓿(Medicago sativa)的研究结果[27]一致。有研究发现在RISC成熟过程中双链miRNA/miRNA*双链伴随Argonaute(AGO)蛋白,其中一条链被催化去除,另一条与靶点结合并引导沉默[28]。推测叶中miR398a-5p 的表达量在盐胁迫前后没有显著改变可能因为miR398a-5p 在叶中裂解,发挥作用的是miR398a-3p。
抵抗盐胁迫时,miRNA 的功能主要通过对靶基因的调控实现。通过降解组测序得到的miR398a 的靶基因有叶绿体中的铜/锌超氧化物歧化酶基因(CSD2)、铜伴侣蛋白基因(CCS)。拟南芥的miR398 能够通过靶向CSD2来清除活性氧、保护细胞膜结构,从而抵抗盐害[29]。而CCS 能够传递铜离子到CSD 中,影响CSD的表达[28]。推测露地菊miR398a 可能通过相同的途径响应胁迫。qRT-PCR 验证了露地菊的根和叶中CSD2和CCS在盐胁迫12 h 后上调。此外,靶基因还预测到了A20/AN1-l 锌指家族蛋白(SAP)基因。SAP基因涉及胁迫应答,能参与种子萌发和抵御多种非生物胁迫[30-31]。在盐胁迫下SAP8也上调表达,但二者匹配度相对其他成员较差,因此二者是否真的是稳定的miRNA-靶基因匹配关系仍待后续研究。
盐胁迫下,野生型拟南芥发芽率和生长情况均优于cgr-miR398a 转基因植株。200 mmol·L-1NaCl胁迫12 d后,野生型拟南芥失水萎蔫,而转基因拟南芥叶片处于半枯黄状态且出现单株死亡现象。ORF 和H2O2是可以造成氧毒害的活性氧(ROS),具有强氧化性,其含量过高会损伤细胞膜结构,降低植物抵御逆境胁迫的能力[32]。抗氧化酶SOD 和POD 能有效清除ROS,在植物应对非生物胁迫时发挥着关键作用[33-34]。胁迫后,转基因植株的OFR 和H2O2积累显著高于野生型,SOD 和POD的活性却显著低于野生型,说明过表达的cgr-MIR398a 可能通过靶向CSD从而降低靶基因的表达,进而降低植物清除ROS的能力,使植株收到的盐胁迫损伤加重。综上,cgr-miR398a 在拟南芥的幼苗期和成苗期均减弱了植物的耐盐能力,且在拟南芥响应盐胁迫中起着负调控作用。
4 结论
本研究对露地菊测序获得的cgr-miR398a 进行分析、靶基因预测,并确定miR398a 在拟南芥中过表达会造成植物体对盐胁迫更加敏感。此研究将为进一步揭示露地菊cgr-miR398a 在生长发育中的功能奠定基础。
