一株金霉素降解新菌株的分离鉴定及降解条件优化
2022-12-05赵慈张茹李思琦李文进宋哲华王晓慧沈鹏
赵慈,张茹,李思琦,李文进,宋哲华,王晓慧,沈鹏*
1.中国环境科学研究院
2.北京化工大学水处理环保材料工程技术研究中心
3.北京京环新能环境科技有限公司
抗生素是抗菌药物的一种。由于其抑菌效果佳、使用方法简便、价格低廉被广泛应用[1]。在世界范围内,中国对于抗生素类药物的生产和消费尤为广泛[2]。抗生素主要分为四环素类、磺胺类、β-内酰胺类、氟喹诺酮类以及大环内酯类等,而四环素类抗生素是常使用的抗生素之一,其消耗量接近抗生素总消耗量的1/2[3-6]。四环素类抗生素主要有金霉素(CTC)、土霉素(OTC)和四环素(TC)等,它们是一类广谱抗生素[7],其中金霉素能够抑制许多立克次体属、支原体属、衣原体属等病原体。进入生物体的抗生素并不能被生物体完全利用,约80%的抗生素会作为抗生素原药或者中间代谢物,以动物体排泄物的形式进入环境中[8-9]。同时,环境中残留的抗生素将通过食物链富集,再次进入到生物体中,会以不同的方式对人类和动物体产生危害[10-11]。因此,环境中的抗生素污染问题亟待解决[12]。
目前,对于被四环素等抗生素污染的废水的处理方法主要分为物化法和生物法两大类。物化法主要包括吸附法[13-14]、光催化法[15-17]、臭氧氧化法[18-19]、电解法[20-21]及膜分离法[22]等。大多数物化法存在处理效率低、成本高昂、管理复杂的缺点,故生物法处理抗生素废水成为研究热点。生物法主要是依靠微生物的生理活动处理抗生素残留,其凭借安全、高效、成本低廉、无二次污染等特点成为日前最具发展潜力及远景的处理手段[23-24]。王梓竹等[25]以养殖场新鲜粪便为选菌材料,分离出一株解淀粉芽孢杆菌N2-13,在最优降解条件下对四环素的降解率达97.27%;陶美等[26]从活性污泥中分离出克雷伯氏菌TTC-1,在最佳降解条件下对四环素的降解率达94.26%;赵永斌[27]以长时间被四环素类抗生素污染的土壤为原料,分离出木糖氧化无色杆菌和枯草芽孢杆菌,2 株菌对四环素均具有高效降解能力;郑茂佳[28]以四环素作为唯一碳源,多次分离纯化得到3 株四环素降解菌,分别命名为TC1、TC2、TC3,在最优降解条件下,菌株TC2 对四环素降解率达86.30%。整体而言,即使已经分离得到降解能力较强的金霉素降解菌,这些降解菌也存在一些明显的缺陷。如菌株生长条件苛刻,难以扩大生产利用等,所以进一步寻找降解性能好的菌株并对其生长条件进行优化显得尤为必要。目前,响应面优化作为有效的优化方法之一,其中的Box-Behnken 方法应用较为广泛,能够综合考虑各因素及其相互作用对响应值的影响,近年来已广泛用于试验条件及生产过程等的优化[29-30]。
笔者从长期生产金霉素饲料的河南驻马店华中正大有限公司的污泥中筛选出若干株能够降解金霉素的菌株,选择其中降解效果最好的菌株对其进行分类鉴定,研究其对金霉素的降解能力及环境因素对降解效果的影响,并对降解条件进行优化设计,以期为该菌株处理含金霉素废水提供理论依据。
1 材料与方法
1.1 材料
1.1.1 样品来源
样品污泥取自长期生产金霉素饲料的河南驻马店华中正大有限公司污水处理站的好氧池。
1.1.2 培养基
富集培养基:胰蛋白胨,10.0 g/L;酵母浸粉,5.0 g/L;NaCl,5.0 g/L。
筛选培养基:Na2HPO4,0.5 g/L;NaH2PO4,0.5 g/L;MgSO4,0.2 g/L;NaCl,0.5 g/L;NH4Cl,1.0 g/L;胰蛋白胨,10.0 g/L;金霉素适量。
无机盐培养基:Na2HPO4,0.4 g/L;NaH2PO4,0.6 g/L;MgSO4,0.2 g/L;NaCl,0.5g/L;NH4Cl,1.0 g/L;CH3COONa,10.0 g/L;金霉素适量。
微量元素溶液:MnCl2·4H2O,0.1 g/L;MgSO4·7H2O,0.5 g/L;ZnSO4·7H2O,0.2 g/L;CuSO4·5H2O,0.5 g/L;FeSO4·7H2O,0.5 g/L;CoCl2·6H2O,0.2 g/L;EDTA,1.0 g/L。
以上培养基灭菌条件为121 ℃高压蒸汽灭菌30 min。
1.1.3 试验仪器
本研究所用试验仪器如表1 所示。
表1 试验仪器Table 1 Experimental apparatus
1.2 试验方法
1.2.1 金霉素降解菌的富集、分离、纯化及保存
将5 mL 污泥样品溶解在95 mL 无菌水中,置于200 mL 锥形瓶中,于摇床中以150 r/min 的速度搅拌30 min,并用无菌水梯度稀释10−7~10−1倍7 个浓度梯度。将10−7倍的稀释样品均匀涂在含50 mg/L金霉素的固体筛选培养基上,设置3 个平行样,在30 ℃生化培养箱进行暗培养,直到菌落长势良好。挑取单个菌落,在固体筛选培养基中纯化5 次,分离出能够耐受50 mg/L 金霉素的初筛菌株,在富集培养基中接种,并于150 r/min、30 ℃摇床中暗培养,富集纯菌株备用。将富集菌株接种于含金霉素的液体培养基,测定金霉素降解率并筛选出降解效果较好的菌株。将纯化所得菌株接种于斜面培养基中培养,置于4 ℃冰箱可保存1 个月。
1.2.2 金霉素降解菌的鉴定
选取降解率最高的菌株进行下一步研究。经形态学观察、革兰氏染色对该菌株进行鉴定,并进行16S rDNA 同源性比对。PCR 扩增细菌上游引物为(27F) 5'-AGAGTTTGATCCTGGCTCAG-3',下游引物(1429R) 5'-GGTTACCTTGTTACGACTT-3。将测序结果提交至BLAST 网站进行比对,利用Neighbor Joining tree 方法进行系统发育树的构建。
1.2.3 正交试验设计
以金霉素降解率为目标进行该菌株降解条件的优化设计。选择碳源、温度、pH、金霉素初始浓度和接种量(体积比,全文同)5 个常见环境因素,探讨不同环境因素对金霉素降解率的影响。设计5 因素5 水平试验,将菌体置于不同条件下的培养基中培养观察金霉素降解情况,具体见表2。
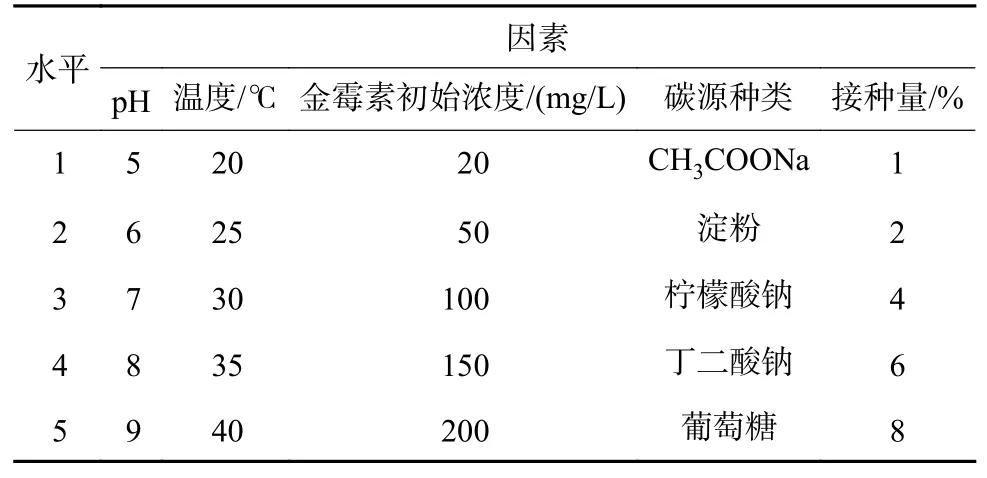
表2 正交试验设计Table 2 Orthogonal test design
1.2.4 不同因素间的相互响应
基于正交试验的结果,选出对降解金霉素影响最大的3 个因素进行响应面优化试验。利用Design-Expert 10 软件进行响应面优化设计及数据分析。为保证模型的准确性及可利用性,依照响应面优化得到的最佳降解条件设计2 组平行验证试验,取平均值。
2 结果与讨论
2.1 金霉素降解菌的筛选
从金霉素制药厂活性污泥中经反复分离纯化,筛选出10 株纯菌株。在金霉素初始浓度50 mg/L、30 ℃、150 r/min 的条件下暗培养3 d,测定各菌株对金霉素的降解效果(图1),选择其中降解率最高的菌株,命名为ZL-1,并作为后续试验菌株。
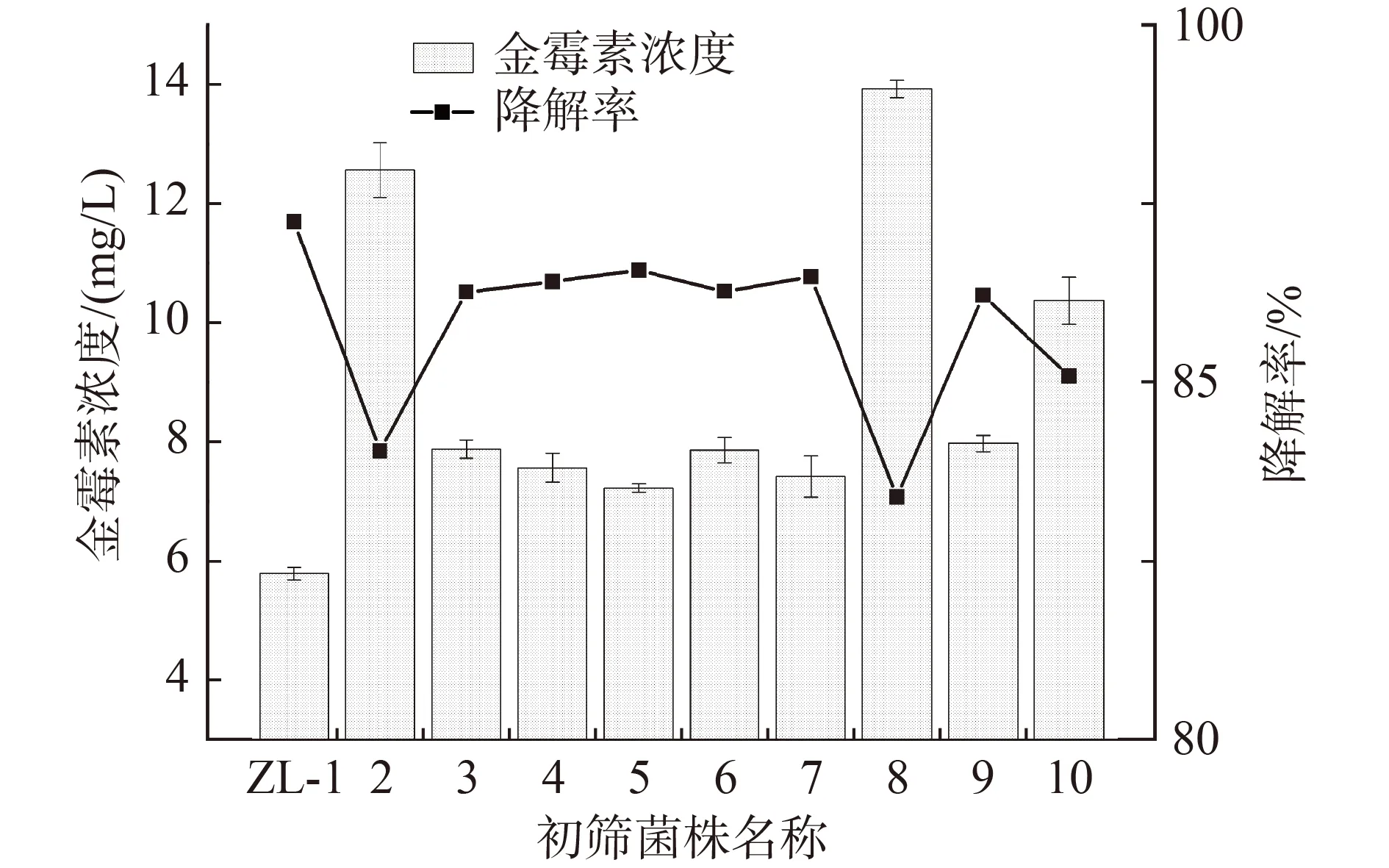
图1 初筛降解菌株对金霉素的降解率Fig.1 Degradation efficiency map of primary screened strains
2.2 菌株ZL-1 的形态特征
肉眼观察菌株ZL-1 的形态特征为无色透明,菌落形状规则,边缘光滑整齐,表面湿润易挑起。扫描电子显微镜(SEM)放大20 000 倍,显示菌体呈椭球形,菌体的大小约为1.3 µm×0.77 µm(图2)。

图2 菌株ZL-1 形态Fig.2 Morphological map of strain ZL-1
2.3 菌株ZL-1 的鉴定
革兰氏染色试验结果表明,菌株ZL-1 为革兰氏阴性菌;通过16S rDNA 测序,获得PCR 的扩增引物长度为1 442 bp,将测序结果提交至BLAST 网站进行比对,表明菌株ZL-1 为不动杆菌属(Acinetobacter sp.),相似度为99.1%,利用Neighbor Joining Tree 方法构建系统发育树,结果见图3。
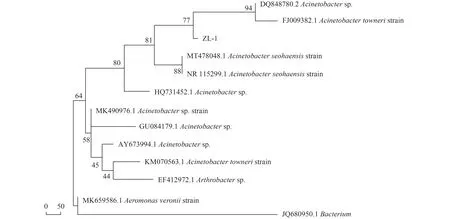
图3 菌株ZL-1 系统发育树Fig.3 Phylogenetic tree of strain ZL-1
2.4 菌株ZL-1 降解条件优化
2.4.1 环境因素对金霉素降解影响的正交试验
不同环境因素对菌株ZL-1 降解金霉素的正交试验结果如表3 所示。从表3 可以看出,试验23 的降解效果最佳,即在pH 为9,温度为30 ℃,金霉素初始浓度为50 mg/L,碳源为CH3COONa,接种量为8%时降解率最高,为74.02%。对表4 中的极差进行分析,发现5 个因素变量的极差由大到小依次为温度(10.312)、接种量(6.438)、金霉素初始浓度(4.816)、碳源种类(4.514)、pH(2.682)。说明温度、接种量和金霉素初始浓度对金霉素降解的影响较大,故取此3 个因素进行后续响应面优化试验。

表3 正交试验结果Table 3 Orthogonal test results

表4 各因素不同水平下降解率的均值及极差Table 4 Mean and extreme difference of degradation efficiency in different levels of factors
2.4.2 不同环境因素之间的响应
基于2.4.1 节正交试验结果,选取了3 个环境因素进行响应面优化,取值如表5 所示,试验结果如表6 所示。利用Design-Expert 10 软件对数据结果进行方差和最小拟二乘法分析,分析结果如表7 所示。分别以A、B、C为自变量,以降解率为响应值,得出二次多项回归模型为:

表5 Box-Behnken 试验因素与水平Table 5 Box-behnken test factors and levels

表6 菌株ZL-1 响应面分析结果Table 6 Response surface analysis result of strain ZL-1

式中:Y为金霉素降解率,%;A为温度,℃;B为金霉素初始素浓度,mg/L;C为接种量,%。
表7 中测定的回归系数(R2)为0.969 5,表明96.95%的响应值符合该模型,经校正后测定系数为0.930 4。该方程模型可用于分析和预测降解金霉素的最佳温度、金霉素初始浓度、接种量和降解率。
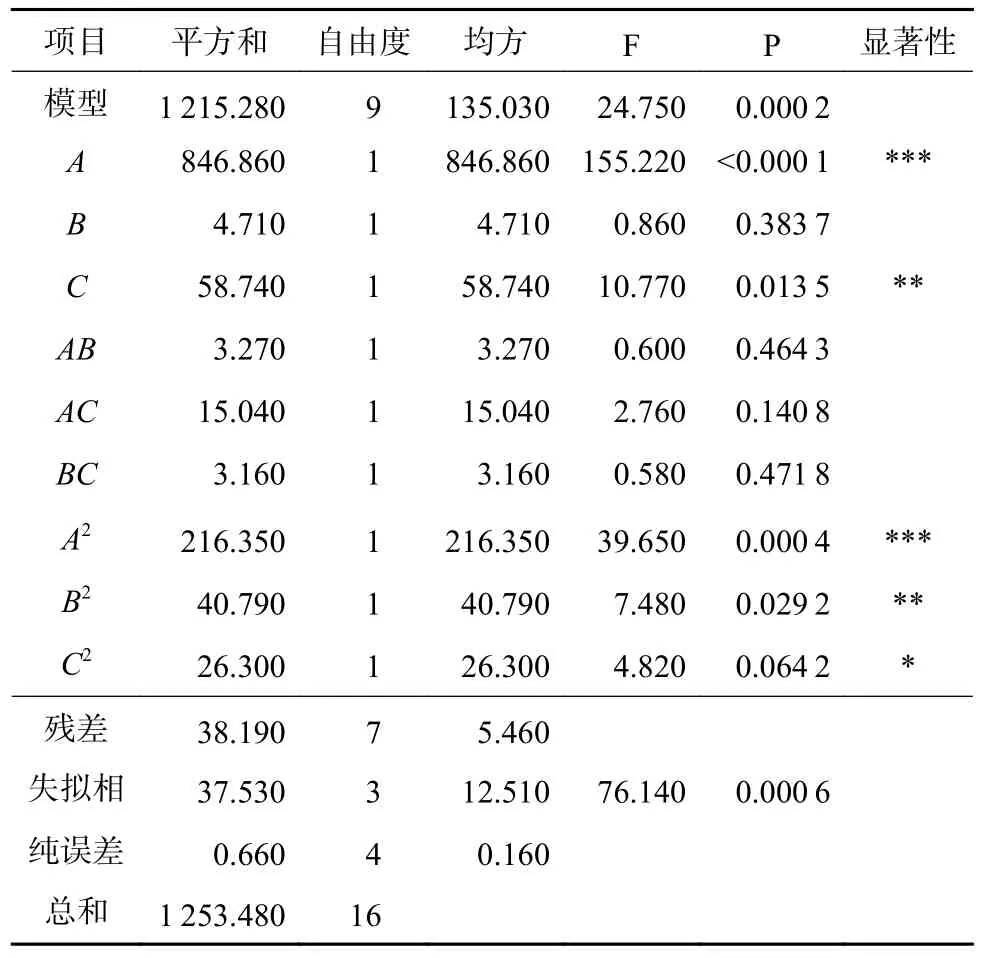
表7 菌株ZL-1 降解金霉素的最小拟二乘法分析Table 7 Minimum quasi-multiplied method for degrading chlortetracycline of strain ZL-1
最小拟二乘法的检验结果表明,回归方程的一次项A为极显著,B不显著,C较显著,二次项A2、B2和C2分别为极显著、较显著和显著。结合响应面分析得到的3D 图形(图4)可以看出各因素的相互作用,且3D 曲线的陡峭程度与试验因素对响应值的影响成正比,可知温度和金霉素初始浓度相互作用显著,且对金霉素的降解率影响较大。金霉素的降解率在中心点附近时达到最大值,即只有在适合的温度、接种量和金霉素初始浓度下,菌株ZL-1 对金霉素的降解率才能达到最高。
从图4(a)可以看出,随着温度的升高,金霉素的降解率基本呈上升趋势,当金霉素的降解率达到最高时,温度为34.409 ℃。随着金霉素初始浓度的增加,金霉素的降解率先增加后减小,当金霉素初始浓度为134.864 mg/L 时,金霉素的降解率达到最高。
从图4(b)可以看出,随着温度的升高,金霉素的降解率升高,当金霉素的降解率最高时,温度为34.409 ℃。随着接种量的增加,金霉素降解率先增加后减小,当接种量为5.223%时,降解率最高。

图4 各因素及其交互作用的响应面Fig.4 Factors and their interaction in response surface chart
从图4(c)可以看出,随着金霉素初始浓度的增加,金霉素的降解率先增加后减小。当金霉素初始浓度为134.864 mg/L 时,金霉素的降解率最高。随着接种量的增加,金霉素的降解率先增加后减小。当接种量为5.223%时,金霉素的降解效率最高。
综上,当金霉素初始浓度为134.864 mg/L,反应温度为34.409 ℃,接种量为5.223%时,菌株ZL-1 对金霉素的降解率最高,为93.723%。
2.4.3 响应面优化验证试验
依据正交试验确定的3 个因素及响应面优化得到的最佳降解条件,确定了菌株ZL-1 的最优降解条件,即金霉素初始浓度为134.864 mg/L,反应温度为34.409 ℃,接种量为5.223%。在该降解条件下进行验证试验,得到金霉素的实际降解率为93.70%,预测降解率为93.723%,说明该模型的预测值与实际的降解率比较贴合。
3 结论
(1)从长期生产金霉素的制药厂的污泥筛选得到1 株能够高效降解金霉素的菌株ZL-1。对ZL-1进行形态学观察、革兰氏染色和16S rDNA 序列分析。结果表明该菌落无色透明,形状规则,边缘光滑整齐,表面湿润易挑起;菌株ZL-1 为革兰氏阴性菌、不动杆菌属。
(2)通过正交试验研究了碳源、温度、pH、金霉素初始浓度、接种量对金霉素降解率的影响,结果表明,温度、接种量和金霉素初始浓度对该菌株降解金霉素的影响较大。温度和金霉素初始浓度交互作用显著,对金霉素的降解率影响最大。
(3)以正交试验的结果为依据,采用响应面优化该菌对金霉素的降解条件并进行验证,确定了降解金霉素的最佳条件,金霉素初始浓度为134.864 mg/L,温度为34.409 ℃,接种量为5.223%,在此条件下,试验测得金霉素实际降解率为93.70%,与模型预测的降解率(93.723%)较为符合。
