乳酸链球菌素(Nisin)的生物合成研究进展
2022-12-05杨勇赵阳娟刘希童星
杨勇,赵阳娟,刘希,童星
(1.广东海天创新技术有限公司,广东 佛山 518064;2.佛山市海天调味食品股份有限公司,广东 佛山 528000;3.佛山市海天(高明)调味食品有限公司,广东 佛山 528511)
乳酸菌是革兰氏阳性、过氧化氢酶阴性、氧化酶阴性、非产孢、微需氧菌,碳水化合物的主要发酵产物是乳酸。乳酸菌包括球菌(Lactococcus,Leuconostoc,Oenococcus,Pediococcus,Tetragenococcus,Streptococcus,Enterococcus)和杆菌(Lactobacillus,Carnobacterium,Bifidobacterium)。这些乳酸菌中有许多是公认的具有开发风味和香气以及延缓腐败的作用的菌。因此,传统上利用这些微生物作为发酵剂进行食品和饮料发酵,应用于种类繁多的农产品(牛奶、肉、水果、蔬菜、谷类等)中。存在于这些发酵剂培养物中的乳酸菌有助于提高感官质量,同时通过原位产生抗菌物质,如乳酸、醋酸、过氧化氢、细菌素等,进行发酵食品的保存。因为总的趋势是减少使用化学添加剂,因此这类天然抑菌剂可以替代传统的化学防腐剂,如二氧化硫、苯甲酸、山梨酸、硝酸盐、亚硝酸盐等。因此,乳酸菌产生的细菌素作为生物食品防腐剂在未来食品保鲜中很有前景[1-7]。
1 细菌素
细菌素(bacteriocins)是由革兰氏阳性菌和革兰氏阴性菌产生的蛋白质化合物,主要是针对其密切相关的细菌。1928年研究人员首次发现了乳酸菌产生的细菌素。随后该细菌素于1971年被鉴定(化学结构见图1),被命名为乳酸链球菌素(Nisin)。早期的研究提出,存在几种不同类型的乳酸链球菌素分子。1952年,Bavin等指出乳酸链球菌素有两种不同类型的分子。同期Berridge等表明乳酸链球菌素可能有4种类型,并定义为A、B、C、D,A和B的生物活性高,C和D的生物活性只有A和B的1/5。1967年,Javis报道了第5种类型E。1991年,Mulders报道了乳酸链球菌素Z,除了His27变为Asn之外,它的结构与Nisin A一致。
Nisin表现了广泛的对革兰氏阳性菌的抑制作用,其抑菌浓度(较低的纳摩尔范围内)对许多革兰氏阳性菌,包括腐败和食源性病原体,如葡萄球菌、杆菌、肉毒梭菌、单增李斯特菌和多种抗药性细菌。Nisin已被多国批准,其广泛应用在食品工业中作为一种安全高效的食品防腐剂已有几十年的历史,广泛应用于各种食品中。我国批准其列入国标GB 2760-86的1990年增补品种中,可用于罐藏食品、植物蛋白食品、乳制品和肉制品中[8]。
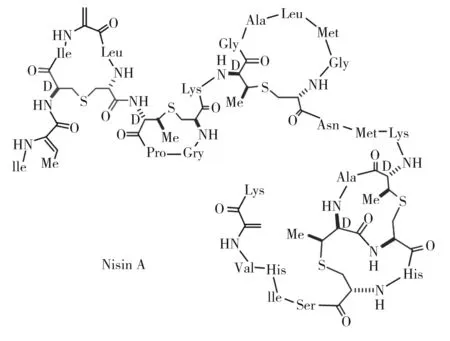
图1 Nisin A的结构Fig.1 The structure of Nisin A
2 Nisin是羊毛硫菌素的一员[10]
过去20多年的基因组测序工作证实核糖体合成的、翻译后修饰的肽(ribosomally synthesized and posttranslationally modified peptides,RiPPs)比之前预期的要普遍得多。在生命的每个阶段,RiPPs在生物体的基因组中被编码,显示出巨大的结构多样性以及生物活性多样性。它们是许多生物医学和食品相关的研究小组关注的焦点。大多数的RiPPs是由一个较大的前体肽生物合成而来,前体肽包括可转变为终产物的核心肽和一个N-或C-端延伸段(先导肽或追随肽,leader or follower peptide)。这些延伸段引导了大多数发生在核心肽中的翻译后修饰。RIPS通常是大环状的,类似于在非核糖体肽中常见的环化。环化可增加其自生的代谢稳定性,改善细胞吸收和预先识别细胞目标。
在目前已公布的基因组中发现含羊毛硫氨酸(lanthionine)的肽,或称之为羊毛硫肽(lanthipeptides)或羊毛硫菌素(lantibiotics)的生物合成基因簇的频率,在所有RiPPs中是最高的。它们在理化性质上共有的特征是富含高度修饰的羊毛硫氨酸,且又具有疏水性。对羊毛硫菌素的研究,特别是对乳酸菌分泌的、热稳定多肽的研究成果最多,因为其中的一员——Nisin作为食品工业中的防腐剂而最受关注。Nisin是第一个,也是迄今为止唯一一个有商业用途的羊毛硫细菌素。卓越的商业成功使乳酸链球菌素在细菌素中的地位达到顶峰。广谱的抗菌活性以及作为食品工业天然防腐剂日益广泛的应用激发了人们对这个羊毛硫菌素分子的研究兴趣。
羊毛硫菌素有Ⅰ型、Ⅱ型、Ⅲ型和Ⅳ型4大类,其中Nisin属于Ⅰ型羊毛硫菌素,包含翻译后修饰氨基酸——羊毛硫氨酸(简写为Lan)和甲基羊毛硫氨酸(简写为MeLan,其中一个β-碳原子上有一个额外的甲基)以及它们的前体——脱氢丙氨酸和脱氢氨基丁酸。Nisin由5个环状结构、34个氨基酸组成,包括2个脱氢丙氨酸残基(位置5和33),1个脱氢氨基丁酸残基(位置2)和5个分子内硫醚羊毛硫氨酸桥(残基3-7)以及甲基羊毛硫氨酸桥(残基8-11、13-19、23-26、25-28)。在成熟过程中,1个23个残基的N-端先导肽从57个残基的前体分子中酶解而脱离,形成34个残基、成熟的Nisin。羊毛硫菌素不寻常的多环结构特征引起了人们对其生物合成途径极大兴趣。
3 Nisin的结构和功能[11-12]
与其他羊毛硫菌素成员相似,Nisin A的结构特征是存在多个非标准氨基酸残基,如由一系列酶介导的翻译后修饰产生的羊毛硫氨酸(Lan)、甲基羊毛硫氨酸(MeLan)。这些修饰不仅赋予多肽的结构和功能,而且使其具有自生抗水解和抗氧化的能力。事实上,这一系列令人满意的分子特性使它们适合用于人类和脊椎动物的治疗,以及制药、生化、农业和食品工业。革兰氏阳性细菌产生这类生物活性肽,用来拮抗与其竞争的其他微生物,从而使这些产抗菌具有选择性优势。这些抗菌肽与目前使用的化学治药物的作用机制相比,对致病性微生物和临床靶点的作用机理不同。
一些重量级的研究表明,乳酸链球菌素发挥其抗菌作用,既通过细胞膜孔的形成(它可以组装成一个总计由4个Nisin分子和8个lipid Ⅱ分子形成的、强有力的“打孔器”,在目标细菌的细胞膜上形成结构非常稳定的孔洞),又通过特异性结合脂质Ⅱ(细胞壁的基本前体物质),从而抑制细胞壁的合成。这种联合作用是位于N-和C-末端的2个结构域共同介导。
N-末端结构域包含3个羊毛硫氨酸环(A、B和C)通过一个由3个氨基酸组成的柔性铰链区(Asn20-Met21-Lys22)与C-末端的2个环所连接见图3。已经鉴定A、B和C环形成了一个“笼状”的外壳,便于结合脂质Ⅱ的焦磷酸部分,从而抑制细胞壁合成。这种结合增强了包含环D和E的C-末端的能力,即在细胞膜中形成孔隙,导致离子和细胞质溶液快速流出。这两种活性的综合作用导致抑制敏感细菌靶点的最小抑制值在纳摩尔范围内。值得注意的是,脂质Ⅱ也是糖肽抗生素万古霉素的靶点。但是,由于Nisin在不同于万古霉素的部位结合脂质Ⅱ,因此它保留了对万古霉素耐药的革兰阳性病原菌的抑制活性。
4 Nisin的生物合成基因簇[13-14]
在过去的20多年中,天然产物肽的生物合成,无论是基因编码还是非核糖体起源,均受到广泛关注。Nisin的生物合成基因簇大小为15 kb左右。
包括编码Nisin前体的结构基因(nisA)在内,其生物合成基因簇还有对Nisin前体进行后修饰的蛋白基因(nisB和nisC)、前体修饰后的分泌(nisT)、自身的免疫(nisIFEG)、酶解释放(nisP)、双组分调节系统(nisKR)。Nisin A的生物合成基因簇见图2。
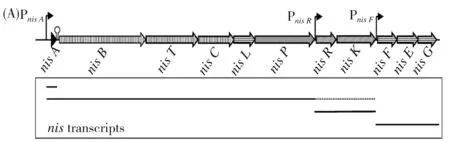
图2 Nisin生物合成基因簇的结构[15]Fig.2 The structure of biosynthetic gene cluster of Nisin
5 Nisin的翻译后修饰[16]
首先,乳酸链球菌素前体肽(NisA)由核糖体合成,没有活性。结构包括N端先导肽以及C-末端前肽,见图3。
对于Nisin A来说,1个羊毛硫氨酸(Lan)和4个甲基羊毛硫氨酸(MeLan)的结构是与N端先导肽相连的非修饰核心肽中的1个丝氨酸和4个苏氨酸残基脱水引入的,生成相应的脱氢丙氨酸(Dha)和Z-脱氢氨基丁酸残基(Dhb),由脱水酶NisB催化。然后是nisC催化分子内、立体选择性Michael加成反应,将半胱氨酸的巯基和Dha或Dhb双键之间进行加成,生成羊毛硫氨酸或甲基羊毛硫氨酸的硫醚交联产物。在此过程中底物Ser/Thr残基的α-碳在立体化学上被转变为D构型。因为典型的羊毛硫肽含有大量的丝氨酸、苏氨酸和半胱氨酸残基,所以终产物是多环结构,展示出显著的结构多样性。
含有前导肽的Nisin随后通过专门的ABC型的转运子nisT而被运输。乳链菌肽的抗菌特性决定了菌株必须对自身产物的影响免疫。由两个不同的系统组成的脂蛋白nisI和ABC转运子nisFEG构成了免疫系统。只有在N端前导序列被特殊的胞外丝氨酸蛋白酶nisP水解后,成熟的具有生物活性的nisA才被释放,见图3。乳酸链球菌素的生物合成被由受体组氨酸激酶(NisK)和转录反应调节因子(NisR)组成的双组分系统调节(以维持在生产和免疫之间的适当平衡)。
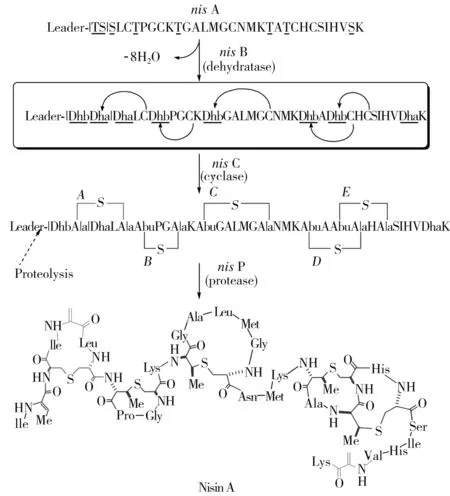
图3 Nisin A的翻译后成熟过程Fig.3 Process of post-translational maturity of Nisin A
NisA前肽由核糖体合成,然后NisB催化丝氨酸和苏氨酸残基(下划线)脱水。NisC以区域和立体选择性的方式催化Cys残基和5个Dha(绿色)和Dhb(品红)残基进行共轭加成反应,生成5个环硫醚:1个羊毛硫氨酸(红色)和4个甲基羊毛硫氨酸(蓝色)。脱水/环化完成后,未修饰的先导肽被NisP蛋白酶进行水解。先导肽的序列是MSTKDFNLDVSVSKDSGSGR。Abu,S-2-氨基丁酸。
6 令人关注的羊毛硫氨酸形成机理[17-18]
虽然所有的羊毛硫肽都是通过丝氨酸或苏氨酸残基脱水,生成脱水氨基酸,随后是半胱氨酸残基的加成,但发生这些反应的催化机理是多样的。目前,已经鉴定了4种,有些在进化上有关联。对于Nisin和其他Ⅰ型羊毛硫肽来说,脱水反应由脱水酶LanB催化,环化反应由环化酶LanC催化。LanB酶分子量较大,大约为120 kDa,并且与数据库中其他特征蛋白质没有同源性。NisB,即参与乳酸链球菌素生物合成的LanB脱水酶,需要在ATP、谷氨酸和一个尚未被鉴定的大分子的共同参与下,对前体肽中的8个Ser/Thr残留物进行脱水反应。在此过程中丝氨酸和苏氨酸的羟基首先被转化为谷氨酰酯,然后发生消除反应,形成碳-碳双键。短暂的谷氨酰化构成了一个新的肽或蛋白质的翻译后修饰反应类型。此前已知的苏氨酸谷氨酰化的例子不是出现在肽类或蛋白质底物上,而是分别出现在谷氨酰胺和谷胱甘肽的水解反应中,作为催化酰基酶的谷氨酰胺酶-天冬酰胺酶和γ-谷氨酰转肽酶的中间代谢产物。目前尚不清楚羊毛硫菌素前体的谷氨酰化到底涉及谷氨酸的α-还是γ-羧基。
参与Nisin生物合成的环化酶nisC的催化半胱氨酸的巯基加成形成Dha和Dhb,通过光谱分析和晶体结构鉴定了这个酶具有一个Zn2+结合位点。与其他激活巯基亲核的酶类似,如法尼基转移酶,Zn2+离子被认为是可激活底物肽中半胱氨酸巯基。NisC不仅与法尼基转移酶的催化机理相似,而且在结构上也与其具有同源性,具有相同一个α,α-桶状环形折叠,Zn2+离子位于桶状结构的顶部。有趣的是,LanB酶与其他预测的脱水酶没有同源性,而LanC样蛋白广泛地在多种高等生物中,包括植物、昆虫和哺乳动物中被发现,且功能未知。
羊毛硫肽生物合成酶最具挑战性的任务是控制着产物环的拓扑结构。从结构上可以看出,目前已知的羊毛硫肽的一小部分,中每个环化酶产生一系列不同序列和大小的环结构。如Nisin,脱水底物肽含有5个半胱氨酸和8个脱水氨基酸,按照上述想法,如果缺乏选择性,环化过程中产生的环拓扑异构体可达6720种。如果同时考虑所有可能形成的立体异构体,这个数字至少是8.6×105。然而,nisC只产生其中的一个结构产物。环化酶是如何实现这些壮举,对于化学家来说,这仍然是一个悬而未决的问题,但一些观点最近开始出现了。一种可能性是完全脱水的中间产物实际上是永远不会形成的。例如,可能是脱水酶和环化酶交替修饰底物肽,以致于环化作用在所有脱水反应发生之前就开始了。这种设想会减少半胱氨酸识别的亲电体的数量。
7 依赖于细胞密度的调节方式
许多革兰氏阳性菌产生的抗菌肽是以依赖于细胞密度的方式调节的。生产这些抗菌肽通常在对数生长期的中期和末期开始产生,在稳定期的初期达到最大值。在许多情况下,这种调节模式涉及到了扮演信息分子(肽信息素)的分泌肽。这些肽信息素在生长过程中会在环境中积累,当达到一定的阈值浓度时,由肽信息素与其同源受体(组氨酸激酶传感蛋白)的相互作用而介导抗菌肽被大量产生,组氨酸激酶传感蛋白可引起跨膜信号传导,激活抗菌肽的产生。这种调节模式归为革兰氏阳性菌肽信息素介导的菌群效应系统中的抗菌肽产生系统。这些系统涉及到了多种表型的细胞密度依赖的调节。
很明显,控制在高细胞密度下产生抗菌肽在生物学上是有意义的。这种调节机制确保了环境中的抗菌肽迅速达到所需的水平杀死产抗细胞的竞争对手。此外,在较高的细胞密度下大量产生AMP,产抗细胞不允许目标微生物启动或形成防御反应,从而确保抗菌肽的有效性。或者,我们可以推理:当在诱导物迅速扩散到细胞环境中的生长条件下,产抗细胞为避免无效、高水平抗菌肽的产生,从而防止这种诱导物积累到触发生产抗菌肽所需的水平。
修饰和分泌组分已被证实与Nisin前体存在互相作用,一起组装成多聚蛋白质复合物。值得注意的是,Nisin基因簇还编码一种胞外蛋白酶(nisP),它参与了Nisin前体前导肽的去除,生成成熟的Nisin分子。基因簇还包含编码EnvZ-OmpR类型的双组分调节系统,由传感激酶(nisK)和一个应答调控子(nisR),参与nis基因的转录调控。对数生长期中期可检测到Nisin的产生,在稳定期开始时达到最大水平。
8 nis基因的转录调控
观察到的Nisin细胞密度依赖性生产揭露了其在转录水平受到调控。Nisin的生物合成基因簇包含几个转录单位。结构nisA基因作为单顺反子mRNA高水平转录,而包含nisABTCIP的多顺反子mRNA的一部分,却以较低的水平转录。
这些mRNA均由位于nisA上游的单个启动子控制,这些转录单位的差异表达可能是由nisA基因下游的一个终止子序列引起的、允许下游基因(nisBTCIP)的有限读取。
另两个Nisin基因簇中的转录单位分别包含nisRK和nisFEG,其转录取决于在nisR和nisF上游的启动子。不过,也有报道称nisRKmRNA也存在于源自nisA启动子的、含有nisABCTIPRK的多顺反子mRNA中。
很明显,调节基因nisRK编码的产物对于Nisin生物合成调控是必需的。然而它们的功能持续几年时间是未知的,直到对Nisin的产生菌乳酸乳杆菌的结构基因nisA进行4个碱基对的缺失试验才回答了这个问题。这种突变不仅导致预料中的Nisin生产能力丧失,而且完全废除了nisA基因转录。通过向培养物中添加亚抑制量的Nisin即可恢复ΔnisA的转录,因此可以得出结论,Nisin不仅具有抗菌活性,而且还是信号分子。有趣的是,有几个Nisin变种似乎或多或少具有诱导肽的潜力,而它们的抗菌活性与野生型Nisin相比,并不是成比例的增加或减少,这说明这两种活性不一定相关。此外,ΔnisA突变株中缺失nisR和/或nisK,就丧失了nisA激活ΔnisA转录的能力,这说明nisA介导的对其编码基因转录激活作用与由nisR和nisK组成的两组分调控系统信号转导有关。这些数据证实除了抗菌肽的活性,Nisin也作为分泌肽信息素,通过菌群效应样的方式,触发相应的信号转导系统,诱导自身的生物合成。
9 nis的启动子
通过引物延伸,以及与大肠杆菌中无启动子的β-葡萄糖醛酸酶基因(gusA)在启动子探针载体pNZ273上进行转录融合,鉴定了Nisin基因簇中的3个启动子。为nisA和nisF启动子驱动的转录,是被Nisin介导的、依赖nisRK的信号传导所触发。而nisR启动子显示不依赖Nisin、具有组成性特征。nisA和nisF启动子活力水平是直接依赖于胞外添加Nisin的浓度,表明诱导剂(Nisin)浓度和由此产生的转录水平之间存在线性剂量反应关系。源自nisA启动子的两个转录拷贝(单独的nisA和nisABTCIP)的相对产量可能维持一个均衡的水平,即Nisin前体相对于其后修饰、运输、加工(nisB、C、T和P),还有免疫组分(nisI)之间的均衡。观察到Nisin介导的nisF启动子的调控,即当细胞遭受较高浓度Nisin时,提供更高的免疫力这一实验现象,为说明nisFEG基因产物在自身细胞对Nisin的免疫中的角色提供了合理的依据。nisRK的组成型表达可能是细胞对Nisin存在的快速反应所必需的,包括免疫反应的快速构建。此外,在Nisin存在的情况下,nisRK表达(作为nisABCTIPRK转录的一部分)的加强甚至可能进一步放大Nisin触发的反应。
10 对Nisin的免疫和耐受[19]
3种重要的表型可导致对细菌素不敏感:免疫与细菌素的产生有遗传上的联系,并发挥最强水平的非敏感性;在细菌素选择性压力下产生、自发突变株的耐受;耐受是由一种与细菌素产生没有遗传联系的基因赋予的。所有对细菌素产生耐受的原因,无非就是以上3个。
Nisin的免疫遗传决定因素被认为是nisI。完整的Nis蛋白与其他蛋白没有同源性,但其N-端与源自革兰氏阴性菌——大肠杆菌、革兰氏阳性菌——枯草芽孢杆菌和乳酸杆菌中的脂肽的信号肽序列有很强的相似性。细菌脂蛋白是一类由脂质部分连接的、锚定在细胞或细胞表面的跨膜蛋白。脂质部分共价连接到位于分泌蛋白N末端的半胱氨酸残基。nisI也具有以上结构,被发现定位于细胞膜外的膜结合脂蛋白。nisI蛋白所赋予的免疫机制仍然是推测的。当脂质部分附着在细胞膜的外部时,脂蛋白nisI可能通过直接与胞外Nisin相互作用或通过干扰Nisin聚集体的结合,从而阻止了通道的形成。
另外,nisE和nisG蛋白具有疏水性的6个跨膜结构域。nisF组分包含两个潜在的ATP结合位点。疏水性的nisF和nisE可形成了一个复合体。因此,有人认为,nisF和nisE构成一个ATP依赖转运体中的跨膜和ATP结合域。nisG与大肠杆菌素免疫蛋白具有同源性,可能具有类似的功能——对Nisin免疫。
11 Nisin前体的分泌和蛋白水解激活以及前导肽的角色
nisP蛋白含一段N端信号序列,一个丝氨酸蛋白酶催化结构域以及羧端膜锚。其结构特征说明分泌后锚定在膜上形成定位在胞外、催化活性的N-末端尾部。没有活性的Nisin前体可被表达nisP蛋白菌株的细胞膜所激活,而且nisP突变株分泌完全修饰但没有后加工的Nisin前体,表明活性功能蛋白——nisP位于细胞膜上,参与Nisin的成熟。
nisT基因编码一个600个残基的蛋白质,与ABC转运蛋白有很强的同源性。ABC转运蛋白有两个主要的同源区域,C-端ATP结合基序和N-端的6个跨膜域。这些数据表明蛋白水解是发生在细胞质膜的外膜面,随后分泌。
细菌素先导肽不同于介导由sec依赖途径分泌蛋白外排的N端信号序列,因为N端信号序列缺乏10个或更多残基的疏水跨膜拉伸和典型的蛋白水解加工位点。Nisin前导肽含有保守的残基,如位置-2处的脯氨酸残基,位置-6处的丝氨酸残基和所谓的-F-N-L-D-V-box。定点突变表明,非常保守的脯氨酸残基并不是加工所必需的,但位置-1处的正电荷和位置-4处的小疏水残基是必需的。在-F-N-L-D-V-box中的苯丙氨酸、亮氨酸或天冬氨酸残基或-6位的丝氨酸残基的突变阻止了Nisin的生物合成,甚至不能检测到前体。迄今为止取得的成果即利用定点突变清楚地证明了先导肽中特殊残基对于Nisin生物合成的重要性。同时,还有证据表明酶解加工是Nisin成熟的最后一步,所以修饰反应发生在前肽阶段,前体分子是没有活性的。因此,前导肽可能在生物合成中的作用,要么是因为它可能包含一个特定的识别基序,可使前体定位于生物合成酶;要么先导肽可与前肽区相互作用以稳定构象,此构象对于正确的修饰至关重要。
12 Nisin成熟的概念模型[20]
因此,结合上述调查结果可得出以下Nisin生物合成的假设模型。
第一步,诱导信号通过双组分信号通路激活负责表达Nisin操纵子的启动子。产抗和免疫已经证明可自动调节。
第二步,翻译生成无活性、未修饰的前体肽。前体含有游离半胱氨酸和未脱水残基。
第三步,Nisin前体分子借助于先导肽、定位到膜连的修饰酶nisB和nisC复合体上。
第四步,脱水以及羊毛硫氨酸和甲基羊毛硫氨酸的形成。
第五步,胞外加工与分泌。Nisin前体被细胞外蛋白酶nisP激活,而nisP通过脂肪酰膜锚勾住细胞膜。分泌后活性Nisin就释放到环境中去。
13 展望
乳酸链球菌素作为天然防腐剂在食品工业中广泛地得到应用。本文对Nisin的生物合成机理等方面进行综述,希望为国内广大研究者在发现新的细菌素方面提供一些思路。
