凯里白酸汤乳酸菌的分离鉴定及菌种性能测定
2022-12-05赵承鑫李艾蒙杨小云田其明钟定江贾利蓉
赵承鑫,李艾蒙,杨小云,田其明,钟定江,贾利蓉*
(1.四川大学 轻工科学与工程学院,成都 610065;2.麻江县明洋食品有限公司,贵州 凯里 556000)
白酸汤起源于贵州省黔东南苗族侗族自治州,是一种以米汤为原料的发酵调味品,富含以乳酸为主的多种有机酸[1],因其滋味爽口且益于健康而深受当地人们喜爱。白酸汤具有增进食欲、清热解暑、助消化、维持肠道稳态、抗氧化、防衰老、抑菌消炎等多种保健功能[2]。白酸汤发酵的主要功能菌种是乳酸菌,其发酵过程中产生的各类有机酸、氨基酸等代谢产物能够赋予酸汤独特的风味[3]。研究显示,人体摄入的大部分乳酸菌在通过消化道进入肠道之前, 会因不耐受胃酸环境而死亡,只有少数耐酸性乳酸菌能够通过胃酸屏障。乳酸菌要发挥益生作用就需要顺利通过胃液进入肠道,并在肠道定植后达到一定的数量[4-5],故乳酸菌食品的益生功效与其能否适应胃肠道的低酸性环境和高胆盐浓度有关。
目前国内对于贵州凯里白酸汤的研究大多侧重于其营养物质[6]、风味成分[7]、工艺优化[8-9]、微生物区系以及微生物对酸汤品质的影响[10-12]等,对酸汤源乳酸菌的研究较少。对乳酸菌胃肠道耐受性的研究主要集中于酸菜源乳酸菌[13-14]、泡菜源乳酸菌[15-16]耐酸性测定,而对白酸汤源乳酸菌产酸能力和耐酸性的相关研究尚未见报道。本试验旨在从贵州凯里白酸汤中分离菌株,为白酸汤中乳酸菌的进一步研究和利用奠定基础。
1 材料和方法
1.1 材料
凯里白酸汤:贵州凯里麻江县明洋食品有限公司。
1.2 试剂
MRS固体培养基、MRS肉汤培养基(均为生物试剂):青岛高科技工业园区海博生物技术有限公司;平板计数琼脂(生物试剂):上海博微生物科技有限公司;氯化钠(分析纯):天津市东丽区天大化学试剂厂;碳酸钙、盐酸(均为分析纯):成都科隆化学品有限公司;胃蛋白酶(分析纯):上海泰坦科技股份有限公司。
1.3 主要仪器与设备
电热式压力蒸汽灭菌锅 浙江新丰医疗器械有限公司;SPX-150B III生化培养箱 天津市泰斯特仪器有限公司;DW-2菌落计数器 杭州大微生物技术有限公司;H2-16KR台式高速冷冻离心机 湖南可成仪器设备有限公司;pH计 上海康仪仪器有限公司。
1.4 实验方法
1.4.1 白酸汤样品中乳酸菌的分离纯化
从发酵时间为3,6,7,8,10 d的白酸汤样品中各取1 mL,用8.5 g/L的生理盐水稀释至10-7,各吸取0.5 mL稀释液接种于含碳酸钙的MRS固体培养基上,于37 ℃下培养48 h,不同发酵时间分别做2个平行。观察菌落形态,选取呈圆形、表面微白色、湿润、边缘整齐、溶钙圈较大的菌落,挑取单菌落在MRS平板上反复划线3~4次,直至获得21个纯菌落平板。并将纯化后的菌株于4 ℃保藏。
1.4.2 菌种鉴定
分别从上述纯菌落平板上挑取21个单菌落,接种培养于含有10 mL葡萄糖蛋白胨液体培养基的无菌离心管中,于37 ℃下培养24 h,不同纯菌落各做2个平行,分别标记为L(单数,用作正式样品)、M(双数,用作备份样品)。离心管用蒸馏水配平,在8000 r/min的转速下离心12 min,弃去上清液,获得菌体沉淀。使用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和142R(5′-GGTTACCTTGTTACGACTT-3′)对细菌进行16S rRNA 基因区域扩增,20 μL PCR 体系包括2 μL 10×Ex Taq buffer, 0.2 μL 5u Ex Taq, 1.6 μL 2.5 mmol/L dNTP Mix,1 μL 5p Primer 1,1 μL 5p Primer 2, 0.5 μL DNA 模板,补 ddH2O 至 20 μL;扩增参数:95 ℃预变性 5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸90 s,循环25次;72 ℃延伸10 min;使用 2%琼脂糖凝胶电泳检测 PCR扩增产物,纯化回收,送至上海美吉生物医药科技有限公司进行Sanger测序,利用Sanger测序获得的两端raw sequence分别进行质控,去除低质量的碱基,获得clean sequence后进行拼接,获得组装序列,与NT数据库Blast获得物种相似度前十的物种信息,并且选择相似度最高的比对物种作为菌鉴的结果,以鉴定到种。
1.4.3 菌种活化扩增及菌悬液制备
从已鉴定出的纯菌种中抽选3株不同菌种菌株,分别接种到含有15 mL MRS肉汤掊养基的无菌离心管中,36 ℃下培养24 h。离心管用无菌水配平,在6000 r/min的转速下离心8 min,弃去上清液后用无菌生理盐水洗涤,并稀释至15 mL,备用。将上述菌液各取1 mL稀释至10-7,10-8,10-9后涂布于平板计数琼脂上,设置一组平行及空白,同时将菌液密封,放入4 ℃环境中抑制其继续增殖;将平板放入36 ℃培养箱中培养48 h后取出读数。根据活菌计数结果,用无菌生理盐水将3株菌稀释至1.00×109CFU/mL,制成菌悬液备用。
1.4.4 不同种乳酸菌的产酸能力测定
取1 mL菌悬液按表1方式接种,空白组接入1 mL无菌生理盐水,于36 ℃培养箱中培养,并控制培养相应时间[17],发酵液总酸度的测定参考GB 12456-2021中的酸碱指示剂滴定法对样品进行测定。
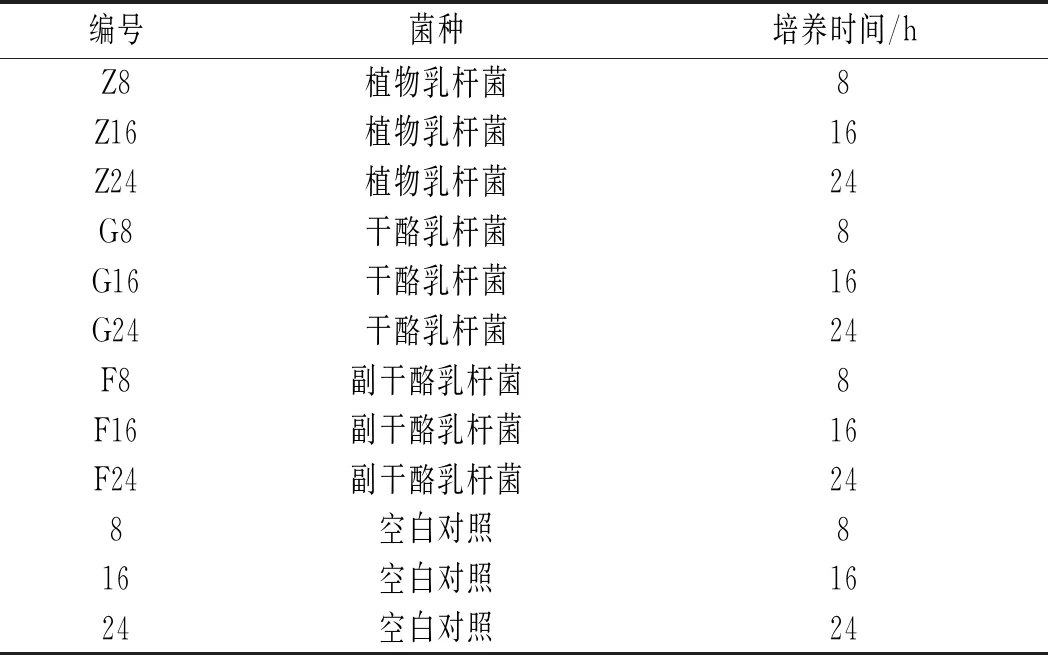
表1 接种方式Table 1 Inoculation methods
1.4.5 不同种乳酸菌的耐酸性测定
用蒸馏水稀释盐酸,分别调节pH值至1.5,2.5,按照1∶100(g/mL)的比例加入胃蛋白酶,充分溶解后用0.20 μm的微孔滤膜过滤。吸取1 mL制备好的菌悬液于9 mL人工胃液中,另取1 mL菌悬液于9 mL蒸馏水中作为对照,混匀后在36 ℃下培养,采用平板涂布计数法,选取合适的稀释梯度分别测定1,2,3 h时的活菌数,每个时间段做两组平行,取平均值。对照组仅测定0 h时即初始的活菌数。按下式计算乳酸菌存活率:
式中:S表示存活率,%;N1表示胃酸处理3 h后的最终活菌数,CFU/mL;N2表示胃酸处理0 h时的活菌数,CFU/mL。
1.4.6 数据处理
实验结果以平均值表示,并采用SPSS 22.0数据软件和OriginPro 2021进行统计分析和作图。
2 结果与分析
2.1 分子生物学鉴定
经鉴定获得7株纯菌株,Blast的比对结果见表2。

表2 7株分离乳酸菌的Sanger测序分析结果Table 2 Sanger sequencing analysis results of seven strains of isolated lactic acid bacteria
由表2可知,根据同源性比对,可判定菌株L7、L9、L15、L19、L29均属于副干酪乳杆菌,菌株L17属于干酪乳杆菌,菌株L31属于植物乳杆菌。后续选择表2中同源性最高的L7(Lactobacillusparacasei)、L17(Lactobacilluscasei)、L31(Lactobacillusplantarum)3株菌进行扩增并进行产酸能力及酸耐受性测定实验。
2.2 白酸汤中不同种乳酸菌的产酸能力测定
产酸能力是乳酸菌的一个主要特征,产酸机制日益受到重视[18]。乳酸菌通过代谢产生乳酸、乙酸、琥珀酸和柠檬酸等有机酸,这些有机酸既能帮助调节肠道pH及菌群平衡、抑制肠道病原菌[19],同时也能提高肠胃中酶的活力,帮助吸收营养物质,调节肠道功能[20]。因此,在实际的工业生产中,产酸能力强的乳酸菌往往具有更高的应用价值。3株乳酸菌发酵不同时间,发酵液的总酸度见表3。
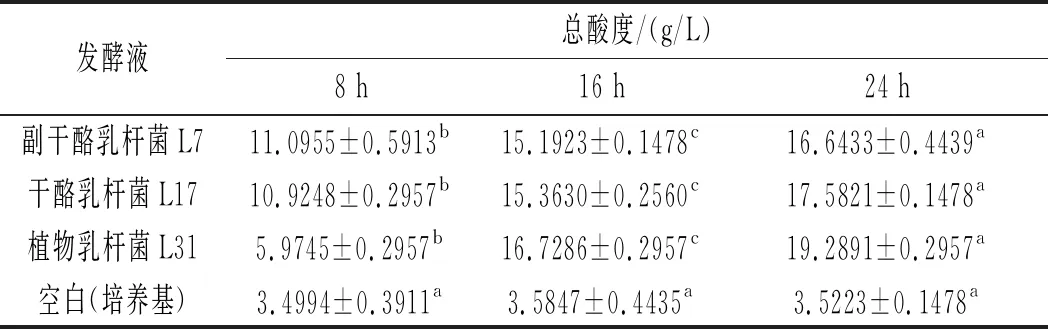
表3 3株乳酸菌发酵液总酸度Table 3 Total acidity of fermentation broth of three strains of lactic acid bacteria
由表3可知,3株菌在培养阶段总酸度不断增加,产酸显著,空白组酸度波动较小,证明培养过程没有受到杂菌影响。0~8 h副干酪乳杆菌L7和干酪乳杆菌L17酸度增长迅速,8~16 h增速减缓,16~24 h趋于平稳;植物乳杆菌L31在0~8 h产酸量少,8~16 h产酸迅速,16~24 h趋于平稳。在0~24 h培养过程中,培养时间对菌液总酸度有显著影响(p<0.05)。
以发酵液总酸度减去空白组培养基的酸度,算作菌株的产酸量,3株菌在不同时间段的产酸量比较见图1。将数据进行以菌种为变量的单因素显著性差异分析,以检验不同菌种在同一时间的产酸量是否存在差异。

图1 不同菌株产酸能力Fig.1 Acid-production capacity of different strains
将产酸阶段分为0~8 h,8~16 h,16~24 h,每个阶段3株菌的产酸速率见图2。将数据进行以菌株为变量的单因素显著性差异分析,以检验不同菌株在同一时间段的产酸速率是否存在差异。
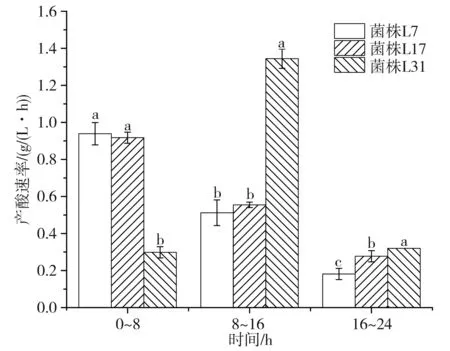
图2 不同菌株产酸速率对比图Fig.2 Comparison of acid-production rates of different strains
由图1和图2可知,3株菌在培养过程中持续产酸,且在24 h培养结束后,还有产酸趋势;其中副干酪乳杆菌L7和干酪乳杆菌L17产酸速率和产酸量相近,在培养前8 h产酸最快,8~16 h速率几乎减半,16~24 h速率显著降低并趋于平衡;而植物乳杆菌L31则在0~8 h产酸速率较低,8~16 h产酸最为迅速,产酸量也反超副干酪乳杆菌L7和干酪乳杆菌L17,在16~24 h阶段速率降低并趋于平衡;植物乳杆菌L31的最大产酸速率及产酸量均大于另外两株菌。以菌种为变量分别对产酸量及产酸速率进行显著性差异分析,得出结果:菌株的差异会对产酸量及产酸速率产生影响。植物乳杆菌L31的产酸特性与干酪乳杆菌L17、副干酪乳杆菌L7存在显著差异;干酪乳杆菌L17与副干酪乳杆菌L7产酸特性相近。干酪乳杆菌L17和副干酪乳杆菌L7产酸主要集中在前8 h,而植物乳杆菌L31在8~16 h有突出的产酸优势。总体产酸效果:植物乳杆菌L31>干酪乳杆菌L17>副干酪乳杆菌L7。
2.3 白酸汤中不同种乳酸菌的耐酸性测定
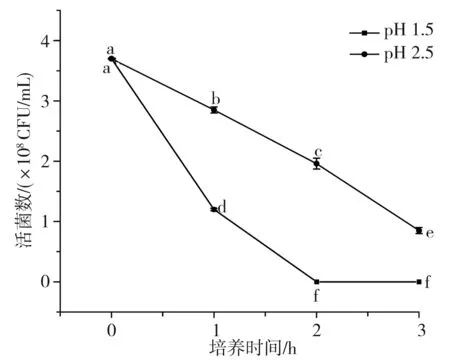
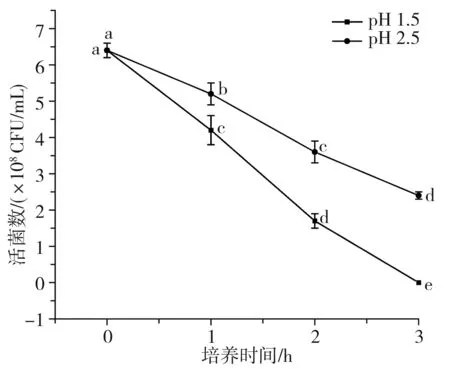
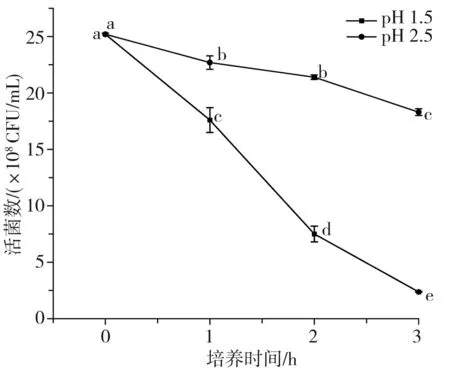
酸汤发酵过程中pH值在3.0~4.0之间波动,人体胃液中胃酸的主要成分为盐酸,纯胃酸的pH值约为0.9,正常胃液的pH值为2.0~3.5[21],进食后胃液会被稀释,pH值甚至上升至3.5[22],比酸汤发酵的酸度更低。因此,仅少数具有良好耐酸能力的乳酸菌可以通过胃酸屏障。已知乳酸菌的耐酸机制有许多种,主要包括酸耐受反应机制、质子泵理论等[23]。由于食物在胃中通过的时间一般低于3 h,液体食物通过的时间更短,因此耐酸性试验选择1.5,2.5这2个pH值下培养试验菌3 h,于10-7,10-8两个稀释梯度下观察其存活情况。
乳酸菌耐酸性测定试验中,存活情况见表4。
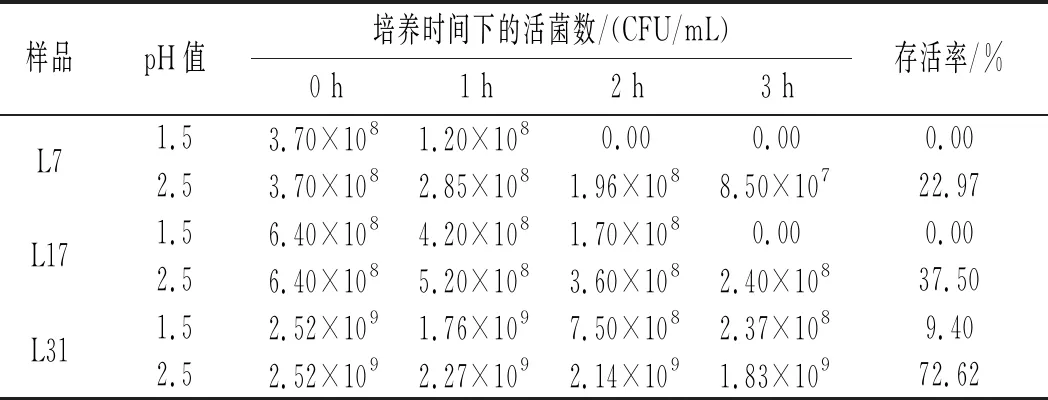
表4 白酸汤中乳酸菌在人工胃液条件下的存活率Table 4 Survival rates of lactic acid bacteria in rice sour soup under the condition of artificial gastric juice
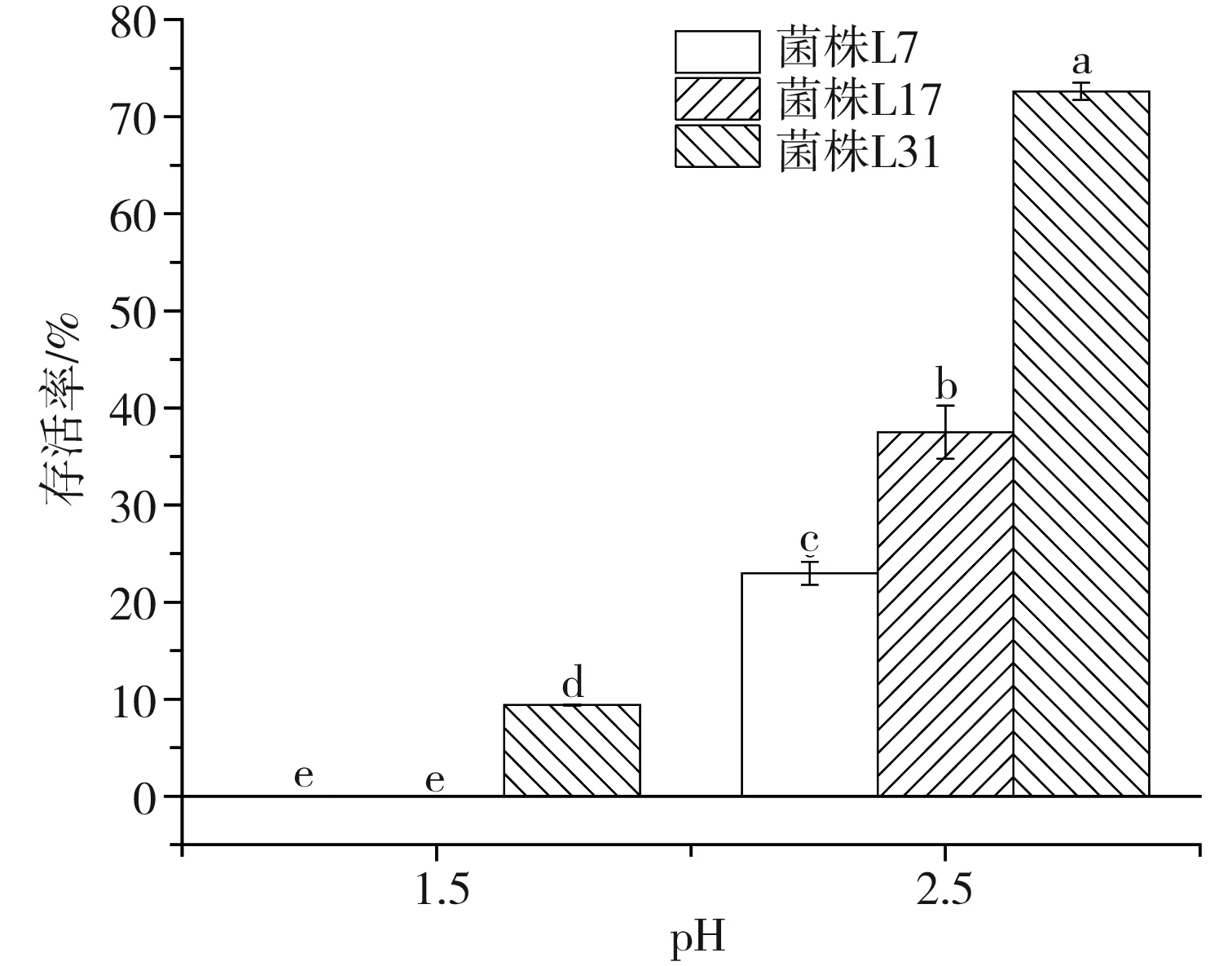
将数据进行以pH为变量的单因素显著性差异分析,以检验同一菌株相同培养时间但不同pH下的存活状态差异,各试验菌株在人工胃液中的存活情况见图3中A~C,图中不同字母表示差异性显著(p<0.05)。将数据进行以菌株为变量的单因素显著性差异分析,以检验不同菌株同一pH下培养3 h后的存活率差异,见图3中D。
A
B
C
D
由表4和图3可知,3株乳酸菌对人工胃液表现出了不同程度的耐受能力,且同一菌株相同pH条件下的初始菌落数和最终菌落数差异性显著(p<0.05),同一菌株相同时间不同pH条件下的活菌数差异也较大,不同菌株相同pH条件下的最终存活率也有一定差异,说明菌种或菌株的不同、生存环境的变化都会对其酸耐受性造成影响。总体上活菌数都随着培养时间的延长和pH的降低而逐渐减少,说明胃液会对乳酸菌造成一定程度的影响。副干酪乳杆菌L7和干酪乳杆菌L17在pH为1.5的人工胃液中培养3 h后存活率为0,菌株L7、L17在pH 2.5的条件下培养3 h后存活率分别为22.97%、37.50%,存活率较低,说明这两株菌对恶劣酸性环境的耐受性较差,其中菌株L7的酸耐受性能最差。植物乳杆菌L31在pH 1.5的人工胃液中培养3 h后存活率仅为9.40%,但在pH 2.5的条件下培养3 h后存活率高达72.62%,说明该菌株的耐酸性较前两者更强,但同样较难在极端酸性条件下生存。温贺等[24]测定了1株酸菜源植物乳杆菌在pH 3.0条件下的存活率为55%,由此可见,本实验的植物乳杆菌L31菌株耐酸能力更强。比较3株乳酸菌的产酸能力和耐酸性,植物乳杆菌L31的产酸能力和耐酸性都强于其他两株菌(L7、L17),由此可见,耐酸能力强的菌株其产酸能力也较强,这与白友菊[25]研究得出的结论相似。3株菌在pH 2.5条件下,3 h后活菌数都保持在107CFU/mL以上,而乳酸菌发挥益生作用的最低活菌数目为106CFU/mL,这说明当摄入数量级为108CFU/mL的酸汤源乳酸菌时,3株乳酸菌均能够通过非空腹情况下的胃酸屏障并有机会在胃肠道中存活并发挥益生作用。
3 结论
本试验从贵州凯里白酸汤中分离提纯出7株乳酸菌,通过Sanger测序鉴定出5株副干酪乳杆菌、1株干酪乳杆菌以及1株植物乳杆菌,对其中3株不同种的乳酸菌(副干酪乳杆菌L7、干酪乳杆菌L17、植物乳杆菌L31)进行产酸能力和耐酸性测定,3株菌均具有良好的产酸能力,其中植物乳杆菌L31的产酸能力最强,且产酸时间点集中;而副干酪乳杆菌L7和干酪乳杆菌L17的产酸量及产酸速率相近,产酸时间长,更易控制产酸进度。3株不同种的乳酸菌的耐酸性测定实验表明,在正常胃液酸度pH 2.5下,3株菌均能存活且有几率进入肠道发挥益生作用,其中酸耐受性强弱顺序为植物乳杆菌L31>干酪乳杆菌L17>副干酪乳杆菌L7;而在空腹胃液酸度pH 1.5下,仅菌株L31能够存活,且存活率较低,但依然能够达到乳酸菌发挥益生作用的最低活菌数目,反映出植物乳杆菌L31具有较好的酸耐受性,有进一步开发的价值。本研究为白酸汤中乳酸菌的开发和利用奠定了理论基础。
