水蛭冻干粉对糖尿病肾病大鼠瘀血阻络证相关指标的干预作用
2022-12-05李雅纯陈志强
杨 帆, 李雅纯, 郭 帅, 陈志强,2*
(1.河北中医学院,河北 石家庄 050091;2.河北省中医院,河北 石家庄 050011)
糖尿病肾病是糖尿病最常见的微血管病并发症之一,其发病率正逐年上升,据国外报道,20%~40%的糖尿病患者合并糖尿病肾病[1-2]。而我国糖尿病肾病导致终末期肾病的比例也日渐增加,现已成为中老年人终末期肾病的首要原因[3]。
中医学认为瘀血阻滞肾脏络脉是糖尿病肾病的主要病机之一[4]。因此,化瘀通络、消除络脉瘀血是治疗糖尿病肾病之关键。然而络病之瘀多病根深伏,病情顽缠,属沉疴痼疾,非一般草木之品所能取效,必藉以虫类药搜邪剔络,因虫类之品为血肉之质,又有动跃攻冲之性,体阴用阳,能深入隧络,直达病所,攻剔痼结之瘀痰,旋转阳动之气,从而使络痹易开,结邪易去。为此,本实验选择了“在破血药中功列第一,只破瘀血而不伤新血”的水蛭作为研究对象。课题组前期研究已经证实了糖尿病肾病大鼠瘀血阻络证的存在[5],故本实验以此大鼠模型为基础,通过灌胃给予水蛭冻干粉,观察其对糖尿病肾病大鼠瘀血阻络证相关指标的干预作用。
1 材料
1.1 动物 48只雄性SD大鼠,SPF级,体质量60~80 g,4~5周龄,由北京维通利华实验动物技术有限公司提供,实验动物许可证号SCXK(京)2016-0006。大鼠在温度(24±1)℃,相对湿度50%~70%条件下,给予普通饲料,适应性饲养1周后开始实验。
1.2 试剂与药物 水蛭冻干粉(批号Z10970056),购自重庆多普泰制药股份有限公司,每1克水蛭冻干粉相当于56个抗凝血酶活性单位。链脲佐菌素(STZ,批号04081408),购自美国Enzo Life Sciences公司;大鼠尿蛋白定量测试盒(批号C035-2-1),购自南京建成生物工程研究所;大鼠纤维蛋白原(vWF)ELISA试剂盒(批号F1713),购自上海西唐生物科技有限公司;大鼠P选择素ELISA试剂盒(批号SXR058),购自上海森雄科技实业有限公司;高脂饲料(蛋白质24.2%,碳水化合物42.1%,脂肪25.4%,总热量比4.7 kcal/g)、普通饲料(蛋白质21.1%,碳水化合物60.6%,脂肪4.5%,总热量比3.6 kcal/g),购自北京博泰宏达生物技术有限公司。
1.3 仪器 DT-2000型电子天平(常熟双杰测试仪器厂);大鼠代谢笼(上海科端生物科技有限公司);稳豪型血糖仪[强生(中国)有限公司];全自动血细胞分析仪(日本Sysmex公司);ACLTOP700型凝血分析仪(美国Beckman公司);7600-020型全自动大型生化分析仪(日本日立公司);全自动血液流变仪(上海寰熙医疗器械有限公司);MICROM-340E型石蜡切片机(德国Zeiss公司);TEC-2800自型动组织包埋机(上海精密仪器仪表有限公司);全自动酶标仪(美国BioTek公司);BX63+DP72型正置研究级显微镜(日本Olympus公司)。
2 方法
2.1 模型建立 采用随机数字表法随机选取8只大鼠作为正常组,给予普通饲料喂养,其余40只大鼠给予高脂饲料喂养6周后禁食不禁水12 h,腹腔注射1%新鲜配制的STZ溶液(35 mg/kg),正常组大鼠腹腔注射等体积溶媒(0.1 mmol/L柠檬酸缓冲液,pH 4.3),72 h后尾静脉取血测量血糖值,随机血糖≥16.7 mmol/L视为糖尿病造模成功[6]。其中血糖不达标者1只,死亡2只,予以剔除。
2.2 分组及给药 将造模成功的大鼠随机分为模型组(10只),水蛭冻干粉低、中、高剂量组(各9只),造模成功后随即给予药物干预,其中水蛭冻干粉低、中、高剂量组分别灌胃给予0.3、0.6、1.2 g/kg水蛭冻干粉[7-8],正常组及模型组灌胃给予等量饮用水,连续给药16周。
2.3 标本收集 大鼠于注射STZ后第3天及药物干预第4、8、12、16周放入代谢笼,自由饮食,留取24 h尿液,并计录各组大鼠体质量、饮水量、尿量。水蛭冻干粉干预16周后,所有大鼠禁食不禁水12 h,腹腔注射10%水合氯醛(0.3 mL/100 g)深度麻醉,仰卧位固定后,股主动脉穿刺取血待测。剖开腹腔,快速取出大鼠肾脏,剥去被膜,称定质量,留取部分肾皮质于4%中性甲醛溶液中固定,用于组织染色及病理观察。
2.4 检测指标
2.4.1 一般情况 观察各组大鼠注射STZ后第3天及药物干预第4、8、12、16周体质量、饮水量、尿量变化情况。
2.4.2 24 h尿蛋白定量 将大鼠尿液于4 ℃、3 500 r/min条件下离心10 min,取上清,按照尿蛋白定量试剂盒说明检测尿蛋白水平,根据大鼠24 h尿量计算24 h尿蛋白定量。
2.4.3 肾脏指数 水合氯醛腹腔注射麻醉大鼠后称定各组大鼠体质量,剖开腹腔快速剥离肾脏被膜,冰冷的生理盐水冲洗后,称定右肾质量,计算肾脏指数。
2.4.4 肾功能、血脂水平 采用全自动大型生化分析仪检测血清尿素氮(BUN)、血肌酐(Scr)、尿酸(UA)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)水平;采用凝血分析仪检测血浆凝血酶原时间(PT)、国际标准化比值(INR)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、血浆纤维蛋白原(Fib)、抗凝血酶Ⅲ(AT-Ⅲ)水平。
2.4.5 血液流变学 将部分血液注入含肝素抗凝剂试管,使血液和抗凝剂混匀,采用全自动血液流变分析仪检测大鼠血液流变学变化。
2.4.6 血浆可溶性P选择素、vWF水平 将部分血液于4 ℃、1 500 r/min条件下离心10 min,分离得到血浆,采用双抗体夹心ABC-ELISA法检测各组大鼠血浆vWF、可溶性P选择素水平。
2.4.7 肾组织病理形态学 肾脏组织于4%多聚甲醛溶液中固定24 h,经脱水、石蜡包埋、切片(4 μm)后,分别用苏木精-伊红(HE)和Masson染色,通过光学显微镜以盲法进行肾组织的形态学评估,并应用Image-Pro Plus 6.0图像分析软件检测Masson染色的肾脏病理切片的胶原沉积量。
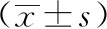
3 结果
3.1 水蛭冻干粉对大鼠一般情况的影响 正常组大鼠体质量增加,反应灵敏,活动自如,毛色光亮洁白;模型组大鼠出现多饮、多尿、多食,形体消瘦,反应迟钝,精神萎靡,毛色枯黄无光泽,并且部分大鼠出现脓疮、腹部包块等;水蛭冻干粉组上述情况有明显改善,体质量增加,活动量增加,毛色变白有光泽。在药物干预过程中模型组大鼠死亡3只,水蛭冻干粉低剂量组大鼠死亡2只,水蛭冻干粉中、高剂量组大鼠各死亡1只。
3.2 水蛭冻干粉对大鼠体质量的影响 STZ注射后3 d,各组大鼠体质量比较无明显变化(P>0.05);正常组大鼠体质量随时间增长逐步增加,与同时间点正常组比较,模型组大鼠体质量降低(P<0.01);与同时间点模型组比较,16周后水蛭冻干粉中、高剂量组大鼠体质量增加(P<0.05),而水蛭冻干粉低剂量组大鼠体质量有所增加,但差异无统计学意义(P>0.05),见表1。

表1 水蛭冻干粉对大鼠体质量的影响
3.3 水蛭冻干粉对大鼠饮水量的影响 与同时间点正常组比较,模型组大鼠饮水量增多(P<0.01);与同时间点模型组比较,12周后水蛭冻干粉中、高剂量组大鼠饮水量减少(P<0.05,P<0.01),16周低剂量组大鼠饮水量减少(P<0.05),见表2。
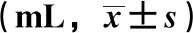
表2 水蛭冻干粉对大鼠饮水量的影响
3.4 水蛭冻干粉对大鼠尿量的影响 与同时间点正常组比较,模型组大鼠尿量增多(P<0.01);与同时间点模型组比较,12周后水蛭冻干粉中、高剂量组大鼠尿量减少(P<0.05,P<0.01),16周低剂量组大鼠尿量减少(P<0.05),见表3。
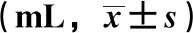
表3 水蛭冻干粉对大鼠尿量的影响
3.5 水蛭冻干粉对大鼠肾功能、24 h尿蛋白定量、肾脏指数的影响 与正常组比较,模型组大鼠BUN、Scr、UA水平,24 h尿蛋白定量,肾脏指数均升高(P<0.01);与模型组比较,水蛭冻干粉各剂量组BUN、Scr、UA水平,24 h尿蛋白定量,肾脏指数均呈剂量依赖性降低(P<0.05,P<0.01),见表4。

表4 水蛭冻干粉对大鼠肾功能、24 h尿蛋白定量、肾脏指数的影响
3.6 水蛭冻干粉对大鼠肾组织病理形态学的影响 如图1所示,正常组大鼠肾组织结构正常,无毛细血管腔扩张,无肾小球肥大或萎缩,基底膜无增厚,系膜细胞无增生,肾间质无炎性细胞浸润;模型组大鼠肾小球体积增大,肾小囊腔变窄,基底膜弥漫增厚,系膜基质增多,肾小管上皮肿胀,管腔狭窄,炎性细胞浸润,部分出现纤维化;与模型组比较,水蛭冻干粉各剂量组大鼠肾组织病理损伤均有一定程度减轻。如图2所示,与正常组比较,模型组大鼠胶原纤维沉积增加(P<0.01);与模型组比较,水蛭冻干粉各剂量组肾间质及肾小球胶原沉积减少(P<0.01)。
3.7 水蛭冻干粉对大鼠空腹血糖、血脂水平的影响 与正常组比较,模型组大鼠FBG、TC、TG、LDL-C水平均升高(P<0.01);与模型组比较,水蛭冻干粉各剂量组大鼠TC、TG、LDL-C水平降低(P<0.01),FBG水平略有下降,但差异无统计学意义(P>0.05);各组大鼠血清HDL-C水平比较差异无统计学意义(P>0.05),见表5。
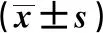
表5 水蛭冻干粉对大鼠空腹血糖、血脂水平的影响
3.8 水蛭冻干粉对大鼠血液流变学的影响 与正常组比较,模型组大鼠全血黏度(低切、中切、高切)、血浆黏度及红细胞聚集指数均升高(P<0.01);与模型组比较,水蛭冻干粉各剂量组大鼠全血黏度(低切、中切、高切)、血浆黏度及红细胞聚集指数水平均呈剂量依赖性降低(P<0.05,P<0.01),见表6。

表6 各组大鼠血液流变学的比较
3.9 水蛭冻干粉对大鼠凝血功能的影响 与正常组比较,模型组大鼠PT、APTT、FIB,AT-Ⅲ、INR水平均升高(P<0.01);与模型组比较,水蛭冻干粉各剂量组大鼠PT、APTT、FIB,AT-Ⅲ、INR水平均降低(P<0.05,P<0.01);各组大鼠血浆TT比较无差异(P>0.05),见表7。

表7 水蛭冻干粉对大鼠凝血功能的影响
3.10 水蛭冻干粉对大鼠血浆可溶性P选择素、vWF水平的影响 与正常组比较,模型组大鼠血浆可溶性P选择素、vWF水平升高(P<0.01);与模型组比较,水蛭冻干粉各剂量组大鼠血浆可溶性P选择素、vWF水平均降低(P<0.01),见表8。

表8 水蛭冻干粉对大鼠血浆可溶性P选择素、vWF水平的影响
4 讨论
糖尿病肾病病程绵长,迁延难愈,多为久病痼疾。久病多虚,久病入络,气虚无以推动血行形成瘀血导致肾络瘀阻。现代研究也证实,糖尿病肾病患者几乎100%存在瘀血的病理状态[9],且多存在糖脂代谢紊乱及凝血-纤溶系统紊乱[10],血液流变学和血流动力学的异常[11-12],内皮细胞功能障碍[13],血液理化性质的改变。鉴于“瘀血阻络”贯穿糖尿病肾病发生发展的始终[14-15],因此,化瘀通络、保持络脉气血通畅和肾络无损是治疗糖尿病肾病之关键。水蛭是常用的活血化瘀通络中药,主要含有蛋白质及多肽类分子等抗凝血成分,此外还包含一些小分子化合物和微量元素[16],其中水蛭素是迄今发现的最强的凝血酶特异性抑制剂[17]。
高血糖是糖尿病的主要特征,脂代谢异常是糖尿病的独立危险因素,而“脂质”具有“肾毒性”[18]。肾小球系膜细胞中存在低密度脂蛋白受体,当低密度脂蛋白与受体结合后可诱导系膜细胞增殖及基质沉积[19];同时低密度脂蛋白也可与肾小球基底膜上的负电荷相结合,使负电荷屏障破坏,从而增加了肾小球基底膜的通透性[20]。另外凝血指标的改变反映了血浆凝血酶及凝血因子活性增高,凝血酶能够明显促进肾小球系膜细胞和上皮细胞增殖[21],同时可导致血液流变学异常,而血液黏度增高可进一步干扰肾脏微循环,加重其缺血缺氧状态,继而通过提高基底膜通透性加重血浆蛋白漏出[22]。本研究结果显示,高脂饲料联合小剂量腹腔注射STZ复制的糖尿病肾病大鼠存在明显的糖脂质代谢紊乱、血液流变学及凝血-纤溶功能异常;水蛭冻干粉能改善大鼠血液流变学及凝血-纤溶功能异常,纠正脂代谢紊乱,但对血糖水平无明显影响。
长期的糖脂代谢紊乱可引起血小板功能异常、内皮损伤及功能障碍[23-24]。P选择素是细胞粘附分子选择素家族的主要成分,是反映血小板活化的金标准[25],与肾脏疾病关系密切[26]。高血糖能刺激血小板膜上高表达P选择素,介导血小板与内皮细胞、白细胞的粘附及微血管内血栓形成。vWF是反映内皮细胞损伤及功能障碍的敏感指标[27],当血管内皮细胞受损时,vWF向循环血液中释放增加并随血液沉积在肾小球基底膜上,同时内皮细胞表面vWF还可与血小板质膜上的受体结合,介导血小板粘附于内膜下基质,增加微血栓形成,而微血栓形成势必加剧血管内皮细胞的损伤。本研究结果显示,模型组大鼠血浆可溶性P选择素、vWF水平均升高;水蛭冻干粉干预后可溶性P选择素、vWF水平降低,表明水蛭冻干粉能抑制血小板活化,减轻内皮细胞损伤。
综上所述,水蛭冻干粉可通过纠正脂代谢紊乱、改善大鼠血液流变学及凝血-纤溶功能异常,抑制血小板过度活化,减轻内皮细胞损伤,进而改善大鼠多饮多尿多食症状,降低尿蛋白排泄,改善肾功能,减轻肾脏病理损伤,从而发挥肾脏保护作用。
