泽泻三萜对小鼠急性肺损伤的保护作用
2022-12-05黄小强李宣宣吴水生刘顺和
黄小强, 李宣宣, 吴水生, 刘顺和, 贾 安, 许 文*, 黄 涛*
(1.黄河科技学院医学院,河南 郑州 450063;2.福建中医药大学药学院,福建 福州 350122;3.郑州市第二人民医院,河南 郑州 450000)
急性肺损伤是由心肺功能衰竭、氧化应激和急性炎症性疾病引起的感染性低氧所致的危及生命的临床综合征[1-2],其特征包括毛细血管内皮细胞、肺泡上皮细胞受损和肺间质、肺血管及肺泡内中性粒细胞数量的增加、聚集。急性肺损伤发病机制复杂,发病率和死亡率一直居高不下[3]。近年来,急性肺损伤的治疗以通气或非通气为主,但是这2种策略疗效并不理想,因此,研制有效治疗急性肺损伤的新药具有重要意义。
泽泻是一种常用的中药材,为泽泻科植物东方泽泻Alismaorientale(Sam.)Juzep.或泽泻Alismaplantago-aquaticaLinn.的干燥块茎,其味甘、淡,性寒,具有利水渗湿、泄热、化浊降脂功效,泽泻三萜是其主要活性成分[4-5]。现代药理学研究表明,泽泻三萜具有广泛的药理作用,如抗炎[6]、抗氧化[7]等。课题组前期通过体内实验证实泽泻三萜对急性肺损伤具有一定的保护作用[8],本研究在此基础上,通过脂多糖(LPS)诱导建立小鼠急性肺损伤模型,探讨泽泻三萜对急性肺损伤的保护作用与其抗氧化、抗炎的相关性,并初步阐明其作用机制。
1 材料
1.1 仪器 多功能酶标仪(瑞士Tecan公司);光学显微镜、石蜡切片机(德国Leica公司);高速低温离心机(美国Thermo Fisher Scientific公司);多用途中草药粉碎机(天津市泰斯特仪器有限公司);电热恒温培养箱(上海一恒科技有限公司);万分之一电子天平[奥豪斯仪器(上海)有限公司];电泳仪、转膜仪、化学发光成像仪(美国Bio-Rad公司)。
1.2 试剂与药物 泽泻采收于福建省建瓯县,经福建中医药大学药学院吴水生教授鉴定为泽泻科泽泻属植物泽泻Alismaorientale(Sam.)Juzep.的干燥块茎。脂多糖(LPS,批号S11060)购自上海源叶生物科技有限公司;醋酸地塞米松片(Dex,批号1904091)购自郑州遂成药业股份有限公司;小鼠肿瘤坏死因子-ɑ(TNF-α,批号2005016)、小鼠白介素-1β(IL-1β,批号2008012)酶联免疫吸附剂检测试剂盒均购自上海西唐生物科技有限公司;丙二醛(MDA,批号190716)、总超氧化物歧化酶(SOD,批号190419)、还原型谷胱甘肽(GSH,批号190814)、谷胱甘肽过氧化物酶(GSH-Px,批号190724)、髓过氧化物酶(MPO,批号20200915)测试盒均购自南京建成生物工程研究所;兔抗转录因子NF-E2相关因子2(Nrf2,批号sc-722,1 000 μL/支)、兔抗血红素氧合酶1(HO-1,批号sc-1796,1 000 μL/支)、兔抗过氧化物酶体增殖物激活受体γ(PPARγ,批号sc-7273,1 000 μL/支)抗体均购自美国Santa Cruz公司;β-actin抗体(批号AA128,100 μL/支)购自上海碧云天生物技术有限公司。其他试剂均为分析纯。
1.3 动物 SPF级昆明小鼠50只,体质量18~20 g,购于上海斯莱克实验动物有限责任公司,实验动物生产许可证号SCXK(沪)2018-0006,实验动物使用许可证号SYXK(闽)2014-0005。饲养于福建中医药大学动物实验中心,温度21~23 ℃,相对湿度55%~75%,12 h/12 h明暗交替。小鼠适应性饲养7 d后,开始正式实验。
2 方法
2.1 溶液制备
2.1.1 泽泻三萜提取物溶液 参考文献[9]报道,将泽泻粉碎后过24目筛,80%乙醇煎煮2次,每次1 h,合并2次滤液并浓缩,采用HP20大孔树脂柱纯化,浓缩洗脱液得油状浸膏,即为泽泻三萜,得率为0.72%,共检测出14种成分,其总含量为885.9 mg/g[10-11],在-20 ℃下保存备用。精密称取适量至研钵中,加入适量0.5% CMC-Na溶液充分研磨,得到0.01、0.002 5 g/mL混悬液,灌胃前进行充分混匀。
2.1.2 醋酸地塞米松溶液 取数片醋酸地塞米松片,研成粉末,加入生理盐水制成质量浓度为0.000 5 g/mL的溶液,即得。
2.1.3 脂多糖溶液 精密称取2 mg LPS粉末,置于10 mL棕色量瓶中,加适量生理盐水完全溶解后定容至10 mL,即得质量浓度为0.2 mg/mL的溶液,在4 ℃下密封(不宜长时间保存)。
2.2 分组、造模与给药 将小鼠随机分为正常组,模型组,醋酸地塞米松组(5 mg/kg),泽泻三萜低、高剂量组(25、100 mg/kg),每组10只。各给药组小鼠灌胃给予相应剂量药物(10 mL/kg),正常组和模型组小鼠灌胃给予等量0.5% CMC-Na溶液,每天1次,连续14 d。末次给药后2 h,造模组小鼠采用鼻腔滴注法,缓慢滴注50 μL含10 μg LPS的生理盐水,正常组小鼠同法给予相同体积生理盐水[12],造模12 h后,小鼠眼眶取血,脱臼处死,迅速取出肺组织,保存备用。
2.3 肺组织湿/干质量比计算 切取小鼠右肺上叶,剔除结缔组织,滤纸吸干表面水分和血液,称定质量,作为肺组织湿质量,随后置于恒温箱中,在80 ℃下连续干燥48 h以上后取出,称定质量,作为肺组织干质量,计算肺组织湿/干质量比[13]。
2.4 试剂盒检测小鼠肺组织MPO、GSH-Px、SOD活性及MDA、GSH水平 剪取适量小鼠肺组织,置于预冷的玻璃研磨器中,加入预冷生理盐水,并在冰水浴中研磨,4 ℃、5 000 r/min离心10 min,吸取上清液,分别制成5%、10%肺组织匀浆液,按照试剂盒说明书检测肺组织MPO、GSH-Px、SOD活性及MDA、GSH水平。
2.5 酶联免疫吸附法小鼠血清 TNF-α、IL-1β水平 小鼠血液于4 ℃、5 000 r/min离心10 min,分离取血清,按照试剂盒说明书检测血清TNF-α、IL-1β水平。
2.6 小鼠肺组织病理学检查 切取小鼠右肺组织下叶,4%多聚甲醛溶液固定24 h,蒸馏水冲洗至无多聚甲醛味,常规梯度乙醇脱水,包埋成蜡块,切片(5 μm),在65 ℃下烘干2 h,梯度乙醇洗脱,二甲苯脱蜡,苏木素-伊红染色,封片,晾干,在光学显微镜下观察并拍照,根据肺泡壁厚度、肺组织破坏、炎症细胞浸润情况进行评分[14],评分标准见表1。
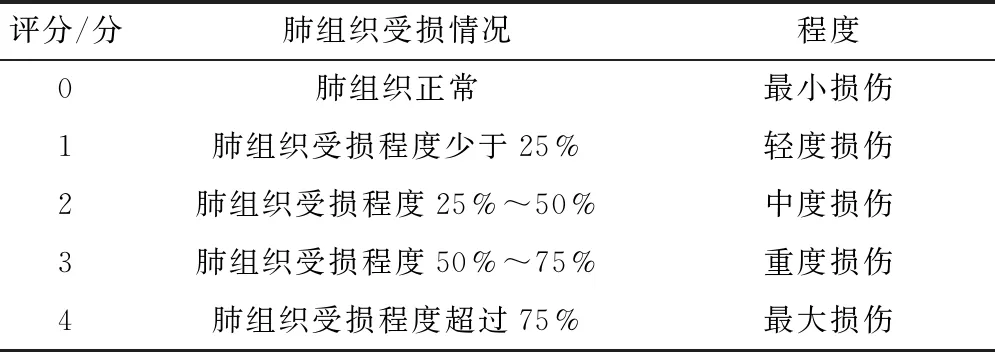
表1 急性肺损伤评分标准
2.7 Western blot法检测小鼠肺组织Nrf2、HO-1、PPARγ蛋白表达 取超低温保存的剩余小鼠肺组织,采用液氮研磨法,按照1∶10比例加入RIPA裂解液和PMSF混合溶液(100∶1),冰上匀浆后静置30 min,4 ℃、12 000 r/min离心10 min,分离取上清,采用BCA蛋白定量检测试剂盒检测蛋白浓度,通过加热变性制备蛋白样品,配制SDS-PAGE凝胶,蛋白样品上样,电泳分离,转移至PVDF膜,5%脱脂奶粉封闭2 h,TBST缓冲液洗膜3次,加一抗(1∶1 000)于4 ℃下孵育过夜,TBST缓冲液洗膜3次,加入二抗(1∶5 000)室温孵育,TBST缓冲液洗膜3次,ECL发光液显影、曝光,通过Image Lab软件对条带进行灰度值分析。
3 结果
3.1 泽泻三萜对小鼠肺组织湿/干质量比的影响 与正常组比较,模型组小鼠肺组织湿/干质量比值升高(P<0.01);与模型组比较,醋酸地塞米松组和泽泻三萜高剂量组小鼠肺组织湿/干质量比值降低(P<0.01),见图1。
3.2 泽泻三萜对小鼠肺组织MPO、GSH-Px、SOD活性及MDA、GSH水平的影响 与正常组比较,模型组小鼠肺组织MPO活性、MDA水平升高(P<0.01),GSH水平及GSH-Px、SOD活性降低(P<0.01);与模型组比较,醋酸地塞米松组和泽泻三萜高剂量组小鼠肺组织MPO活性、MDA水平降低(P<0.01),GSH水平及GSH-Px、SOD活性升高(P<0.05,P<0.01),泽泻三萜低剂量组小鼠肺组织MDA水平降低(P<0.05),SOD活性升高(P<0.05),见图2。
3.3 泽泻三萜对小鼠血清TNF-α、IL-1β水平的影响 与正常组比较,模型组小鼠血清TNF-α、IL-1β水平均升高(P<0.01);与模型组比较,醋酸地塞米松组和泽泻三萜高剂量组小鼠血清TNF-α、IL-1β水平均降低(P<0.01),泽泻三萜低剂量组小鼠血清IL-1β水平降低(P<0.05),见图3。
3.4 泽泻三萜对小鼠肺组织病理形态变化及肺损伤评分的影响 正常组小鼠肺组织结构清楚、无渗出液,没有出现水肿及炎细胞浸润等病理现象;与正常组比较,模型组小鼠肺组织结构紊乱,肺泡间隔增厚,出现明显的炎性浸润和间质水肿等病理现象,肺损伤评分升高(P<0.01);与模型组比较,各给药组小鼠肺组织损伤均有不同程度的缓解,以醋酸地塞米松组、泽泻三萜高剂量组更明显,表现为肺组织充血水肿减轻,出血减少,肺泡壁增厚程度减轻,炎性细胞浸润有一定程度减轻,肺损伤评分降低(P<0.01),见图4~5。
3.5 泽泻三萜对小鼠肺组织Nrf2、HO-1、PPARγ蛋白表达的影响 与正常组比较,模型组小鼠肺组织Nrf2、HO-1、PPARγ蛋白表达均降低(P<0.05,P<0.01);与模型组比较,醋酸地塞米松组和泽泻三萜高剂量组小鼠肺组织Nrf2、HO-1、PPARγ蛋白表达均升高(P<0.05,P<0.01),泽泻三萜低剂量组小鼠肺组织Nrf2蛋白表达升高(P<0.05),见图6。
4 讨论
脂多糖是革兰氏阴性菌细胞外壁的主要化学成分之一[15],进入体内后能够引起肺泡上皮细胞受损、肺部结构和生理功能的改变,感染小鼠后能够建立急性肺损伤动物模型[16]。急性肺损伤的主要病理学特征为肺泡水肿、通透性增加、肺组织微循环发生障碍,其中肺泡水肿程度的大小也能够反映肺损伤的严重程度[17]。肺组织湿/干质量比值能客观反映毛细血管通透性的相对程度,同时也是反映肺水肿的重要指标[17-18]。当LPS刺激机体后,能够激活体内巨噬细胞,导致机体产生大量炎症因子,例如TNF-α、IL-1β等[19],诱导中性粒细胞在肺间质和肺泡内聚集,从而导致一系列肺组织损伤,如血管充血、肺水肿、肺泡萎缩等。本研究结果显示,泽泻三萜对肺组织湿/干质量比值、MPO活性及TNF-α、IL-1β水平均有调节作用,提示,泽泻三萜可通过抑制肺组织水肿,TNF-α、IL-1β分泌及MPO活性缓解LPS诱导小鼠急性肺损伤作用。
氧化应激被认为是肺损伤的另一个重要原因,它不仅能直接诱导组织损伤,还能调节参与肺炎症反应的通路,肺损伤患者和动物模型均出现严重的氧化应激,MDA水平升高[20]。机体在氧化应激过程中会产生大量活性氧(ROS),能够对肺实质细胞造成一定程度的氧化损伤[21]。研究报道,在急性肺损伤的发生发展全过程均有氧化应激反应伴随[22]。ROS产生过多,可抑制氧自由基清除剂SOD活性及GSH水平,使脂质过氧化终产物MDA水平升高,损伤肺组织造成急性肺损伤的发生[23]。
文献研究报道,泽泻三萜具有抗氧化作用[24],但其是否对LPS诱导产生急性肺损伤引起的肺组织局部氧化应激反应具有调节作用,目前尚未报道。本研究结果显示,泽泻三萜能够降低小鼠肺组织MDA水平,同时升高SOD、GSH-Px活性及GSH水平,提示,泽泻三萜对急性肺损伤小鼠氧化应激反应具有一定调节作用。
Nrf2在调节MDA、SOD、GSH、GSH-Px过程中起着非常重要的作用[25-26]。正常情况下,Nrf2与Keap1相结合,处于非活性、易降解的状态,当细胞受相关信号刺激时Keap1构象会发生改变或Nrf2直接被磷酸化,从而导致两者解离,Nrf2进入细胞核,并与ARE结合,激活ARE下游的抗氧化蛋白HO-1的表达,从而发挥抵抗体内外界的刺激[25,27]。HO-1是机体调节氧化应激的重要因子,通过上调HO-1的表达,可以调节MDA、SOD、GSH和GSH-Px等表达,从调节氧化应激引起的损伤[28]。增加Nrf2表达可降低机体抗氧化应激表达,从而对细胞产生保护作用[29]。本实验结果显示,泽泻三萜能够上调小鼠肺组织Nrf2、HO-1蛋白表达,提示,泽泻三萜对急性肺损伤的保护作用与Nrf2/HO-1信号通路激活有关。
PPARγ具有促进自噬的作用[30],激活PPARγ通路能够抑制炎症因子的分泌[31-32]。本研究结果发现,泽泻三萜能够上调急性肺损伤小鼠肺组织PPARγ蛋白表达,提示,泽泻三萜能够通过激活PPARγ表达抑制炎症因子的分泌,从而起到保护急性肺损伤的作用。
综述所述,泽泻三萜对急性肺损伤小鼠有保护作用,一方面通过激活Nrf2/HO-1信号通路及调节机体氧化应激,从而减轻肺组织氧化损伤;另一方面,通过上调PPARγ蛋白表达抑制炎症因子TNF-α、IL-1β产生,抑制炎症反应。
