蛇床子素白蛋白纳米粒的制备及其体内药动学研究
2022-12-04谈秀凤
辛 娟, 易 华, 李 明, 谈秀凤
(1.黄河科技学院,河南 郑州 450063;2.上海中医药大学,上海 201203)
蛇床子素是从蛇床子Cnidiummonnieri(L.)Cusson中提取出的一种香豆素类活性成分,具有抗心律失常、壮阳、抗肿瘤、抑菌、抗炎、抗过敏、降血压、抗骨质疏松、增强免疫等药理作用[1-3],在心脑血管疾病、内分泌系统、神经系统、免疫系统等方面中的应用较多,但该成分溶解度仅为4.65 μg/mL,影响了溶出度[4],而且胃肠道稳定性差[5],导致口服吸收生物利用度较低(仅为15.65%)[6],不利于药效发挥。另外,蛇床子素logP为3.46[7],脂溶性较高,故提高该成分溶解度、溶出度有利于增加其体内吸收程度。
白蛋白是一种安全的纳米载体材料[8-10],可提高难溶性药物的溶解度、溶出度、体内稳定性[11-13],促进药物吸收,并且自身可作为辅料制备冻干制剂。同时,蛇床子素与白蛋白之间具有较强的结合作用,故在一定制剂条件下可形成纳米粒[14]。本实验制备蛇床子素白蛋白纳米粒,并考察其体内药动学,以期为相关新制剂开发提供策略。
1 材料
Milli-Q超纯水处理系统(美国Millipore公司);安捷伦1200型高效液相色谱仪(美国安捷伦公司);MS105/A型电子分析天平(瑞士梅特勒-托利多公司);JC-HJ-A型磁力搅拌器(青岛聚创环保集团有限公司);Master-sizer型粒度分析仪(英国马尔文仪器有限公司);Z32HK型高速离心机(德国Hermle公司);KQ-300DB型超声仪(昆山市超声仪器有限公司);超滤离心管(30 K,美国Pall公司);BK-FD10S型冻干机(博科控股集团有限公司);QIMO-DCY-12S型氮气吹扫仪[琪摩(上海)电子科技有限公司]。
蛇床子素对照品(批号110822-201810,纯度99.5%,中国食品药品检定研究院);蛇床子素原料药(批号20191215,纯度98%,西安佰斯特生物科技有限公司)。牛血清白蛋白(批号190725,纯度≥98%,盐城赛宝生物科技有限公司)。
SD大鼠,雌雄兼具,体质量(250±20)g,购自河南省动物实验中心,动物生产许可证号SCXK(豫)2016-0001。
2 方法与结果
2.1 白蛋白纳米粒及其冻干粉制备 参考文献[12, 15-16]报道,称取处方量原料药至一定体积无水乙醇中,超声溶解,作为有机相;称取处方量牛血清白蛋白,置于40 mL pH 7.0缓冲液中,600 r/min磁力搅拌溶解,作为水相,将有机相以2 mL/min滴速滴加到水相中,超声处理20 min,加入100 μL 0.2%戊二醛固化12 h,在40 ℃下减压旋蒸1 h,除去无水乙醇,4 ℃、20 000 r/min离心45 min,移弃上清液,加蒸馏水至40 mL,过0.45 μm微孔滤膜,即得白蛋白纳米粒,再将其置于-20 ℃中冰箱冷冻3 d,迅速转移至初始温度为-20 ℃的冷冻干燥机中抽真空后冷冻3 d,即得冻干粉。除不加原料药外,同法制备空白白蛋白纳米粒。
2.2 蛇床子素含量测定
2.2.1 色谱条件 Hypersil C18色谱柱(150 mm×4.6 mm,5 μm);流动相水-甲醇(60∶40);体积流量1.0 mL/min;柱温35 ℃;检测波长429 nm;进样量20 μL。
2.2.2 线性关系考察 称取20 mg对照品至50 mL量瓶中,甲醇超声溶解后定容,得400 μg/mL贮备液,流动相制成20、10、5、1、0.1、0.05 μg/mL对照品溶液,在“2.2.1”项色谱条件下进样测定。以对照品峰面积(Y)对其质量浓度(X)进行回归,得方程为Y=14.148 2X+0.415 3(r=0.999 7),在0.05~20 μg/mL范围内线性关系良好。
2.2.3 供试品溶液制备 取白蛋白纳米粒1 mL,置于10 mL量瓶中,加入约5 mL甲醇,超声处理2 min以沉淀蛋白,甲醇定容至刻度,取1 mL至10 mL量瓶中,8 500 r/min离心10 min,取上清液,即得。
2.2.4 方法学考察 取“2.2.3”项下供试品溶液适量,于0、3、6、9、12、24 h在“2.2.1”项色谱条件下进样测定,测得蛇床子素峰面积RSD为1.36%,表明溶液在24 h内稳定性良好。取“2.2.3”项下供试品溶液适量,在“2.2.1”项色谱条件下进样测定6次,测得蛇床子素峰面积RSD为0.56%,表明仪器精密度良好。取白蛋白纳米粒适量,按“2.2.3”项下方法制备6份供试品溶液,在“2.2.1”项色谱条件下进样测定,测得蛇床子素峰面积RSD为1.64%,表明该方法重复性良好。取9份白蛋白纳米粒,每份0.5 mL,置于10 mL量瓶中,随机分为3组,分别加入对照品溶液0.5、1、1.5 mL,按“2.2.3”项下方法制备供试品溶液,在“2.2.1”项色谱条件下进样测定,测得蛇床子素平均加样回收率分别为100.93%、99.37%、99.78%,RSD分别为1.06%、0.63%、1.11%。
2.3 包封率、载药量测定 在超滤离心管(截留分子量8 000~14 000 Da)中加入1 mL白蛋白纳米粒,8 500 r/min离心10 min,HPLC法测定滤液中游离蛇床子素量(m游离);取白蛋白纳米粒1 mL,按“2.2.3”项下方法制备供试品溶液,HPLC法测定蛇床子素总量(m总),计算包封率、载药量,公式分别为包封率=[(m总-m游离)/m总]×100%、载药量=[(m总-m游离)/m总质量]×100%,其中m总质量表示白蛋白纳米粒总质量。
2.4 Box-Behnken响应面法 在课题组前期研究基础上,选择蛇床子素用量(X1)、白蛋白用量(X2)、无水乙醇用量(X3)作为影响因素,包封率(Y1)、载药量(Y2)作为评价指标,因素水平见表1,结果见表2。
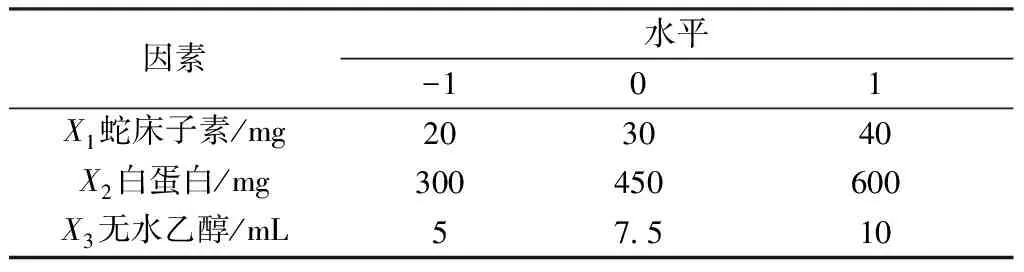
表1 因素水平

表2 试验设计与结果

表3 方差分析
响应面分析见图1。由图1A~1C可知,随着白蛋白用量增加,包封率呈升高趋势;随着蛇床子素用量增加,包封率呈降低趋势;随着无水乙醇用量增加,包封率先升后降。由图1D~1F可知,随着白蛋白用量增加,载药量呈降低趋势;随着蛇床子素用量增加,载药量呈升高趋势;随着无水乙醇用量增加,载药量先升后降。设置包封率最小值为50%,最大值为100%;载药量最小值为2%,最大值为15%,得到最优工艺为蛇床子素用量29.05 mg,白蛋白用量321.66 mg,乙醇用量7.59 mL,包封率为84.61%,载药量为6.87%,考虑到实际操作性,将其修正为蛇床子素用量29 mg,白蛋白用量322 mg,乙醇用量7.6 mL。
按上述优化工艺平行制备3份白蛋白纳米粒,外观见图2A,测得平均包封率为83.71%,载药量为6.59%,分别与预测值84.61%、6.87%接近;平均Zeta电位为-26.45 mV(图3),粒径为113.82 nm(图4),PDI为0.081。冻干粉外观见图2B,可知为片状疏松状态的粉末,加入蒸馏水复溶后平均Zeta电位为-22.61 mV,粒径为153.73 nm,PDI为0.127。
2.5 溶解度测定 取过量原料药、物理混合物(蛇床子素+空白白蛋白纳米粒)、白蛋白纳米粒冻干粉适量,置于烧瓶中,加入10 mL蒸馏水(仍有药物沉淀于底部),25 ℃、600 r/min磁力搅拌72 h,取上层混悬液,8 500 r/min离心15 min,取上清液,计算溶解度。结果,原料药、物理混合物溶解度分别为4.65、7.83 μg/mL,而白蛋白纳米粒达107.98 μg/mL,是原料药的23.22倍。
2.6 体外释药研究
2.6.1 人工胃液、人工肠液制备 取10 g胃蛋白酶,加400 mL纯化水搅拌溶解;取3.8 mL浓盐酸,加500 mL纯化水,将两者合并后振荡混匀,加5 mL吐温-80,纯化水补至1 000 mL,振荡混匀,即得人工胃液。取磷酸二氢钾6.8 g,加500 mL纯化水,振荡溶解,0.1 mol/L NaOH溶液调节pH至6.8;取胰蛋白酶10 g,加400 mL纯化水,振荡溶解,将两者合并后振荡混匀,加5 mL吐温-80,纯化水补至1 000 mL,振荡混匀,即得人工肠液。
2.6.2 操作过程 取原料药、物理混合物、白蛋白纳米粒冻干粉适量(以蛇床子素计均为5 mg),5 mL空白释放介质制成混悬液,置于透析袋中(截留分子量8 000~14 000 Da),取1 000 mL人工胃液,设定温度为37 ℃,转速为100 r/min,于0、0.25、0.5、1、2 h各取样3 mL,并加入同体积的人工胃液;同法考察各样品在人工肠液中的释药情况,取样时间为0、0.25、0.5、1、2、2.5、3、4、6、8、12 h,绘制释药曲线,结果见图5~6。由此可知,白蛋白纳米粒在人工胃液或人工肠液中的累积释放度均高于原料药,在人工胃液中2 h内为44.86%;在人工肠液中8 h内为90.40%,12 h内为93.67%。
2.7 稳定性考察 称取2份白蛋白纳米粒冻干粉,每份0.2 g,置于50 mL人工胃液或人工肠液中(4 ℃),在37 ℃下于0、0.5、1、2、3、4、5 h测定粒径,结果见图7。由此可知,白蛋白纳米粒冻干粉粒径在蒸馏水中的变化程度最小,5 h后仍小于200 nm;在人工胃液中2 h后粒径增加至457.92 nm;在人工肠液中2 h后粒径增加至352.17 nm,4 h后接近1 000 nm。
2.8 体内药动学研究
2.8.1 分组、给药与采血 取禁食1 d的大鼠18只(其间可自由饮水),随机分为3组,每组6只,分别灌胃给予原料药、物理混合物(原料药+空白白蛋白纳米粒)、白蛋白纳米粒冻干粉的混悬液(用0.5%CMC-Na溶液配制,蛇床子素质量浓度为3.5 mg/mL),剂量均为30 mg/kg,乙醚麻醉后于0.25、0.5、0.75、1.0、1.5、2、3、4、6、8、10、12 h眼眶取血各约0.2~0.3 mL,置于肝素化离心管中,振荡混匀,3 000 r/min离心2 min,分离血浆,密封,保存于-20 ℃冰箱中。
2.8.2 血浆处理 将大鼠血浆在室温下解冻后精密吸取100 μL,置于离心管中,加入内标溶液(精密称取丹皮酚对照品20.80 mg,置于50 mL量瓶中,甲醇溶解定容并稀释至400 ng/mL,即得)100 μL、甲醇3 mL,密封涡旋3 min,6 500 r/min离心8 min,取上层有机相,氮气缓慢吹干,100 μL甲醇复溶,6 500 r/min离心8 min,进样分析。
2.8.3 线性关系考察 取“2.2.2”项下贮备液适量,甲醇稀释至1 600、1 200、800、200、50、20 ng/mL,分别精密吸取100 μL至离心管中,45 ℃氮气缓慢吹干,加入100 μL空白血浆,作为血浆对照品溶液,按“2.8.2”项下方法处理,在“2.2.1”项色谱条件下进样测定。以对照品质量浓度(Y)对其与内标峰面积比值(X)进行回归,得方程为Y=143.68X+3.12(r=0.994 6),在20~1 600 ng/mL范围内线性关系良好。
2.8.4 专属性考察 取空白血浆、血浆对照品溶液(20 ng/mL)、给药12 h后血浆适量,按“2.8.2”项下方法处理,在“2.2.1”项色谱条件下进样测定,结果见图8,可知该方法专属性良好。
2.8.5 方法学考察 取20、800、1 600 ng/mL血浆对照品溶液适量,在“2.2.1”项色谱条件下各进样测定6次,测得对照品、内标峰面积比值RSD分别为12.07%、7.66%、9.18%,表明仪器精密度良好。取800 ng/mL血浆对照品溶液,于0、2、4、8、12、24 h在“2.2.1”项色谱条件下进样测定,测得对照品、内标峰面积比值RSD为6.04%,表明样品在24 h内稳定性良好。制备800 ng/mL血浆对照品溶液,平行6份,按“2.8.2”项下方法处理,在“2.2.1”项色谱条件下进样测定,测得对照品、内标峰面积比值RSD为10.43%,表明该方法重复性良好。取20、800、1 600 ng/mL血浆对照品溶液适量,按“2.8.2”项下方法处理,在“2.2.1”项色谱条件下进样测定,测得蛇床子素平均加样回收率分别为93.59%、89.41%、92.25%,RSD分别为9.17%、5.42%、7.01%。
2.8.6 结果分析 取含原料药、物理混合物、白蛋白纳米粒的血浆适量,在“2.2.1”项色谱条件下进样测定,采用DAS2.0药动学软件自动拟合数据,绘制血药浓度-时间曲线,结果见图9、表4。由此可知,与原料药比较,物理混合物Cmax、tmax、Cmax、AUC0~t无显著差异(P>0.05),表明空白白蛋白纳米粒对蛇床子素基本无促吸收作用;与原料药、物理混合物比较,白蛋白纳米粒Cmax、AUC0~t、AUC0~∞升高(P<0.01),tmax缩短(P<0.05),口服生物利用度增加至3.29倍。
表4 蛇床子素主要药动学参数
3 讨论
蛇床子素、白蛋白用量会影响白蛋白纳米粒包封率、载药量,故结合前期预实验需要对两者(20~40、300~600 mg)进行优化。随着乙醇用量增加,体系依次经历澄清、乳光、浑浊、沉淀等变化,而乳光至浑浊是初步形成纳米粒的最佳区间,故其不足时去溶剂化效果较差,影响纳米粒形成[17],但过多时又会导致白蛋白直接沉淀,结合预实验,确定该参数优化区间为5~10 mL。
本实验发现,原料药未能全部释放,可能与体外释药实验时间不够长、本身颗粒较大等原因有关;将其制成白蛋白纳米粒后可增加亲水性[9-11]、溶解度、比表面积,从而加快药物释放。白蛋白纳米粒可大大提高药物溶解度,可能与后者比表面积激增有关[13],并且文献[9-10, 17-18]报道,药物在白蛋白纳米粒中以无定形形式存在,故可能也会对其溶解度提高产生积极影响。
药动学研究结果显示,物理混合物对蛇床子素的药动学参数有一定改变,但程度远小于白蛋白纳米粒,而白蛋白纳米粒tmax缩短,可能是由于在复杂胃肠道环境中酶解对其产生破坏作用,从而使药物快速释放所致[19-20];Cmax、AUC0~t升高,可能是因为该剂型可增加药物亲水性,提高溶解度、溶出度,从而解决了吸收瓶颈,最终口服吸收生物利用度增加至3.29倍。今后,可研究蛇床子素白蛋白纳米粒的注射药动学、药效[21]、质量标准等,以期为其进一步开发利用提供更全面的实验数据及参考资料。
