NRG1基因修饰的大鼠BMSCs对体外氧糖剥夺/复氧损伤少突胶质细胞的保护作用*
2022-12-03赵富生陈君杨国宏符禹玄张可心李媛媛武庚
赵富生,陈君,杨国宏,符禹玄,张可心,李媛媛,武庚
(牡丹江医学院,黑龙江 牡丹江 157000)
脑卒中又称中风,是一种常见的急性脑血管疾病。在我国每年约150万~200万病人死于脑血管疾病,死亡率为149.49/10万人,其中大约80%为缺血性脑卒中[1]。脑缺血/再灌注损伤是缺血性脑卒中的关键环节,其病理机制与氧化应激、炎症和兴奋性毒性等因素有关[2]。少突胶质细胞是脑白质的重要组成细胞,对神经元具有支持、营养、保护和形成髓鞘等多种功能,对低灌注非常敏感,极易发生缺血缺氧损伤[3]。因此,探寻有效的干预措施阻止或改善缺血/再灌注导致的少突胶质细胞损伤具有重大意义。
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是存在于骨髓中的非造血干细胞,具有取材方便,易于扩增,分泌包括外泌体在内的多种细胞因子,并能稳定表达外源基因等优点,因而被用于修复缺血性损伤和组织缺损[4-5]。在脑卒中大鼠模型中,通过尾静脉注射BMSCs可减轻血脑屏障渗漏,促进血管形成,减小脑梗死面积,改善大鼠神经功能[6]。经腹主动脉移植BMSCs可通过增加损伤部位血管内皮生长因子含量,进而介导其下游磷脂 酰 肌 醇3-激 酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/AKT)信号通路促进脊髓缺血再灌注损伤大鼠后肢功能恢复[7]。PI3K/AKT信号通路在细胞增殖、分化、迁移、凋亡及炎症反应等多种病理生理过程中发挥重要调节作用[8]。有研究报道,神经调节蛋白1(neuregulin 1,NRG1)通过激活PI3K/AKT通路减轻脓毒症引起的大鼠膈肌萎缩[9]。体外研究显示,NRG1通过激活PI3K/AKT通路促进耳蜗核神经干细胞向神经元和神经胶质细胞分化,抑制细胞凋亡[10]。NRG1是一种含表皮生长因子样结构域的跨膜蛋白,参与神经细胞发育、髓鞘形成、突触塑型以及神经受体表达,在神经系统发育过程中发挥重要作用[11]。研究表明,NRG1通过与其受体ErbB2、ErbB3和ErbB4结合,形成同源或异二聚体,激活细胞内酪氨酸激酶,参与调控少突胶质细胞增殖和分化[12]。有研究报道,鞘内注射NRG1蛋白能够减轻炎症反应,减少硫酸软骨素聚糖蛋白生成,抑制胶质瘢痕形成,促进大鼠神经功能恢复[13]。将NRG1基因过表达的脂肪基质干细胞注射到大鼠纹状体,可通过NRG1-ErbB4通路促进MAPK磷酸化,减小脑梗死面积,改善脑卒中大鼠神经功能[14]。我们的前期研究表明,NRG1基因过表达施万细胞通过上调ErbB2和ErbB4表达,促进神经元存活,改善脊髓损伤大鼠肢体运动功能[15]。然而,上调BMSCs中NRG1的表达,能否提升BMSCs对氧糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)所致少突胶质细胞损伤的保护作用,目前尚未见报道。因此,本研究拟构建少突胶质细胞OGD/R模型,体外观察NRG1基因修饰的大鼠BMSCs对少突胶质细胞OGD/R损伤的保护作用,并探讨其可能机制,旨在为脑卒中治疗提供参考资料。
材料和方法
1 材料
1.1 动物1月龄SPF级SD大鼠6只,雌雄各半,体重90~100 g,由牡丹江医学院实验动物中心提供,许可证号为SCXK(黑)2019-003。
1.2 细胞大鼠少突胶质前体细胞系CG4购自上海淳麦生物科技有限公司。
1.3 主要试剂与仪器pcDNA3.1(+)-NRG1-IRES/eGFP质粒(广州赛业生物科技有限公司);Transwell(Corning);丙二醛(malondialdehyde,MDA)试剂盒(南京建成生物工程研究所);二氢乙啶(dihydroethidium,DHE)、calcein/PI染色试剂盒、衰老相关β-半乳糖苷酶(senescence-associatedβ-galactosidase,SA-β-Gal)染色试剂盒和乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(碧云天生物技术有限公司);ELISA试剂盒(上海康朗生物科技有限公司);Fu-Gene6转染试剂(Promega);抗p21、p53、PI3K和AKT抗体(Proteintech);抗p-PI3K和p-AKT抗体(Abcam)。ELx800酶标仪(BioTek);激光共聚焦显微镜(Nikon);MIC-101细胞缺氧气室(Billups-rothenberg)。
2 方法
2.1 BMSCs分离培养颈椎脱臼处死大鼠,在无菌条件下分离股骨和胫骨,用10 mL DMEM冲洗骨髓腔,经200目无菌筛网过滤冲洗液,接种于50 mL培养瓶中,常规培养72 h后更换培养液,当细胞汇合达80%~90%时,进行传代培养[16]。
2.2 NRG1质粒转染BMSCs取第3代BMSCs按1×108/L、每孔2 mL接种于6孔板中,分为对照(BMSCs)组、空质粒转染BMSCs(empty vector-BMSCs)组和NRG1质粒转染BMSCs(NRG1-BMSCs)组。按照Fu-Gene6转染试剂说明书用NRG1质粒和空载质粒分别转染BMSCs,具体操作参照文献进行[13]。转染24 h和72 h,收集各组BMSCs,按照ELISA试剂盒说明测定各组细胞裂解液和培养液中NRG1蛋白含量。
2.3 OGD/R模型建立和实验分组取CG4细胞更换无糖DMEM培养液,置于缺氧培养气室中,通入混合气体(95%N2和5%CO2)37℃培养2 h,更换完全培养液,37℃、5% CO2培养箱中复氧复糖培养22 h,建立OGD/R细胞模型[17]。BMSCs(1.5×108/L)或NRG1-BMSCs(1.5×108/L,转染72 h)与OGD/R处理CG4细胞(1.5×108/L)在Transwell中共培养。将实验分为4组:对照(control)组,CG4细胞常规培养24 h;OGD/R组,OGD/R处理CG4细胞后,常规培养24 h;BMSCs组,OGD/R处理CG4细胞后,与BMSCs常规共培养24 h;NRG1-BMSCs组,OGD/R处理CG4细胞后,与NRG1-BMSCs常规共培养24 h,进行后续实验。采用倒置相差显微镜观察CG4细胞形态学变化。
2.4 MTT实验取各组CG4细胞,以3×107/L接种于96孔培养板,每孔100µL,培养24 h,加MTT工作液(每孔10µL),孵育4 h后弃培养液,加100µL DMSO,酶标仪在570 nm波长处测定吸光度(A)。细胞活力(%)=(样品平均A值-空白孔平均A值)/(对照组平均A值-空白孔平均A值)×100%。
2.5 细胞划痕实验取各组CG4细胞,以5×108/L接种于6孔培养板,培养24 h,用20µL吸头垂直于培养皿底部水平划痕(0 h),继续培养24 h,显微镜下观察细胞分布并采集图像。采用ImageJ软件测量划痕面积,计算划痕愈合率。划痕愈合率(%)=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
2.6 氧化应激检测取各组CG4细胞,应用DHE荧光探针检测各组CG4细胞内活性氧(reactive oxygen species,ROS)水平,采用硫代巴比妥酸法测定CG4细胞裂解液中MDA含量,通过比色法检测CG4细胞内总抗氧化能力(total antioxidant capacity,TAOC)水平,实验操作均按照试剂盒说明书进行。
2.7 细胞衰老检测取各组CG4细胞,室温固定,加1 500µL SA-β-Gal染色工作液,光镜下观察拍照。各组随机选取6个视野,计算阳性细胞率并求均值。阳性细胞率(%)=阳性细胞数/总细胞数×100%。
2.8 细胞死亡率检测参照文献[18],采用calcein/PI双染法检测细胞存活情况。红色荧光代表PI染色细胞,为死亡细胞,绿色荧光代表calcein染色细胞,为存活细胞。取各组CG4细胞,接种于铺有玻片6孔培养板,培养24 h,加calcein/PI染色工作液,37℃避光孵育30 min,收集CG4细胞玻片,激光共聚焦显微镜采集图像。采用ImageJ分析细胞死亡率。细胞死亡率(%)=PI阳性细胞数/(calcein阳性细胞数+PI阳性细胞数)×100%。
2.9 LDH漏出率检测参照文献[19]操作。取各组CG4细胞,接种于96孔板中,对照组选取6孔加20µL LDH,作为样品细胞最大酶活性对照孔,其它各组每孔加20µL细胞培养液,常规培养1 h。收集各组CG4细胞培养液离心,取120µL上清液加入到新的96孔板中,各孔加60µL LDH工作液,室温孵育30 min,酶标仪在490 nm处测定A值。LDH漏出率(%)=(处理样品A值-空白孔平均A值)/(细胞最大酶活性A值-空白孔平均A值)×100%。
2.1 0 Western blot检测蛋白表达收集各组CG4细胞,用RIPA裂解液提取总蛋白,使用BCA法测定蛋白质浓度,变性后每孔加等量蛋白(30µg),进行凝胶电泳和转膜。然后将PVDF膜置于5% BSA中封闭2 h,加入β-actin、衰老相关蛋白(p21和p53)和PI3K/AKT通路蛋白(p-PI3K、PI3K、p-AKT和AKT)抗体(均以1∶1 000的比例稀释),4℃孵育过夜。次日加相应Ⅱ抗,37℃孵育2 h,加ECL发光试剂显影成像,用ImageJ软件参照β-actin分析目的蛋白条带相对灰度值,计算目的蛋白质相对表达水平。
3 统计学处理
采用SPSS 18.0软件进行统计分析,结果以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),采用SNK-q检验进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 BMSCs培养及NRG1质粒转染BMSCs
细胞培养第1天,倒置相差显微镜下观察BMSCs呈球形、漂浮未贴壁,分布均匀;培养第3~5天,BMSCs呈多角形或长梭形,贴壁生长,形成多个散在细胞集落;传代培养后,BMSCs排列紧密,呈束状生长(图1A~C)。BMSCs转染NRG1质粒后呈现明亮绿色荧光(图1D~F)。ELISA结果显示,与BMSCs组相比,NRG1-BMSCs组培养液上清和细胞裂解液中NRG1蛋白含量在转染72 h均显著升高(P<0.05),见图1G、H。
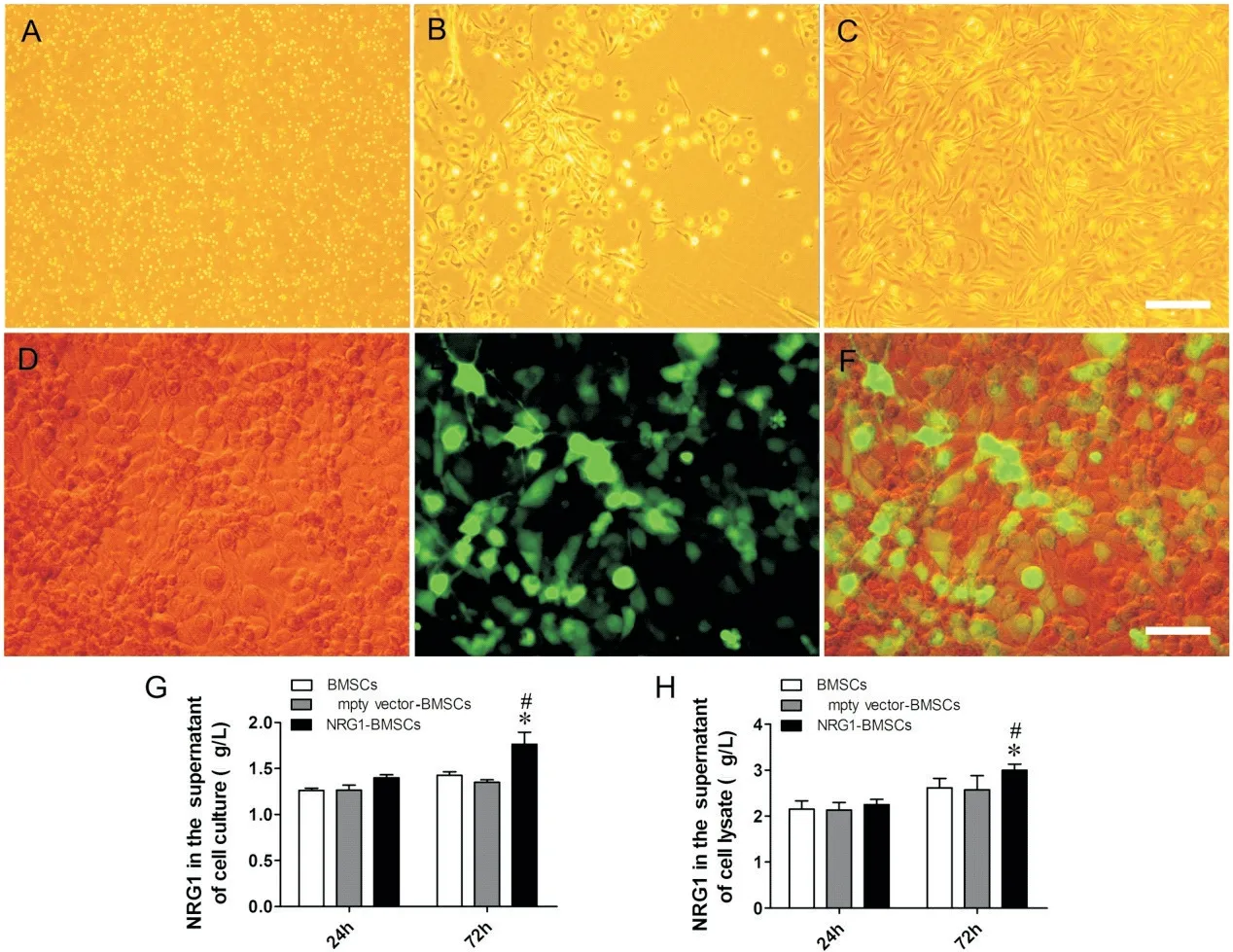
Figure 1.Rat BMSCs culture and NRG1 plasmid transfection in BMSCs.A and B:morphological changes of primary BMSCs on the 1st and 3rd days observed under inverted microscope;C:morphological changes of BMSCs in the 3rd generation observed under light microscope;D and E:BMSCs transfected with pcDNA3.1(+)-NRG1-IRES/eGFP plasmid were observed under inverted and fluorescence microscope,respectively;F:overlay of light microscope image and fluorescence image(green)of NRG1-BMSCs;G and H:comparison of NRG1 protein content in culture medium and cell lysate of the BMSCs,empty vector-BMSCs and NRG1-BMSCs groups.Scale bar=200µm in A,B and C;scale bar=100µm in D,E and F.Mean±SD.n=6.*P<0.05 vs BMSCs group;#P<0.05 vs empty vector-BMSCs group.图1 大鼠BMSCs培养及NRG1质粒转染BMSCs
2 NRG1-BMSCs对OGD/R引起的CG4细胞形态变化及活力的影响
建立CG4细胞OGD/R模型,实验分组见图2A。各组CG4细胞形态变化如图2B所示,control组CG4细胞胞体透亮,呈梭形或三角形,突起细长;OGD/R组CG4细胞肿胀,胞体变暗,胞突减少;与NRG1-BMSCs共培养后,CG4细胞肿胀明显减轻,漂浮细胞减少,细胞突起增多。MTT结果如图2C所示,与control组相比,OGD/R组CG4细胞活力显著降低(P<0.01);与OGD/R组相比,NRG1-BMSCs组CG4细胞活力显著升高(P<0.01),但未恢复到control组水平(P<0.01);BMSCs组与OGD/R组相比,细胞活力有所升高,但未见显著差异(P>0.05)。
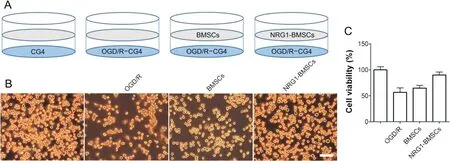
Figure 2.Effects of NRG1-BMSCs on the morphological changes and viability of CG4 cells induced by OGD/R.A:schematic diagram of experimental grouping;B:the morphological changes of CG4 cells observed under light microscope(scale bar=100µm);C:comparison of CG4 cell viability in each group.Mean±SD.n=6.**P<0.01 vs control group;##P<0.01 vs OGD/R group.图2 NRG1-BMSCs对OGD/R引起的CG4细胞形态变化及活力的影响
3 NRG1-BMSCs对OGD/R导致的CG4细胞迁移能力的影响
细胞划痕实验结果如图3所示,与control组相比,OGD/R组CG4细胞划痕愈合率显著降低(P<0.01);与OGD/R组相比,NRG1-BMSCs组划痕两侧细胞密度增大,空白面积明显减少,划痕愈合率显著增加(P<0.01),但仍低于对照组(P<0.01);BMSCs组与OGD/R组相比,划痕愈合率增加,但未见显著性差异(P>0.05)。
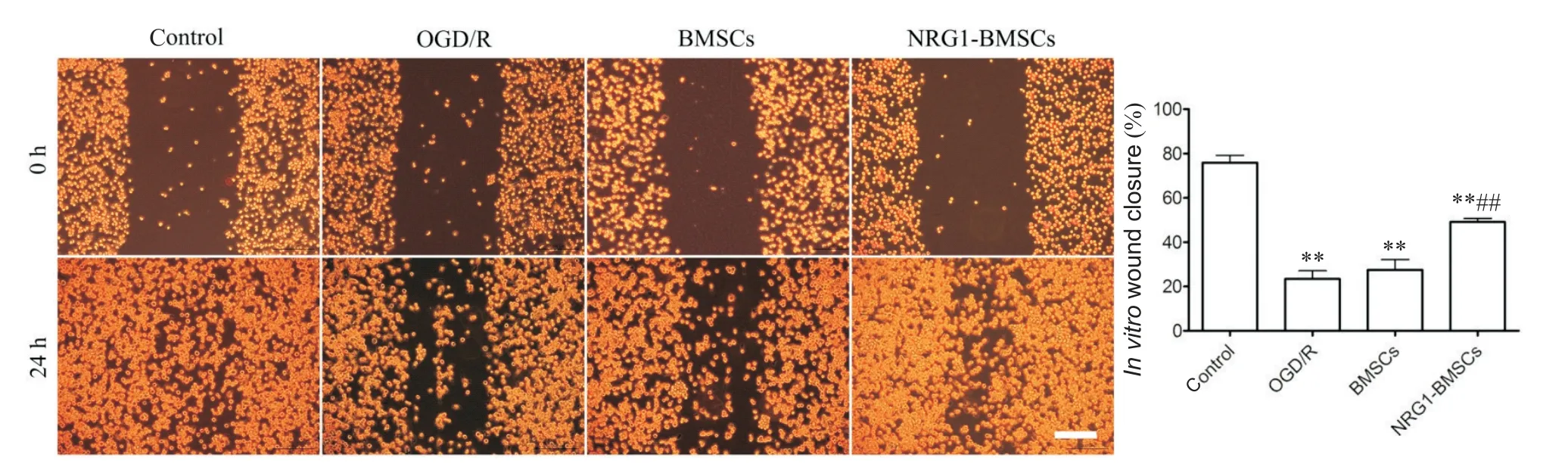
Figure 3.Effects of NRG1-BMSCs on the migration of CG4 cells induced by OGD/R.Wound healing assay was performed,and the healing rate of the CG4 cells at 24 h in each group was determined.Scale bar=200µm.Mean±SD.n=6.**P<0.01 vs control group;##P<0.01 vs OGD/R group.图3 NRG1-BMSCs对OGD/R导致的CG4细胞迁移能力变化的影响
4 NRG1-BMSCs对OGD/R诱导的CG4细胞氧化应激的影响
细胞氧化应激检测如图4所示,与control组相比,OGD/R组CG4细胞内ROS和MDA含量显著升高(P<0.01),而T-AOC水平显著降低(P<0.01);与OGD/R组相比,NRG1-BMSCs组CG4细胞内ROS和MDA含量显著降低(P<0.01),T-AOC水平显著升高(P<0.05),但未恢复到control组水平(P<0.05);BMSCs组与OGD/R组相比ROS、MDA和T-AOC水平均未见显著性差异(P>0.05)。
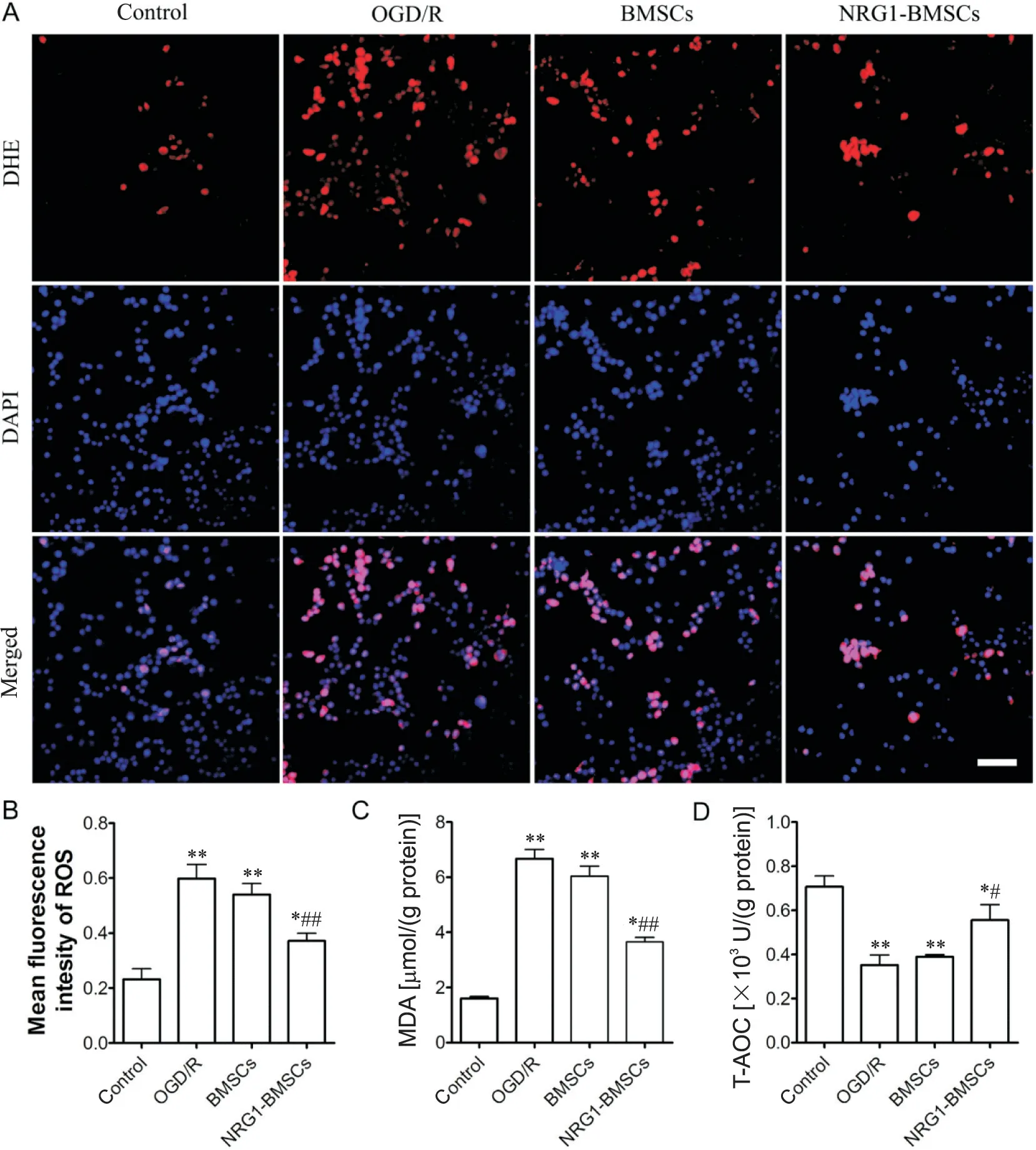
Figure 4.Effects of NRG1-BMSCs on oxidative stress in CG4 cells induced by OGD/R.A:representative DHE fluorescence staining images of CG4 cells in each group(red represented ROS,and blue represented nuclei stained with DAPI;scale bar=100µm);B:quantitative analysis of DHE fluorescence intensity in each group;C and D:quantitative analysis of MDA content and T-AOC level in CG4 cells of each group.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs OGD/R group.图4 NRG1-BMSCs对OGD/R诱导的CG4细胞氧化应激的影响
5 NRG1-BMSCs对OGD/R诱导的CG4细胞衰老的影响
细胞衰老检测如图5所示,与control组相比,ODG/R组CG4细胞衰老阳性率及衰老相关蛋白p21和p53水平均显著升高(P<0.01);与OGD/R组相比,NRG1-BMSCs组衰老细胞阳性率及p21和p53蛋白水平显著降低(P<0.01),但未恢复到control组水平(P<0.05);BMSCs组与OGD/R组相比,CG4细胞衰老阳性率及p21和p53蛋白水平有所降低,但未见显著差异(P>0.05)。
6 NRG1-BMSCs对OGD/R诱导的CG4细胞死亡的影响
细胞死亡检测如图6A、B所示,与control组相比,OGD/R组PI阳性细胞显著增多(P<0.01);与OGD/R组比,NRG1-BMSCs组PI阳性细胞显著减少(P<0.01),但未恢复到control组水平(P<0.01)。LDH漏出率检测如图6C所示,与control组相比,ODG/R组CG4细胞LDH漏出率显著增加(P<0.01);与OGD/R组相比,NRG1-BMSCs组CG4细胞LDH漏出率显著降低(P<0.01),但未恢复到control组水平(P<0.01)。
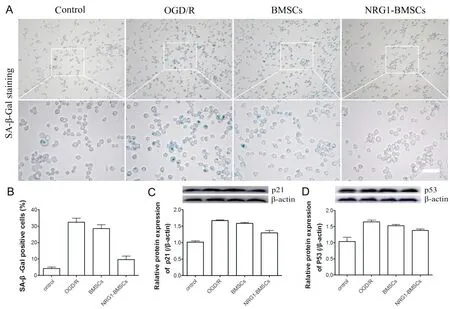
Figure 5.Effects of NRG1-BMSCs on CG4 cell senescence induced by OGD/R.A:representative SA-β-Gal staining images of CG4 cells in each group(scale bar=100µm);B:quantitative analysis of SA-β-Gal positive rate of CG4 cells in each group;C and D:the protein expression levels of p21 and p53 in CG4 cells were detected by Western blot.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;##P<0.01 vs OGD/R group.图5 NRG1-BMSCs对OGD/R诱导的CG4细胞衰老的影响
7 NRG1-BMSCs对OGD/R诱 导 的CG4细 胞PI3K/AKT通路相关蛋白表达的影响
与control组 相 比,OGD/R组CG4细 胞p-PI3K/PI3K和p-AKT/AKT比 值 显 著 降 低(P<0.01);与OGD/R组比,NRG1-BMSCs组CG4细胞p-PI3K/PI3K和p-AKT/AKT比值显著升高(P<0.01),但仍未恢复到control组水平(P<0.01);BMSCs组与OGD/R组相比,CG4细胞p-PI3K/PI3K和p-AKT/AKT比值略有升高,但未见显著性差异(P>0.05),见图7。
讨 论
OGD/R细胞模型模拟了脑卒中的部分病理变化过程,是构建脑缺血/再灌注体外模型的常用方法[20]。本研究采用CG4细胞建立OGD/R模型模拟脑卒中后少突胶质细胞损伤,体外探讨NRG1基因修饰的大鼠BMSCs对OGD/R导致的少突胶质细胞损伤的保护作用,结果显示NRG1-BMSCs能够抑制OGD/R诱导的少突胶质细胞衰老以及死亡,其作用机制可能与调节PI3K/AKT信号通路,减轻细胞氧化应激有关。据我们所知,这项研究首次明确了NRG1基因修饰的大鼠BMSCs对少突胶质细胞OGD/R损伤的保护作用并提出了可能的保护机制。
NRG1在神经元迁移、胶质细胞发育以及神经元和胶质细胞联系过程中发挥重要作用[21]。本研究通过全骨髓贴壁法分离培养大鼠BMSCs,荧光显微镜观察可见NRG1质粒成功转染BMSCs。在NRG1-BMSCs培养液和细胞裂解液中,NRG1蛋白水平显著升高且呈现时间依赖性增加。该结果提示,将NRG1-BMSCs移植到脑缺血区可能增加局部NRG1含量,一定程度上改善损伤局部微环境,促进受损神经修复。
有研究报道,BMSCs培养液通过激活PI3K/AKT信号通路减轻OGD/R导致的离体皮层神经元损伤,抑制caspase-3蛋白表达,提高神经元存活率,发挥神经保护作用[22]。本研究将NRG1-BMSCs与OGD/R处理后的CG4细胞共培养,结果表明NRG1-BMSCs能够显著提高CG4细胞的活力和迁移能力,提示NRG1能够提升BMSCs对CG4细胞OGD/R损伤的保护作用。有研究报道,缺氧预处理的BMSCs可通过NRG1/PI3K/AKT信号通路促进人脐静脉内皮细胞增殖、迁移以及血管生成[23]。研究表明,将BMSCs与髓核细胞三维共培养可提高髓核细胞增殖活性,抑制β-半乳糖苷酶以及基质金属蛋白酶9表达,减轻TNF-α诱导的髓核细胞衰老[24]。本研究结果显示,OGD/R引起CG4细胞衰老,也可破坏CG4细胞膜导致LDH外漏,诱发CG4细胞死亡。然而,NRG1-BMSCs能够减轻OGD/R引起的细胞膜破坏,抑制CG4细胞死亡。此外,NRG1-BMSCs能够抑制OGD/R介导的衰老相关蛋白p21和p53表达,延缓OGD/R诱导的CG4细胞衰老和死亡。我们推测,NRG1-BMSCs神经保护作用可能与减轻OGD/R诱发的CG4细胞氧化应激有关。

Figure 6.Effects of NRG1-BMSCs on the death of CG4 cells induced by OGD/R.A:representative calcein/PI fluorescence staining images of CG4 cells in each group(red represented dead cells stained with PI,and green represented live cells stained with calcein;scale bar=100µm);B:quantitative analysis of PI positive CG4 cells in each group;C:LDH leakage rate of CG4 cells in each group.Mean±SD.n=6.**P<0.01 vs control group;##P<0.01 vs OGD/R group.图6 NRG1-BMSCs对OGD/R诱导的CG4细胞死亡的影响
研究表明,脑缺血再灌注过程中产生大量氧自由基,诱发一系列细胞反应,如线粒体损伤、脂质过氧化、细胞衰老和凋亡[25]。因此,如何有效抑制氧化应激被认为是防治OGD/R诱发脑损伤潜在的靶点。有研究报道,小檗碱预处理的BMSCs分泌液能抑制过氧化叔丁醇诱导的ROS生成,减轻氧化应激导致的离体神经元凋亡[26]。在本研究中,我们检测了CG4细胞内ROS水平和脂质过氧化产物MDA含量,结果显示OGD/R导致CG4细胞中ROS和MDA含量显著增加,NRG1-BMSCs能够减少OGD/R引起的ROS过量产生和MDA积累。该结果提示,NRG1-BMSCs对OGD/R诱导的氧化应激和脂质过氧化损伤具有一定的抑制作用。此外,本研究表明,NRG1-BMSCs能够恢复OGD/R处理后CG4细胞内T-AOC含量。这些研究结果提示,NRG1-BMSCs能够减轻OGD/R导致的CG4细胞氧化应激,抑制ROS引起的CG4细胞衰老和死亡。PI3K是一种细胞内磷脂酰肌醇激酶,激活后与AKT蛋白结合,通过调节下游蛋白,参与细胞存活、生长及凋亡[27]。有研究报道,NRG1通过激活PI3K/AKT信号通路减轻脓毒症引起的氧化应激和炎症反应,改善大鼠膈肌功能[28]。本研究结果显示,OGD/R抑制CG4细胞内p-PI3K和p-AKT蛋白表达。我们认为OGD/R引起的氧化应激可能抑制细胞内PI3K/AKT通路磷酸化。然而,NRG1-BMSCs能够提高OGD/R处理后CG4细胞内PI3K和AKT磷酸化水平。因此,本研究认为PI3K/AKT信号通路参与调控OGD/R诱导的CG4细胞衰老及死亡,NRG1-BMSCs对CG4细胞的保护作用可能与PI3K/AKT信号通相关。
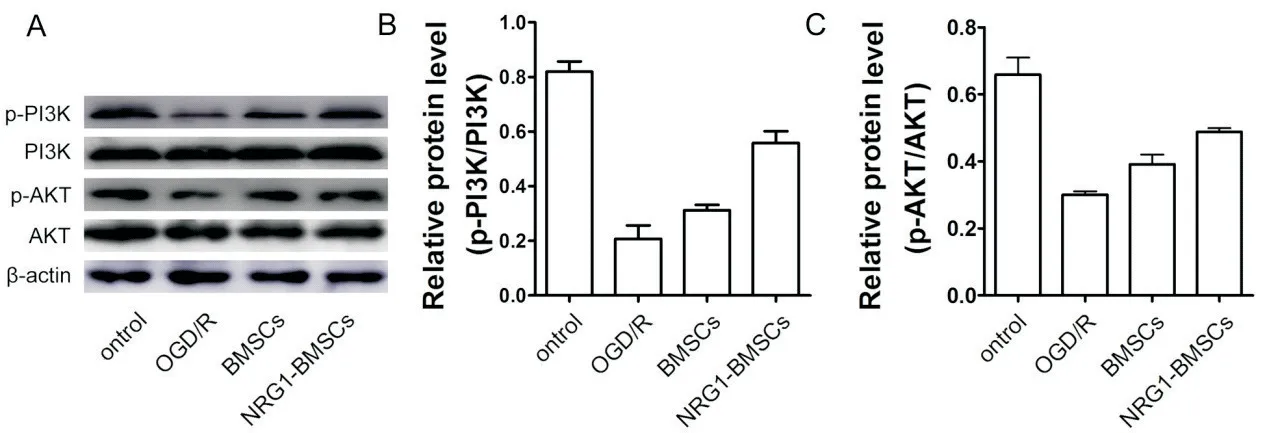
Figure 7.Effects of NRG1-BMSCs on the expression of PI3K/AKT signaling pathway-related proteins in CG4 cells induced by OGD/R.Mean±SD.n=6.**P<0.01 vs control group;##P<0.01 vs OGD/R group.图7 NRG1-BMSCs对OGD/R诱导的CG4细胞PI3K/AKT信号通路相关蛋白表达的影响
综上所述,NRG1-BMSCs能够抑制OGD/R诱导的CG4细胞衰老和死亡,其保护作用可能与调节PI3K/AKT信号通路,减轻细胞氧化应激有关。本研究为脑卒中治疗提供了新的实验依据,但目前研究结果均为体外研究,下一步将采用动物模型深入探究NRG1-BMSCs对OGD/R损伤的修复机制。
