核心钟基因Bmal1通过JNK/caspase-3信号通路抑制缺血再灌注损伤PC12细胞的炎症及凋亡*
2022-12-03曾富康张宇星周德生陈瑶刘利娟李中
曾富康,张宇星,周德生,陈瑶,刘利娟,李中△
(1湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 410208;2湖南中医药大学第一附属医院,湖南 长沙 410007)
脑梗死是一种由脑血管供血障碍导致脑缺血、缺氧和相应的神经功能缺损的常见疾病,是世界范围内导致死亡和残疾的主要原因[1-2]。治疗急性脑梗死的原则是及时恢复缺血区的再灌注,但快速再灌注可加重脑功能损伤,即脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)[3]。由于脑组织缺血缺氧,血液再灌注导致自由基的快速形成,导致大量炎症因子的释放,细胞内钙超载,最终激活凋亡基因,导致神经元细胞凋亡。研究表明,在CIRI中,c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路的过度激活会加剧炎症反应和细胞凋亡[4],而胱天蛋白酶3(caspase-3)作为caspase家族中的一个重要成员,常在细胞凋亡过程中起到关键作用,被广泛用作凋亡的生物标志物[5]。
昼夜节律是自然界从单个细胞到高等生物广泛存在的生命表象,指生物体为了适应地球上周而复始的变化,逐渐进化而形成的机体固有的节律变化,而这种节律正是在复杂的生物钟基因及钟控基因精密的网络调控下,产生节律震荡,调节着机体稳态,影响着体内生理病理过程[6]。Bmal1(brain and muscle Arnt-like 1)作为生物钟的核心基因之一,发挥重要的调控作用。国外实验发现,Bmal1高表达可显著减小缺血再灌注小鼠的梗死体积,减轻脑肿胀,降低神经功能缺损评分,促进神经元存活,减少细胞凋亡[7],但具体调控机制尚不明确。
PC12细胞来源于大鼠肾上腺髓质中的嗜铬细胞瘤,并具有神经内分泌细胞的一般特性,常被广泛应用于神经系统疾病的体外研究[8],因此,我们通过慢病毒转染建立了PC12细胞Bmal1基因沉默模型和阴性对照模型,并使用氧糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)诱 导 建 立CIRI的体外损伤模型,探讨核心生物钟基因Bmal1对脑缺血再灌注损伤后PC12细胞炎症反应及凋亡的影响。
材料和方法
1 材料
1.1 细胞株大鼠肾上腺嗜铬细胞瘤PC12细胞购自中国科学院上海细胞库(货号:TCR9)。
1.2 试剂DMEM高糖培养基(批号:WH0521E91)和DMEM无糖培养液(批号:WH0221E41)均购自武汉普诺赛生命科技有限公司;强效RIPA裂解液(批号:2021JOAC1053+)和CCK-8试 剂 盒(批 号:2021J0GF1008)购自北京普利莱基因技术有限公司;白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号分别为N20036303和N21036304)均购自武汉华美生物工程限公司;抗磷酸化JNK、caspase-3和β-actin抗体(批号分别为80024-1-RR、19677-1-AP和66009-1-Ig)均购自武汉三鹰生物技术有限公司;山羊抗兔IgGⅡ抗(批号:SY0102)购自武汉伊莱瑞特生物科技有限公司;超纯总RNA提取试剂盒(批号:20200813)购自杭州新景生物试剂开发公司;逆转录试剂盒和扩增试剂盒(批号分别为0522011和05238502)购自苏州近岸科技有限公司;β-actin引物由北京擎科生物有限公司合成;慢病毒si-Bmal1(序列 为5"-CACACATGGTTCCACAGCCAGTGAA-3")和si-NC(序列为5"-TTCTCCGAACGTGTCACGTAA-3")购自上海汉恒生物科技(上海)有限公司。
1.3 仪器三气培养箱和Heraeus Fresco 17型超速冷冻离心机(Thermo Fisher Scientific);SW-CJ-1FD超净工作台(苏州苏净仪器自控设备有限公司);Cytation 3型多功能酶标仪(BioTek);Axio Vert A1倒置显微镜(ZEISS);ChemiDocTMXRS+化学发光凝胶成像分析仪、Gel Doc XR+凝胶成像系统、Mini-PROTEAN Tetra型电泳槽和Mini Trans-Blot型转印槽(Bio-Rad);CytoFLEX AW39253流式细胞仪(Beckman)。
2 方法
2.1 细胞培养将PC12细胞放入含有3~4 mL完全培养基(89%高糖DMEM+10%胎牛血清+1%青霉素-链霉素混合液)的25T培养瓶中,置于37 °C的三气培养箱(95%O2和5%CO2)中培养,取对数生长期的细胞用于随后实验。
2.2 PC12细胞OGD/R处理用无糖DMEM替代培养基,然后在5%CO2和95%N2的条件下放置4 h,后再弃去无糖培养基加入高糖培养基并放入含5%CO2的培养箱复氧24 h建立OGD/R模型[9]。
2.3 慢病毒转染及si-Bmal1稳转株建立将PC12细胞作为悬浮液,接种于每孔(6~8)×104的6孔板中24~36 h。当其密度达到40%~50%时,根据MOI=50分别加入合适体积含si-Bmal1和si-NC的慢病毒培养基,24 h后,更换一次培养基。转染72 h后,通过绿色荧光蛋白(green fluorescent protein,GFP)的表达来检测转染效率,建立si-Bmal1稳转株,未处理的PC12细胞作为空白对照组。采用Western blot和RTqPCR检测si-Bmal1沉默效率。感染复数(multiplicity of infection,MOI)=病毒滴度(TU/mL)×病毒体积(mL)/细胞个数。
2.4 CCK-8法检测细胞活力采用CCK-8法检测细胞活力。(1)将细胞分为Bmal1沉默组、阴性对照组及空白组,每组以每孔2×107/L接种于96孔板上。每组重复5个孔,放入三气培养箱中培养24、48、72和96 h。每孔加入10µL CCK-8溶液,在37℃下孵育2 h,使用酶标仪读取450 nm处吸光度(A),根据时间和相应的值绘制细胞活力曲线。(2)分组同前,将PC12细胞以每孔2×107/L接种于96孔板,每组重复5个孔。经OGD/R处理后,每孔加入10µL CCK-8溶液,在37℃下孵育2 h,用酶标仪读取450 nm处A值,并计算细胞活力。细胞活力(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
2.5 Western blot法检测JNK/caspase-3信号通路相关蛋白的表达量收集各组细胞,加入RIPA蛋白裂解液、磷酸酶抑制剂,冰上裂解,提取细胞总蛋白,采用BCA蛋白定量试剂盒测定蛋白质量浓度,配制成2 g/L的蛋白体系,蛋白样品经凝胶电泳,转至PVDF膜,5%牛奶室温封闭60 min,分别加入p-JNK(1∶5 000)、caspase-3(1∶2 000)和β-actin(1∶8 000)Ⅰ抗,4℃孵育过夜;加入山羊抗兔IgG抗体(1∶8 000),37℃孵育60 min;采用ECL高效化学发光试剂盒显影,并用ImageJ软件进行定量分析。
2.6 RT-qPCR检测Bmal1及JNK/caspase-3信号通路mRNA的表达水平按照超纯总RNA提取试剂盒说明书提取细胞总RNA并使用逆转录试剂盒合成cDNA,最后使用扩增试剂盒进行RT-qPCR。反应条件设置为:95℃预变性30 s;95℃5 s,58℃30 s,40个循环;熔解曲线分析65~95℃,每0.5℃1个循环检测荧光信号。采用2-ΔΔCt法进行相对定量分析,以β-actin为内参照。引物序列见表1。

表1 RT-qPCR引物序列Table 1.Sequences of the primers for RT-qPCR
2.7 ELISA法检测细胞上清液中炎症因子水平采用ELISA法检测各组细胞上清液中IL-1β和IL-6的水平。使用酶标仪读取样品在450 nm处的A值。根据标准曲线计算各样本内炎症因子的含量。
2.8 流式细胞术及TUNEL染色法检测各组细胞凋亡率每组的PC12细胞以每孔5×108/L的速度接种在24孔板的载玻片上,用OGD/R处理进行建模。(1)根据凋亡检测试剂盒的说明进行实验。在荧光显微镜每个样本随机选取3个视野,使用ImageJ 5.0软件计数细胞总数目和TUNEL阳性细胞数,计算TUNEL阳性率。TUNEL阳性率(%)=TUNEL阳性细胞数目/细胞总数目×10%。(2)收集各组PC12细胞,用PBS调节浓度至3×108/L,然后在1 mL细胞悬液中加入200µL Annexin V-APC染色液,再加入20µL碘化丙啶染色液并混合,用流式细胞仪检测。凋亡指数(%)=凋亡细胞数量/检测到的细胞总数×100%。
2.9 免疫荧光检测关键蛋白JNK核内表达情况将各组PC12细胞用PBS清洗3次,4%多聚甲醛固定20 min,0.5%Triton X-100通透15 min,5%BSA室温封闭60 min,加入PBS稀释的Ⅰ抗(JNK 1∶500),4℃孵育过夜,PBS清洗3次,后加入PBS稀释的荧光兔Ⅱ抗(1∶500),37℃孵育1 h,PBS清洗后,加入DAPI进行染色,最后抗荧光淬灭剂封片,在荧光显微镜下拍照。
3 统计学处理
采用GraphPad Prism 8.0.2进行统计及画图,计量资料以均数±标准差(mean±SD)表示。组间比较若符合正态性与方差齐性时,采用单因素方差分析,若不符合正态性时,采用Kruskal-Wallis秩和检验。以P<0.05为差异有统计学意义。
结 果
1 转染验证
如图1所示,在荧光显微镜下可观察到si-Bmal1组及si-NC组PC12细胞中GFP发出的荧光,blank组则无荧光蛋白表达,表明转染模型建立成功,确认转染效率>90%;如图2所示,与si-NC组相比,si-Bmal1组PC12细胞中Bmal1的mRNA及蛋白表达水平均显著下降(P<0.05)。
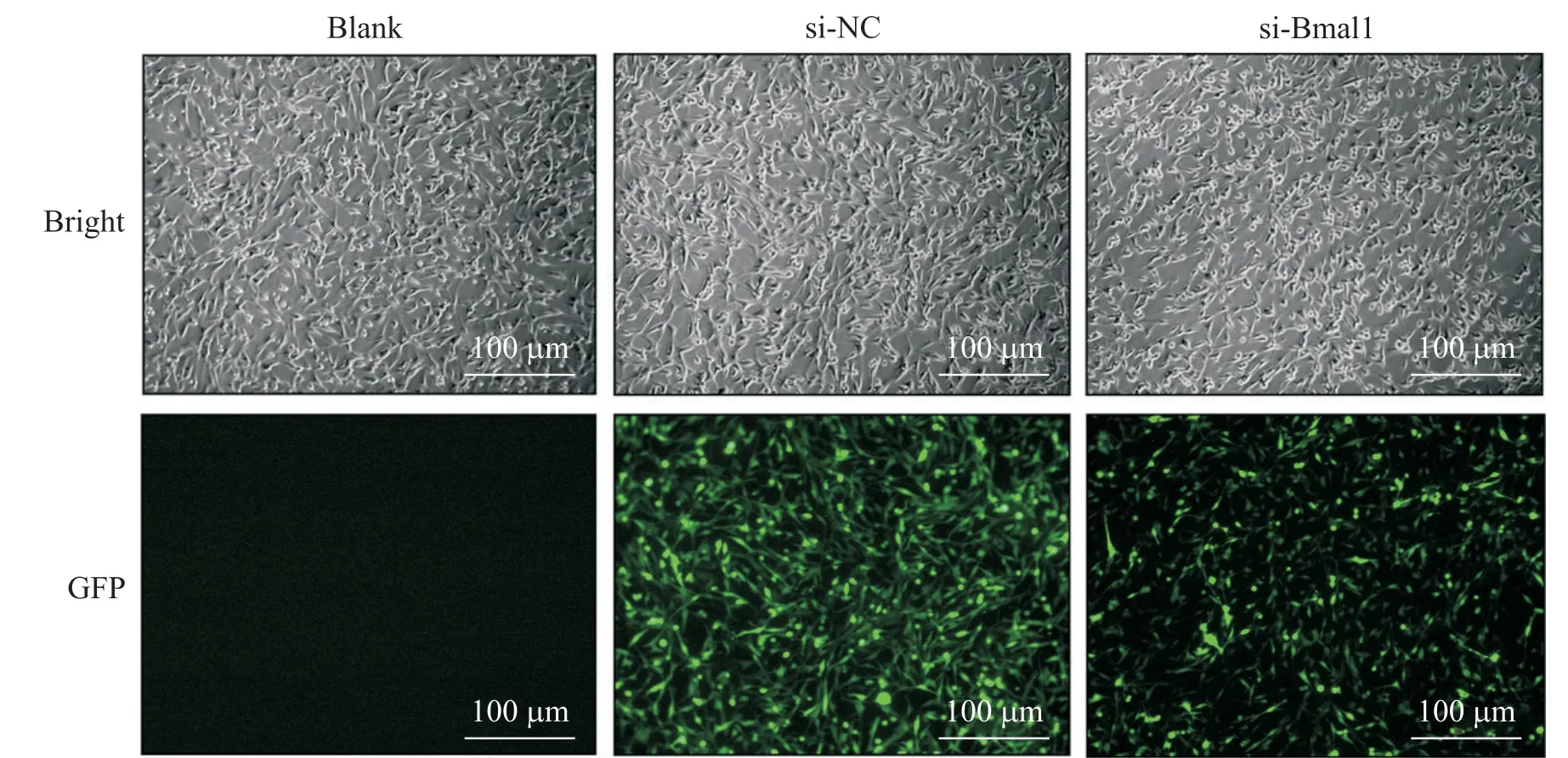
Figure 1.Results of fluorescence expression after lentiviral transfection of circadian clock gene Bmal1.图1 生物钟基因Bmal1慢病毒转染荧光表达结果
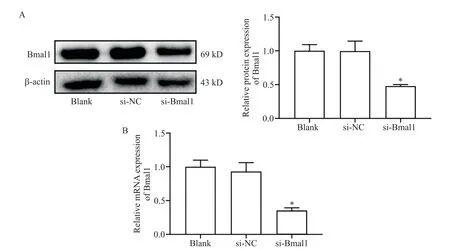
Figure 2.Validation of transfection efficiency of circadian clock gene Bmal1 silencing.A:the protein expression of Bmal1 detected by Western blot;B:the mRNA expression of Bmal1 detected by RT-qPCR.Mean±SD.n=3.*P<0.05 vs si-NC group.图2 生物钟基因Bmal1沉默转染效率验证
2 沉默生物钟基因Bmal1对PC12细胞活力及OGD/R后细胞活力的影响
如图3所示,在48 h、72 h和96 h时,与si-NC组相比si-Bmal1组细胞活力下降(P<0.05);与si-NC组相比,si-Bmal1组在OGD/R后细胞活力抑制程度显著增加(P<0.01),提示沉默生物钟基因Bmal1基因可能会抑制细胞活力及加重OGD损伤。

Figure 3.Effects of circadian clock gene Bmal1 silencing on PC12 cell viability at different time points(A)and after OGD/R(B).Mean±SD.n=5.*P<0.05,**P<0.01 vs si-NC group.图3 沉默生物钟基因Bmal1对PC12细胞活力及OGD/R后细胞活力的影响
3 沉默生物钟基因Bmal1对JNK/caspase-3信号通路相关蛋白的影响
如图4所示,与blank组相比,OGD/R组p-JNK及cleaved caspase-3蛋白水平显著上升(P<0.01);与si-NC组相比,si-Bmal1组p-JNK及cleaved caspase-3蛋白水平进一步升高(P<0.05或P<0.01),提示沉默Bmal1基因会促进JNK蛋白磷酸化和caspase-3蛋白活化。
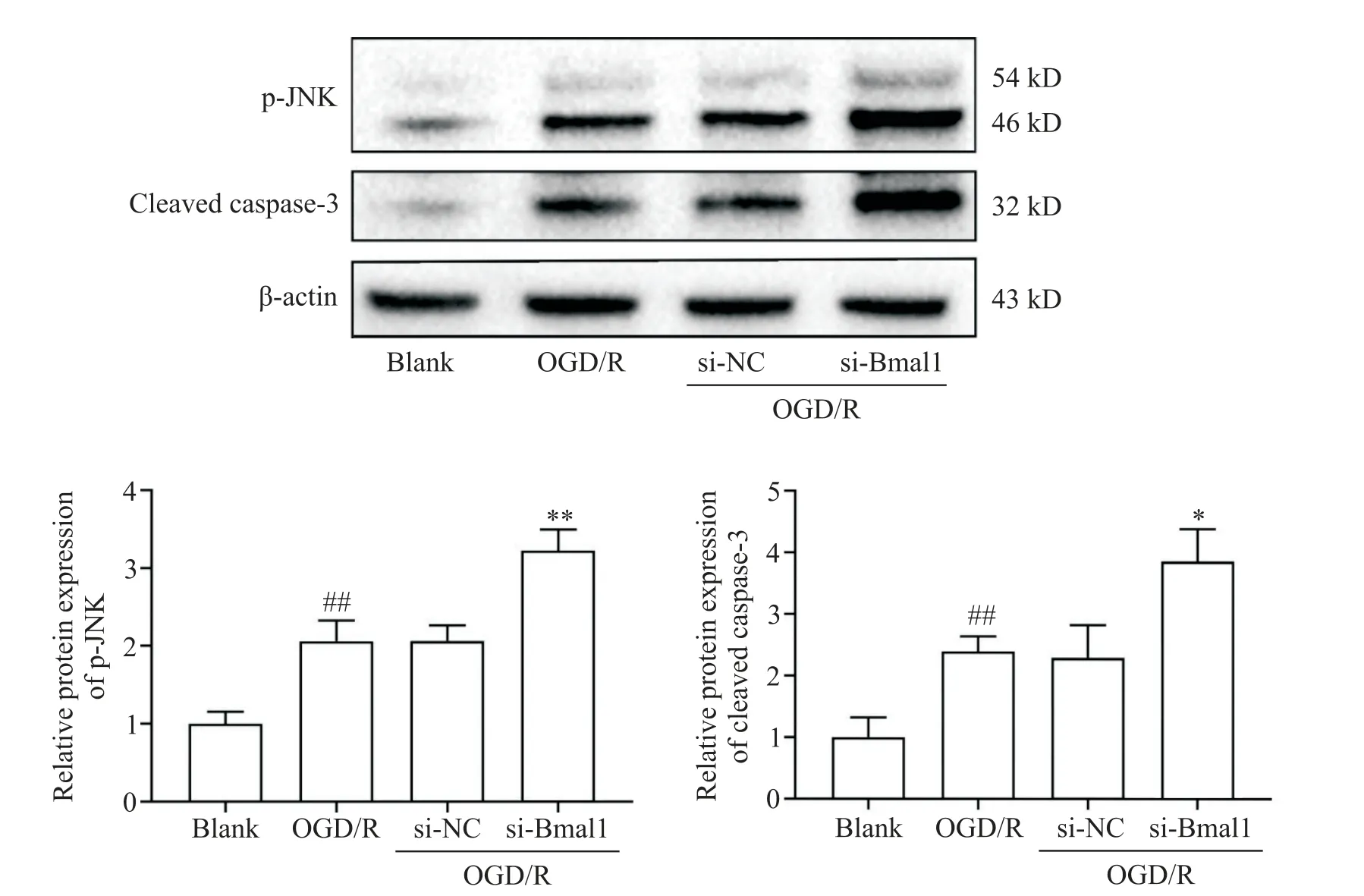
Figure 4.Effects of circadian clock gene Bmal1 silencing on JNK/caspase-3 signaling pathway-related protein expression.Mean±SD.n=4.##P<0.01 vs blank group;*P<0.05,**P<0.01 vs si-NC group.图4 沉默生物钟基因Bmal1对JNK/caspase-3信号通路相关蛋白表达的影响
4 沉默生物钟基因Bmal1对JNK/caspase-3信号通路mRNA表达的影响
如图5所示,和blank组相比,OGD/R组JNK及caspase-3 mRNA表达水平显著上升(P<0.01);与si-NC组相比,si-Bmal1组JNK及caspase-3 mRNA表达水平进一步升高(P<0.05),提示沉默Bmal1基因会促进JNK及caspase-3的mRNA表达。
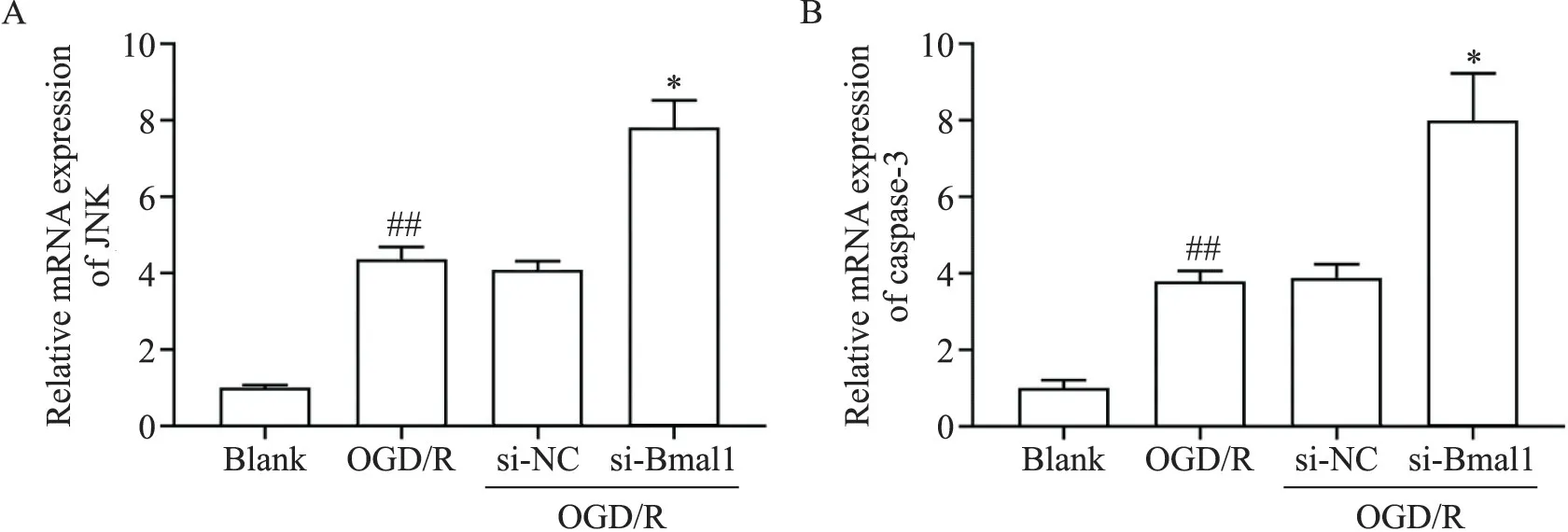
Figure 5.Effects of circadian clock gene Bmal1 silencing on mRNA expression of JNK(A)and caspase-3(B).Mean±SD.n=4.##P<0.01 vs blank group;*P<0.05 vs si-NC group.图5 沉默生物钟基因Bmal1对JNK和caspase-3 mRNA表达的影响
5 沉默生物钟基因Bmal1对细胞上清液中炎症因子水平的影响
如图6所示,与blank组相比,OGD/R组炎症因子IL-6及TNF-α水平显著上升(P<0.01);与si-NC组相比,si-Bmal1组IL-6及TNF-α水平进一步升高(P<0.01),提示沉默Bmal1基因会促进细胞炎症因子IL-6及TNF-α的分泌。
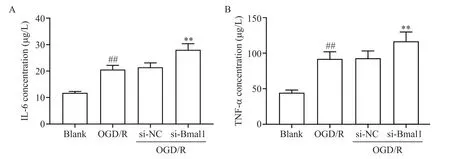
Figure 6.Effects of circadian clock gene Bmal1 silencing on the levels of inflammatory factors in the cell supernatant.A:IL-6;B:TNF-α.Mean±SD.n=4.##P<0.01 vs blank group;**P<0.01 vs si-NC group.图6 沉默生物钟基因Bmal1对细胞上清液中炎症因子水平的影响
6 沉默生物钟基因Bmal1对细胞凋亡水平的影响
如图7所示,与blank组相比较,OGD/R组细胞凋亡指数及TUNEL阳性率水平均显著上升(P<0.05或P<0.01);与si-NC组相比,si-Bmal1组细胞凋亡指数及TUNEL阳性率则进一步升高(P<0.05或P<0.01),提示沉默Bmal1基因会加重细胞凋亡。
7 沉默生物钟基因Bmal1对JNK核内表达的影响
如图8所示,blank组细胞JNK蛋白于胞浆及细胞核中均有分布;经OGD/R诱导刺激后,JNK蛋白在细胞核内荧光表达强度显著升高(P<0.01);si-Bmal1组JNK蛋白较si-NC组相比在细胞核中荧光表达强度进一步升高(P<0.05),提示沉默Bmal1基因会促进JNK蛋白的核内表达。
讨 论
CIRI是急性脑梗死中常见的病理现象,细胞凋亡是再灌注损伤重要发病机制,也是继发性脑功能损伤的重要原因,再灌注损伤细胞凋亡的机制可能与一系列炎症反应和凋亡因子及信号转导途径有关。细胞凋亡是一种细胞死亡形式,它是因为细胞内外因素的激活,导致细胞本身自杀程序形成的病理生理过程。目前对于再灌注损伤所引发的细胞凋亡暂无特殊治疗方式及药物,因此减轻细胞凋亡或许能成为脑缺血再灌注损伤的重要干预手段。大量文献表明,昼夜节律显著影响脑梗死的易感性、损伤、恢复和治疗反应机制[10]。昼夜节律是在细胞水平上发生的一种内源性振荡,其周期约为24 h,通过生物钟基因调节着细胞生长代谢,如增殖和分化等,参与了哺乳动物的各种病理生理过程的调节和维持[11]。Bmal1是生物钟的核心基因之一。研究发现,Bmal1基因敲除可促进人原髓细胞白血病HL-60细胞的凋亡,抑制细胞增殖能力[12];靶向敲除生物钟核心基因Bmal1的小鼠不仅显示出昼夜节律的完全丧失、严重地降低了寿命,还伴有各种早衰症状和认知缺陷、提高脑血管疾病的发病风险[13]。Bmal1作为生物钟基因负反馈回路的关键调控元件,调节着体内的氧化应激、炎症反应、凋亡和自噬等过程[14-16]。实验研究表明,昼夜节律的破坏会加剧脑缺血再灌注小鼠大脑中的炎症反应,导致缺血性中风后梗死面积增加,可能与免疫反应失调相关[17]。进一步研究发现,核心钟基因Bmal1可直接通过E-box与其启动子结合来控制核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)的mRNA表达以调节其活性,缺乏Bmal1的细胞中Nrf2活性显著降低,导致炎症细胞因子产生增加[18]。国外研究证明,敲减Bmal1基因会抑制沉默信息调节因子1(silent information regulator 1,SIRT1)的表达,从而加剧了缺氧/复氧(hypoxia and reoxygenation,H/R)刺激下人肾皮质近曲小管上皮细胞HK-2的线粒体损伤,增加细胞凋亡的程度[19]。以上文献均说明生物钟Bmal1基因不仅作用于缺血再灌注损伤中的单一机制,而是多重影响着缺血再灌注损伤导致的神经元凋亡、氧化应激及自噬等过程[20],但Bmal1基因是如何调控细胞凋亡的途径尚未确定。
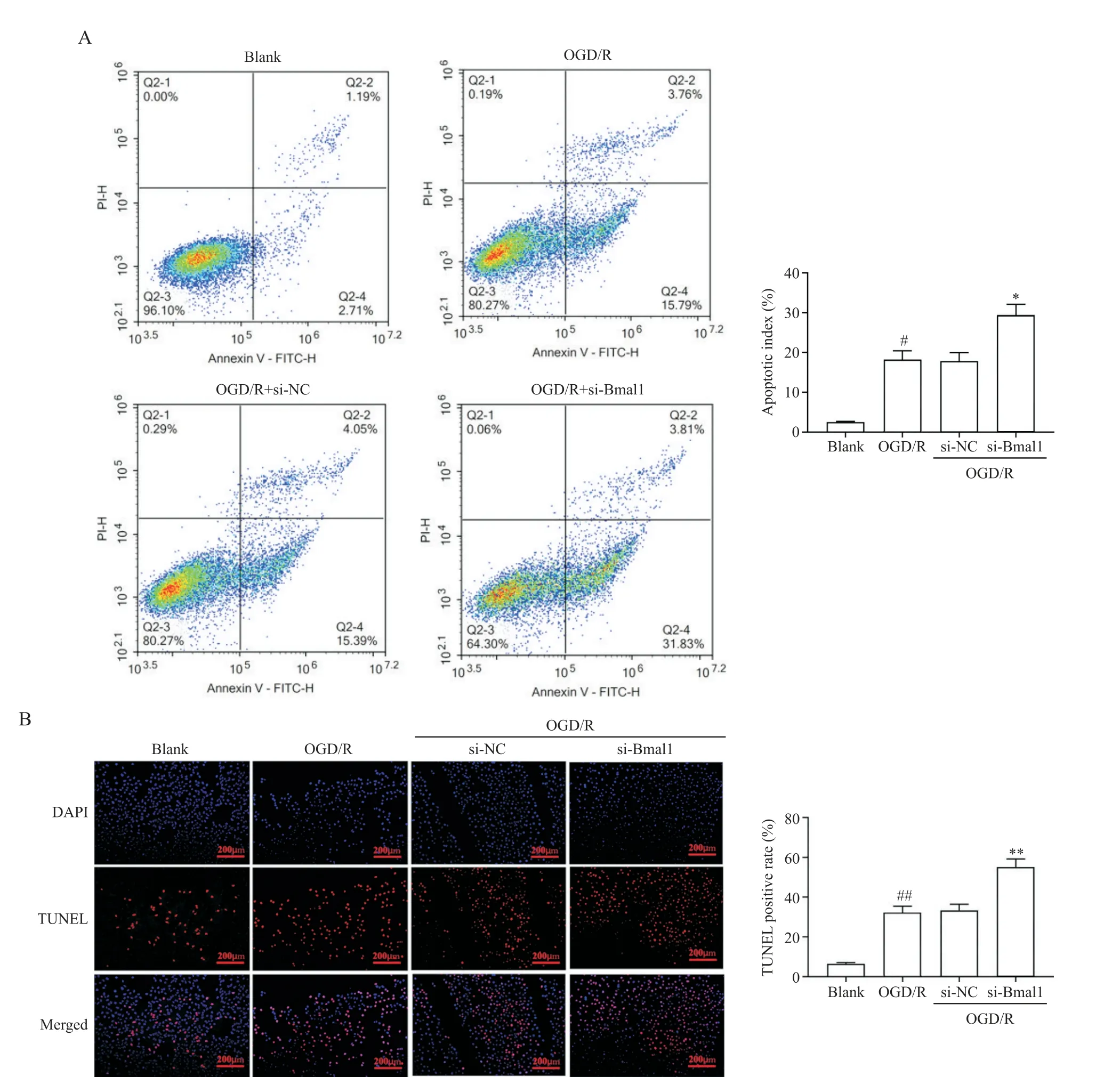
Figure 7.Effect of circadian clock gene Bmal1 silencing on the level of apoptosis.A:flow cytometry;B:TUNEL staining.Mean±SD.n=3.#P<0.05,##P<0.01 vs blank group;*P<0.05,**P<0.01 vs si-NC group.图7 沉默生物钟基因Bmal1对细胞凋亡水平的影响
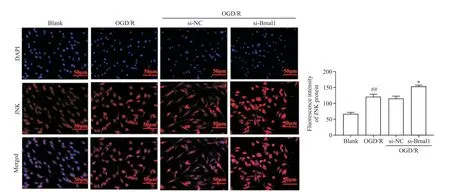
Figure 8.Effect of circadian clock gene Bmal1 silencing on JNK protein expression.Mean±SD.n=3.##P<0.01 vs blank group;*P<0.05 vs si-NC group.图8 沉默生物钟基因Bmal1对JNK蛋白表达的影响
JNK是丝裂素活化蛋白激酶(mitogen-activated protein kinases,MAPK)家族成员之一,也被称为应激活化蛋白激酶(stress-activated protein kinase,SAPK)。JNK通路调节多种生理病理过程,包括炎症反应、细胞分化、细胞增殖和凋亡等[21],是已被证实在缺血再灌注损伤中发挥重要调控作用的信号通路之一,且在缺血再灌注损伤过程中存在过度激活现象,抑制JNK通路可保护神经元免受损伤[22]。JNK在细胞质及细胞核中均有分布,受到刺激后,JNK在细胞核中迅速显著积累,导致相应基因的表达发生改变[23]。研究显示,脑缺血再灌注的刺激首先激活JNK信号通路,被激活的JNK又可进一步磷酸化其核底物及胞浆底物,促进神经元的凋亡。JNK激活后可通过2条途径发挥作用:一是上调促凋亡相关蛋白和炎症因子如Bax、FasL和TNF等的表达从而激活死亡受体凋亡通路,另一条途径是通过调节Bcl-2家族成员的活性参与线粒体介导的细胞凋亡通路,通过这2条途径激活的caspase-3可激活CAD(caspase-activated DNase),并可切割核DNA修复酶,从而导致核DNA不可复性的损伤,最终导致细胞凋亡[24]。我们实验结果发现PC12细胞在OGD/R诱导后细胞活力显著下降,JNK mRNA及p-JNK蛋白水平均上升,JNK蛋白核内表达增强,下游蛋白caspase-3被激活mRNA及蛋白表达均上调,炎症因子TNF-α和IL-6水平升高,细胞凋亡数增加,提示OGD/R诱导会激活JNK通路,从而促进炎症因子的释放及细胞凋亡。
综上所述,我们猜测Bmal1基因是否能够通过调控JNK信号通路来减少细胞炎症反应及凋亡损伤,因此我们通过慢病毒转染建立PC12细胞Bmal1基因沉默模型及阴性对照模型,采用OGD/R诱导建立CIRI体外模型。结果显示,沉默生物钟基因Bmal1表达可显著抑制PC12细胞的活力,这与既往的研究结果相符,但Bmal基因调控细胞增殖的机制此次实验未能深入研究。我们还发现相较正常组及Bmal基因阴性对照组,Bmal1基因沉默会增强OGD/R对细胞活力的抑制作用,增加炎症因子IL-6和TNF-α的分泌,促进细胞凋亡。我们通过Western blot、RT-qPCR及免疫荧光等检测手段发现Bmal1基因沉默组在OGD/R后相较模型组及Bmal1基因阴性对照组JNK信号通路及下游caspase-3其蛋白及基因的表达水平进一步升高,炎症因子水平IL-6和TNFα进一步增加,Bmal1基因沉默组免疫荧光JNK蛋白核内的高表达情况亦佐证了Bmal1基因对JNK/caspase-3信号通路具有调控作用。我们证实沉默核心钟基因Bmal1会促进JNK/caspase-3信号通路过度激活从而加重脑缺血再灌注损伤后细胞炎症反应及凋亡损伤。或许生物钟基因可以作为一种新的治疗靶点,通过调节生物钟或它的重要组成部分来降低CIRI所引发的细胞炎症反应及凋亡损伤。
