创伤后神经元自噬水平下降及谷氨酸介导的凋亡增多可导致创伤后癫痫易患性增加*
2022-12-03王洁柴晓洋李昱晨陆克义
王洁,柴晓洋,李昱晨,陆克义
(1山西医科大学第一医院神经内科,山西 太原 030001;2首都医科大学附属北京潞河医院,北京 101149;3山西医科大学第一医院核医学科,山西 太原 030001)
创伤后癫痫(post-traumatic epilepsy,PTE)是患者在创伤性脑损伤(traumatic brain injury,TBI)一周之后出现的癫痫发作[1],其潜伏期由数周至数年不等。在TBI患者中PTE的发病率为1.9%~30%[2]。临床上,基于一些评价标准,如格拉斯哥昏迷评分、颅骨损伤程度、神经影像检查结果等,可将TBI分为轻度、中度及重度,轻型TBI占TBI的90%以上[3]。轻型TBI后发生PTE危害巨大,然而临床研究发现,脑电图[4]、脑磁图[5]等均无法作为预测PTE发生的有效检查手段,故尚不知如何预测及预防PTE的发生,明确轻型TBI后PET的发病机制对于早期预测并预防其发生显得尤为重要。
目前认为,PTE是一种非刺激性、由脑组织功能缺损而诱发的癫痫发作形式。一些研究表明,TBI后引发的兴奋性递质释放增多、神经细胞丢失[6]及血脑屏障破坏均可增加PTE发生的风险。这些证据提示在PTE潜伏期内发生的神经生物学改变是引起PTE的重要原因。
谷氨酸(glutamate,Glu)是中枢兴奋性神经递质,大脑皮质含量最高。Glu过多可引起活性氧过量生成和/或细胞内抗氧化防御系统受损,使脑细胞过度兴奋、自由基产生增多,并进而导致脑细胞损伤,引起癫痫、痴呆等疾病[7]。Glu可通过诱导脑细胞线粒体释放活性氧,进而导致细胞损伤。有研究发现,通过调节神经元氧化应激损伤[8]、保护线粒体膜电位[9],可以减弱Glu所介导的细胞毒性作用,发挥神经保护作用。
本研究制备轻型TBI后PTE模型,观察在PTE潜伏期内,皮层组织谷氨酸、凋亡及自噬水平变化。探讨PTE潜伏期内的病理生理改变,为研究PTE的发生机制提供依据。
材料和方法
1 实验材料
1.1 实验动物雄性SD大鼠,体重180~220 g,由山西医科大学实验动物中心提供,动物合格证编号为:SCXK(晋)2019-0004。大鼠在室温(25℃)下进行12 h的光照/黑暗循环饲养,适时喂水、喂食。本研究获得山西医科大学伦理委员会批准。
1.2 主要试剂兔抗大鼠微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)、beclin-1和β-actin抗体(Cell Signaling Technology);生物素标记的山羊抗兔IgG、生物素标记的马抗小鼠IgG和辣根过氧化物酶标记的链亲和素(北京中衫生物技术有限公司);caspase ELISA试剂盒为Invitrogen产品;雷帕霉素(rapamycin,Rapa)为LC Laboratories产品;其他试剂均为国产分析纯。
2 方法
2.1 轻型TBI后PTE模型制备用10%水合氯醛(3 mL/kg)腹腔注射麻醉大鼠后,将其置入Noble-Collip创伤仪中(直径约30.5 cm),以每分钟40转,转动5 min。创伤组大鼠随鼓转动,每转1圈跌落1次,sham组大鼠固定于创伤仪内壁,只随创伤仪转动,不由高处跌落。观察造模后大鼠饮食活动情况,观察并记录TBI后7~90 d内发生痫性发作大鼠的数量及其发作形式。对于发生痫性发作的大鼠通过脑电图观察并记录其脑电波情况,确认发生痫性发作。TBI后4 d将4µL的100 mmol/L FeCl2水溶液注射至成年SD大鼠感觉运动皮层(硬膜下1.2 mm),注射速度为1µL/min。对照组注射生理盐水。观察并记录TBI后7~90 d内发生痫性发作大鼠的数量及其发作形式。对于发生痫性发作的大鼠通过脑电图观察并记录其脑电波情况,确认发生痫性发作。
2.2 癫痫记录观察并记录大鼠创伤前(30 min)、后(7~90 d)大鼠的行为学变化。用数字摄像机持续监测大鼠的行为。根据Racine[10]制定的分级标准判定癫痫发作:0级(无任何癫痫发作)、Ⅰ级(凝视发作)、Ⅱ级(出现规律性点头、伴或不伴面部抽动)、Ⅲ级(一侧前肢震颤)、Ⅳ级(站立、双前肢震颤及持续性点头)、Ⅴ级(前肢震颤加重,失去平衡跌倒而出现全身强直-阵挛性发作)和Ⅵ级(发作衰竭导致死亡)。PTE发生率=发生痫性发作的大鼠数/每组大鼠数×100%。
2.3 电极植入和视频脑电图记录将发作癫痫的大鼠称重,用水合氯醛(400 mg/kg,腹腔注射)麻醉。将大鼠固定于立体定位仪上,用镊子轻轻拉出舌头,防止呼吸道阻塞,两侧对称,调整齿杆-2.3 mm固定,使颅骨处于同一水平面。用单面刀片剃去头部毛,用碘伏消毒头部皮肤。依次切开皮肤、皮下组织及骨膜,钝性分离骨膜以暴露颅骨。3%H2O2烧灼止血并消毒颅骨表面,清晰暴露前、后囟。用颅骨钻钻透颅骨,小心打2个孔。将两个脑电记录电极置于颅骨孔中,轻轻接触皮层。使用牙科水泥覆盖并固定电极在颅骨上,无线发射端置于肩背侧。缝合皮肤,将动物放回鼠笼,置温暖安静处,直至清醒。用于记录脑电信号。
2.4 Western blot将创伤后大鼠海马组织在冰浴环境中用酶解缓冲液溶解,超声匀浆后离心,SDSPAGE分离蛋白,将蛋白转至PVDF膜上,经封闭、与Ⅰ抗孵育、与相应Ⅱ抗孵育后,检测免疫印迹。配制化学发光液,通过全自动曝光仪显像,用ImageJ软件分析条带灰度值。以β-actin为内参照,得出目的蛋白相对表达量。
2.5 ELISA法取创伤后大鼠海马组织50 mg组织置于培养皿中,手术剪剪碎,加入200µL预冷的裂解液工作液,冰上用玻璃匀浆器匀浆。将匀浆好的样本转移到1.5 mL的离心管中,冰浴放置5 min裂解,12 000 r/min在4°C下离心10~15 min,小心地吸取上清转移至新的EP管中,并置于冰上待用。取少量样本用Bradford法测定蛋白浓度,按照试剂盒流程测定caspase-3及caspase-9酶活性。
2.6 高效液相色谱将已经过滤并脱气的流动相注入储液罐;用流动相冲洗金属过滤器,然后将过滤器浸入储液罐的流动相中;依次启动高效液相色谱仪:泵→检测器→高效液相色谱软件→设置软件参数;启动泵,运行5 min,结束后关闭所有排气阀;以固定的速率(1 mL/min)运行流动相,走基线,直到基线平稳;基线平稳后,在软件中设置样品的运行参数;将固定体积的样品溶液注入进样阀,然后在软件中启动注入命令,进样器中的样品溶液就随流动相进入色谱柱;通过软件监视各项读数,当检测器检测到样品所有峰值,停止运行并设置新的进样。
4 统计学处理
采用SPSS 21.0软件进行统计分析。数据以均数±标准差(mean±SD)表示。两组间均数比较用两样本t检验,多组之间的比较采用单因素方差分析,率的比较采用卡方检验或Fisher检验。以P<0.05为差异有统计学意义。
结 果
1 TBI后大鼠PTE易患性增加
TBI后大鼠7~90 d内PTE的发生率为11.2%,与sham组相比差异有统计学意义(P<0.01),提示PTE模型制备成功。
为观察TBI之后大鼠对不良刺激的敏感性,在造模后第4天予大鼠皮层注射明显低于致痫剂量的FeCl2,结果显示TBI+FeCl2组73.2%大鼠出现复杂部分性发作,同期sham+FeCl2组无1例大鼠出现痫性发作,TBI+FeCl2组与TBI组及sham+FeCl2组相比均有显著差异(P<0.01),见图1。

Figure 1.Incidence of post-traumatic epilepsy(PTE)of the rats in sham,TBI,TBI+FeCl2,sham+FeCl2 and zVAD+TBI+FeCl2 groups.Mean±SD.n=6.**P<0.01 vs sham group;##P<0.01 vs TBI group;△△P<0.01 vs TBI+FeCl2 group.图1 各组大鼠PTE的发生率
2 神经细胞凋亡是TBI后PTE易患性增加的可能原因之一
TBI后给予FeCl2检测到大鼠海马神经细胞凋亡明显增多,caspase-3及caspase-9活性升高,与sham+FeCl2组相比差异有统计学意义(P<0.01),见图2。
为观察凋亡对PTE的影响,预先给予凋亡抑制剂zVAD-FMK(zVAD),结果显示zVAD+TBI+FeCl2组PTE发生率下降至32.6%,与TBI+FeCl2组相比差异有统计学意义(P<0.01),见图1。
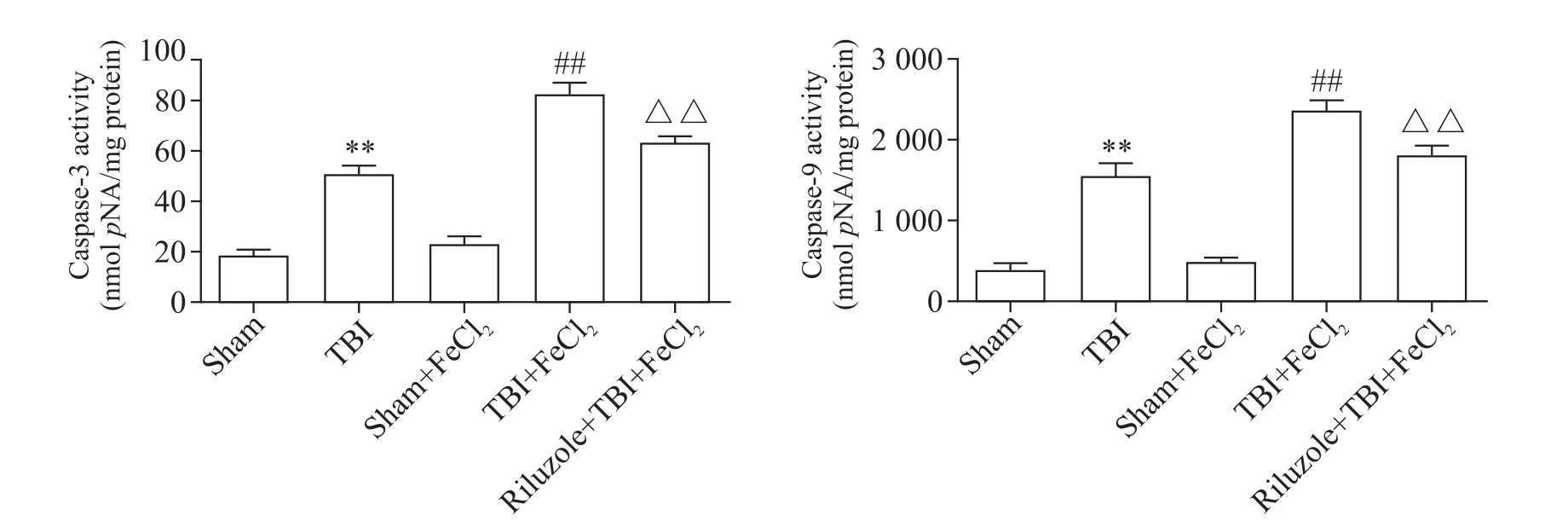
Figure 2.The activity of caspase-3 and caspase-9 in sham,TBI,sham+FeCl2,TBI+FeCl2,riluzole+TBI+FeCl2 groups.Mean±SD.n=6.**P<0.01 vs sham group;##P<0.01 vs sham+FeCl2 group;△△P<0.01 vs TBI+FeCl2 group.图2 各组大鼠caspase-3和caspase-9活性
3 PTE潜伏期内脑组织中Glu生成增多可引起神经细胞凋亡水平升高
与sham+FeCl2组相比,TBI+FeCl2组 脑 内Glu含量显著增多(P<0.01),见图3。为进一步明确Glu升高对凋亡的影响,预先给予Glu释放抑制剂riluzole,结果显示caspase-3和caspase-9活性均显著降低(P<0.01),见图2。
4 PTE潜伏期内稳定线粒体膜及清除自由基可抑制神经细胞凋亡
与TBI+FeCl2组相比,预先给予线粒体膜稳定剂cyclosporine A可 显 著 降 低caspase-3和caspase-9活性(P<0.01),而给予自由基清除剂SOD后,caspase-9和caspase-3活性亦显著下降(P<0.05),见图4。
5 TBI后自噬水平下降可导致神经细胞凋亡增多
与sham+FeCl2组相比,TBI+FeCl2组大脑皮层组织的LC3-II及beclin-1蛋白水平均显著下降(P<0.01);预先给予自噬激动剂Rapa后,自噬水平升高,引起caspase-3水平下降,与TBI+FeCl2组相比有显著差异(P<0.01),见图5。这提示上调自噬可减轻神经细胞凋亡。
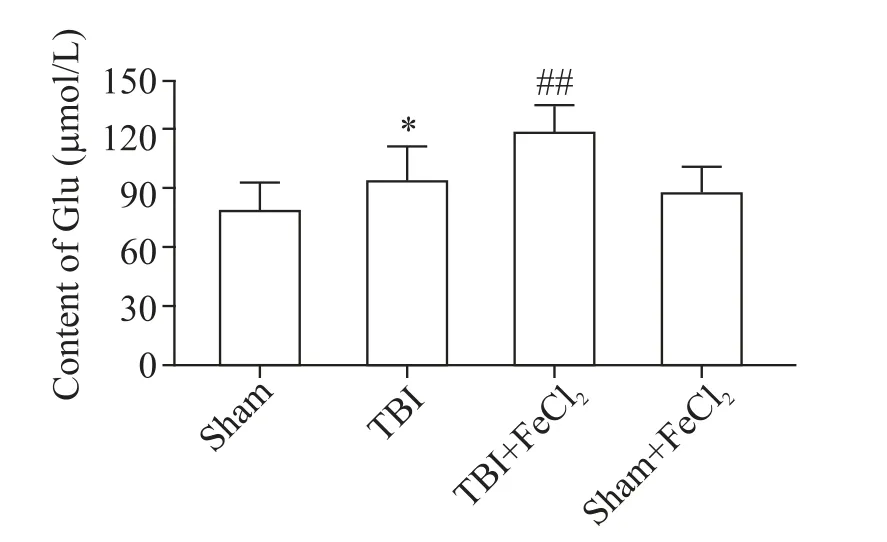
Figure 3.Glutamate(Glu)content in rat brain tissues in sham,TBI,sham+FeCl2,and TBI+FeCl2 groups.Mean±SD.n=6.*P<0.05 vs sham group;##P<0.01 vs sham+FeCl2 group.图3 各组大鼠脑内Glu含量
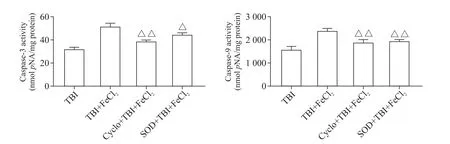
Figure 4.Effects of stabilizing mitochondrial membrane and scavenging free radicals on the apoptosis in TBI,TBI+FeCl2,Cyclo+TBI+FeCl2 and SOD+TBI+FeCl2 groups.Mean±SD.n=6.△P<0.05,△△P<0.01 vs TBI+FeCl2 group.图4 稳定线粒体膜及清除自由基对凋亡的影响

Figure 5.The protein expression of autophagy-related molecules and apoptosis-related molecules.Mean±SD.n=6.##P<0.01 vs sham+FeCl2 group;△△P<0.01 vs TBI+FeCl2 group.图5 各组细胞自噬和凋亡相关蛋白的表达情况
讨 论
PTE是TBI后的迟发性并发症之一,TBI可以是由单纯脑创伤引起,也可以是全身机械性创伤的局部表现。在实际生活中,TBI往往是一些柔和的以及震荡性的轻型TBI。轻型TBI通常被称为运动相关损伤的脑震荡[11],轻型TBI的发病率是重度及中度脑损伤的10倍以上。在美国,每年有超过380万人被诊断出患有外伤性脑损伤,其常见原因包括机动车事故、运动损伤和与工作相关的事故[12]。这部分患者在全身损伤过程中,头颅及心脏并未出现直接的损伤,然而有研究报道,其PTE发生率[13]明显升高。目前3种最常用于研究PTE的TBI动物模型是:外侧液压冲击损伤、重量下降冲击加速度损伤和受控的皮质损伤。这三种动物模型均需要精确的外科开颅手术,使大脑的结构完整性遭到破坏,均为局灶性损伤,且损伤程度较重。除此之外实行开颅术(或颅骨切除术),可能会对硬脑膜产生轻微损伤或手术期间导致出血,这种损伤本身就有引起癫痫发作的可能。本研究中,我们使用Noble-Collip鼓制轻型TBI后PET模型,该模型可较好的模拟临床上柔和的以及震荡性的损伤过程。本研究发现,轻型TBI后大鼠7~90 d内PTE的发生率为11.2%,与既往报道相似,提示模型制备成功。
创伤后癫痫模型的局限性之一在于其PET发生率较低,尤其是轻型TBI后的PET,而非创伤后癫痫动物模型的癫痫发生率相对稳定。严重创伤可以直接损伤脑细胞,导致皮层神经细胞异常放电,引起早发性癫痫,而轻度创伤可以通过使神经元细胞对损伤的敏感性增高,导致PTE易患性增加。皮层下注射FeCl2是制造创伤后癫痫的经典模型,通过模拟损伤后红细胞外渗、溶解和含铁血黄素沉积于神经纤维网内而导致癫痫发生,其致痫效果与剂量相关,小剂量不足以引起癫痫发作[14]。本研究在TBI后第4天予大鼠皮层下注射明显低于致痫剂量的FeCl2,期间73.2%大鼠出现复杂部分性发作,而同期对照组中无1例大鼠出现痫性发作。结果表明,轻型TBI后PET对损伤的敏感性增加,提示其潜伏期内可能存在神经生物学改变,进而导致其对轻微损伤的敏感性增加。
细胞凋亡是一种由基因调控和一系列酶参与的细胞主动死亡过程,是一系列caspase级联反应的结果[15]。caspase可通过多条途径被活化,其中经线粒体途径导致线粒体外膜通透化,释放多种致凋亡因子引起caspase-9活化,最终激活凋亡效应酶即caspase-3,通过水解多种重要的蛋白而导致细胞凋亡。已有研究证实,神经保护剂可以通过减轻TBI后脑水肿及皮层细胞凋亡发挥脑保护作用[16];通过降低caspase活性进而起到改善TBI后大鼠认知的作用[17];通过减少TBI后继发性神经元丢失促进神经功能恢复[18],提示神经细胞凋亡在TBI后脑损伤过程中发挥了重要作用。本研究发现,与sham+FeCl2组相比,TBI后给予FeCl2检测到大鼠脑内神经细胞凋亡明显增多,caspase-3和caspase-9活性显著升高。为进一步明确PTE易患性增加是否与神经细胞凋亡有关,我们在皮层注射小剂量FeCl2前,给予凋亡抑制剂zVAD-FMK后,caspase-3水平下降,且PTE的发生率明显下降,提示神经细胞凋亡是TBI后PTE易患性增加的重要原因之一。在生理情况下,细胞凋亡受多种促凋亡分子和(或)抑制凋亡分子之间平衡的调控,而在病理状况下,调控机制的失衡将导致疾病的发生。因此,阐明PTE潜伏期内促凋亡的机制,将成为预防PTE研究中非常有意义的关键环节。
Glu是中枢兴奋性神经递质,Glu过多可引起活性氧过量生成和/或细胞内抗氧化防御系统受损,使脑细胞过度兴奋、自由基产生增多,并进而导致脑细胞损伤。有研究发现,Glu可通过诱导脑细胞线粒体释放活性氧,导致细胞损伤,而通过抑制一氧化氮合酶活性及减少一氧化氮的生成可以减弱Glu所介导的细胞毒性作用,发挥神经保护作用[8]。以上研究提示,脑内Glu产生增多可介导神经细胞损伤。在正常情况下,大多数位于线粒体内膜上的通透性转换孔(mitochondrial permeability transition pore,MPTP)处于关闭状态,当机体在各种损伤因素作用下MPTP开放,线粒体膜电位下降,线粒体的通透性升高,细胞内活性氧等物质生成增多,促进细胞凋亡并导致相关器官的损伤。本研究发现,与sham+FeCl2组相比,TBI+FeCl2组检测到大鼠脑内Glu含量和神经细胞凋亡均明显增多,以caspase-3及caspase-9的表达增高为主。而预先给予Glu抑制剂后,caspase-3及caspase-9表达下降,提示PTE潜伏期内Glu产生增多可能通过损伤线粒体导致神经细胞凋亡增多。
在进一步探讨线粒体损伤在促进凋亡中的作用机制时,我们发现预先给予线粒体膜稳定剂后,caspase-3及caspase-9明显下降,而给予自由基清除剂后,虽然能够降低caspase-9明显,但只能轻度降低caspase-3,而这一现象无法用损伤线粒体释放活性氧促凋亡的机制解释,提示由Glu导致的线粒体损伤可能通过其他机制介导神经细胞凋亡。
正常情况下,受损伤的线粒体需要被及时清除以维持细胞的正常活动状态。研究表明,细胞主要通过自噬选择性地清除损伤的线粒体[19]。自噬作为真核生物细胞内基本的新陈代谢活动之一,存在于神经元、胶质细胞和细胞外基质中,在其中发挥着的双刃剑作用[20],在生理状况下,自噬能起到保护神经细胞的作用,而自噬的调节失常会引起神经退行性疾病[21]及癫痫[22]。本研究中,我们检测了PTE潜伏期内神经细胞的自噬水平,结果发现其水平明显下降,而注射小剂量FeCl2之前预先给予自噬激动剂Rapa后,自噬水平升高,神经细胞凋亡明显降低,提示自噬水平的降低是导致神经细胞凋亡的可能原因。
综上所述,本研究发现PTE潜伏期内Glu释放增多,通过引起自噬水平下降进而导致神经细胞凋亡增加,可能是轻型TBI后PTE易患性增加的机制之一。
