蒲公英总黄酮对CCl4 致大鼠肝损伤的保护作用
2022-12-03朱正望付双楠薛宁马瑞雪郭桓博苗明三朱平生
朱正望 付双楠薛宁 马瑞雪 郭桓博 苗明三 朱平生
(河南中医药大学, 河南 郑州450046)
肝脏是人体重要的解毒和代谢器官,多种因素如病毒感染、药物滥用、有毒化学物质、过度饮酒等都会引起肝功能异常导致肝损伤,是肝硬化、肝癌等众多肝脏疾病的重要始动因素,重者可进一步发展为急性肝衰竭[1⁃2]。针对肝损伤的早发现、早干预对避免其进展为重型肝病和保障大众健康具有十分重要的意义。临床上对于肝损伤的治疗多采用维生素类、核苷类似物、保肝降酶药等对症治疗,对改善患者的症状虽有一定的疗效,但也会加重肝脏的负担[3⁃4]。因此,探索更安全高效、早期干预的药物对于临床肝病的防治具有重要意义。
中医药对于肝病的防治疗效显著,近年来在肝病的基础实验和临床研究方面已成为主要的热点[5⁃6]。蒲公英是一种应用十分广泛的药食同源中药,性寒,味苦、甘,归肝、胃经,具有清热解毒、利尿消肿的作用[7]。黄酮类是蒲公英的有效成分之一,具有抗炎、抗氧化、保肝利胆、增强免疫力等多种药理活性,应用价值大[8⁃9]。众多研究发现,黄酮类成分在抗肝损伤方面效果显著,具有广阔的开发前景和研究空间[10⁃11]。前期研究发现,Arg1、α⁃GST、PNP、GLDH 作为CCl4致大鼠肝损伤早期生物标志物,较传统肝功能检测指标具有较好的灵敏性[12]。本研究在此基础上检测CCl4肝损伤大鼠传统肝功能指标、脂质过氧化指标、早期生物标志物,观察蒲公英总黄酮对CCl4肝损伤早期的干预作用。
1 材料
1.1 仪器 Multiskan Fc 型酶标仪、YZB5065⁃2011 型洗板机(美国Thermo Fisher Scientific 公司);KDC⁃160HR 型高速冷冻离心机(合肥科大创新股份有限公司中佳分公司);UV⁃2000 型紫外可见分光光度计[尤尼柯(上海)仪器有限公司];BX63 型电动显微镜(日本Olympus 公司);ABI7500 型荧光定量PCR 仪(美国Applied Biosystems公司)。
1.2 试剂与药物 蒲公英总黄酮(含量>50%,批号20160505,西安澳瑞特生物科技有限公司)。联苯双酯(批号A020141206,台州万邦德制药集团股份有限公司);丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、总胆红素(TBIL)、超氧化物歧化酶(SOD)、丙二醛(MDA)、还原型谷胱甘肽(GSH)、天冬氨酸氨基转移酶(AST)试剂盒(批号20160809、20160808、20160812、20160730、20160810、20160810、20160810,南京建成生物工程研究所);精氨酸酶⁃1(Arg⁃1)、α⁃谷胱甘肽⁃S⁃转移酶(α⁃GST)、嘌呤核苷酸磷酸化酶(PNP)、谷氨酸脱氢酶(GLDH)ELISA 试剂盒(批号均为20160810,苏州卡尔文生物科技有限公司);TRIzol 总RNA 提取试剂盒[批号DP405⁃02,天根生化科技(北京)有限公司];CCl4(批号20160302,天津市富宇精细化工有限公司)。
1.3 动物 Wistar 大鼠,SPF级,体质量180~220 g,雌雄各半,购自济南朋悦实验动物繁育有限公司,实验动物生产许可证号SCXK(鲁)2014⁃0007,实验动物使用许可证号SYXK(豫)2015⁃0005。研究经河南中医药大学实验动物伦理委员会批准(批准号DWLL16010005)。
2 方法
2.1 分组、造模与给药 144 只大鼠随机分为空白组,模型组,联苯双酯组(3.75 mg/kg),蒲公英总黄酮低、中、高剂量组(50、100、200 mg/kg),每组24只,给药组分别按相应剂量灌胃给予联苯双酯或蒲公英总黄酮混悬液,空白组、模型组灌胃给予等量蒸馏水,给药容量10 mL/kg,每天1次,连续7 d。末次给药1 h后,空白组大鼠腹腔注射橄榄油溶液10 mL/kg,其余各组大鼠腹腔注射10% CCl4橄榄油溶液10 mL/kg 进行造模[13]。
2.2 样本采集与指标检测 于造模后3、6、12、24 h 取各组大鼠6只,腹腔注射10% 水合氯醛(3 mL/kg)进行麻醉,腹主动脉取血,3 500 r/min 离心10 min,分离血清,取肝右叶加预冷生理盐水制成10%组织匀浆,3 500 r/min离心10 min,取上清液;取肝左叶于4%甲醛溶液中固定,HE 染色,光镜下观察肝组织病理变化。采用微板法检测血清ALT、AST、ALP、TBIL 水平及肝组织SOD 活性、GSH水平,比色法检测肝组织MDA 水平,ELISA 法检测血清Arg⁃1、α⁃GST、PNP、GLDH 水平,RT⁃qPCR 法检测血清及肝组织中miR⁃122 mRNA 表达。
2.3 统计学分析 通过SPSS 21.0 软件进行处理,计量资料以()表示,各组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 蒲公英总黄酮对大鼠血清ALT、AST 水平的影响 与空白组比较,模型组大鼠血清ALT、AST 水平在3、6、12、24 h 均升高(P<0.01)。与模型组比较,联苯双酯组大鼠血清ALT 水平在3、12、24 h,蒲公英总黄酮低、中剂量组在3、24 h 降低(P<0.05,P<0.01),蒲公英总黄酮高剂量组无明显变化(P>0.05);联苯双酯组、蒲公英总黄酮低剂量组大鼠血清AST 水平在3、6、12 h 降低(P<0.05,P<0.01),蒲公英总黄酮中、高剂量组无明显变化(P>0.05),见表1。
表1 蒲公英总黄酮对大鼠血清ALT、AST 水平的影响(,n=6)

表1 蒲公英总黄酮对大鼠血清ALT、AST 水平的影响(,n=6)
注:与空白组比较,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01。
3.2 蒲公英总黄酮对大鼠血清ALP、TBIL 水平的影响 与空白组比较,模型组大鼠血清ALP、TBIL 水平在3、6、12、24 h 均升高(P<0.01)。与模型组比较,联苯双酯组、蒲公英总黄酮低剂量组大鼠血清ALP 水平在3、6、12、24 h,蒲公英总黄酮中剂量组在6、12、24 h,蒲公英总黄酮高剂量组在12、24 h 降低(P<0.05,P<0.01);联苯双酯组及蒲公英总黄酮低、中剂量组大鼠血清TBIL 水平在12 h 降低(P<0.05),蒲公英总黄酮高剂量组无明显变化(P>0.05),见表2。
表2 蒲公英总黄酮对大鼠血清ALP、TBIL 水平的影响(,n=6)
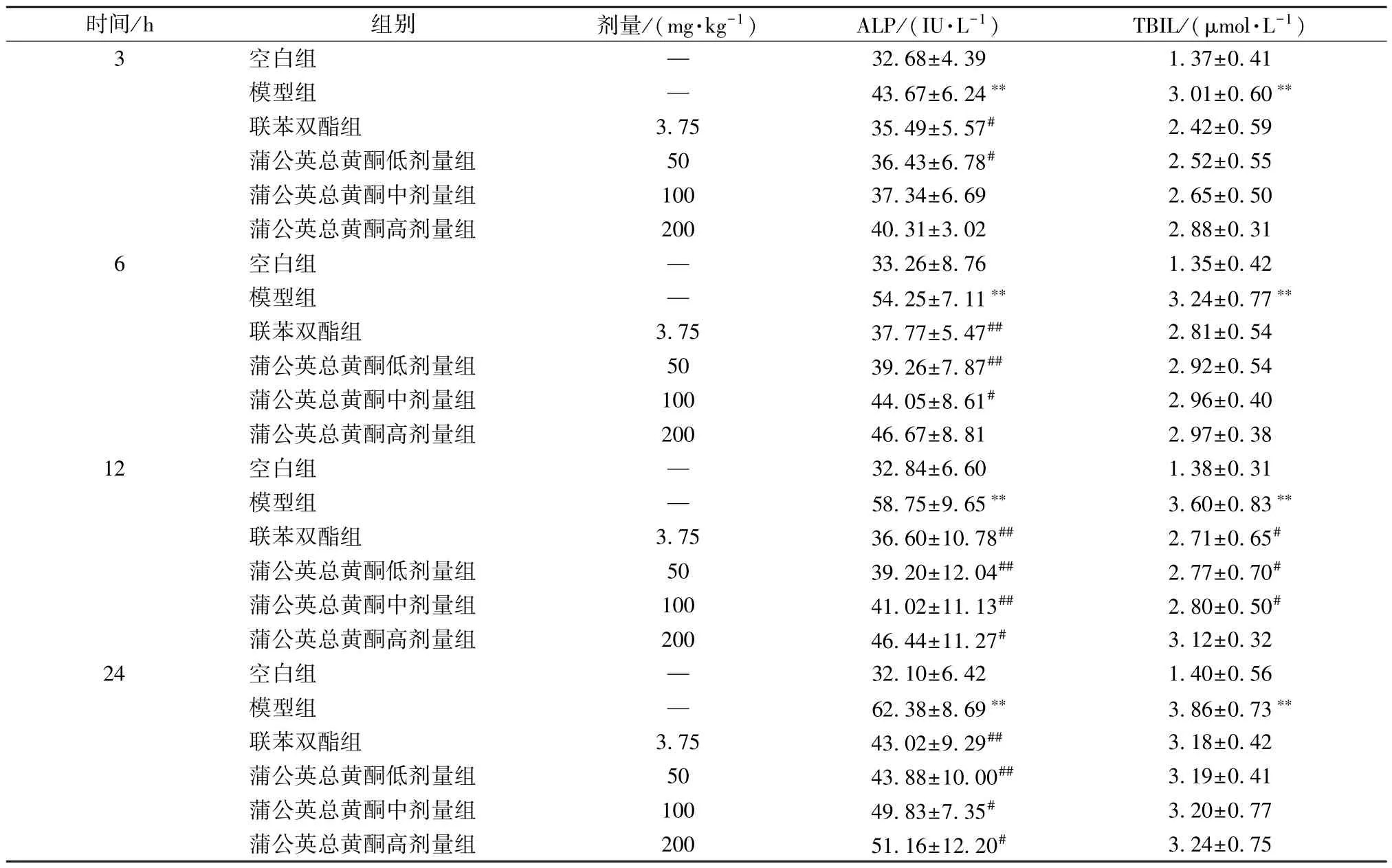
表2 蒲公英总黄酮对大鼠血清ALP、TBIL 水平的影响(,n=6)
注:与空白组比较,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01。
3.3 蒲公英总黄酮对大鼠肝组织SOD 活性及MDA、GSH水平的影响 与空白组比较,模型组大鼠肝组织MDA 水平在3、6、12、24 h 均升高(P<0.01),SOD 活性降低(P<0.05,P<0.01),GSH 水平在6、12、24 h 均降低(P<0.01)。与模型组比较,联苯双酯组大鼠肝组织SOD活性在24 h 升高(P<0.05),蒲公英总黄酮各剂量组无明显变化(P>0.05);联苯双酯组、蒲公英总黄酮低剂量组大鼠肝组织GSH 水平在6、12、24 h,蒲公英总黄酮中剂量组在6、24 h,蒲公英总黄酮高剂量组在24 h 升高(P<0.05,P<0.01);联苯双酯组及蒲公英总黄酮低、中剂量组大鼠肝组织MDA 水平在3、6、12、24 h,蒲公英总黄酮高剂量组 在6、12、24 h降低(P<0.05,P<0.01),见表3。
表3 蒲公英总黄酮对大鼠肝组织SOD 活性及MDA、GSH 水平的影响(,n=6)
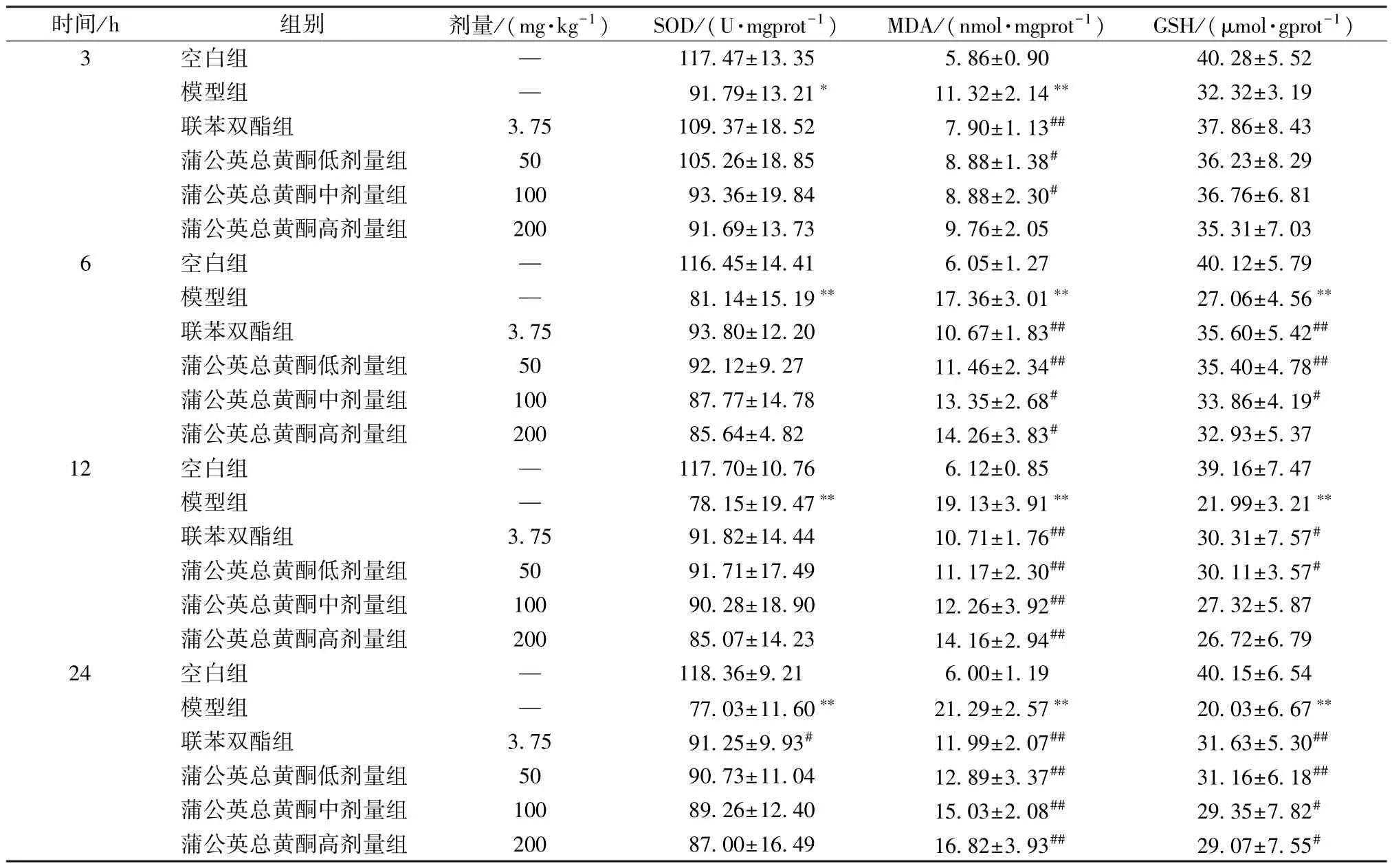
表3 蒲公英总黄酮对大鼠肝组织SOD 活性及MDA、GSH 水平的影响(,n=6)
注:与空白组比较,∗P<0.05,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01。
3.4 蒲公英总黄酮对大鼠血清Arg⁃1、α⁃GST 水平的影响 与空白组比较,模型组大鼠血清Arg⁃1、α⁃GST 水平在3、6、12、24 h 均升高(P<0.01)。与模型组比较,联苯双酯组大鼠血清Arg⁃1 水平在3 h,蒲公英总黄酮低、高剂量组在3、12 h,蒲公英总黄酮中剂量组在3、12、24 h 降低(P<0.05,P<0.01);联苯双酯组及蒲公英总黄酮中、高剂量组大鼠血清α⁃GST 水平无明显变化(P>0.05),蒲公英总黄酮低剂量组α⁃GST 水平在3 h 降低(P<0.01),见表4。
表4 蒲公英总黄酮对大鼠血清Arg⁃1、α⁃GST 水平的影响(,n=6)
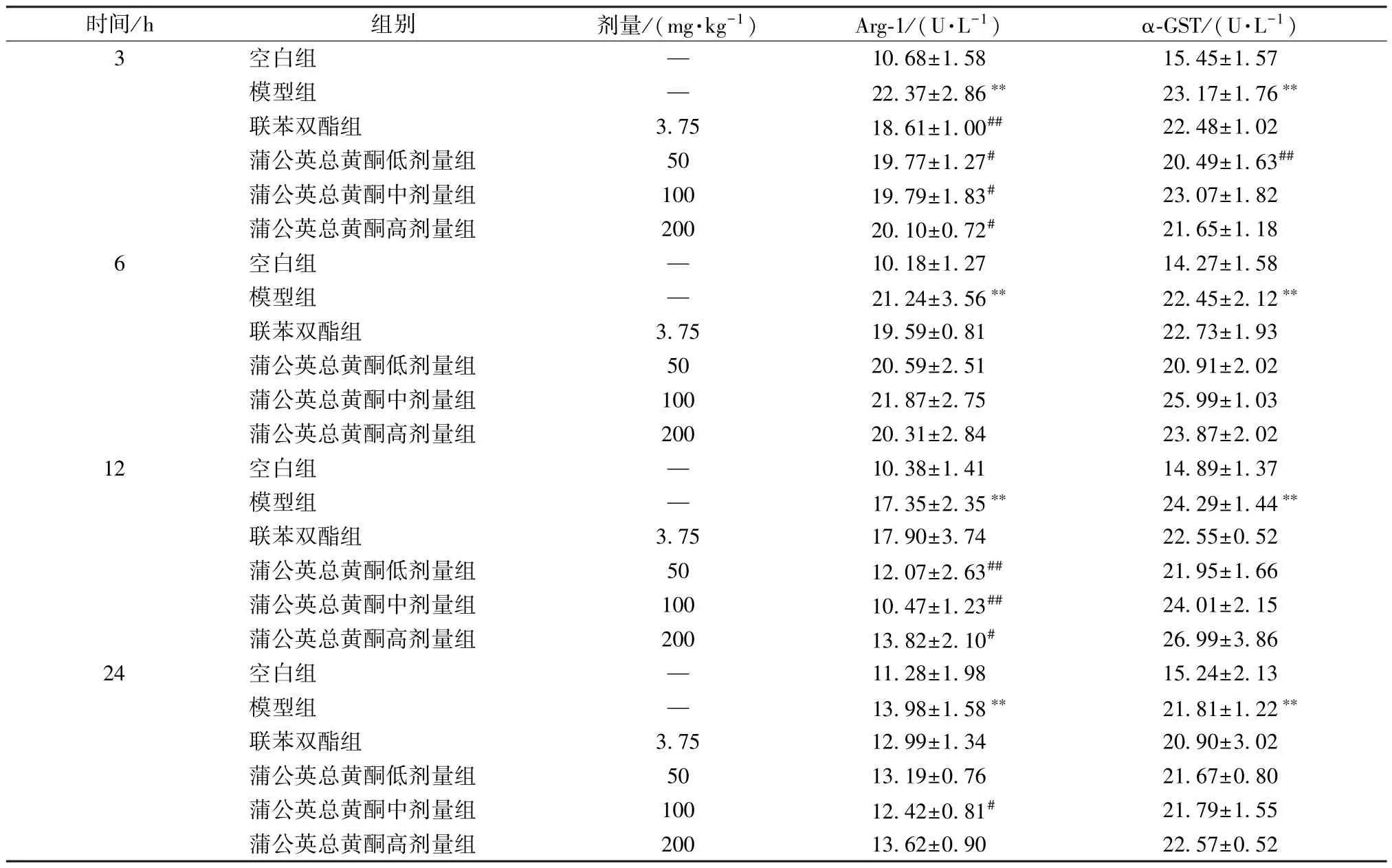
表4 蒲公英总黄酮对大鼠血清Arg⁃1、α⁃GST 水平的影响(,n=6)
注:与空白组比较,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01。
3.5 蒲公英总黄酮对大鼠血清PNP、GLDH 水平的影响与空白组比较,模型组大鼠血清PNP、GLDH 水平在3、6、12、24 h 均升高(P<0.05,P<0.01)。与模型组比较,联苯双酯组大鼠血清PNP 水平在3、6、12 h,蒲公英总黄酮低剂量组在12 h,蒲公英总黄酮中剂量组在3、6 h,蒲公英总黄酮高剂量组在6 h 降低(P<0.05,P<0.01);联苯双酯组大鼠血清GLDH 水平在3 h,蒲公英总黄酮各剂量组在3、12 h 降低(P<0.01),见表5。
表5 蒲公英总黄酮对大鼠血清PNP、GLDH 水平的影响(,n=6)
注:与空白组比较,∗P<0.05,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01。
3.6 蒲公英总黄酮对大鼠血清及肝组织miR⁃122 mRNA 表达的影响 与空白组比较,模型组大鼠血清miR⁃122 mRNA表达在3、6、12、24 h 均升高(P<0.01),肝组织miR⁃122 mRNA 表达在6、24 h 升高(P<0.05)。与模型组比较,联苯双酯组、蒲公英总黄酮中剂量组大鼠血清miR⁃122 mRNA表达无明显变化(P>0.05),蒲公英总黄酮低、高剂量组在6、12 h 降低(P<0.05,P<0.01);联苯双酯组、蒲公英总黄酮高剂量组大鼠肝组织miR⁃122 mRNA 表达在24 h 降低(P<0.05),蒲公英总黄酮低、中剂量组无明显变化(P>0.05),见表6。
表6 蒲公英总黄酮对大鼠血清及肝组织miR⁃122 mRNA 表达的影响(,n=3)

表6 蒲公英总黄酮对大鼠血清及肝组织miR⁃122 mRNA 表达的影响(,n=3)
注:与空白组比较,∗P<0.05,∗∗P<0.01;与模型组比较,#P<0.05,##P<0.01。
3.7 蒲公英总黄酮对大鼠肝组织病理变化的影响 空白组大鼠肝小叶结构清晰,肝索排列有序,肝细胞未见异常;模型组大鼠肝小叶结构消失,肝索排列紊乱,多数肝细胞肿胀、坏死,可见大量的肝细胞脂肪变性,并有明显的炎细胞浸润现象,且随造模时间的增加,损伤逐渐加重;联苯双酯组大鼠肝细胞偶见点状坏死,汇管区有少量炎细胞浸润,肿胀不明显;蒲公英总黄酮各剂量组大鼠肝细胞病变程度较轻,肝细胞肿胀及脂肪变性较少,肝细胞坏死程度明显减轻,部分胞浆内可见小的脂滴形成,见图1。

图1 各组大鼠肝组织HE 染色(×200)
4 讨论
CCl4作为典型的化学性肝毒性物质,其诱导的大鼠肝损伤表现及进程与人类肝损伤病理变化相似,因此被广泛用于肝损伤大鼠模型的研究以及保肝药物的筛选[14⁃15]。CCl4通过腹腔注射进入肝脏,经肝微粒体细胞色素P450 代谢酶系统,产生三氯甲基等毒性物质,可结合细胞膜上的磷脂分子,引发脂质过氧化反应,破坏肝组织细胞膜结构,使细胞膜的通透性增加[16⁃17]。
肝组织受到损伤时,肝细胞内各种酶如ALT、AST 会大量释放到血液中,因此,血清中转氨酶升高是肝损伤的重要指标,在一定程度上反映了肝细胞受损程度[18]。肝损伤导致体内ALP、TBIL 排泄障碍而反流入血,从而引起血清ALP、TBIL 水平增高,其主要反映肝脏受损时黄疸和胆汁淤积的程度[19⁃20]。在脂质过氧化反应过程中,机体产生大量的MDA,持续破坏肝细胞膜结构,加剧肝脏受损程度,使肝细胞发生变性甚至坏死,从而加重病变[21]。SOD、GSH 是机体重要的内源性抗氧化酶,能有效清除体内过量的自由基并增强机体的抗氧化能力,保护肝细胞结构和功能的完整[22⁃23]。本研究显示,蒲公英总黄酮预防性干预后,降低了大鼠血清中AST、ALT、TBIL、ALP 水平,减少肝组织中MDA 水平,提高SOD 活性和GSH 水平,各给药组大鼠肝细胞病变程度减轻,肝细胞肿胀及脂肪变性较少,说明蒲公英总黄酮可以减轻体内氧化应激损伤,稳定肝细胞结构,减少炎细胞浸润从而减轻肝脏损伤的程度。
PNP 主要位于肝细胞等的细胞质中,正常情况下多数检测不到,只有当肝细胞受到损伤时,才会在血液中被检测到,其敏锐度高于传统的肝损伤指标,可以作为潜在的肝细胞损伤的标志物[24];Arg⁃1 是肝脏中重要的水解酶,多分布于肝细胞核、微粒体,能够催化精氨酸生成尿素和鸟氨酸,研究表明其在肝损伤中有较高的灵敏度[25];GLDH 在肝脏中水平最高,肝损伤时线粒体膜受到破坏,血液中的GLDH 升高,其对于肝损伤的诊断具有较高的敏感性[26];α⁃GST 多分布在肝小叶中心细胞,在肝损伤早期就会透过受损的细胞膜进入血液,是理想的早期肝损伤指标[27];miR⁃122 是在肝细胞中特异性高表达的miRNA,对于维持肝脏的正常代谢功能有重要的调控作用,在肝损伤早期血液中就可以检测到其表达显著升高,较传统的肝功能检测指标更灵敏[28⁃29]。本研究显示,蒲公英总黄酮各剂量组可以不同程度降低大鼠血清中PNP、Arg⁃1、GLDH、α⁃GST 水平和miR⁃122 表达,但对于相关指标的改善作用量效关系不明显,初步表明蒲公英总黄酮在CCl4致大鼠肝损伤早期即可起到一定的预防和保护作用,后期仍有待进行进一步的深入研究。
