白藜芦醇mPEG⁃PLGA 纳米粒的制备及其体内药动学、抗肿瘤活性研究
2022-12-03李伟宏王风云
李伟宏 王风云
(河南应用技术职业学院, 河南 郑州450042)
白藜芦醇是一种主要存在于花生、葡萄、藜芦、虎杖等植物中的多酚类成分,可有效抑制肺癌、乳腺癌、白血病、卵巢癌、皮肤癌、肝癌等肿瘤细胞增殖[1⁃2],尤其是抗卵巢癌活性,正引起医药研究人员重视,该成分可能通过调控SIRT1、Nrf2 表达来阻断STAT3 信号通路活化[3],从而抑制卵巢癌细胞的增殖并诱导其凋亡。但该成分溶解度很差,仅为28.3 μg/mL[4],从而大大限制了其口服吸收生物利用度和抗肿瘤活性[5]。
研究表明,聚合物纳米粒在改善中药活性成分生物利用度、提高药效等方面具有较大优势[6]。聚乙二醇单甲醚⁃聚乳酸⁃乙醇酸共聚物(mPEG⁃PLGA)由于具有稳定性好、生物相容性高等优势,在纳米制剂中的应用越来越多。本实验将白藜芦醇制成mPEG⁃PLGA 纳米粒,再考察其体内药动学,并采用对数生长期的HO⁃8910PM 肿瘤细胞建立裸鼠卵巢癌皮下移植瘤模型来评价其抗肿瘤活性,以期为其他相关制剂开发提供参考。
1 材料
1.1 仪器 安捷伦1260 型高效液相色谱仪(美国安捷伦公司);RG⁃18 型磁力搅拌器(河南金博仪器制造有限公司);MSE125P⁃CE 型电子分析天平(德国赛多利斯公司);R⁃200 型旋转蒸发仪(瑞士Buchi 公司);PRD⁃S⁃027 型超声仪(深圳市普瑞登科科技有限公司);Mastersizer 3000 型激光粒度分析仪(英国马尔文仪器有限公司);TTL⁃DCI型氮气吹扫仪(北京同泰联科技发展有限公司);VD⁃650 型桌上式超净工作台(河南郑州南北仪器设备有限公司);KHVORTEX⁃5 型漩涡混合器(北京中慧天诚科技有限公司);HSX⁃1000N 型恒温恒湿培养箱(上海幕斯实验设备有限公司)。
1.2 试剂与药物 白藜芦醇原料药(批号191115,纯度95.7%,湖北鑫润德化工有限公司);白藜芦醇对照品(批号111535⁃201904,纯度99.7%,中国食品药品检定研究院)。顺铂(批号20201011,南京泽朗医药科技有限公司);单甲氧基聚乙二醇⁃聚乳酸⁃羟基乙酸共聚物(mPEG⁃PLGA,乳酸∶羟基乙酸=75∶25,mPEG、PLGA 相对分子质量分别为2 000、30 000,广州市碳水科技有限公司);泊洛沙姆188(批号4142071742E,德国BASF 公司);二甲基亚砜(DMSO,批 号7516389C)、RPMI⁃1640 培养基(批号2031583611)(美国Sigma⁃Aldrich 公司);胎牛血清(批号200920,美国Gibco 公司)。
1.3 动物 SPF 级健康BALB/c 裸鼠,体质量18~22 g;清洁级SD 大鼠,体质量220~240 g,均购自河南省动物实验中心,动物生产许可证号SCXK(豫)2016⁃0001。
1.4 细胞 人卵巢癌细胞株HO⁃8910PM 购自河南省肿瘤研究所,培养至融合度大于80%时,采用胰蛋白酶消化传代。
2 方法与结果
2.1 白藜芦醇含量测定
2.1.1 色谱条件 Waters C18色谱柱(150 mm×4.6 mm,5 μm),药动学实验加Phenomenex C18预柱(4 mm×2 mm,5 μm);流动相甲醇⁃水(4∶6);体积流量1.0 mL/min;柱温30 ℃;检测波长306 nm;进样量20 μL。
2.1.2 线性关系考察 称取白藜芦醇对照品10.0 mg(避光操作),转移至100 mL 棕色量瓶中,甲醇超声溶解并定容至刻度,得0.1 mg/mL贮备液,流动相稀释成10.0、5.0、1.0、0.5、0.1、0.05 μg/mL 对照品溶液,在“2.1.1”项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=1.227 5X-0.192 3(r=0.999 9),在0.05~10 μg/mL范围内线性关系良好。
2.1.3 供试品溶液制备 取mPEG⁃PLGA 纳米粒混悬液1 mL 至100 mL 棕色量瓶中,加入甲醇超声破坏纳米粒,流动相定容至刻度,过0.45 μm 微孔滤膜,即得。
2.1.4 方法学考察 取同一份mPEG⁃PLGA 纳米粒混悬液,按“2.1.3”项下方法平行制备6 份供试品溶液,在“2.1.1”项色谱条件下进样测定,测得白藜芦醇含量RSD 为1.43%,表明该方法重复性良好。取0.05、1.0、10.0 μg/mL 对照品溶液各6份,在“2.1.1”项色谱条件下进样测定,测得白藜芦醇日内精密度RSD 分别为0.68%、0.22%、0.14%,日间精密度RSD 分别为1.09%、0.36%、0.43%,表明该方法精密度良好。取9 份mPEG⁃PLGA 纳米粒混悬液,每份0.5 mL,分为3组,每组3份,分别按80%、100%、120%水平加入对照品溶液,加入甲醇超声处理后流动相定容,过0.45 μm 微孔滤膜,在“2.1.1”项色谱条件下进样测定,测得白藜芦醇平均加样回收率分别为99.46%、100.27%、100.06%,RSD 分别为1.34%、1.12%、0.58%。
2.2 mPEG⁃PLGA 纳米粒及其冻干粉制备 采用乳化⁃溶剂挥发法。取白藜芦醇原料药25 mg、mPEG⁃PLGA 500 mg,溶于20 mL 丙酮中,作为有机相;制备0.8%泊洛沙姆188 溶液100 mL,作为水相,将有机相滴加至水相中,滴毕后超声处理(功率250 W,每间隔2 s 工作2 s)15 min,在50 ℃下减压旋蒸以除尽丙酮溶剂,过0.45 μm 微孔滤膜,即得mPEG⁃PLGA 纳米粒,补加蒸馏水至100 mL 作为混悬液。往混悬液中加入6%甘露醇,摇匀后预冻2 d,待冷阱降至-30 ℃时立即放入冷冻干燥机中1 d,即得其冻干粉。
2.3 包封率、载药量测定 取mPEG⁃PLGA 纳米粒混悬液3 mL 至具塞离心管中,14 000 r/min 离心45 min,取上清液,在“2.1.1”项色谱条件下进样测定,计算游离药量(W1);取离心后沉淀物,冷冻干燥后精密称定质量(W);另取mPEG⁃PLGA 纳米粒混悬液1 mL 至100 mL 棕色量瓶中,加入甲醇超声处理后流动相定容,过0.45 μm 微孔滤膜,取续滤液,在“2.1.1”项色谱条件下进样测定,计算白藜芦醇总量(W0),测定载药量、包封率,公式分别为载药量=[(W0-W1)/W] ×100%、包封率=[(W0-W1)/W0] ×100%。取3批mPEG⁃PLGA 纳米粒混悬液,测得其平均包封率为84.42%,载药量为3.84%;冻干粉复溶后同法测定包封率,测得其平均值为79.46%。
2.4 冻干粉质量分数测定 取mPEG⁃PLGA 纳米粒混悬液1 mL,按“2.3”项下方法计算W0;另取适量,加入6%甘露醇后按“2.2”项下方法制备冻干粉,称定质量(W总),计算冻干粉质量分数,公式为质量分数=(W0/W总)×100%,测得其平均值为0.32%。
2.5 粒径、PDI、Zeta 电位测定 取mPEG⁃PLGA纳米粒混悬液3批,每批0.5 mL,分散于4 mL 蒸馏水中,混匀,测定粒径、PDI、Zeta 电位,结果见图1。由此可知,平均粒径为143.72 nm,PDI为0.121,表明纳米粒均一性良好;Zeta 电位为-6.7 mV,表明纳米粒表面带有一定量的负电荷,有利于制剂稳定。再取冻干粉3批,复溶后测得其平均粒径为182.15 nm,PDI 为0.147,Zeta 电位为-5.8 mV,见图2。
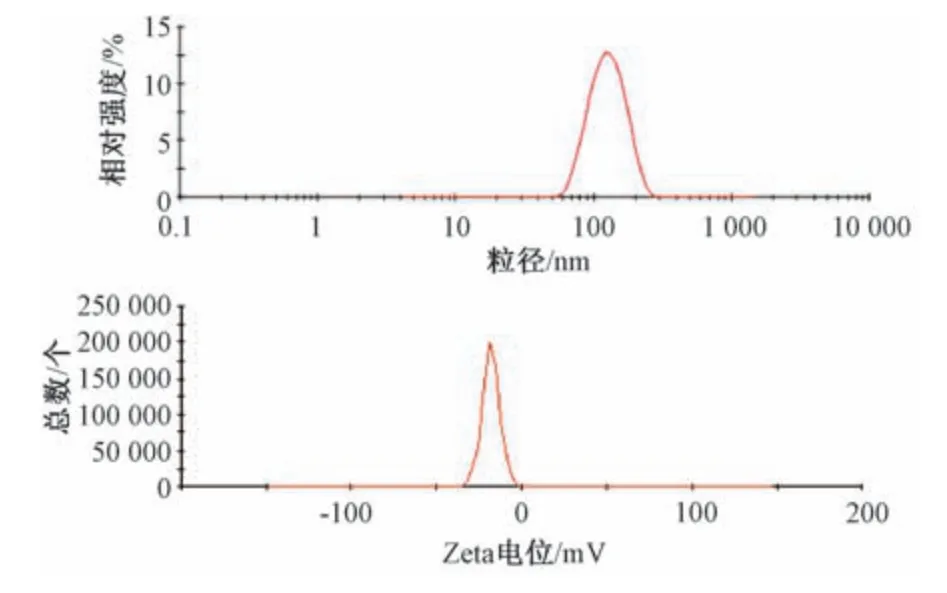
图1 白藜芦醇mPEG⁃PLGA 纳米粒粒径分布、Zeta 电位Fig.1 Particle size distribution and Zeta potential of resveratrol mPEG⁃PLGA nanoparticles
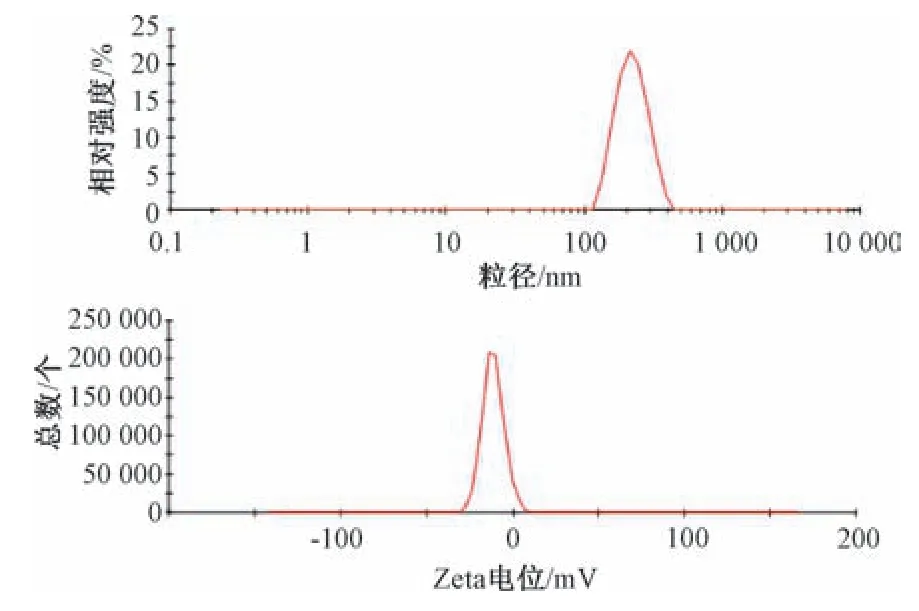
图2 冻干粉粒径分布、Zeta 电位Fig.2 Particle size distribution and Zeta potential of lyophilized powder
2.6 体外释药研究 取冻干粉适量(含15 mg 白藜芦醇),加入释放介质至3 mL,转移至透析袋(使用前活化,截留分子量14 kDa),两端扎紧,同法制备等量原料药溶液,测得白藜芦醇在0.5%吐温80 溶液中的溶解度为79.50 μg/mL。为使原料药达到漏槽条件,选择900 mL 0.5%吐温80 溶液作为释药介质,于0、0.25、0.5、1、2、2.5、3、4、6、8、12、24、36 h 取样,设定转速、温度分别为100 r/min、(37±1)℃,过0.45 μm 微孔滤膜,测定白藜芦醇含量,计算累积释放度,结果见图3。由此可知,原料药36 h 内累积释放度仅为32.68%;mPEG⁃PLGA 纳米粒释放过程主要分为2个阶段,0~6 h 属于快速释药期,6 h 内累积释放度为47.47%,而6~36 h 属于缓慢释药期,36 h内累积释放度为74.12%。
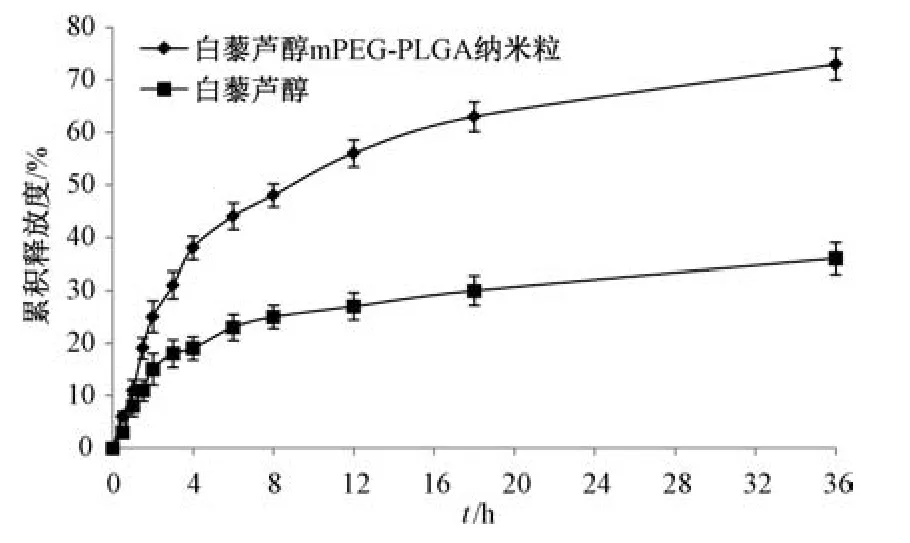
图3 白藜芦醇体外释药曲线(n=6)Fig.3 In vitro drug release curves for resveratrol(n=6)
2.7 体内药动学研究
2.7.1 分组、给药与采血 配制原料药、mPEG⁃PLGA 纳米粒冻干粉的0.5%CMC⁃Na 混悬液,作为灌胃液(白藜芦醇质量浓度均为5 mg/mL)。取12只禁食约12 h(可自由饮水)的大鼠,抛币法随机分为白藜芦醇组、白藜芦醇mPEG⁃PLGA 纳米粒组,每组6只,灌胃给药(40 mg/kg),于0、0.5、1、1.5、2、2.5、3、4、6、8、12 h 眼眶后静脉丛取血各约0.3 mL,引流至肝素浸润的离心管中,立即于振荡器上涡旋5 s,3 000 r/min 离心2 min,分离上层血浆,低温保存。
2.7.2 血浆处理 参考文献[7] 报道的方法并略作改进,血浆室温解冻后取100 μL,1.0 mL 乙酸乙酯⁃甲醇(18∶2)混合溶剂溶解,于振荡器上涡旋3 min,-4 ℃、8 000 r/min 离心15 min,分离出上层有机相,40 ℃N2挥除有机溶剂,残渣加入100 μL 甲醇,涡旋溶解后进样分析。
2.7.3 线性关系考察 对照品溶液用甲醇依次稀释至1 500、1 000、500、100、50、20 ng/mL,分别取100 μL,40 ℃氮气挥干,再加入100 μL 空白血浆,涡旋30 s,按“2.7.2”项下方法处理,即得血浆对照品溶液,在“2.1.1”项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=0.260 8X-0.092 2(r=0.994 6),在20~1 500 ng/mL 范围内线性关系良好。
2.7.4 专属性考察 取空白血浆、灌胃给药12 h后血浆、血浆对照品溶液(20 ng/mL)适量,按“2.7.2”项下方法处理,在“2.1.1”项色谱条件下进样测定,结果见图4。由此可知,杂质不干扰测定,表明该方法专属性良好。
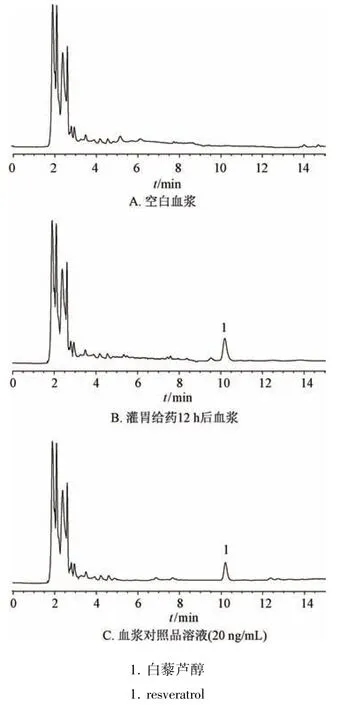
图4 白藜芦醇HPLC 色谱图Fig.4 HPLC chromatograms of resveratrol
2.7.5 方法学考察 取灌胃给药0.5 h 后血浆适量,于1、2、3、4、5、6 d 在“2.1.1”项色谱条件下进样测定,保存于-15 ℃冰箱中,测得白藜芦醇峰面积RSD 为5.84%,表明血浆在6 d 内稳定性良好。取20、500、1 500 ng/mL 血浆对照品溶液适量,同一天内在“2.1.1”项色谱条件下进样测定6次,测得白藜芦醇峰面积RSD 分别为6.34%、7.94%、8.63%,表明该方法日内精密度良好;同法连续测定6 d,每天1次,测得白藜芦醇峰面积RSD 分别为9.63%、8.09%、6.38%,表明该方法日间精密度良好。取上述3 个质量浓度血浆对照品溶液各100 μL,氮气吹除有机溶剂,加入100 μL 空白血浆,涡旋混匀,按“2.7.2”项下方法处理,在“2.1.1”项色谱条件下进样测定,测得白藜芦醇平均加样回收率分别为95.05%、90.67%、94.66%,RSD 分别为3.93%、7.43%、4.86%。
2.7.6 结果分析 血药浓度⁃时间曲线见图5,再采用实际测得值计算Cmax、tmax,梯形法计算AUC,结果见表1。由此可知,与原料药比较,mPEG⁃PLGA 纳米粒tmax、t1/2延长(P<0.01),Cmax、AUC0~t、AUC0~∞升高(P<0.01),相对生物利用度提高至3.56 倍。
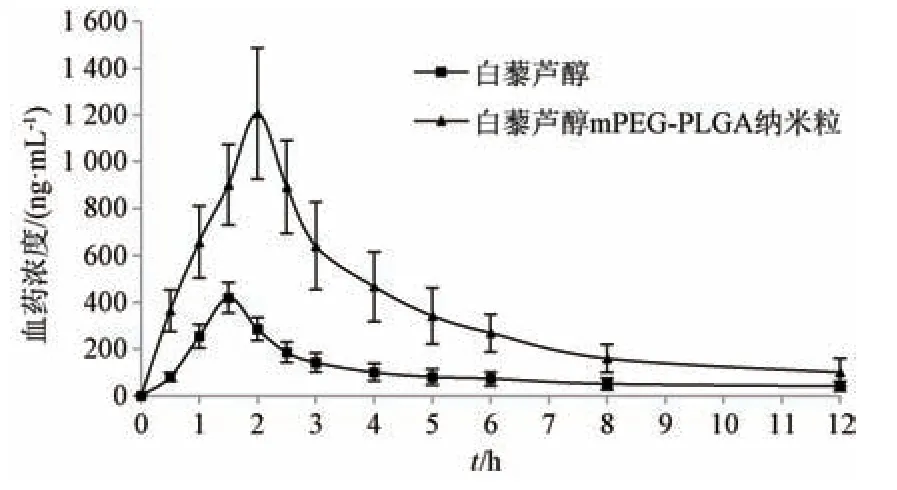
图5 白藜芦醇血药浓度⁃时间曲线(n=6)Fig.5 Plasma concentration⁃time curves for resveratrol(n=6)
表1 白藜芦醇主要药动学参数(,n=6)Tab.1 Main pharmacokinetic parameters for resveratrol(,n=6)
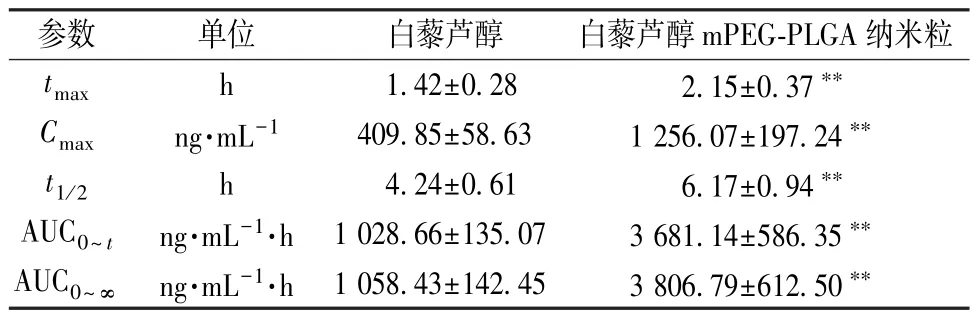
表1 白藜芦醇主要药动学参数(,n=6)Tab.1 Main pharmacokinetic parameters for resveratrol(,n=6)
注:与白藜芦醇比较,∗∗P<0.01。
2.8 抗肿瘤活性研究
2.8.1 荷瘤模型建立 取处于对数生长期HO⁃8910PM 细胞,采用RPMI⁃1640 培养液(无血清)重悬细胞密度至2×107/mL,悬液振荡后于超净工作台上按每只0.2 mL 剂量接种于裸鼠背部皮下,继续饲养于SPF 级实验室。2 周后,接种部位出现肿瘤结节,选择直径大于0.4 cm 者进行实验。
2.8.2 分组、给药与指标检测 将40 只荷瘤裸鼠随机分为空白组(生理盐水)、阳性组(2 mg/kg 顺铂)、白藜芦醇组(40 mg/kg)及白藜芦醇mPEG⁃PLGA 纳米粒低、高剂量组(30、40 mg/kg),每3 d灌胃给药1次,共21 d,每3 d 测量肿瘤短径(a)、长径(b),计算瘤体积V,公式为V=a·b2·π/6[8]。颈椎脱臼处死荷瘤裸鼠,剥离瘤体,测量瘤重,计算抑瘤率,公式为抑瘤率=(1-给药组平均瘤重/空白组平均瘤重)×100%[8]。
2.8.3 结果分析 实验结束后,空白组、阳性组、白藜芦醇组及白藜芦醇mPEG⁃PLGA 纳米粒低、高剂量组荷瘤裸鼠体质量分别增加14.2%、-10.3%、10.8%、7.4%、-2.7%,下降程度均未超15%,说明毒性反应较小[9]。随着时间延长,空白组荷瘤裸鼠肿瘤生长最快,精神状态、活动情况最差;白藜芦醇组、白藜芦醇mPEG⁃PLGA 纳米粒各剂量组荷瘤裸鼠精神状态、活动情况优于空白组,随着剂量增加两者改善程度更明显。
图6 显示,白藜芦醇组、白藜芦醇mPEG⁃PLGA 纳米粒低剂量组荷瘤裸鼠瘤体积在各个时间点比较,差异均无统计学意义(P>0.05),而高剂量组在7 d 后小于白藜芦醇组(P<0.01)。
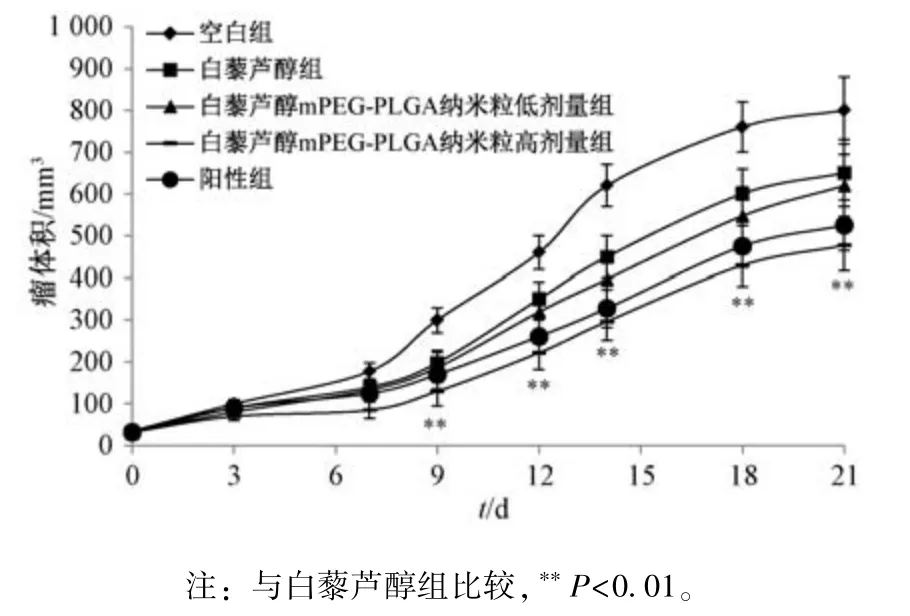
图6 各组荷瘤裸鼠瘤体积(n=8)Fig.6 Tumor volumes of tumor⁃bearing nude mice in various groups(n=8)
表2 显示,与空白组比较,白藜芦醇组、白藜芦醇mPEG⁃PLGA 纳米粒各剂量组荷瘤裸鼠瘤重降低(P<0.01);白藜芦醇组、白藜芦醇mPEG⁃PLGA 纳米粒低剂量组抑瘤率比较,差异无统计学意义(P>0.05),而高剂量组高于白藜芦醇组(P<0.01),同时体质量降低程度明显低于阳性组,表明它具有低毒高效的特点。
表2 各组荷瘤裸鼠瘤重、抑瘤率比较(,n=8)Tab.2 Comparison of tumor weights and tumor inhibition rates of tumor⁃bearing nude mice among various groups(,n=8)
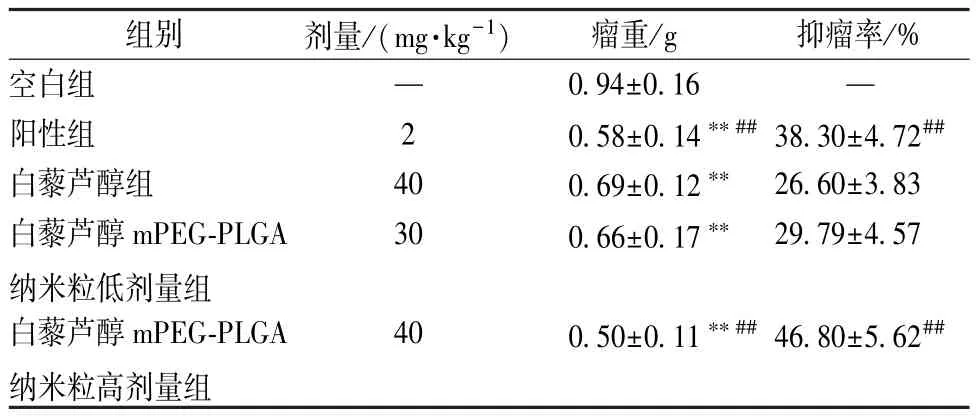
表2 各组荷瘤裸鼠瘤重、抑瘤率比较(,n=8)Tab.2 Comparison of tumor weights and tumor inhibition rates of tumor⁃bearing nude mice among various groups(,n=8)
注:与空白组比较,∗∗P<0.01;与白藜芦醇组比较,##P<0.01。
3 讨论
王敏[7]、王建泽等[8]分别将白藜芦醇制成自微乳、微乳,口服生物利用度分别提高至131.84%、1.45倍,但改善程度不明显,而且处方中表面活性剂用量较大,有溶血风险,安全性不可靠;张纯刚等[5]将该成分制成固体分散体,虽然生物利用度提高至200%,但该剂型吸湿性较高,稳定性也不理想;于琛琛等[9]将该成分制成包合物,生物利用度提高至225.6%,也存在改善空间;杨娟等[10]在引入磷脂复合物后将该成分制成固体脂质纳米粒,但制备工艺稍显复杂,而且粒径稍大(218.6 nm)。本实验所制备的白藜芦醇mPEG⁃PLGA 纳米粒相对口服生物利用度可提高至3.56倍,与前期报道比较具有较大的优势,其原因[11⁃12]为胃肠道黏膜表面的黏液中含有大量黏蛋白,可有效阻止药物穿透胃肠道进入血液循环,将该成分制成mPEG⁃PLGA 纳米粒后由于其表面亲水性大大增强,减弱了黏蛋白对药物的静电引力或疏水作用的影响[13],药物可顺利吸收进入血液循环;该剂型粒径较小,有利于药物经过肠道中的派伊尔氏结进入血液循环,实现药物高效吸收,同时增加了药物比表面积,减少了胃肠道各种酶对药物稳定性的影响,也有助于改善口服吸收生物利用度。
顺铂是治疗卵巢癌最有效的药物之一[14⁃15],但其不良反应明显,容易造成小鼠机体器官损伤。刘青青等[16]报道,小鼠腹腔注射给予小剂量顺铂(每次1 mg/kg,每周1次,连续3 周)后不良反应相对较低;结合前期预实验及小鼠体质量下降程度,本实验选择顺铂剂量为2 mg/kg(每天3次,连续3 周)作为阳性组用量。抗肿瘤活性研究结果表明,mPEG⁃PLGA 纳米粒可提高白藜芦醇体内抑瘤药效[17⁃18],可能与改善后者生物利用度有关[19⁃20],有望将该制剂开发成抗卵巢癌新药。
