联苯双酯固体分散体的制备及表征
2020-05-08魏忠莉李青松何仲贵
王 群,魏忠莉,李青松,何仲贵
联苯双酯固体分散体的制备及表征
王 群,魏忠莉,李青松,何仲贵*
(沈阳药科大学 无涯创新学院,辽宁 沈阳 110016)
制备联苯双酯固体分散体,以提高联苯双酯的体外溶出度。以聚乙二醇 6 000(Polyethylene glycol 6000,PEG6000)、聚维酮K30(Povidone K30,PVP K30)和泊洛沙姆188(Poloxamer 188,P188)为载体,采用溶剂挥发法制备联苯双酯固体分散体。同时,采用差示扫描量热法(Differential scanning calorimetry,DSC)、X射线粉末衍射法(X-ray powder diffraction,XRPD)和红外光谱法(Infrared Spectroscopy,IR)等技术对固体分散体进行表征。在三种载体制备的固体分散体中,联苯双酯的体外溶出度明显提高,且三种载体对联苯双酯的增溶效果依次为:P188>PVP K30>PEG6000。DSC、XRPD和IR结果表明,联苯双酯以分子形式或无定型存在于固体分散体中。采用溶剂挥发法制备联苯双酯固体分散体,能明显提高联苯双酯体外溶出度。
药剂学;联苯双酯;固体分散体;溶出度
联苯双酯(bifendate,DDB)是人工合成五味子丙素的中间产物,是我国自主研发的一类保肝护肝药[1]。具有降酶、抗病毒、抗氧化、免疫调节等药理作用,临床上用于治疗慢性、迁延性肝炎伴谷丙氨酸转氨酶升高,也可用于治疗化学毒物、药物引起的谷丙氨酸转氨酶升高[2-5]。
由于联苯双酯在水中几乎不溶,溶解度约为2.5 mg·L-1,导致其口服生物利用度很低,只有约20%~30%,溶解度低已经成为限制联苯双酯应用的首要因素[6]。有实验表明[7-9],联苯双酯具有很好的体内外相关性,即体外溶出度越高,口服生物利用度越高。基于此,本文作者采用溶剂挥发法制备联苯双酯固体分散体,以提高其体外溶出度。
1 仪器与材料
YRE-5299旋转蒸发器(巩义予华仪器有限公司),BSA124S-CW电子分析天平(赛多利斯科学仪器(北京)有限公司),DZX-6050B真空干燥箱(上海福玛实验设备有限公司),HITACHI高效液相色谱仪(日本日立公司),RC12AD智能溶出仪(天津天大天发科技有限公司),KQ-250B超声波清洗器(昆山超声仪器有限公司),PHS-3BW pH计(上海般特仪器制造有限公司),DCS-1差示扫描量热仪(德国梅特勒公司),Bruker D8 discover X射线衍射仪(德国布鲁克AXS有限公司),EQUINOX55傅里叶红外光谱仪(德国布鲁克光谱仪器公司)
联苯双酯原料药(武汉远成共创科技有限公司),十二烷基硫酸钠(天津大茂化学试剂厂),泊洛沙姆188(德国巴斯夫),聚乙二醇6000(湖南尔康制药股份有限公司),聚维酮K30(安徽山河药用辅料股份有限公司),氢氧化钠、二氯甲烷(天津恒兴化学试剂有限公司),磷酸二氢钠(天津大茂化学试剂厂),其他试剂(分析纯,市售)。
2 方法与结果
2.1 联苯双酯体外溶出度测定方法的建立
2.1.1溶出介质的选择
由于联苯双酯在水中溶解度很低,因此,需要在溶出介质中加入适量的表面活性剂十二烷基硫酸钠(sodium dodecyl sulfate,SDS),同时,考虑到体内外相关性,最终确定以质量分数为0.5%的SDS磷酸盐缓冲液作为溶出介质。
质量分数0.5%SDS磷酸盐缓冲液的配制:称取磷酸二氢钠6.895 g、氢氧化钠0.896 g和SDS 5.0 g,加水溶解并稀释至1 000 mL,调节pH值至6.8即可。
2.1.2最大吸收波长的确定
精密称取联苯双酯原料药适量,用甲醇稀释成适当质量浓度。以甲醇为空白对照,照《中华人民共和国药典》(2015年版)四部紫外-可见分光光度法(通则0401)[10],在波长200~400 nm内进行扫描。结果见图1。
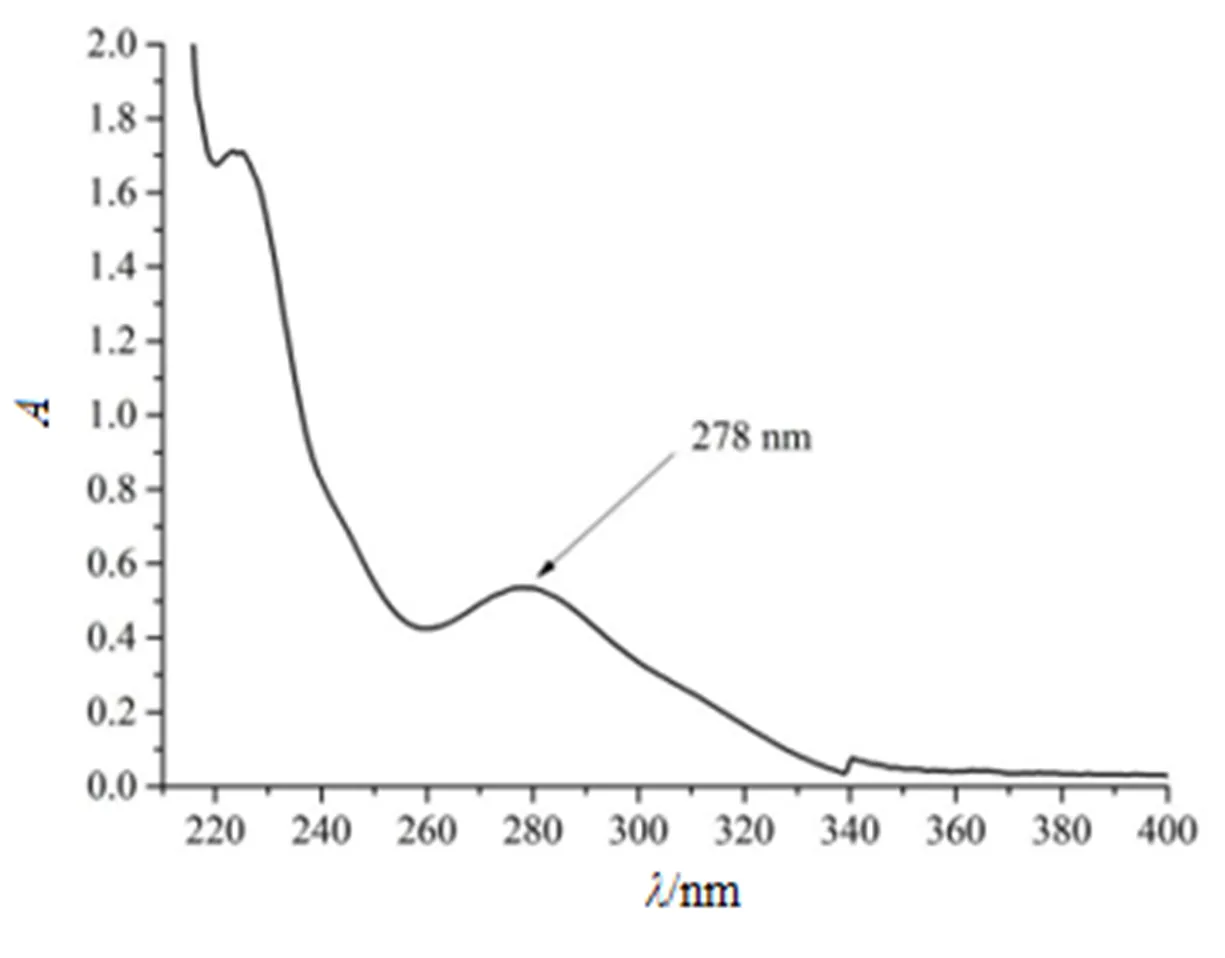
Fig. 1 The UV spectrum of DDB
由扫描结果可知,联苯双酯在波长278 nm处有最大吸收,因此选择波长278 nm作为联苯双酯溶出度测定的检测波长。
2.1.3色谱条件
色谱柱:Kromasil C18(200 mm × 4.6 mm,5 μm);流动相:甲醇-水(体积比70:30);检测波长:278 nm;流速:1 mL·min-1;柱温:30 °C;进样量:20 µL。
2.1.4线性与范围
精密称取联苯双酯原料药约15 mg,置于100 mL量瓶中,加甲醇适量,超声使其完全溶解。放冷至室温,用甲醇定容至刻度,即得约150 mg·L-1的储备液。精密量取150 mg·L-1的储备液适量,用质量分数0.5%SDS磷酸盐缓冲液分别稀释成0.75、1.5、3.0、4.8、6.0、9.0和12.0 mg·L-1的系列标准溶液。精密量取系列标准溶液20 μL,注入高效液相色谱仪,记录色谱图。以峰面积()为纵坐标,质量浓度()为横坐标绘制标准曲线。回归方程为=3.02×104+1.16×103,=0.999 5,结果表明,质量浓度在0.75~12.0 mg·L-1内,联苯双酯峰面积与质量浓度呈良好的线性关系。
2.1.5仪器精密度试验
精密量取150 mg·L-1的储备液1 mL于50 mL量瓶中,用质量分数0.5%SDS磷酸盐缓冲液稀释定容至刻度线,配制成3.0 mg·L-1的样品溶液。精密量取3.0 mg·L-1的样品溶液20 μL,注入高效液相色谱仪,连续进样6次,记录峰面积并计算相对标准偏差(RSD/%)。结果表明,仪器精密度RSD<1.0%,符合《中华人民共和国药典》(2015年版)要求,说明仪器精密度良好。
2.1.6溶液稳定性试验
精密量取150 mg·L-1的储备液1 mL于50 mL量瓶中,用质量分数0.5%SDS磷酸盐缓冲液稀释至刻度线,配制成3.0 mg·L-1的样品溶液,室温避光放置,分别于0、2、4、6、8、10和12 h,精密量取20 µL,注入高效液相色谱仪,记录峰面积并计算相对标准偏差(RSD/%)。结果表明,RSD为0.28%,说明联苯双酯溶液在室温、避光条件下放置12 h,稳定性良好。
2.1.7溶出度测定方法
照《中华人民共和国药典》(2015年版)溶出度与释放度测定法第二法,称取相当于联苯双酯25 mg的固体分散体,装于1号胶囊壳中进行溶出度测定。以质量分数0.5%SDS磷酸盐缓冲液 1 000 mL为溶出介质,溶出介质温度恒定在(37 ± 0.5)°C,转速75 r·min-1,依法操作,分别在10、20、30、45、60、90和120 min取样10 mL,同时用空白介质补足10 mL。样品经0.45 μm滤膜过滤,取续滤液1 mL,加甲醇4 mL稀释后作为供试品溶液。同时配制约3 mg·L-1的对照品溶液。取上述溶液各20 μL,注入高效液相色谱仪,记录色谱图,按外标法以峰面积计算药物的累计溶出度。
2.2 联苯双酯固体分散体的制备
2.2.1样品的制备
以常用的水溶性载体聚乙二醇6 000(Polyethylene glycol 6000,PEG6000)、聚维酮K30(Povidone K30,PVP K30)和泊洛沙姆188(Poloxamer 188,P188)为载体,制备联苯双酯固体分散体。精密称取联苯双酯及PEG6000、PVP K30和P188适量,按照药物与载体质量比为1:8的比例将其加入到茄型瓶中,再加入二氯甲烷适量,超声至完全溶解。将溶液于40 °C条件下旋转蒸发除去有机溶剂,然后在真空干燥箱中干燥至有机溶剂完全挥干,将样品研磨后过180 µm筛,置于干燥箱中备用。
按照药物与载体质量比为1:8,精密称取联苯双酯及P188适量,采用等量递加法混匀后过180 µm筛,作为物理混合物,放置于干燥箱中备用。
2.2.2载体的选择
取上述三种载体制备的联苯双酯固体分散体(相当于联苯双酯25 mg),照“2.1.7”溶出度测定方法,考察不同载体对联苯双酯固体分散体溶出的影响。结果见图2。
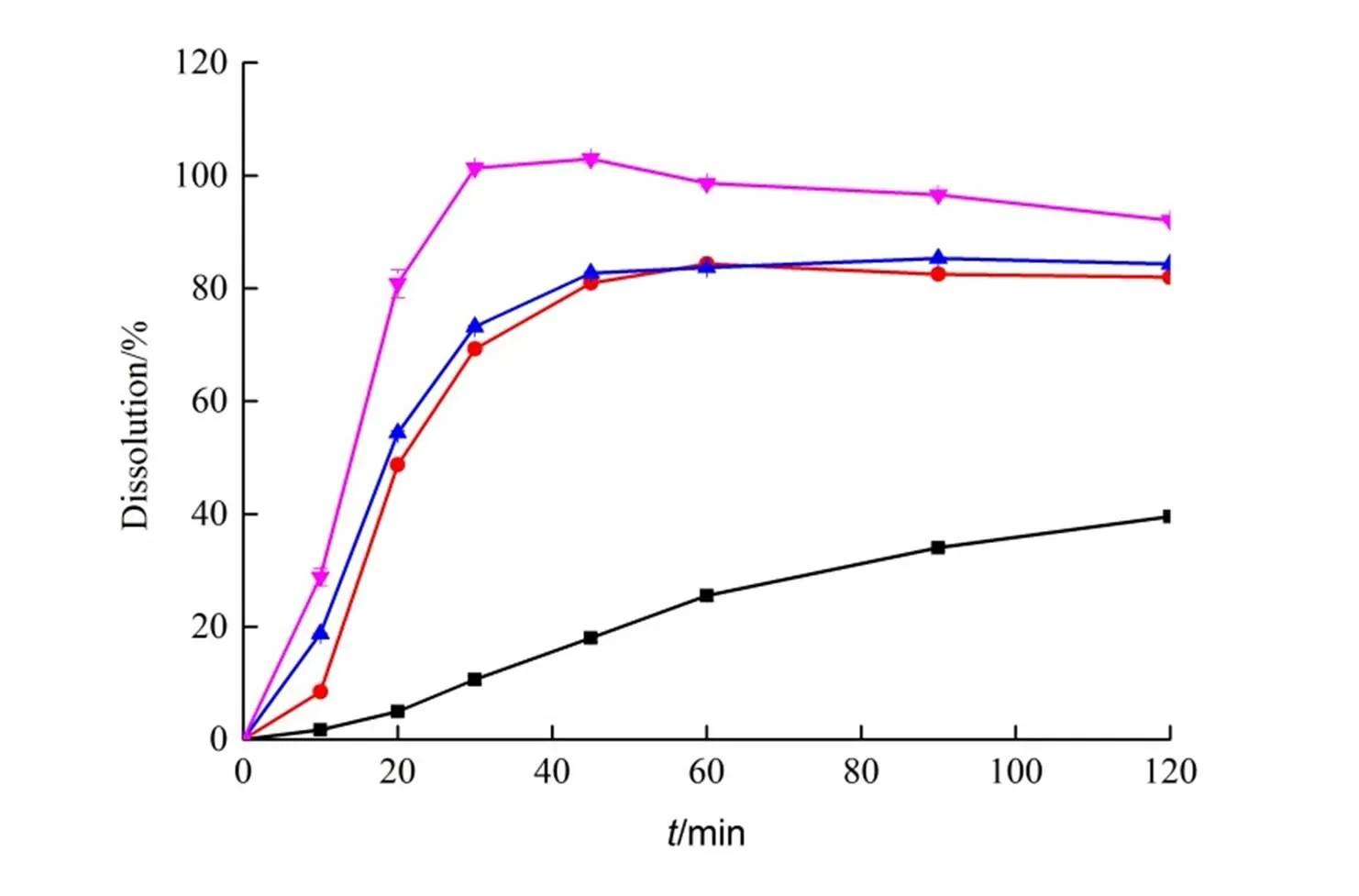
―DDB;―DDB-PEG6000;―DDB-PVP K30;―DDB-P188
由实验结果可以看出,三种载体制备的联苯双酯固体分散体中,联苯双酯的体外溶出度均高于联苯双酯原料药。其中,三种载体对联苯双酯的增溶效果依次为:P188>PVPK30>PEG6000,因此,选用P188为载体,继续考察不同载药量对联苯双酯固体分散体的影响。
2.2.3载体比例的考察
以P188为载体,按药辅比分别为1:2、1:5、1:8、1:10和1:12制备联苯双酯固体分散体。照“2.1.7”溶出度测定方法,考察不同载药量对联苯双酯固体分散体溶出的影响。结果见图3。

―DDB;―Physical mixture;―m(DDB):m(P188)=1:2;―m(DDB):m(P188)=1:5;―m(DDB):m(P188)=1:8;―m(DDB):m(P188)=1:10;―m(DDB):m(P188)=1:12
由实验结果可以看出,以P188为载体,不同药辅比制备的联苯双酯固体分散体中,联苯双酯的体外溶出度均大于其原料药和物理混合物,且随着载体比例的增大,联苯双酯溶出度也随之增大。当药辅比为1:8时,联苯双酯在30 min内溶出度即可达到90%以上。
综上,采用溶剂挥发法,以P188为载体,药辅比为1:8制备联苯双酯固体分散体。
2.3 联苯双酯-P188固体分散体的表征
2.3.1差示扫描量热法(differential scanning calorimetry, DSC)
分别精密称取联苯双酯原料药、空白载体、物理混合物及固体分散体约3~5 mg置于坩埚中,以空坩埚为参比,置于氮气流中,以10 °C·min-1的速率升温,从30 °C升温至200 °C 。结果见图4。

a―DDB; b―P188; c―Physical mixtue; d―DDB-P188
由扫描结果可知,联苯双酯原料药在180.8 °C有吸热峰,P188在57.5 °C有吸热峰,物理混合物中存在联苯双酯和P188共同的吸热峰;而在固体分散体中,联苯双酯的吸热峰完全消失,说明联苯双酯以无定型或者分子形式存在于固体分散体中。
2.3.2 X射线粉末衍射法(X-ray powder diffraction, XRPD)
分别取联苯双酯原料药、空白载体、物理混合物及固体分散体适量,进行XRPD分析。CuKa靶石墨单色器衍射束单色比,高压56 kV,单流30 mA,扫描2角度为3~40°,扫描速度为0.2°·s-1。结果见图5。

a―DDB; b―P188; c―Physical mixtue; d―DDB-P188
由扫描结果可知,联苯双酯2在6.30°、12.55°、19.85°、23.80°、25.15°和31.00°存在明显的晶体衍射峰,P188在19.35°和23.55°处也存在晶体衍射峰,在物理混合物中存在两者共同的衍射峰,但有部分联苯双酯特征峰强度减弱;而在以P188为载体的固体分散体中,仍然在19.35°和23.55°处存在P188的晶体衍射峰,并不存在联苯双酯的晶体衍射峰,说明联苯双酯以无定型或者分子形式存在于固体分散体中。
2.3.3 红外光谱法(Infrared Spectroscopy, IR)
分别取联苯双酯原料药、空白载体、物理混合物及固体分散体适量进行IR测定。采用溴化钾压片法进行测定,波长范围4 000~400 cm-1,分辨率为4 cm-1。测定结果见图6。

a―DDB; b―P188; c―Physical mixtue; d―DDB-P188
由红外图谱可知,联苯双酯在1 716.3 cm-1处有明显的羰基吸收峰,P188在3 454.6 cm-1处有明显的羟基吸收峰。在物理混合物中,存在两者的特征峰。在固体分散体中,联苯双酯在1 716.3 cm-1处的羰基吸收峰强度减弱,同时左移至1 721.3 cm-1,P188在3 454.6 cm-1处的吸收峰强度也明显减弱,同时左移至3 457.4 cm-1,说明联苯双酯与P188之间有氢键形成。
3 讨论
a. 联苯双酯属于BCSⅡ类药物,溶解度低是限制其应用的首要因素。基于此,采用溶剂挥发法制备联苯双酯固体分散体,提高其体外溶出度,以期提高其口服生物利用度。
b. 溶出试验结果表明,以PEG6000、PVP K30和P188三种载体制备的固体分散体中,以P188为载体制备的固体分散体对联苯双酯增溶作用最强。以P188为载体,不同药辅比制备的固体分散体中,联苯双酯体外溶出度均高于其原料药和物理混合物;且当药辅比为1:8时,联苯双酯在30 min内溶出度即可达到90%以上。DSC、XRPD和IR结果表明,联苯双酯与P188形成了氢键,联苯双酯在固体分散体中以分子形式或无定型存在。
c. 对于难溶性药物联苯双酯来说,粒径大小会影响到其体外溶出度,但是,将联苯双酯制备成固体分散体后,联苯双酯在固体分散体中以分子形式或无定型存在,其溶解度会有所提升。因此,后续没有考察粒径大小对联苯双酯固体分散体溶出度的影响。
d. 因为联苯双酯对热不稳定,因此不建议采用熔融法或者热熔挤出法等方法制备联苯双酯固体分散体。由于联苯双酯易溶于氯仿、二氯甲烷等有机溶剂,最终是以二氯甲烷为溶剂,采用溶剂挥发法制备联苯双酯固体分散体。对于溶剂残留问题,由于二氯甲烷沸点很低,易于挥发,所以将固体分散体在真空干燥箱中40 ℃条件下放置24 h,尽可能完全的除去有机溶剂。因此,后期将不再对有机溶剂进行检测。
[1] EI-BESHBISHY H A. The effect of dimethyl dimethoxy biphenyl dicarboxylate(DDB) against tamoxifen-induced liver injury in rats: DDB use is curative or protective[J]. Journal of Biochemistry and Molecular Biology, 2005, 38(3): 300-306.
[2] PAN S Y, YANG R, DONG H, et al. Bifendate treatment attenuates hepatic steatosis in cholesterol/bile salt-and high-fat diet-induced hypercholesterolemia in mice[J]. European Journal of Pharmacology, 2006, 552(1/2/3): 170-175.
[3] LIU M H, ZHAO L S, YANG D, et al. Preclinical pharmacokinetic evaluation of a new formulation of a bifendate solid dispersion using a supercritical fluid chromatography-tandem mass spectrometry method[J]. Journal of Pharmaceutical and Biomedical Analysis, 2014, 100: 387-392.
[4] GU X K, REN Z G, PENG H, et al. Bifendate-chalcone hybrids: a new class of potential dual inhibitors of P-glycoprotein and breast cancer resistance protein[J]. Biochemical and Biophysical Research Communications, 2014, 455(3/4): 318-322.
[5] NIE J J, YANG D Z, HU K, et al. Study on four polymorphs of bifendate based on X-ray crystallography[J]. Acta Pharmaceutica Sinica B, 2016, 6(3): 234-242.
[6] CAI C, LIU M, LI Y, et al. A silica-supported solid dispersion of bifendate using supercritical carbon dioxide method with enhanced dissolution rate and oral bioavailability[J]. Drug Development and Industrial Pharmacy, 2016, 42(3): 412-417.
[7] 田霞. 联苯双酯过饱和自微乳制剂的研究[D]. 北京:中国人民解放军军事医学科学院, 2011.
[8] 刘悦. 联苯双酯纳米混悬液的研究[D]. 济南:山东大学, 2012.
[9] 李慧. 热熔挤出技术制备联苯双酯固体分散体的研究[D]. 沈阳:沈阳药科大学, 2009.
[10] 国家药典委员会. 中华人民共和国药典:四部[M]. 北京:中国医药科技出版社, 2015: 38-40.
Preparation and characterization of bifendate solid dispersions
WANG Qun, WEI Zhongli, LI Qingsong, HE Zhonggui*
(,,110016,)
A solid dispersion of bifendate was prepared to improve thedissolution of bifendate.Bifendate solid dispersions were prepared by solvent evaporation method using PEG6000, PVP K30 and P188 as carriers. Meanwhile, the solid dispersions were characterized by DSC, XRPD and IR.Thedissolution of bifendate was significantly improved in the solid dispersion prepared by three carriers, and the solubilization effect of the three carriers on bifendate was in the order of P188 > PVP K30 > PEG6000. DSC, XRPD and IR results showed that bifendate was in an amorphous or molecular form in the solid dispersions.Thedissolution ofbifendate can significantly improve after it was loaded in the solid dispersions by solvent evaporation method.
pharmaceutics; bifendate; solid dispersions; dissolution
R94
A
(2020)02–0093–08
10.14146/j.cnki.cjp.2020.02.002
2019-05-30
王群(1992-),男(汉族),安徽亳州人,硕士研究生,E-mail wqsyykdx@163.com;
何仲贵(1965-),男(汉族),宁夏盐池人,教授,博士,博士生导师,主要从事药剂学和生物药剂学研究,Tel. 024-23986321,E-mail hezhonggui@vip.163.com。
(本篇责任编辑:马丽丽)
