新鲜党参酵母菌固体发酵工艺优化及其有效成分、抗氧化活性研究
2022-12-03王燕萍贾旭森牛伟霞王艳崔方胡芳弟
王燕萍 贾旭森 牛伟霞王艳崔方 胡芳弟∗
(1.兰州大学药学院, 甘肃 兰州730000; 2.东阿阿胶股份有限公司, 山东 聊城252000)
党参是一种重要的药食同源中药,含多糖、黄酮、党参炔苷、苍术内酯Ⅲ等功效成分及氨基酸、蛋白质等营养成分[1],具有健脾益肺、养血生津等功效,主要用于增强机体免疫力、改善胃肠道功能、提高学习和记忆能力等[2⁃3]。
发酵可改变中药材活性成分含量及结构,常被用于其增效减毒方面[4⁃5]。中药固体发酵是以中药材为发酵基质,利用一种或多种菌种进行发酵的方法[6],可增加其活性组分含量和活性[7⁃8]。
酵母菌是典型的糖菌,喜在含糖较高、偏酸性的环境中生长[9],而新鲜党参中富含糖分,可作为其天然营养体系。前期报道,新鲜党参中多糖、黄酮、党参炔苷等成分含量均高于加工后药材[10];预实验表明,在不添加任何营养物质和水的情况下,酵母菌可充分利用新鲜党参中的营养物质进行发酵并大量繁殖。因此,本实验采用酵母菌固体发酵新鲜党参,并对该工艺进行优化,以期为该药材的开发利用提供新方法。
1 材料
1.1 仪器 安捷伦1260 高效液相色谱,购自美国安捷伦科技公司;UV⁃1700 紫外分光光度计,购自日本Shimadzu 公司;DHG9070A 电热鼓风干燥箱,购自上海一恒科学仪器有限公司;CPA225D 电子分析天平、PH计,购自赛多利斯科学仪器(北京)有限公司;无菌培养皿、接种环,购自广州赛国生物科技有限公司;IS⁃RDD3 台式恒温振荡器,购自美国精骐公司;H1650 高速离心机,购自湖南湘仪科技有限公司;FreeZone®6L 冷冻干燥机,购自美国Labconco 公司;LS⁃35LD 灭菌锅,购自致微(厦门)仪器有限公司;破壁机,购自浙江苏泊尔股份有限公司;750T 多功能粉碎机,购自上海市浦恒信息科技有限公司;25×16 血球计数板,购自上海市求精生化试剂仪器有限公司;S⁃433D氨基酸全自动分析仪、LCAK06/Na 磺酸基强酸性阳离子交换树脂色谱柱,购自德国Sykam公司;N⁃WYVAP 112 型氮吹仪,购自美国Organomation 公司;S220⁃K 型酸度计,购自瑞士Mettler⁃Toledo 公司。
1.2 试剂与药物 新鲜党参采自甘肃省临洮县,经甘肃省中医药大学附属医院杨锡仓主任药师鉴定为桔梗科植物党参Codonopsis pilosula(Franch.)Nannf 的新鲜根。高活性干酵母菌(酿酒酵母属)Saccharomyces cerevisiae,购自安琪酵母股份有限公司。蛋白胨、酵母膏,购自北京奥博星生物技术有限公司;琼脂,购自北京索莱宝科技有限公司;葡萄糖(批号110833⁃200302),购自中国食品药品检定研究院。芦丁对照品(批号05⁃1001),购自上海中药标准化研究中心;氨基酸对照品(包括丙氨酸Ala、精氨酸Arg、天冬氨酸Asp、半胱氨酸Cys、谷氨酸Glu、甘氨酸Gly、组氨酸His、异亮氨酸Ile、亮氨酸Leu、赖氨酸Lys、蛋氨酸Met、苯丙氨酸Phe、脯氨酸Pro、丝氨酸Ser、苏氨酸Thr、酪氨酸Tyr、缬氨酸Val,批号SLBM6769V),购自美国Sigma⁃Aldrich 公司。茚三酮、色谱纯甲醇,购自天津市富宇精细化工有限公司;其他试剂均为分析纯;水为超纯水。
2 方法
2.1 酵母菌固体发酵工艺建立
2.1.1 培养基制备 YEPD 固体培养基配方为蛋白胨2%、酵母膏1%、葡萄糖1%、琼脂2%,pH自然,在120 ℃下高压蒸汽灭菌20 min;YEPD 液体培养基配方为蛋白胨2%、酵母膏1%、葡萄糖1%,pH 自然,在120 ℃下高压蒸汽灭菌20 min。
2.1.2 菌种活化 将菌种接种于YEPD 固体培养基中,活化48 h 备用。
2.1.3 液体培养扩繁 将活化菌种接种于YEPD液体摇瓶培养基中,在温度30 ℃、转速220 r/min条件下培养24 h,使其产生大量菌体,作为液体菌种。
2.1.4 发酵产物制备 将新鲜党参用破壁机多次打碎至无较大颗粒,置于500 mL 锥形瓶中,在120 ℃下高压蒸汽灭菌20 min,取出,静置至室温,接入酵母菌种,置于恒温恒湿箱中避光发酵,发酵产物置于40 ℃电热鼓风干燥箱中干燥,即得。
2.2 发酵终点确定 将酵母菌按一定比例接种在灭菌后的新鲜党参基质中进行发酵,在不同时间点取出菌质,测定pH值,再取不同时间点发酵产物,测定浸出物含量。
2.2.1 醇浸出物、水浸出物含量测定 按照2020年版《中国药典》四部2201 项下热浸法[11]进行测定,其中水为蒸馏水,测定醇浸出物时以稀乙醇替代蒸馏水。
2.2.2 pH 值测定 采用PH 计测定发酵过程中菌质pH 值。
2.3 酵母菌固体发酵工艺优化 文献[12] 报道,酵母菌最适生长温度为30 ℃,新鲜党参含水量为66.6%,在此基础上以含水量(A)、温度(B)、加菌量(B)为影响因素,设计三因素三水平L9(33)正交试验,具体见表1。预实验发现,新鲜党参发酵后指标成分黄酮、多糖、党参炔苷含量分别增加了75.45%、46.35%、44.68%,即黄酮含量变化最明显,故选择其作为评价指标。

表1 因素水平Tab.1 Factors and levels
2.3.1 黄酮供试品溶液制备 精密称取新鲜党参、灭菌党参适量(均相当于干药材1.0 g)及1.0 g发酵党参粉末,置于具塞三角瓶中,10 倍量甲醇超声提取3次,每次30 min,滤过,合并滤液,在60 ℃下减压蒸干,甲醇复溶并定容至10 mL 量瓶中,即得,每种样品平行3 份。
2.3.2 含量测定 参考文献[13] 报道,将供试品溶液稀释适当倍数,采用紫外可见分光光度法测定吸光度,以其为纵坐标,溶液质量浓度为横坐标绘制标准曲线,计算含量。
2.4 发酵前后微观结构变化研究 参考文献[14]报道,采用扫描电子显微镜(SEM)进行观察。
2.5 发酵前后有效成分含量变化研究
2.5.1 总糖、多糖、低聚糖
2.5.1.1 供试品溶液制备 精密称取新鲜党参、灭菌党参适量(均相当于干药材1.0 g)及1.0 g发酵党参粉末,95%乙醇加热回流提取2 次进行脱脂,每次1 h,滤过,药渣干燥,加10 倍量水煎煮3次,每次40 min,合并滤液,在70 ℃下减压浓缩至25 mL,作为总糖供试品溶液。取适量,加95%乙醇至终体积分数为80%,在4 ℃下静置24 h后离心,取上清液,置于水浴锅上蒸干,加水溶解并定容至25 mL 量瓶中,作为低聚糖供试品溶液。将沉淀用水溶解并定容至25 mL 量瓶中,作为多糖供试品溶液。上述溶液均平行制备3 份。
2.5.1.2 含量测定 参考文献[15] 报道,采用紫外可见分光光度法测定吸光度,以其为纵坐标,溶液质量浓度为横坐标绘制标准曲线,计算含量。
2.5.2 三萜
2.5.2.1 供试品溶液制备 精密称取新鲜党参、灭菌党参适量(均相当于干药材1.0 g)及1.0 g发酵党参粉末,置于250 mL 具塞三角瓶中,加100 mL 95%乙醇超声提取3次,每次30 min,滤过,合并滤液,在60 ℃下减压浓缩至干,30 mL氯仿溶解,饱和NaHCO3溶液萃取3次,将NaHCO3层用6 mol/L HCl 调节pH 值至3~4,最后用氯仿萃取3次,合并氯仿层,在60 ℃下减压蒸干,用无水乙醇溶解并定容至50 mL 量瓶中,即得。
2.5.2.2 含量测定 参考文献[16] 报道,将供试品溶液稀释适当倍数,采用紫外可见分光光度法测定吸光度,以其为纵坐标,溶液质量浓度为横坐标绘制标准曲线,计算含量。
2.5.3 党参炔苷
2.5.3.1 供试品溶液制备 精密称取新鲜党参、灭菌党参适量(均相当于干药材1.0 g)及1.0 g发酵党参粉末,加10 倍量甲醇回流提取3次,每次40 min,滤过,滤液浓缩后定容至10 mL 量瓶中,即得。
2.5.3.2 含量测定 参考文献[13] 报道,将供试品溶液稀释适当倍数,采用HPLC 法测定。
2.5.3.3 色谱条件参考文献 [13] 报道,DiamonsiL C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈⁃水(26∶74);体积流量1 mL/min;柱温30 ℃;检测波长267 nm;进样量10 μL。
2.5.4 氨基酸
2.5.4.1 供试品溶液制备 精密称取适量新鲜党参(相当于干药材0.5 g)、灭菌党参(相当于干药材1.0 g)及1.0 g 发酵党参粉末,置于水解管中,加入6 mol/L 盐酸10 mL,再加入1%苯酚溶液3滴,将水解管置于-20 ℃冰箱中冷冻5 min 后通氮气封口,置于110 ℃烘箱中水解22 h,取出放冷至室温,打开水解管,水解液过滤后吸取0.5 mL至10 mL EP 管内,氮气吹干,残留物用6 mL稀释液溶解,0.22 μm 微孔滤膜过滤,即得。
2.5.4.2 含量测定 参考文献[17] 报道,采用HPLC 法测定。
2.5.4.3 色谱条件 LCAK 06/Na 型磺酸基强酸性阳离子交换树脂色谱柱(4.6 mm×150 mm,5 μm);流动相缓冲液A、缓冲液B、再生液C;衍生化试剂茚三酮;体积流量A 泵(洗脱泵)0.45 mL/min,M 泵(衍生泵)0.25 mL/min;检测波长440 nm(脯氨酸)、570 nm(其余氨基酸);进样量50 μL。
2.6 发酵前后抗氧化活性变化研究
2.6.1 供试品溶液制备 取 “2.5.1.1”项下95%乙醇提取物,在60 ℃下减压浓缩至25 mL,即得。
2.6.2 清除率测定
2.6.2.1 DPPH 自由基 参考文献[18] 报道,取稀释5 倍后的供试品溶液、80 μg/mL DPPH 溶液各1 mL,摇匀,避光反应30 min,以蒸馏水为空白调零,在517 nm 波长处测定吸光度A1;以稀乙醇代替供试品溶液,同法测定吸光度A0,计算清除率,公式为清除率=(1-A1/A0)×100%,重复3次,取平均值。
2.6.2.2 超氧阴离子自由基 参考文献[19]报道,取供试品溶液1 mL,加 入 Tris⁃HCl 缓冲液(16 mmol/L,pH 8.0)、NADH⁃2Na(338 mmol/L)、PMS(30 mmol/L)、NBT(72 mmol/L)各1 mL,混匀后室温反应5 min,以蒸馏水为空白调零,在560 nm 波长处测定吸光度A1,以稀乙醇代替供试品溶液,同法测定吸光度A0,计算清除率,公式为清除率=(1-A1/A0)×100%,重复3次,取平均值。
2.6.2.3 羟自由基 参考文献[20⁃21] 报道,取供试品溶液0.2 mL,依次加入反应液(20 mmol/L pH 7.4 的磷酸盐缓冲液、2.67 mmol/L 脱氧核糖、100 mmol/L EDTA)0.6 mL 及0.4 mmol/L 硫酸亚铁胺溶液、10 mmol/L 过氧化氢溶液各0.2 mL,37 ℃水浴加热15 min,再加入1% 硫代巴比妥酸(TBA)溶液、2% 三氯乙酸(TCA)溶液各1 mL终止反应,沸水浴加热15 mim 后冷却至室温,以蒸馏水为空白调零,在532 nm 波长处测定吸光度A1;以稀乙醇代替供试品溶液,同法测定吸光度A0,计算清除率,公式为清除率=(1-A1/A0)×100%,重复3次,取平均值。
3 结果
3.1 发酵终点确定 发酵过程中会产生酒精,对酵母菌有毒害作用,酵母菌呼吸产物积累使pH 值发生改变而不再适宜其生长,故pH 值可作为判断发酵终点的指标。由图1 可知,pH 值在48 h 后趋于稳定,可认为发酵达到终点。
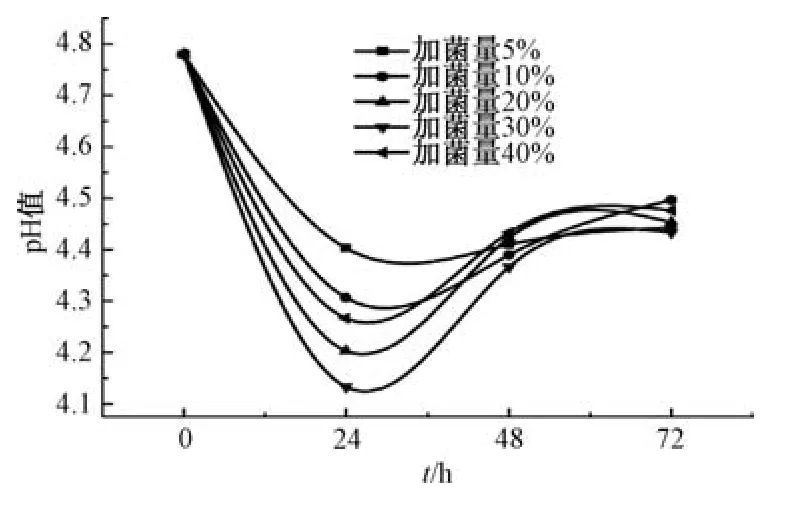
图1 不同发酵时间pH 值变化Fig.1 pH value changes at different fermentation time
另外,酵母菌呼吸时会消耗营养物质,导致后者不足,很难维持前者代谢需求,从而使反应速率降低或停止,故水浸出物、醇浸出物含量也可作为判断发酵终点的指标。由图2 可知,醇浸出物、水浸出物含量在48 h 后趋于稳定,故确定发酵时间为48 h。
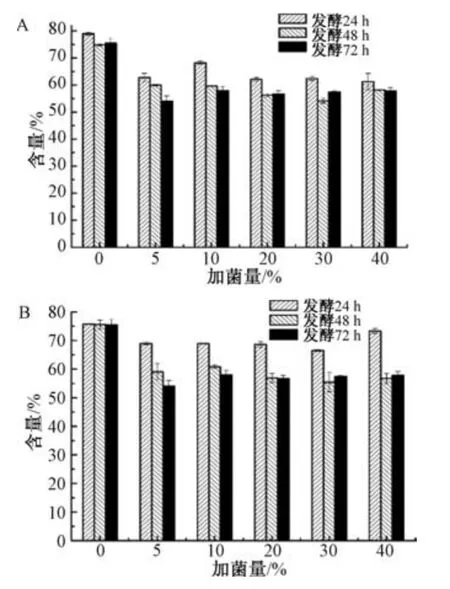
图2 不同发酵时间醇浸出物(A)、水浸出物(B)含量变化Fig.2 Content changes of alcohol extract(A)and water extract(B)at different fermentation time
3.2 酵母菌固体发酵工艺优化 表2 显示,各因素影响程度依次为B(温度)>C(加菌量)>A(含水量)。方差分析见表3,可知因素B有显著影响(P<0.05),而A、C无显著影响(P>0.05),综合考虑工艺的操作性及成本,最终确定最优工艺为A1B2C2,即发酵温度30 ℃,含水量66%,加菌量10%。
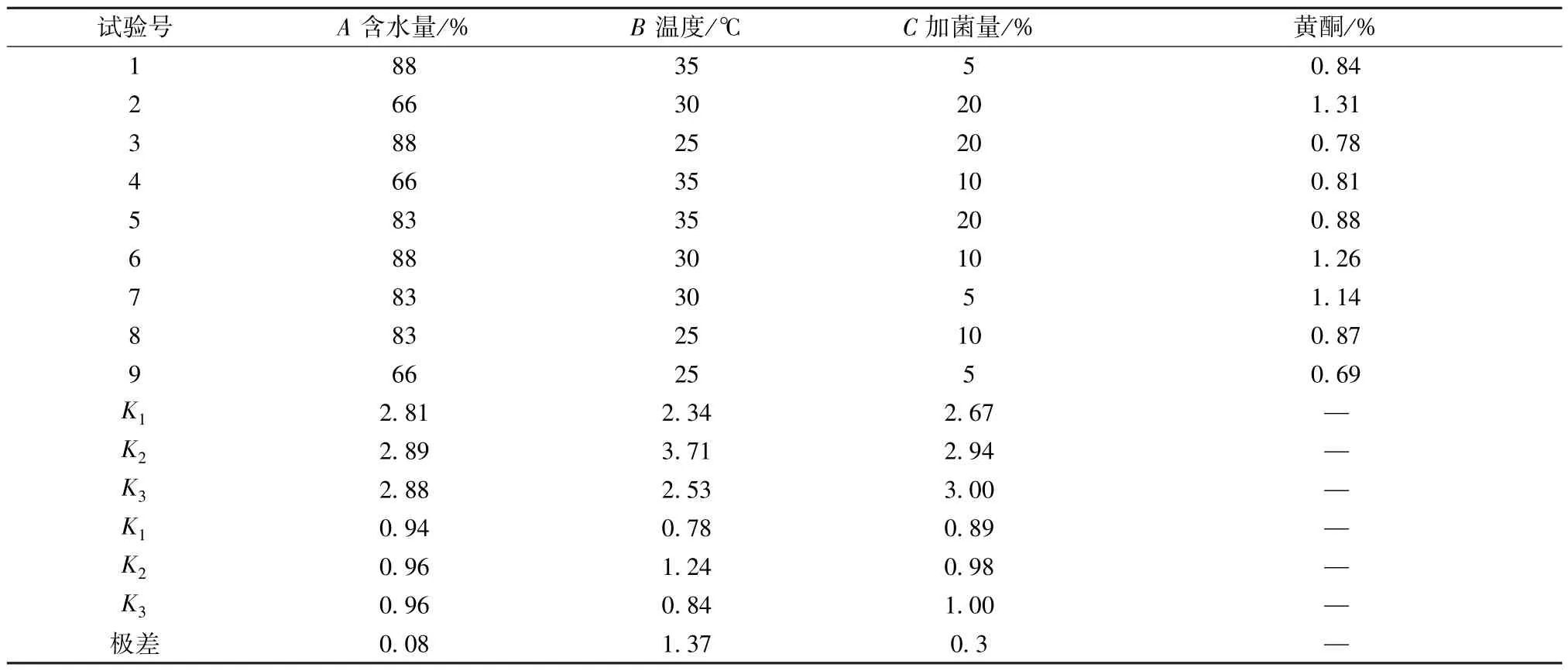
表2 试验设计与结果(n=3)Tab.2 Design and results of tests(n=3)
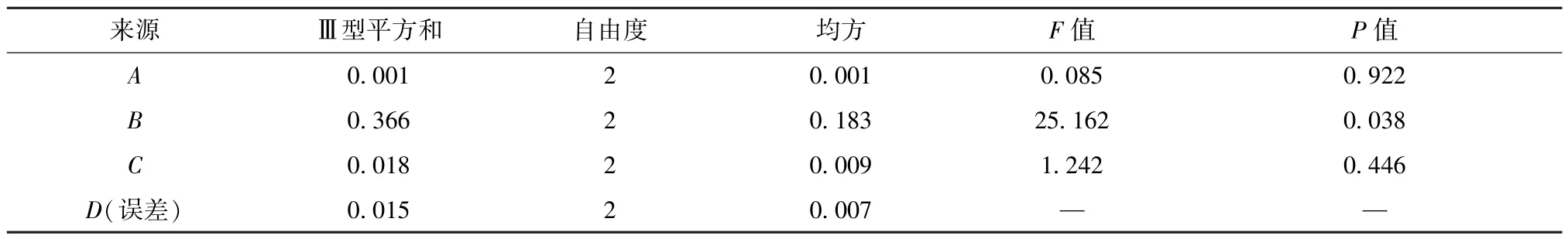
表3 方差分析Tab.3 Analysis of variance
按照上述优化工艺制备3 批样品,测得黄酮含量分别为1.23%、1.22%、1.18%,平均值为1.21%,RSD 为2.19%,表明该工艺稳定可行。
3.3 发酵前后微观结构变化 图3 显示,发酵可使新鲜党参的致密组织变成了疏松多孔的结构。

图3 各样品SEM 图Fig.3 SEM images of various samples
3.4 发酵前后有效成分含量变化 表4 显示,与新鲜党参比较,发酵党参中低聚糖、总糖含量分别降低7.56%、35.95%,前者含量降低的原因是酵母菌以其为糖源进行生长代谢活动,进而使后者含量降低;黄酮、多糖、三萜、党参炔苷、总氨基酸含量分别升高70.27%、47.92%、128.00%、41.38%、69.90%;除了胱氨酸外,其余16 种氨基酸含量均升高,其中12 种增加率在60%以上,同时药用氨基酸(Glu、Asp、Arg、Gly、Phe、Tyr、Met、Leu、Lys)、人体必需氨基酸(Thr、Val、Met、Phe、Lys、Ile、Leu)含量分别升高66.39%、74.16%。
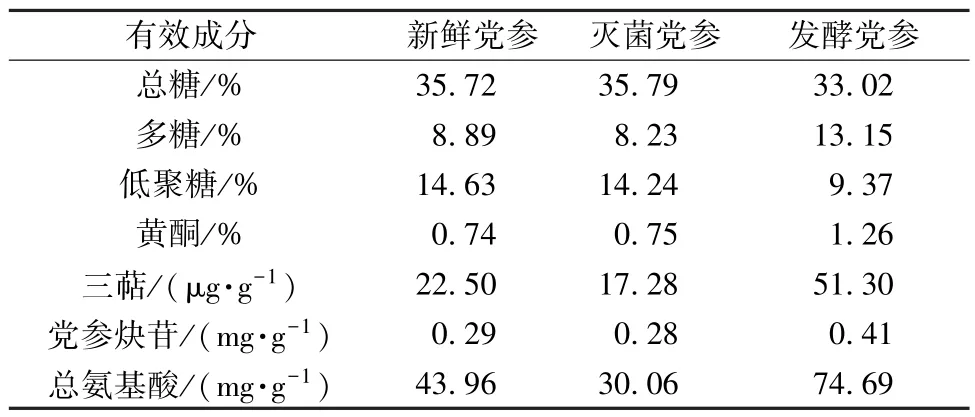
表4 发酵前后有效成分含量变化(n=3)Tab.4 Content changes of effective constituents before and after fermentation(n=3)
3.5 发酵前后抗氧化活性变化 图4 显示,发酵后DPPH、超氧阴离子、羟自由基清除活性均加强,其原因一方面为有效成分发生了转化,具有较强的抗氧化活性;另一方面,在发酵过程中酵母菌通过自身生长代谢产生一些活性物质,可能使其抗氧化活性增加。
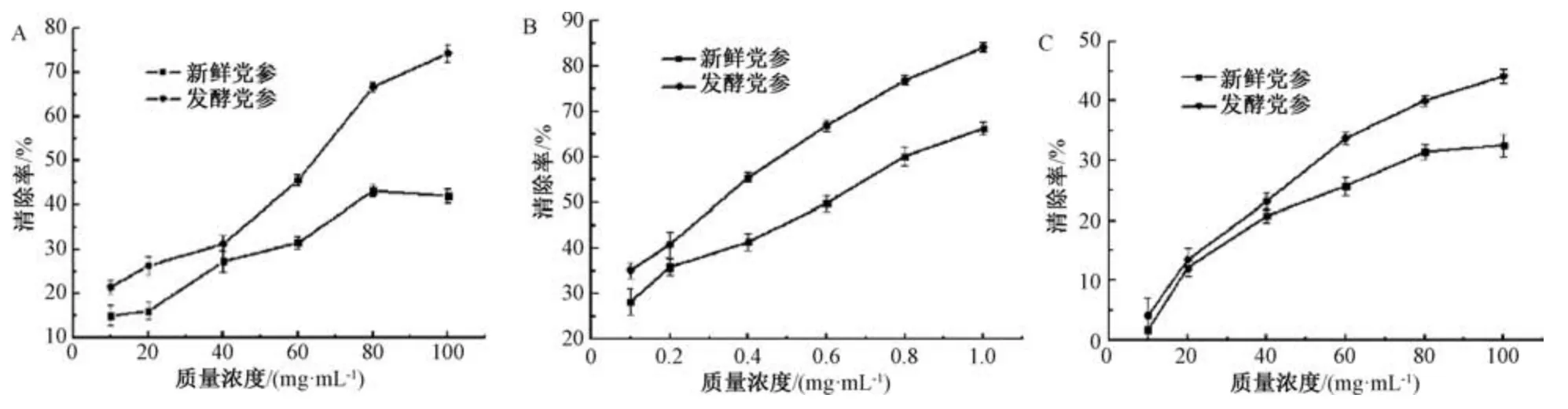
图4 发酵前后对超氧阴离子自由基(A)、DPPH 自由基(B)、羟自由基(C)清除率变化Fig.4 Scavenging rate changes on superoxide anion free radical(A),DPPH free radical(B)and hydroxyl free radical(C)before and after fermentation
4 讨论
本实验首先通过发酵前后水浸出物、醇浸出物含量及发酵过程中pH 值确定发酵终点,发现三者在48 h 后趋于稳定,表明已达到了发酵终点。再以黄酮含量为指标,设计三因素三水平正交试验对发酵工艺进行优化,最终确定为温度30 ℃,含水量66%,加菌量10%。最后考察了有效成分含量及自由基清除活性,发现发酵后党参黄酮、多糖、三萜、党参炔苷、总氨基酸含量分别升高了70.27%、47.92%、128.00%、41.38%、69.90%,而总糖、低聚糖含量分别降低了7.56%、35.95%;发酵产物95%乙醇提取物对DPPH、超氧阴离子、羟自由基的清除活性较高。新鲜党参通过酵母菌发酵后,多糖含量增加,总糖、低聚糖含量降低,可为开发适用于糖尿病患者的特医食品提供一定思路。
