斑马鱼ddx27基因对tp53基因的调控作用
2022-12-03陈改拓周志杰周泽斌包林珠邱军强李伟明张庆华
陈改拓,周志杰,周泽斌,包林珠,邱军强,李伟明,张庆华
1.上海海洋大学水产种质资源发掘与利用教育部重点实验室/上海海洋大学国家水生动物病原库,上海 201306;2.密歇根州立大学农业和自然资源学院,美国,密歇根,东兰辛 48824
DDX 解旋酶(DEAD-box RNA helicase,DDX)属于解旋酶超家族2(helicase superfamily 2,SF2)的成员,是真核生物、古细菌和细菌中最大的RNA 解旋酶家族之一[1]。DDX 解旋酶的特征是存在一个特定的氨基酸基序Asp-Glu-Ala-Asp(D-E-A-D),它参与RNA 代谢并发挥多种功能,如翻译过程、转录过程、RNA 稳定性、mRNA 输出、mRNA 剪接等[2]。在人类和斑马鱼中DDX 解旋酶家族成员众多,数量庞大,并且它们在结构上高度保守[3]。DDX 解旋酶主要与癌症、病毒感染和个体发育相关。例如人类DDX3在多数乳腺癌患者中过度表达,并且与乳腺癌远端转移相关[4]。
斑马鱼ddx27和人类DDX27一样,作为DDX 解旋酶家族的一员,同样也含有保守的D-E-A-D 序列。DDX27 调控核糖体RNA(rRNA)的成熟,参与调节47S 核 糖 体RNA(rRNA)的 形 成[5]。目 前 有 关DDX27 的研究主要聚焦于人类癌症领域,发现DDX27 与恶性肿瘤的发生有关。例如,DDX27 通过控制细胞周期有助于胃癌细胞的集落形成,而DDX27的敲除可以抑制细胞周期进程而降低胃癌细胞的生存能力[6]。在大肠癌中DDX27的异位表达增强了大肠癌细胞的增殖、迁移和侵袭能力,同时也抑制了细胞凋亡[7]。斑马鱼ddx27除了调控核糖体的生物发生外,还与肌肉发生过程中特异转录物的翻译有关,缺失ddx27的斑马鱼骨骼肌的生长和再生遭受了严重损害,这种情况被认定为一种新的核糖体疾病[8]。
TP53基因在调控癌症发生和发展中具有重要作用,并且与DDX 解旋酶关系密切。例如有研究发现TP53与DDX3基因之间的P53-DDX3 通路的改变会导致P21蛋白减少,与早期人乳头瘤病毒相关肺癌病人的无复发生存率(recurrence free survival,RSF)相关[9]。DDX5和DDX17基因在乳腺癌中高表达,苏木酰化的DDX5 和DDX17 通过调节雌激素受体和P53 的活性对乳腺癌产生影响[10]。 DEADbox RNA 解旋酶家族成员之间在结构上高度保守,并且在进化上也高度保守,均含有RNA和ATP结合位点这两个高度保守的核心区域结构[11]。而DDX27、DDX3、DDX5 和DDX17 同属于DEAD-box RNA解旋酶家族,均与癌症发生联系密切。因此,我们猜测ddx27和tp53之间也可能存在相应的调控关系,有必要进行详细的研究。
目前斑马鱼被广泛用于水产及人类疾病模型的研究,如早期发育、免疫调节[12]、合成代谢[13]和癌症等领域。斑马鱼在病理生理、发育和遗传方面与人类表现出高度的相似性[14]。相较于线虫和果蝇,斑马鱼与哺乳动物在进化上的关系更密切,具有更强的研究潜力。本研究通过构建斑马鱼ddx27基因真核表达载体,并将其转染到HEK293T 细胞中,利用亚细胞定位和蛋白质免疫印迹检测蛋白水平的表达,最后将ddx27真核表达载体与tp53启动子共转,探究过表达ddx27对tp53的影响,以期为疾病及动物发育相关机制的深入研究提供良好的实验材料,并为水生动物DDX 解旋酶家族成员的功能研究奠定基础。
1 材料与方法
1.1 试验材料和主要试剂
试验用人胚肾细胞(human embryonal kidney,HEK293T)和内参质粒phRL-TK均由海军军医大学李楠教授惠赠。tp53基因启动子报告基因载体pGL3-p53-Luc由笔者所在实验室自行构建。
DH5α 感受态细胞购自北京擎科生物科技有限公司;高保真酶购自天根科技(北京)有限公司;胶回收/DNA纯化试剂盒、质粒提取试剂盒和同源重组试剂2×ClonExpress Mix 均购自南京诺唯赞科技股份有限公司;简单培养基Opti-MEMTM、胰蛋白酶购自Gibco Life Technologies(美国);Fugene®HD Trans⁃fection Reagent 转染试剂、Dual-Luciferase®报告基因活性检测试剂盒均购自Promega(美国);哺乳动物表达载体p3XFLAG-CMV-7、Bovine Serum Albumin、TritonTMx-100 购自Sigma(美国);小鼠抗FLAG-tag单克隆抗体、β-actin、Rabbit pAb、Peroxidase-Conju⁃gated Goat Anti-Rabbit IgG(H+L)购自翌圣生物科技(上海)股份有限公司;Goat anti-Mouse IgG(H+L)Secondary Antibody、Alexa FluorTM488goat antimouse lgG9(H+L)购自Invitrogen(美国)。
试验所用主要仪器:共聚焦显微镜(Leica,STELLARIS 5),酶标仪(BioTek,Synergy2),电泳仪(Bio-Rad,PowerPac Basic),照胶仪(Bio-Rad,Gel Doc EZ Imager)。
1.2 斑马鱼Ddx27氨基酸序列保守性分析
首先利用SMART网站(http://smart.embl.de/)分析斑马鱼Ddx27 蛋白的结构域。通过NCBI 网站得到其他物种的Ddx27 氨基酸序列之后,对斑马鱼Ddx27 氨基酸序列与人(Homo spaiens)、半滑舌鳎(Cynoglossus semilaevis)、蟒蛇(Python bivittatus)、大山雀(Parus major)和鸭嘴兽(Ornithorhynchus anati⁃nus)等物种的Ddx27 氨基酸序列进行比对。之后将各物种的Ddx27 氨基酸序列输入MEGA7.0 软件,利用软件内的邻接法(NJ)构建系统进化树分析斑马鱼Ddx27氨基酸序列的种间保守性。
1.3 斑马鱼ddx27真核表达载体的构建
根据NCBI 网站上登录的斑马鱼ddx27基因(NM_001002869.1)的编码序列(coding sequence,CDS)在两端设计引物:利用诺唯赞官网的CE De⁃sign 引物设计程序,输入ddx27基因CDS 区序列、载体序列并选择好2个酶切位点,确认后得到带同源臂的引物序列,如表1 所示。利用高保真酶与野生型(wild type,WT)斑马鱼的cDNA,进行ddx27CDS区片段的扩增,扩增程序为:98 ℃变性10 s、56 ℃退火15 s、72 ℃延伸30 s,进行34 个循环,最后保存在4 ℃(扩增体系同文献[15])。电泳检测PCR产物,用割胶纯化试剂盒对目标条带进行PCR 产物纯化回收。回收产物为带有同源臂的片段,再利用同源重组连接酶使之与PstⅠ和BamHⅠ双酶切后的pC⁃MV-3×Flag 质粒连接。得到连接产物后,将产物加入到解冻后的DH5α 感受态细胞中,冰置30 min,通过热激转化法将连接产物也就是重组质粒转化到DH5α 感受态细胞中,经过氨苄抗性筛选出多个单菌落进行扩摇培养,再以扩摇的菌液为模板用通用引物(表1)进行菌液PCR,将出现正确片段大小的菌液全部送生工生物工程(上海)股份有限公司测序,测序结果与目的片段序列一致的菌液继续扩摇,取其中部分进行保藏,剩下的菌液通过试剂盒提取重组质粒。
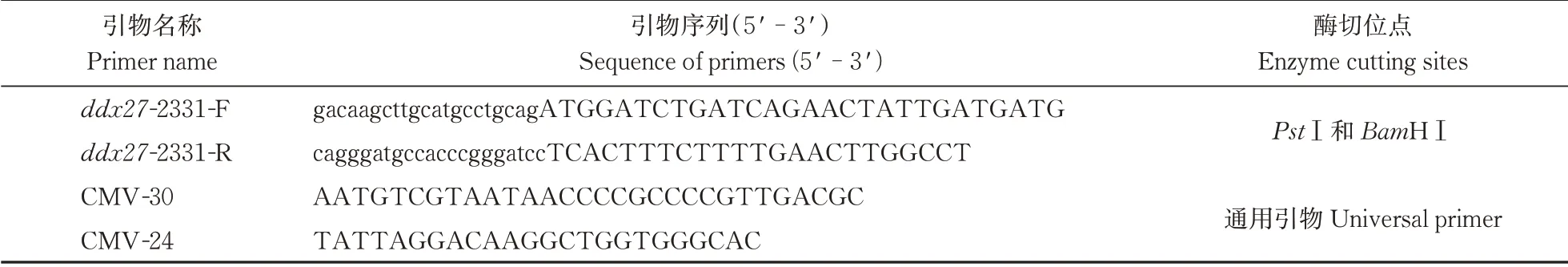
表1 构建ddx27重组质粒所用引物以及酶切位点的选择Table 1 Primers required for the construction of ddx27 recombinant plasmid and selection of enzyme digestion sites
1.4 Western blot验证Ddx27蛋白的表达
使用脂质体法将试验组pCMV-3×Flag-ddx27真核表达载体与对照组pCMV-3×Flag 载体各自转染至HEK293T 细胞中,在细胞裂解液中加入1∶1 000 蛋白酶抑制剂,在培养36 h 后向24 孔板加入细胞裂解液提取蛋白。取试验组与对照组各20 μL和40 μL 蛋白样品进行SDS-PAGE 聚丙烯胺凝胶电泳,加入冰盒后先80 V 电泳30 min,待样品迁移至浓缩胶后再100 V 电泳80 min。电泳结束后用湿法转膜器将凝胶上的条带转至NC 膜上,封闭液封闭1 h,弃去封闭液,以鼠源FLAG-tag 抗体为一抗(1∶3 000倍稀释)孵育过夜,后用PBST 漂洗滤膜3 次,每次6 min,以山羊抗鼠为二抗(1∶3 000 倍稀释)孵育5 h,再用PBST 漂洗滤膜4 次,每次6 min,加入显影液拍照,用相同的操作得到β-actin 蛋白条带,最后分析Western blot结果。
1.5 亚细胞定位检测Ddx27蛋白的表达位置
将复苏后的HEK293T 细胞培养至状态稳定后,把pCMV-3×Flag-ddx27质粒转染到细胞中。在培养皿中用HD 转染试剂将pCMV-3×Flag-ddx27和pCMV-3×Flag 各自转染800 ng。转染36 h 后,经多聚甲醛固定,甲醇透化,缓冲液封闭后,添加一抗(FLAG-tag)和荧光二抗进行孵育,之后添加DAPI于黑暗中孵育,最后在共聚焦显微镜下观察标本并拍照。详细步骤参照文献[16]。
1.6 双荧光素酶试验
待复苏后的HEK293T 细胞状态稳定后,将转染复合物(表2)添加到24 孔细胞培养板中。培养36 h后使用酶标仪进行双荧光素酶检测并利用分析软件计算萤火虫荧光素酶(firefly luciferase)与海肾荧光素酶(Renillaluciferase)所激发的荧光强度的比值,比较对照组与试验组之间的差异。每组设置3 个生物学重复,每个生物学重复内再设置3 个技术重复,共9个重复。详细步骤参照文献[15]。

表2 双荧光素酶试验转染复合物配比Table 2 Dual-luciferase assay transfection complex proportion
1.7 统计学处理
试验所有原始数据用Excel 软件进行统计分析,以平均值(mean)±标准误差(SE)表示。利用Prism 8软件进行显著性分析,若P<0.05 则表示组间具有显著性差异。
2 结果与分析
2.1 斑马鱼Ddx27氨基酸序列同源性分析
SMART 网站结构域分析结果显示斑马鱼Ddx27 蛋白编码776 个氨基酸,拥有2 个主要的结构域:位于220~421 氨基酸位点的DEXDc 结构域与460~541 氨基酸位点的HELICc 结构域,这2 个结构域符合Ddx27 蛋白作为RNA 解旋酶的这一功能。氨基酸序列比对结果显示斑马鱼与遮目鱼Ddx27 氨基酸一致性最高,为83.99%,与人DDX27 的一致性为72.39%,与小鼠的一致性为71.46%,与鸭嘴兽的一致性为70.78%,与家燕的一致性为67.85%,与鬃狮蜥的一致性为61.64%。系统进化树构建结果表明,哺乳动物、鸟类和爬行类DDX27 聚为一大支,硬骨鱼类Ddx27 聚为另一大支,哺乳动物各自聚为一个分支(图1)。结合上述斑马鱼Ddx27 结构域与同源性分析结果,我们发现斑马鱼Ddx27 蛋白在进化中具有较高的保守性。

图1 斑马鱼Ddx27系统进化树构建Fig.1 Phylogenetic tree construction of zebrafish Ddx27
2.2 斑马鱼ddx27基因CDS区真核表达载体构建结果与验证
为了能够在体外表达斑马鱼Ddx27 蛋白,利用同源重组法构建了斑马鱼ddx27真核表达载体,结果显示,ddx27基因CDS 区PCR 扩增结果(图2A)与菌液PCR 电泳检测结果(图2B)均在对应位置显示出与预测片段大小一致的单一明亮条带。说明目的片段已经成功连接到载体上。将构建的真核表达载体命名为pCMV-3×Flag-ddx27,经测序验证其信息与预测信息一致,表明ddx27真核表达载体构建成功。
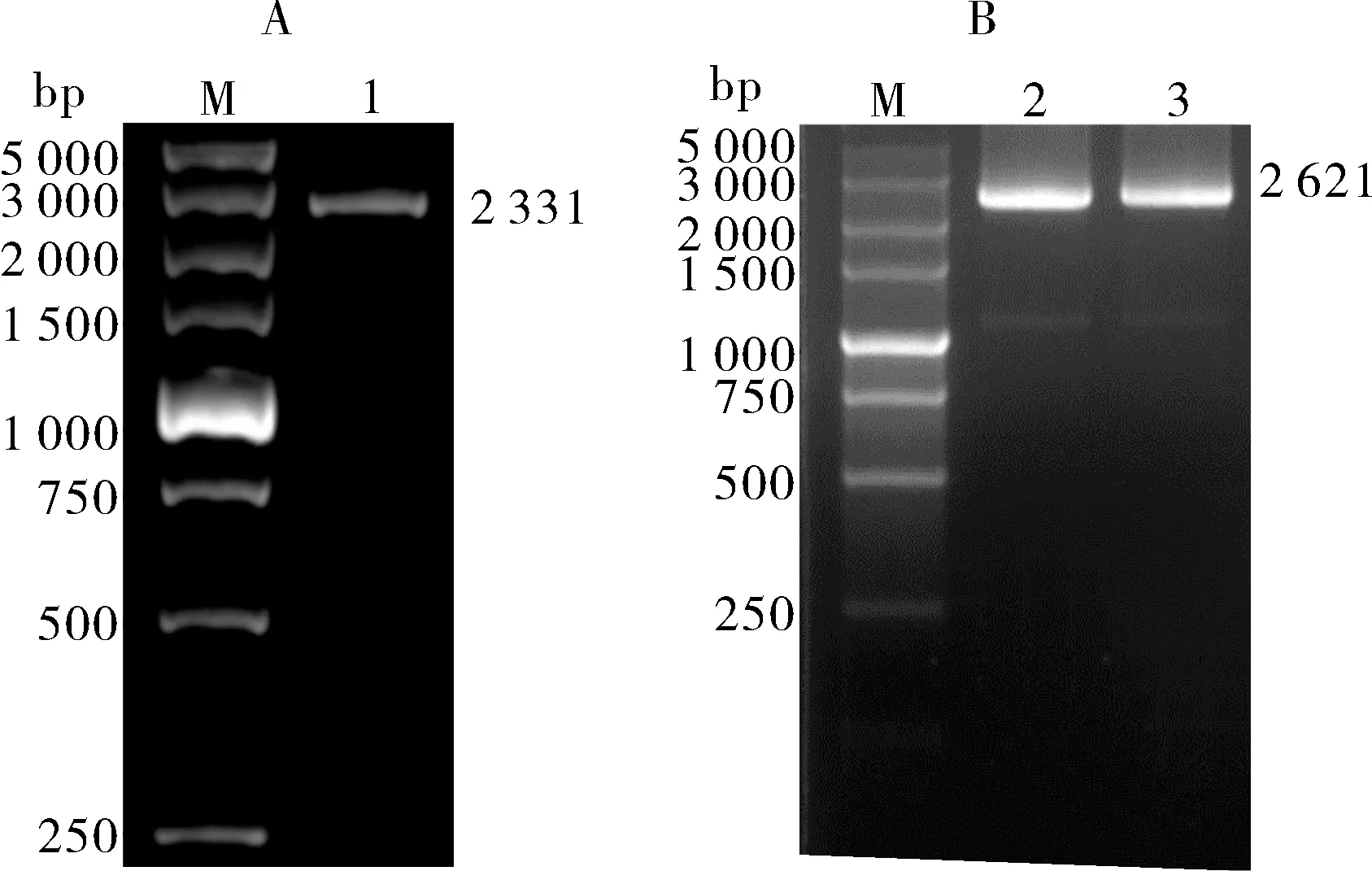
图2 ddx27基因CDS区序列克隆与真核表达载体构建验证Fig.2 Sequence cloning of CDS region of ddx27 gene and validation of eukaryotic expression vector construction
2.3 蛋白免疫印迹法验证重组质粒的表达
为了验证重组质粒能否在HEK293T 细胞中表达,利用Western blot 进行蛋白表达分析,结果显示只有试验组出现了明显的条带,大小约为100 ku,与预测蛋白大小基本一致。表明重组质粒成功在HEK293T细胞中表达Ddx27蛋白(图3)。

图3 Ddx27蛋白Western blot检测结果Fig.3 Western blot results of Ddx27 protein
2.4 重组质粒在HEK293T细胞中的表达位置
亚细胞定位结果如图4 所示。图中呈现蓝色荧光的是DAPI试剂标记的细胞核,呈现绿色荧光的是FLAG 标签抗体标记的pCMV-3×Flag-ddx27,同时进行明场观察。试验组绿色荧光与蓝色荧光重叠,而对照组没有观察到绿色荧光,说明pCMV-3×Flag-ddx27载体聚集于HEK293T 细胞的细胞核中进行表达,Ddx27 蛋白定位于细胞核,符合ddx27参与细胞核内rRNA加工的功能。

图4 pCMV-3×Flag-ddx27在HEK293T细胞中的定位Fig.4 Localization of pCMV-3×Flag-ddx27 in HEK293T cells
2.5 双荧光素酶试验结果
通过比较对照组与试验组pGL3-tp53-Luc 启动子的荧光素酶相对活性,发现过表达斑马鱼ddx27基因后,pGL3-tp53-Luc 启动子的转录活性显著升高,约为对照组活性的1.8 倍,试验组和对照组具有显著差异(图5)。说明过表达斑马鱼ddx27基因可以显著促进tp35基因的表达。
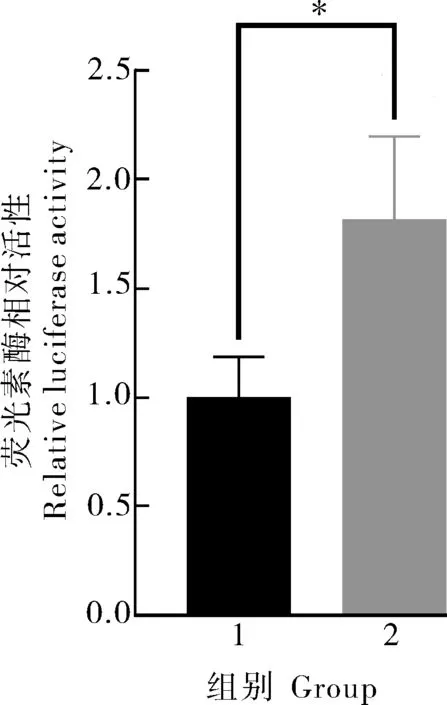
图5 斑马鱼ddx27对tp53转录活性的影响Fig.5 Effect of zebrafish ddx27 on the transcriptional activity of tp53
3 讨 论
DEAD-box解旋酶家族几乎参与各种与RNA相关的生化进程,其中DDX27 参与调控核糖体的生物发生中rRNA 的成熟[17]。斑马鱼Ddx27 能够调控特定细胞中rRNA 的成熟,具有特异性,当斑马鱼缺乏Ddx27 会导致肌肉细胞核的rRNA 合成缺陷,而其他DDX 解旋酶家族成员不能弥补这种缺陷,验证了ddx27在骨骼肌中的高度特化作用[8]。我们研究发现ddx27在HEK293T 细胞的细胞核中表达,证实了ddx27于细胞核内调控rRNA 的成熟的功能,但HEK293T 细胞属于肾细胞,并且DDX27在多种癌细胞中高表达,说明DDX27的功能并不局限于此。
最新研究发现在人类乳腺癌中DDX27 的过度表达可增强与干细胞相关的生物标记物的表达,并促进干细胞活性,导致乳腺癌细胞的增殖和迁移[18]。DDX27 还能通过增强ERK 信号传导,在人类肝癌中起诱导作用[19]。通过siRNA 技术敲除肾癌细胞中的DDX27基因后能够有效降低肾癌细胞的迁移和侵袭能力[20]。上述研究都在人类癌细胞中发现DDX27高表达,暗示DDX27 在人类癌细胞中发挥癌基因作用,可以将其作为癌症治疗的靶点。斑马鱼ddx27基因作为人类DDX27基因的同源基因,参与斑马鱼肌肉的发育,而我们的研究发现ddx27基因可以增强tp53基因的转录活性,并且斑马鱼tp53基因启动子区预测到了Sp1、c-Jun 和NF-kappaB1 等转录因子结合位点,Sp1 和c-Jun 均与凋亡相关,NF-kappaB1能够调节翻译水平上的P53 表达[15]。另有研究发现DDX10 下调后可以通过Akt/NF-κB 途径促进卵巢癌的增殖[21],说明斑马鱼ddx27可能通过Akt/NFκB 途径调控tp53,而tp53在斑马鱼脑神经嵴发育中起到了重要作用[22],因此ddx27除了参与多种癌症的发生,还可能参与动物不同组织器官的发育过程,这需要进一步的深入研究。斑马鱼作为新兴的模式动物,作为硬骨鱼类的代表,对其DDX 解旋酶家族分子功能的研究较少。我们的研究显示斑马鱼Ddx27 蛋白氨基酸序列与人类及小鼠同源基因的一致性高达70%以上,表明斑马鱼ddx27基因与人类和小鼠中的同源基因功能存在较高的保守性,因此,斑马鱼能够成为研究人类疾病机制的有效动物模型。
综上所述,本研究对构建成功的斑马鱼pCMV-3×Flag-ddx27真核表达载体进行了蛋白表达分析以及亚细胞定位,过表达斑马鱼ddx27基因载体后,能够增强tp53基因的表达,为进一步解析动物发育疾病及人类各种癌症发生的详细机制奠定了理论基础,也为进一步研究DDX 家族的功能和机制提供可靠的研究材料。
