前导肽区域N-糖基化影响骆驼凝乳酶原在毕赤酵母中的分泌表达和热稳定性研究
2022-12-03王楠杨彩峰彭华康郭文芳王梦琪李刚强刘德虎
王楠,杨彩峰,彭华康,郭文芳,王梦琪,李刚强,刘德虎
(中国农业科学院生物技术研究所,北京 100081)
凝乳酶(chymosin)是一种天冬氨酸蛋白酶,来源于未断奶哺乳动物的胃黏膜细胞,它可以切割κ-酪蛋白中Phe105和Met106之间的肽键,使奶中的酪蛋白析出,形成固态[1]。凝乳酶是奶酪工业生产中的重要酶制剂,但通过宰杀哺乳动物幼崽获取凝乳酶的成本极高,因此,采用微生物重组表达的方法是制备动物凝乳酶的主要方式[2]。重组牛凝乳酶是目前奶酪生产用酶的主要来源。近年研究发现,骆驼来源的凝乳酶对牛乳具有更高的凝乳活性、切割特异性和热稳定性[3-4],在降低奶酪的生产和储运成本、提升奶酪风味方面更具优势。此外,由于不同动物来源的酪蛋白结构不同,导致牛凝乳酶对骆驼奶无活性,而骆驼凝乳酶可以高效凝固牛奶[3],因此,骆驼凝乳酶具有更加广阔的应用前景。毕赤酵母具有遗传操作简单、生长速度快、适应高密度发酵以及对人畜无害等诸多优势,是工业中常用的外源蛋白表达系统[5]。2016年,骆驼凝乳酶已成功在毕赤酵母中重组表达[6],但发酵液表达量较低,仅为37 mg·L-1,不能满足工业生产需求。本文尝试通过对骆驼凝乳酶原蛋白进行N-糖基化修饰,以提高其在毕赤酵母中的表达量,进而为降低骆驼凝乳酶的生产成本、促进产业化应用提供新的研究思路。
N-糖基化是真核生物最常见的蛋白质翻译后修饰方式之一[7],糖蛋白上的N-糖基化位点是保守的,N-寡糖链特异性的结合到新合成多肽的N-糖基化结合位点(Asn-Xxx-Ser∕Thr,Xxx 不能为Pro)的Asn上[7]。N-糖基化能够显著地影响蛋白在真核宿主中的表达水平,李剑凤等[8]研究发现,糖蛋白吸血蝙蝠纤溶酶原激活剂α1(DSPAα1)分子的第117 和第362 位的N-糖基化对其在毕赤酵母中的分泌表达具有重要作用,去糖基化突变体N117Q和N362Q的表达量显著下降;Tian等[9]使用N-糖基化抑制剂衣霉素处理重组表达乙酰木聚糖酯酶(分子中含有2个N-糖基化位点)的毕赤酵母细胞,发现乙酰木聚糖酯酶的分泌表达量下降18%。铜绿假单胞菌弹性蛋白酶(Psendomonas aeruginosaelastinase,PAE)前导肽的第51 位和第93 位增加N-糖基化位点能够提高表达量,而第11 和第127位添加N-糖基化位点则降低表达量[10]。人尿激酶原[11]和牛肠激酶[12]的N-糖基化对其在毕赤酵母中的分泌表达水平没有影响。尽管已有许多实例证实N-糖基化可以影响蛋白表达量,但对于不同的蛋白,这种影响的表现不同,其中的分子机制尚没有清晰而统一的解释。N-糖基化除了影响蛋白的表达量以外,对蛋白自身的分子特性也会产生影响,包括酶活和热稳定性等。例如,重组表达的纤维二糖水解酶,将酶蛋白分子活性位点上的N-糖基化去掉,可以提高酶活[13]。华根霉来源的脂肪酶分子的N-糖基化对其温度稳定性具有显著的影响[14]。综上,N-糖基化对糖蛋白分子的活性、热稳定性和表达量都可能产生影响。
骆驼凝乳酶原蛋白分子含有365个氨基酸,其中N 端42 个氨基酸是前导肽,前导肽具有自我切割活性[3]。含有前导肽的凝乳酶原全长分子没有活性,只有在前导肽完成自我切割后,产生的成熟凝乳酶才具有凝乳活性[3,6]。本课题组前期研究发现,成熟肽直接在酵母中重组表达没有活性,且已报道的重组凝乳酶也均为含有前导肽的酶原形式[3,15-17],可见,前导肽对凝乳酶重组表达是必需的。成熟的骆驼凝乳酶蛋白序列中含有2个N-糖基化位点(142N和333N),导致酵母重组表达的凝乳酶原在SDS-PAGE 或Western-blot 检测时,常以2种相近的分子量形式出现,较低分子量为无糖基化形式,较高分子量为低糖基化形式[3,6]。
本研究拟采用N-糖基化的方法,提高骆驼凝乳酶原在毕赤酵母中的表达量。由于凝乳酶活性的发挥需要前导肽的自我切除,因此,本研究选择在前导肽区域进行N-糖基化突变,既可以对表达量产生影响,又不改变成熟蛋白氨基酸序列,因此不影响酶活,以期为提高骆驼凝乳酶原在毕赤酵母中的表达量提供新的研究思路。
1 材料与方法
1.1 菌株、质粒和试剂
大肠杆菌克隆载体pEASY-T、Trans10 感受态细胞以及cDNA 合成试剂盒、Green qPCR SuperMix 试剂盒购自北京全式金生物技术有限公司;毕赤酵母表达载体pPIC9K、毕赤酵母表达菌株GS115 和Bis-Tris 4~12%Gel 购自Invitrogen(美国);各种限制性内切酶和糖苷内切酶PNGase F 购自NEB(美国);DNA 无缝连接试剂盒购自中美泰和生物技术(北京)有限公司;DNA、蛋白质分子量标准和凝乳酶原兔多克隆抗体购自武汉爱博泰克生物科技有限公司;碱性磷酸酶标记的兔二抗购自Abcam(美国);脱脂奶粉购自Sigma(美国);酵母总RNA 提取试剂盒购自北京原平皓生物技术有限公司;其他生化试剂为国产分析纯。
1.2 骆驼凝乳酶原N-糖基化突变体基因及其表达载体的构建
1.2.1 骆驼凝乳酶原N-糖基化突变体基因的构建 根据骆驼凝乳酶原基因Chy序列(GenBank:AJ131677.1)设计突变体基因扩增引物(表1)。本实验室前期已构建了含有野生型骆驼凝乳酶原(wild)基因的毕赤酵母表达质粒载体(wild-9K)[6]。本研究共构建6 种N-糖基化突变体基因,其中突变体chy11基因的构建方法为:首先以质粒载体wild-9K 为模板,以chy11-F 和chy-R 为引物,PCR扩增第11 位突变的基因片段(引物chy11-F 中带有突变位点),再以该PCR 产物为模板,以chy-F和chy-R 为引物,PCR 扩增突变体chy11全长基因。突变体chy26基因的构建方法为:以质粒载体wild-9K 为模板,以chy26-2F 和chy-R 为引物进行PCR 扩增(引物chy26-2F 中带有突变位点),再以该PCR 产物为模板,以chy26-1F 和chy-R 为引物,进行第2轮PCR 扩增,然后以该扩增产物为模板,以chy-F 和chy-R 为引物,进行第3 轮PCR 扩增,获得突变体chy26全长基因。突变体chy34基因的扩增方法为:首先以wild-9K 为模板,以chy34-F 和chy-R 为引物,PCR 扩增得 到含有 第34 位突变位点的3’端部分基因片段,同时,以wild-9K 为模板,以chy-F 和chy34-R 为引物,PCR扩增得到含有第34 位突变位点的5’端部分基因片段,再以上述两端PCR 产物等比例混合物为模板,以chy-F 和chy-R 为引物,PCR 扩增,获得突变体chy34 全长基因。突变体chy35、chy38和chy39的构建方法同chy34。

表1 本研究所用引物Table 1 Primers used in this study
1.2.2 含突变体基因的表达载体的构建 引物chy-F和chy-R的5’端含有pPIC9K表达载体NotⅠ位点处的同源序列,采用DNA 无缝连接试剂盒将上述6种突变体基因的PCR产物分别与NotⅠ酶切的pPIC9K 进行重组连接,获得6 种含突变体基因的表达载体(mchy-9K)。突变基因位于α 因子分泌信号肽和AOX1终止子之间,形成完整的AOX1启动子-分泌信号肽-突变基因-AOX1终止子表达框。载体DNA 经测序验证基因已发生突变,DNA测序由生工生物工程(上海)股份有限公司完成。
1.3 骆驼凝乳酶原在毕赤酵母中的分泌表达
野生型和突变体凝乳酶原表达载体分别用SalⅠ线性化,采用电击转化法转化至毕赤酵母GS115 菌株的感受态细胞中。电击仪为Bio-Rad Micropulser Electroporater (Bio-Rad,美国),主要参数设置为:电压1 500 V,电阻200 Ω,电容50µF[感受态制备方法和电转方法参照Multi-Copy Pichia Expression Kit(Invitrogen)操作说明书]。转化后的感受态涂布于含有0.5 mg·mL-1G418 的YPD 固体培养基(1%酵母提取物、2%蛋白胨、2%葡萄糖、1.5%琼脂)平板上,28°C静置培养3~5 d至阳性克隆出现。将阳性克隆分别挑取至含有0.4 mg·mL-1G418的10 mL BMGY液体培养基(1%酵母提取物、2%蛋白胨、4%甘油)中,28°C、200 r·min-1震荡培养48 h,至OD600约为2.0。发酵液10 000 r·min-1离心5 min收集菌体,将菌体重悬于含有0.4 mg·mL-1G418的10 mL BMMY(1%酵母提取物、2%蛋白胨、0.5%甲醇)液体培养基中,28°C、200 r·min-1诱导培养72 h,培养期间每间隔24 h补加0.5%(体积分数)甲醇。发酵液10 000 r·min-1离心5 min收集上清,采用Western-blot 方法[18]对发酵液上清中凝乳酶原蛋白进行定性鉴定,采用ELISA方法[19]对表达量进行相对定量分析。
1.4 骆驼凝乳酶原基因荧光定量PCR
在比较各凝乳酶原突变体在毕赤酵母中的表达量之前,为确定表达量的差异来源于N-糖基化而非基因拷贝数的差异,首先采用相同的转化方法和相同的G418浓度,筛选阳性转化子。然后采用荧光定量PCR 的方法对转化子中凝乳酶原突变体基因的mRNA进行测定和比较分析。具体方法如下:取2 mL 的0.5%甲醇诱导24 h 的发酵液(含0.4 mg·mL-1G418 的BMMY 液体培养基),12 000 r·min-1离心1 min,收集菌体。采用酵母总RNA 提取试剂盒提取总RNA,cDNA 合成试剂盒进行cDNA 的合成,以cDNA 为模板,内参基因为actin,以qPCR-F∕R 和actin-F∕R 为引物(表1),利用Green qPCR SuperMix 试剂盒进行荧光定量PCR,荧光定量PCR 仪为QuantStudio 3 instrument(Thermo Fisher Scientific,美国)。
1.5 重组骆驼凝乳酶原的活性和温度稳定性测定
为测定前导肽区域突变后是否影响其自切割活性,将重组蛋白的发酵液上清进行酸-中和处理后,测定凝乳活性。凝乳活性测定的底物制备方法为:用10 mmol·L-1磷酸钾缓冲液(pH5.5)配制26%(质量体积分数)脱脂奶粉作为底物。凝乳酶原采用酸-中和处理进行活化,具体方法为:野生型和突变体的酵母表达菌株经0.5%甲醇诱导72 h 后,12 000 r·min-1离心1 min,收集发酵液上清;将发酵液上清用1 mol·L-1HCl调pH至2.0,25 ℃静置2 h,使前导肽在酸性条件下进行自我切割,再用1 mol·L-1NaOH 调pH 至5.5,即为活化后的酶液。取490 µL 底物与10 µL 酶液于2 mL 离心管中,37 ℃缓慢震荡5 min,如此时乳液凝固,即成熟肽发挥了凝乳活性,表明前导肽具有自我切割活性。温度稳定性测定是将发酵液上清在梯度温度(25~65 ℃)下静置8 h 后,测定其残余相对凝乳活力,最终确定凝乳酶的温度稳定性[6]。
2 结果与分析
2.1 6 种突变体骆驼凝乳酶原N-糖基化突变位点分析
借助前导肽原始蛋白序列中既有的Ser 或Thr,将其-2 位置氨基酸突变为Asn,在仅改变1 个氨基酸的情况下,构建成N-糖基化的保守序列Asn-Xxx-Ser∕Thr,目的是尽量减少对原始序列的改变,从而减少对前导肽自切割活性的影响。另外,Asp 的分子结构与Asn 相近,将第26 位的Asp突变为Asn,同时将第28 位的Leu 突变为Thr,形成1 个N-糖基化位点,以增加糖基化位置的多样性。6种突变体的N-糖基化位点如图1所示,根据N-寡糖链连接到蛋白序列上的位置,分别命名为:chy11、chy26、chy34、chy35、chy38和chy39,对应的氨基酸突变位点分别为:G11N、D26N∕L28T、A34N、V35N、K38N 和Y39N,突变后的位点均形成了N-糖基化保守序列。将突变体基因构建到毕赤酵母表达载体中,经DNA 测序,证明突变表达载体构建成功。

图1 骆驼凝乳酶前导肽的N-糖基化突变位点Fig.1 Mutant sites of N-glycosylation in the propeptide of prochymosin.
2.2 N-糖基化对骆驼凝乳酶原在毕赤酵母中分泌表达水平的影响
2.2.1 骆驼凝乳酶原糖基化分析 经甲醇诱导表达后,对发酵液上清进行Western-blot 鉴定,结果(图2)显示,所有的突变体均能够在GS115 中分泌表达(图2A),与野生型相比,突变体chy11、chy26与野生型的蛋白分子量差异不大,均为2条带,分子量较大的条带为低糖基化形式,分子量约为45 kD;较小的为无糖基化形式,分子量约为40 kD。突变体chy34、chy35、chy38和chy39的蛋白分子量达到70 kD 左右,且条带呈弥散状,为过度糖基化(hyper-glycosylated)形式的典型带形。野生型和所有突变体均用糖苷酶PNGase F去糖基化处理后,分子量均下降至40 kD(图2B),表明突变体分子量和带形的差异均来自N-糖基化。

图2 野生型和突变体凝乳酶原Western-blot分析Fig.2 Western-blot analysis of wild and mutant prochymosins
2.2.2 骆驼凝乳酶原分泌表达量分析 对突变体的相对分泌表达量(图3)分析表明,与野生型相比,突变体chy34、chy35、chy38和chy39的分泌水平显著提高,其中chy34的分泌水平最高。
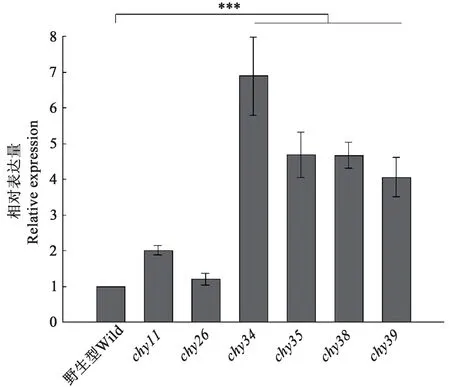
图3 发酵液上清中野生型和突变体凝乳酶原的相对分泌表达量比较Fig.3 Secretion level comparison of wild and mutant prochymosins by western-blot
同时,采用荧光定量PCR 法测定和比较了重组酵母中野生型和突变体基因的转录水平,结果(图4)显示,野生型和突变体chy11、chy35、chy39的转录水平无显著差异,与chy26、chy34、chy38在P<0.05 水平上有显著差异,但差异较小,均不超过1.4 倍。与图3 相对比可知,mRNA 水平与表达水平无相关性,即表达量的差异不是来源于基因拷贝数以及转录水平的差异,而是糖基化的差异。
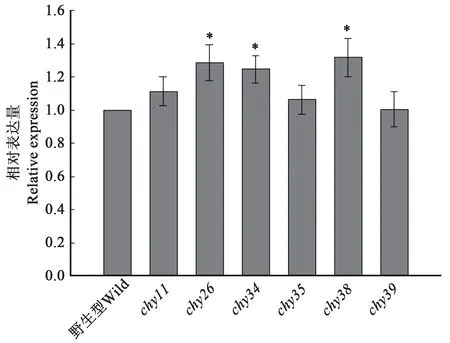
图4 荧光定量PCR比较凝乳酶原基因的相对转录水平Fig.4 qPCR analysis of the relative mRNA levels of the prochymosin genes
2.3 N-糖基化对骆驼凝乳酶原前导肽自切割活性的影响
如图5 所示,所有的突变体均表现出凝乳活性(阴性对照为空菌株GS115 的发酵液上清经过同样的酸-中和处理后的活性测定),表明6 种N-糖基化突变均不影响前导肽的自切割活性。

图5 凝乳酶原前导肽的自切割活性分析Fig.5 Analysis of autocatalytic cleavage of the propeptide by confirming the milk-clotting acitity
2.4 N-糖基化对骆驼凝乳酶原热稳定性的影响
N-糖基化除了影响凝乳酶的表达水平外,还可能影响其温度稳定性。通过测定凝乳酶相对剩余酶活比较了野生型和6 种突变体的温度稳定性。与野生型相比,6 种突变体的温度稳定性均有不同程度的提高(图6)。野生型和突变体在25 ℃保温8 h 后,凝乳活性均没有变化;当温度升高至45 ℃时,野生型相对酶活下降至50%,而6种突变体的活性仍保持100%;当温度达到50 ℃时,野生型的酶活完全丧失,突变体仍有20%~80%的相对酶活;当温度达到60 ℃时,所有突变体的相对酶活均丧失。上述结果表明,前导肽区域6种不同位置的N-糖基化突变,均可以提高凝乳酶原的温度稳定性。

图6 野生型和突变体凝乳酶原的热稳定性比较Fig.6 Comparison of thermostability of wild and mutant prochymosins
3 讨论
研究表明,N-糖基化对不同的外源蛋白在真核宿主中的表达量会产生不同的影响。即使是同种外源蛋白,不同的N-糖基化位置,也会产生不同的影响。例如,DSPAα1 分子的N-糖基化会提高其在毕赤酵母中的表达量[8],而弹性蛋白酶PAE 的N-糖基化对表达量的影响与糖基化的位置有关[10]。目前关于N-糖基化影响蛋白表达量的分子机制尚未得到明确的解析,无法预测N-糖基化对表达量的影响方式。本研究为提高骆驼凝乳酶原在毕赤酵母中的表达量,构建了在前导肽6 个不同位置添加N-糖基化位点的突变体,发现其中4 个位点(第34 位、第35 位、第38 位、第39 位)能够显著提高表达量,表明采用N-糖基化的方法可以提高骆驼凝乳酶原的表达量,且N-糖基化的位置起着关键作用。
在6 种N-糖基化突变体中,chy11和chy26的分子量与野生型差别不大,只是低糖基化的比例有所提高,它们的分泌表达量提升不显著。突变体chy34、chy35、chy38、chy39的分子量显著增加,表明这4 个突变位点发生了过度糖基化,过度糖基化是糖蛋白进入高尔基体后寡糖链被进一步加长导致的[20],这些蛋白条带呈现弥散状,主要是由于过度糖基化寡糖链的糖不均一性[21]以及寡糖链与蛋白结合后,改变了蛋白质与SDS 的结合[22],进而改变蛋白在凝胶中的迁移行为所引起的。同时,它们的分泌表达量也显著提高。其中突变体chy34表达量最高。由此可见,特定位点的N-糖基化是提高骆驼凝乳酶原在毕赤酵母中分泌表达水平的有效方法。
本研究中,尽管突变体chy34、chy35、chy38和chy39的表达量显著提高,但凝乳酶原只有在前导肽完成自我切割后,才能发挥凝乳活性,因此,在N-糖基化突变后,前导肽仍能保持自切割活性是其工业应用的关键。活性测定结果表明,所有的突变均不影响前导肽的自切割。这可能归功于每种突变体均只突变了1~2 个氨基酸位点,尽量减少对前导肽结构的影响,另外,也可能是前导肽本身与成熟凝乳酶相互作用的自由度较大,个别氨基酸的突变不影响两者的相互作用,也不影响凝乳酶原的蛋白三级结构。前导肽区域的N-糖基化突变不仅提高了凝乳酶原的分泌表达量,而且不影响活性,因此,在相同的发酵条件下,骆驼凝乳酶原的生产成本也将会降低,有利于工业生产和应用。
温度稳定性也是凝乳酶生产、运输和储藏等环节的重要影响因素。已有许多报道显示,N-糖基化能够影响糖蛋白的温度稳定性[21,23-24],本研究发现,N-糖基化能够显著提高蛋白的热稳定性,即使chy11和chy26突变体的分泌表达量提高的并不显著,但它们的温度稳定性也比野生型有了显著的提高。这种N-糖基化对温度稳定性的积极作用,可能是由于糖链能够增加附近氨基酸的结构刚性,使其更不易变性[25]。同时,糖链是亲水性的大分子,糖链的存在使蛋白在水溶液中更加不易于形成沉淀。另外,Dalit 等[26]报道了糖链对蛋白质结构稳定性影响的关键在于糖链的位置,而不是糖链的长度,本研究也验证了这一假说,即突变体chy11和chy26为低糖基化形式,而chy34、chy35、chy38和chy39为过度糖基化形式,但这些糖基化都对温度稳定性产生了显著的影响。
综上所述,骆驼凝乳酶原前导肽特定位点的N-糖基化,能够显著提高其在毕赤酵母中的分泌表达水平和温度稳定性,且不影响前导肽的自我切割。本研究为降低重组骆驼凝乳酶的工业生产成本,扩大毕赤酵母的应用范围提供了研究基础,同时也为阐释N-糖基化影响糖蛋白表达的分子机制提供了新的参考。
