响应面法优化低聚木糖诱导大豆抗毒素合成条件
2022-12-03王凯强杨雪李常风段晓彭晴乔宇石波
王凯强,杨雪,李常风,段晓,彭晴,乔宇,石波*
(1.长治医学院药学系,山西长治 046000;2.中国农业科学院饲料研究所,北京 100081)
植物抗毒素是植物受到外源诱导子刺激产生的低分子有机化合物,属于次生代谢产物,表现出多种生物活性[1]。大豆抗毒素(glyceollins,GLYs)是豆科植物受到外源诱导子诱导合成的防御性异戊二烯化黄酮类化合物,具有抑菌、抗氧化、抗炎、抗雌激素等活性,后来发现其有调节葡萄糖与脂质代谢、促进药物递送、诱导成骨及保护神经与心血管的潜在作用[2-3],因此在医药、保健品、化妆品等领域具有巨大的应用价值,引起广泛关注。
自然状态下的健康豆科植物或种子中没有大豆抗毒素累积或含量极低。相关研究主要采用细菌、真菌及其细胞壁提取物或代谢产物、重金属、酸等诱导子诱导大豆合成GLYs[4-6],而这些诱导子存在微量有机混合物或者有毒化合物,潜在威胁甚至危害人体健康,影响大豆功能产品的品质[7]。典型的功能性寡糖作为益生元显示出调节肠道菌群、降低血脂血压和血清胆固醇、促进营养消化吸收和抗氧化等生理功能[8]。功能性寡糖诱导子诱导GLYs 合成的报道相对较少。低聚木糖(xylooligosaccharides,XOS)也称木寡糖,是由2~7个D-木糖分子以β-1,4 糖苷键连接而形成的功能性寡糖,其中木二糖与木三糖较常见[9]。研究显示,XOS能促进人体肠道内有益菌显著生长,并抑制有害菌繁殖,维持肠道菌群平衡[10]。有益菌如双歧杆菌能利用XOS 维持自身生长和增殖,其通过产生短链脂肪酸如乙酸、丙酸、丁酸来抑制有害菌繁殖[11]。XOS 也具有增强免疫力的活性[12]。此外,酸奶添加3.5%(质量体积分数)XOS 能促进大鼠对钙、镁和铁等矿物元素的吸收。轻度慢性肝病患者以3.0 g·d-1服用XOS 14 d 后,血氨含量低于服用前,表明XOS有护肝功效[10]。
近年来,随着我国人口结构调整、生活节奏加快、工作压力增加和饮食习惯改变,亚健康和慢性疾病趋于常态化,已成为影响人体健康的主要因素。功能性食品具有特殊的营养功能,为改善人体健康和慢性病营养干预的重要方式,具有广阔的市场需求和发展前景[13]。大豆富含多种功能性成分,如异黄酮、多肽、低聚糖和卵磷脂,且易于获取,因此功能性大豆食品的开发成为热点[14]。值得关注的是,大豆抗毒素的外源诱导合成进一步拓宽了功能性大豆食品的应用思路。同时,GLYs活性评价的研究也要求保证一定的供试量。然而市场上缺乏商品化的GLYs 及其化学对照品,GLYs的化学合成方法尚未成熟,外源诱导的生物合成就成为GLYs 合成的重要方法。本课题组采用褐藻酸寡糖、纤维寡糖、低聚木糖、卡拉胶寡糖、果胶寡糖和壳聚糖诱导大豆合成GLYs。黑豆与大豆同属豆类,但相关研究报道较少。响应面法(response surface methodology,RSM)是20 世纪中后期兴起的用于优化工艺参数的数学统计方法,可建立模型预测各因素和水平下的目标响应值和确定最佳条件,并且结合方差分析能够评价各因素和水平及其交互效应对响应值的影响[15-16],已广泛用于豆类活性物质提取条件的优化[17-18]。因此,本研究以低聚木糖诱导黑豆合成GLYs 的含量为考察目标,以诱导时间、诱导质量浓度、培养温度为考察单因素,在此基础上利用中心组合设计(central composite design,CCD)-RSM 优化GLYs合成的诱导条件,为大豆抗毒素制备及功能产品开发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 黑豆 选取临沂产鲁黑豆2号品种的大粒黑豆(Linyi Large,LL)、济宁产神农架品种的大粒黑豆(Jining Large,JL)和黑龙江产哈尔滨小黑豆品种的小粒黑豆(Heilongjiang Parvule,HP)为试验材料。其中,临沂产大粒黑豆购自临沂市沂河路粮油市场,百粒重为39.18 g;济宁产大粒黑豆购自济宁良源坊食品有限公司,百粒重为38.43 g;黑龙江产小粒黑豆购自佳木斯市三江农场,百粒重为18.96 g。
1.1.2 试剂 低聚木糖购自山东龙力生物科技有限公司;甲醇、乙腈为色谱纯,购自美国Fisher Scientific 公司;乙醇、甲酸为分析纯,购自北京化工厂;大豆抗毒素对照品由课题组制备得到。
1.1.3 仪器 2695 型HPLC 仪(配备2996 型PDA检测器)与Xevo TQ-S 型UPLC-MS∕MS 仪,美国Waters公司;Sykam S1125型半制备HPLC仪(配备S3245 型UV∕Vis 检测器),德 国Sykam公司;SORVALL®RC-6 Plus 型高速冷冻离心机,美国Thermo Scientific公司;ETS-D4型加热磁力搅拌器,德国IKA 公司;3K15型医用离心机,德国Sigma公司;SF-3120 型自动分部收集器,日本Advantec 公司;LGJ-18型真空冷冻干燥机,北京松源华兴公司;DHG-9030A 型电热恒温鼓风干燥箱,上海精宏实验设备公司;ZWY-2102 型恒温培养振荡器,上海智城分析仪器制造公司。
1.2 方法
1.2.1 大豆抗毒素诱导与合成确认 ①XOS 诱导。黑豆诱导方法参照文献[19],无霉斑、粒径一致且颗粒饱满的黑豆用75%乙醇处理3 min,灭菌蒸馏水清洗若干次,置于25 ℃左右的灭菌水中浸泡5 h;然后用无菌刀片将膨胀的种子分为2 片子叶,在子叶表面划出约9~12 mm2的伤口,且背面不发生破裂;将子叶置于培养皿内润湿的无菌滤纸上,向伤口内加入60µL无菌过滤XOS溶液并用封口膜密封,在相对湿度(relative humidity,RH)65%、24~26℃条件下暗培养若干天。对照黑豆子叶处理方法如上,伤口加入60µL灭菌水。样品的提取参照文献[19]方法,步骤如下:子叶经冻干研磨后,称取0.3 g 粉末于离心管中,以料液比(g·mL-1)为1∶6的比例加入1.8 mL 80%乙醇,盖严并浸在50 ℃水浴中,磁力搅拌提取1 h,以15 000 r·min-1离心15 min,取上清液过0.22µm 有机滤膜,即得粗提液。
②大豆抗毒素合成确认。粗提液经半制备HPLC 仪-收集器分离馏分、高效液相色谱(high performance liquid chromatography,HPLC)分析及超高效液相色谱-串联质谱法(ultra performance liquid chromatography mass spectrometry,UPLC-MS∕MS)确认[19]。半制备HPLC 方法采用Waters 600E(配备Waters PAD 检测器);YMC-Pack ODS-AQ C18(20 mm×250 mm,5µm)制备色谱柱(美国YMC 公司);流动相A、B为90%乙腈水与5%乙腈水,流速3.0 mL·min-1,进样体积2 mL,波长285 nm,检测时间90 min。梯度洗脱:0~10 min,100%B;10~70 min,100%B→0%B;70~90 min,0%B。大豆抗毒素含量测定采用Waters 2695 HPLC-2996 PDA 检测器及色谱工作站;SunChrom 反相C18 色谱柱(4.6 mm×250 mm,5µm)(北京金欧亚科技发展有限公司),柱温40 ℃;流动相A、B 为pH 3.0 乙酸水与乙腈,流速1.0 mL·min-1,洗脱方法如表1所示;进样体积10µL,波长285 nm,检测时间65 min。含量计算依据课题组建立的大豆抗毒素积分值(Y)对质量浓度(X)的回归方程[20]:Y=1.0 × 107X+754.32,R2=0.999 9。
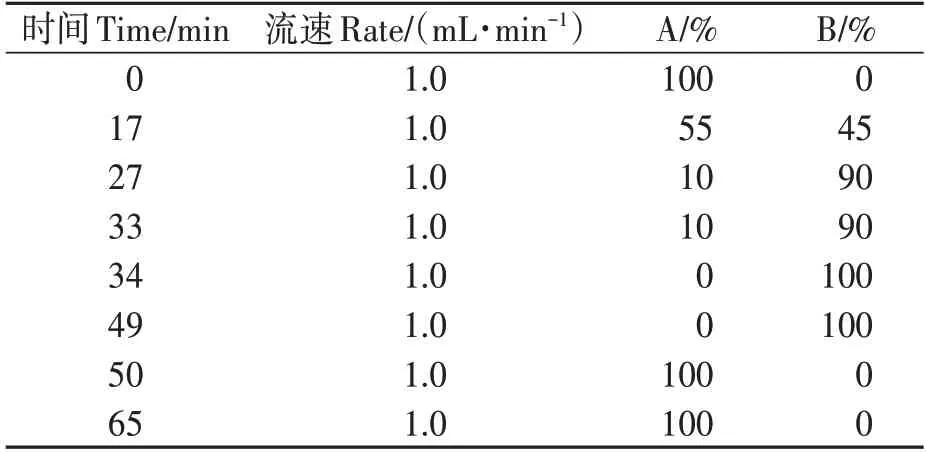
表1 HPLC梯度洗脱程序Table 1 HPLC gradient elution procedure
1.2.2 3 个产地黑豆中大豆抗毒素诱导合成量的比较 不同产地黑豆在XOS 诱导含量4.0%,诱导时间3 d,培养温度25 ℃时,比较大豆抗毒素的合成累积量。
1.2.3 单因素试验 分别研究诱导时间、XOS 质量浓度、培养温度对大豆抗毒素合成量的影响。其中,诱导时间单因素试验:XOS 质量浓度4.0 g·100 mL-1,培养温度25 ℃,设置诱导时间分别为1、2、3、4、5、6和7 d;XOS质量浓度单因素试验:诱导时间4 d,培养温度25 ℃,设置XOS 质量浓度分别为2.0、3.0、4.0、5.0、6.0、7.0 和8.0 g·100 mL-1;培养温度单因素试验:诱导时间4 d,XOS质量浓度4.0 g·100 mL-1,设置培养温度分别为17、21、25、29和33 ℃,进行XOS 诱导大豆抗毒素合成条件的优化。
1.2.4 响应面试验 利用CCD-RSM 对大豆抗毒素合成条件进行综合优化。自变量诱导时间(X1)、XOS 诱导质量浓度(X2)及培养温度(X3)编码为五水平,即-1.682、-1、0、+1、+1.682,各因素水平为诱导时间2~6 d、XOS诱导质量浓度3.0~7.0 g·100 mL-1、培养温度17~33 ℃(表2)。试验设计含20个试验点(14个析因点和6个零点)(表3)。在响应面试验中,应用Design-Expert 8.0.6 软件进行三因素五水平的CCD-RSM试验,获得XOS诱导黑豆子叶中大豆抗毒素累积量的优化条件及其下的预测值。此外,对模型的显著性与适用性进行方差分析。
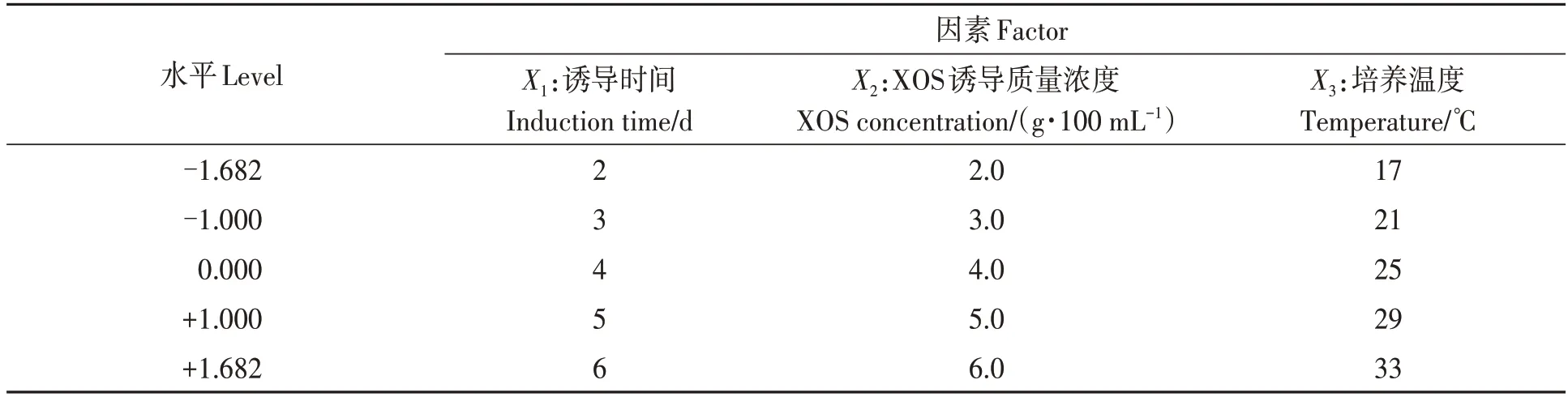
表2 中心组合设计因素与水平Table 2 Factors and levels for central composite design
1.2.5 优化条件验证 对获得最高诱导量的大豆抗毒素优化条件进行验证,检验结果与软件获得的预测值是否一致。
1.3 数据分析
采用SPSS 24.0软件对数据进行统计分析。
2 结果与分析
2.1 大豆抗毒素合成确认
在XOS 诱导子叶组织而获得提取物的HPLC谱图中,新产生化合物的色谱峰保留时间约在22.5 min(图1A),相较与对照谱图(图1B)没有出现。通过半制备HPLC 仪分离获得受刺激子叶组织中合成的新化合物,HPLC分析确认及纯化浓缩馏分中的化合物,且利用HPLC与UPLC-MS∕MS对浓缩液进行检测分析。结果显示,分离纯化得到的新化合物的HPLC谱图如图1C所示。采用电喷雾离子源正离子(ESI+)模式下的UPLC-MS∕MS 对新化合物分析,由于3种最常见GLY异构体Ⅰ、Ⅱ与Ⅲ的分子式与分子量分别为C20H18O5与338,得出质谱图中质荷比(mass charge ratio,m∕z)339 是大豆抗毒素质子化得到的准分子离子[M+H]+,同时m∕z 321为[M+H]+丢失1个水分子产生的碎片离子[M+H-H2O]+,m∕z 229为[M+H-H2O]+丢失1个苯氧基团产生的碎片离子[M+H-H2O-C6H4O]+(图1D)。由获得的质谱数据得到,在受到外源刺激的子叶组织提取物的色谱图中,保留时间约22.5 min的新合成化合物确认为GLY Ⅰ、GLY Ⅱ与GLY Ⅲ。由上可知,XOS对黑豆子叶组织的外源诱导刺激作用能够导致子叶组织合成和积累次生代谢产物GLYs,同时GLYs 的诱导合成也是子叶组织细胞对XOS 刺激作出的防御性反应中的一部分。

图1 低聚木糖诱导子叶组织中大豆抗毒素的合成确认Fig.1 Confirmation of the glyceollins synthesis from XOS-induced soybean cotyledon tissue
2.2 不同产地黑豆子叶中GLYs含量的分析
在XOS诱导质量浓度4.0 g·100 mL-1与诱导时间3 d条件下,比较3个产地黑豆中GLYs诱导合成量,结果(图2)显示,临沂产大粒黑豆、济宁产大粒黑豆与黑龙江产小粒黑豆中GLYs 累积量分别为1.425 2、0.973 2、0.899 0 mg·g-1DW。其中,济宁产大粒与黑龙江产小粒黑豆子叶中GLYs累积量显著低于临沂产大粒黑豆,而济宁产大粒与黑龙江产小粒黑豆间无显著差异。由上可得,临沂产大粒黑豆更适用于后续GLYs 诱导合成条件优化的响应面试验。

图2 3个产地黑豆子叶中GLYs的诱导合成量Fig.2 Synthesized GLYs content from three origins of black soybean under induction
2.3 GLYs合成条件的优化
分别考察诱导时间、XOS诱导质量浓度及培养温度对GLYs 诱导合成量的影响,筛选诱导时间、XOS诱导质量浓度及培养温度单因素的水平范围。由图3 可知,当诱导时间为2 d 时,GLYs 累积量达到较高水平,此后随着时间的延长累积量增加不明显;当XOS质量浓度为4.0 g·100 mL-1,培养温度为25 ℃,在诱导时间2~6 d下的GLYs累积量差异不显著(P>0.05),故诱导时间选择2~6 d;当XOS 诱导质量浓度在2.0~8.0 g·100 mL-1时,GLYs累积量发生明显变化,而当诱导时间与培养温度一定时,诱导质量浓度为4.0 g·100 mL-1时合成GLYs 量显著高于8.0%时的累积量(P<0.05),与7.0%时的累积量差异不显著(P>0.05),考虑到GLYs积累量及XOS 诱导质量用量,故诱导质量浓度选择在2.0~6.0 g·100 mL-1;当诱导时间与诱导质量浓度一定时,培养温度25 ℃下的GLYs累积量显著高于其他培养温度(P<0.05),17~33 ℃范围的GLYs含量发生明显变化,故选择此培养温度范围。综合单因素试验结果,诱导时间2~6 d、诱导质量浓度2.0~6.0 g·100 mL-1及培养温度17~33 ℃为中心组合设计响应面试验进行的单因素水平范围。
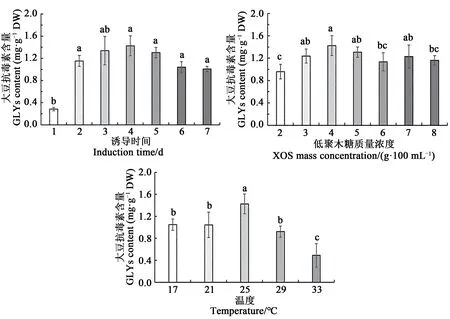
图3 不同因素下临沂大粒黑豆中大豆抗毒素的诱导合成量Fig.3 Synthesized GLYs contents from LL under induction of different factors
2.4 中心组合设计-响应面试验的分析
以单因素试验结果为基础,采用三因素五水平的CCD-RSM 试验优化GLYs 合成的诱导条件。表3 为CCD-RSM 试验设计及GLYs 含量结果。应用Design-Expert 软件对数据进行多元回归拟合,获得二次多项回归方程如下。

表3 诱导时间、诱导浓度和培养温度的中心组合设计及GLYs含量Table 3 CCD of induction time,XOS concentration and temperature and the GLYs content
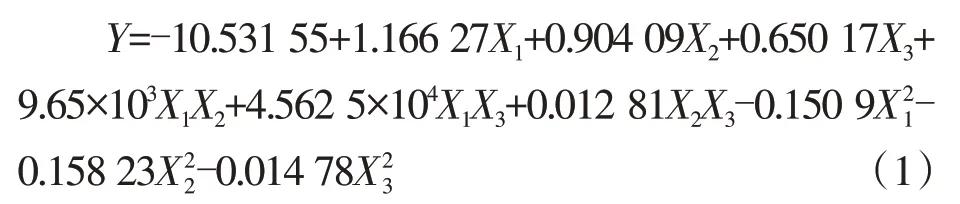
式中,Y为GLYs 累积量(mg·g-1DW),X1为诱导时间(d),X2为诱导质量浓度(g·100 mL-1),X3为培养温度(℃),回归系数R2=0.925 4,表明模型拟合较好。
GLYs 合成的优化条件为诱导时间4.03 d、诱导质量浓度4.08 g·100 mL-1、培养温度23.83 ℃,此时GLYs累积量为1.411 8 mg·g-1DW。对建立的模型进行方差分析(表4),F值为13.78(P=0.000 2),表明模型适合度达到显著水平;响应面试验的误差较小(失拟项F=0.67,P=0.665 0);培养温度对GLYs合成累积量影响极显著,诱导时间和诱导浓度对GLYs合成累积量影响不显著;各因素间交互作用不显著;各因素对GLYs累积量的影响呈现二次曲线关系(P<0.001);且培养温度对GLYs合成累积量的影响较大,其次为诱导质量浓度和诱导时间。综上所述,此模型可用于预测GLYs的合成累积量。

表4 诱导时间、诱导质量浓度和培养温度的中心组合设计试验模型的可信度Table 4 Credibility for CCD model of induction time,XOS concentration and temperature
模型误差统计分析可用于评价其精密度、精确度及可信度。本研究预测相关系数(predictedR-squares,PredR2)和调整相关系数(adjustedRsquares,AdjR2)分别为0.706 9 与0.858 3,二者接近,显示GLYs 的拟合过程有效;变异系数(coefficient of variation,CV)为11.02%,显示建立的模型具有较高的精确度与可信度;模型的信噪比(Adeq precision)为11.427(>4),显示建立的模型有较高的精密度。由此表明,回归模型有良好的预测性。Design-Expert软件分析(图4)表明,残差的正态概率分布和预测值与实际值分布均处于一条直线,残差与预测值分布较为分散,显示拟合模型具有较好的适应性。
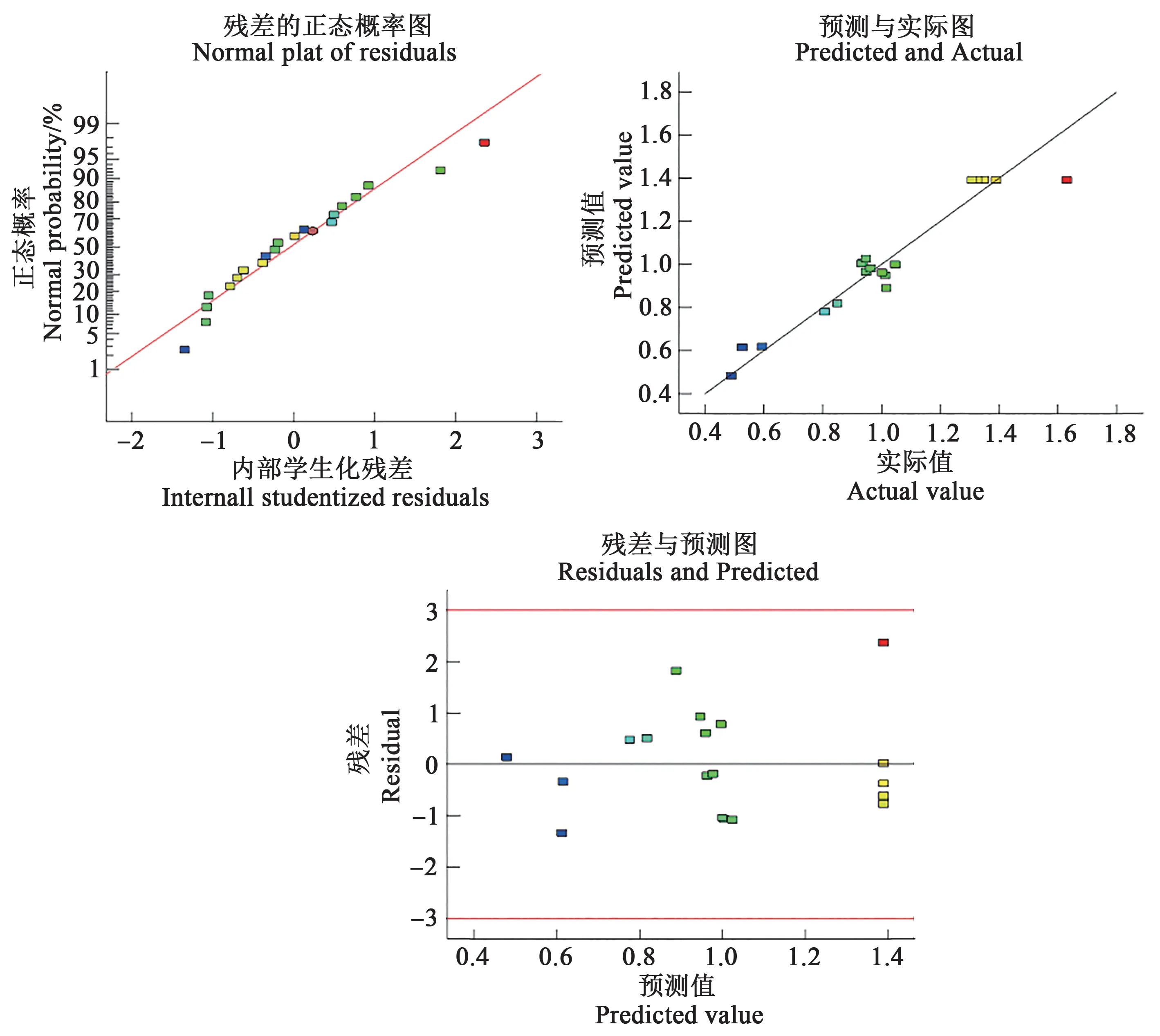
图4 拟合模型的适应性分析Fig.4 Adaptability analysis of the fitting model
图5 是以诱导时间、XOS 诱导质量浓度、培养温度三因素交互效应的3D 曲面图和等高线图。当以培养温度为中心点时,GLYs累积量随着诱导时间从2~4 d 先增加后降低;诱导质量浓度在2.0~4.0 g·100 mL-1时明显增加,之后随着质量浓度的增加逐渐减少;曲线走势显示诱导质量浓度的3D 曲面上升幅度比诱导时间的曲面上升稍明显(图5A),表明在研究诱导时间和诱导质量浓度交互效应时,诱导质量浓度对GLYs 累积量影响更为明显;诱导质量浓度的等高线变化比诱导时间明显(图5B)。当以诱导时间为中心点时,培养温度的响应面3D 曲面的升高幅度比诱导质量浓度的曲面上升幅度大(图5C);培养温度的等高线变化比诱导质量浓度明显(图5D)。当以诱导质量浓度为中心点时,培养温度的响应面3D曲面的升高幅度比诱导质量时间的曲面上升幅度大(图5E);培养温度的等高线变化比诱导时间明显(图5F)。综上,培养温度对GLYs 累积量影响显著。
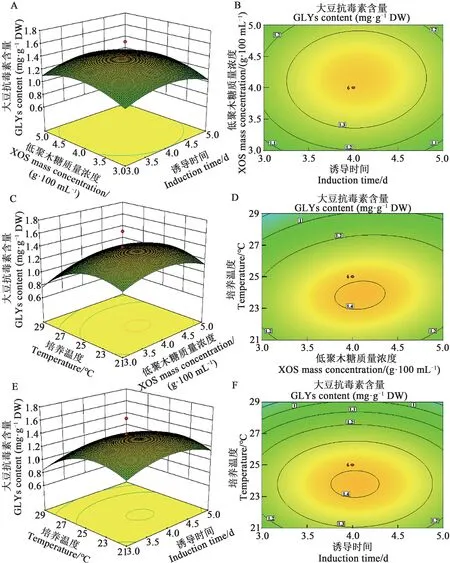
图5 诱导时间、XOS诱导质量浓度、培养温度交互效应对GLYs累积量的等高线图和曲面图Fig.5 Contour and response surface plots for the interactive effects of induction time,XOS mass concentration
2.5 验证试验
在XOS 诱导质量浓度4.0 g·100 mL-1与诱导时间3 d 条件下,临沂产大粒黑豆诱导获得的GLYs 累积量显著高于济宁产大粒与黑龙江产小粒黑豆(P<0.05)。为了验证大豆抗毒素预测值的优化条件,在获得的优化条件(诱导时间4.03 d、诱导质量浓度4.08 g·100 mL-1、培养温度23.83 ℃)下,选择临沂大粒黑豆材料开展验证工作。为满足验证试验的可操作性,验证条件设为诱导时间4 d、低聚木糖诱导质量浓度4 g·100 mL-1、培养温度24 ℃。在3次重复试验中,GLYs诱导合成量达到 1.376 5 mg·g-1DW,与理论 预测值1.411 8 mg·g-1DW 的相对误差为2.5%,表明响应面模型与实际合成量拟合良好,中心组合设计-响应面试验获得的模型有较好的预测性。
3 讨论
大豆抗毒素具有抑菌、抗氧化、抗炎、抗雌激素、代谢调节、药物递送、成骨、神经和心血管保护等多种功效,在医药、保健品、化妆品等领域显示出巨大的潜在应用前景,因此,其获取途径受到极大关注。由于化学合成方法尚未成熟[21-22],自然状态下健康豆科植物中GLYs 含量又极低或不存在,因此,采用诱导子外源诱导合成成为大豆抗毒素的主要来源。
目前,细菌、真菌及其细胞壁提取物或代谢产物、重金属离子等被用作诱导子诱导豆类获取GLYs,但这些诱导子存在安全隐患,因此,以功能性寡糖作为诱导子诱导合成被认为是安全健康的获得方式。董向艳等[23]发现β-葡聚糖酶和多聚半乳糖醛酸酶2 种酶单一水解甘薯渣制备的纤维寡糖、果胶寡糖诱导大豆生成的GLYs 量分别为0.80、0.46 mg·g-1DW,而这2种酶联合水解甘薯渣产生的复合寡糖诱导生成的GLYs 量最高可达1.21 mg·g-1DW。胡佳等[19]通过探究褐藻酸寡糖诱导大豆产生GLYs的最优条件和累积变化,以外在因素对GLYs 合成的影响展开,得出大豆中GLYs 合成量最高为0.525 mg·g-1FW。张迷敏等[24]探究褐藻酸寡糖诱导大豆合成累积GLYs 过程中的大豆营养成分变化时发现,与未处理时的0.01 mg·g-1GLYs相比,诱导第5天时GLYs累积量最高为1.72 mg·g-1DW。Peng 等[25]考察了不同分子量及不同古洛糖醛酸(G)∕甘露糖醛酸(M)值的褐藻酸寡糖的GLYs 诱导活性,得到4种褐藻酸寡糖片段△G、△MG、△GMG 及△MGGG 为诱导子诱导的GLYs 累积量为1.233 9、0.347 2、0.649 4、1.061 1 mg·g-1DW。由此表明,不同来源的功能性寡糖在一定程度上均能诱导大豆生成GLYs,但存在差异,表明筛选功能性寡糖来源具有重要研究意义。
为了快速提高大豆抗毒素合成量或开发功能豆类产品,本研究以大豆抗毒素诱导合成条件进行单因素试验,初步得到诱导累积量的最优条件:XOS 诱导质量浓度4.0 g·100 mL-1、培养温度25 ℃下诱导4 d。外在因素对低聚木糖诱导大豆抗毒素生成有一定影响,随着诱导时间、XOS诱导质量浓度与培养温度超过最佳条件GLYs累积量均出现下降,这可能是由于诱导时间延长会滋生微生物,而增加诱导质量浓度会损伤细胞生命活力,过高的培养温度会抑制酶的催化活性[26],从而导致GLYs 合成逐渐受阻至累积量下降。以单因素试验得到的最优条件作为中心组合设计-响应面试验的中心点,采用Design-Expert软件对有限次数的试验进行拟合,建立预测大豆抗毒素响应值的模型且获得优化条件:XOS 诱导质量浓度4.08 g·100 mL-1、诱导时间4.03 d、培养温度23.83 ℃;且验证试验表明采用优化条件时,大豆抗毒素实际诱导累积量符合响应面模型的预测。由此表明,该方法合理可行,为大豆抗毒素制备及功能产品开发提供了理论依据。
