新型镁合金生物材料的体内外相容性研究
2022-12-02高质涵高铭泽刘海峰付高洁
高质涵,高铭泽,孙 艺,刘海峰,付高洁,肖 阳
(1. 牡丹江医学院医药研究中心,黑龙江 牡丹江 157011) (2. 牡丹江医学院医学影像学院,黑龙江 牡丹江 157011) (3. 东北财经大学工商管理学院,辽宁 大连 116000) (4. 牡丹江医学院附属第二医院,黑龙江 牡丹江 157011)
1 前 言
可生物降解金属在医学领域引起了越来越多的关注,因为它们在达到所需功能后可以自行降解,减少带给患者的经济和身体负担,适合作为临时固定的骨科植入物使用。镁材料被视为最适合用作新一代人体植入材料的可生物降解金属[1]。近年来,众多研究表明,镁合金具有优异的生物相容性和物理特性,可用于医疗应用,尤其是作为骨科和颌面植入物[2]。目前应用于临床的植入物材料包括不可降解金属(例如钛合金)和可生物吸收的聚合物[3]。尽管钛合金材料目前已被广泛使用,但这种材料具有一定的局限性,主要包括对周围骨骼的应力屏蔽,必要时需要做去除植入物的翻修手术以及在术后一段时间可能发生变形。此外,近年来研究发现,这些不可降解金属会产生有害的磨损颗粒,从而导致植入物松动和故障,甚至发生骨溶解[1-3]。可降解的可生物吸收聚合物往往缺乏承载植入物[4]所需的机械强度。聚合物植入物在手术期间和术后发生断裂的情况已被报道,这种情况下患者的恢复更加复杂,引起了人们对植入材料安全性的担忧[5-9]。此外,可生物吸收的聚合物材料还会产生酸性降解产物,从而进一步导致植入失败和组织炎症。
镁基植入物的主要优点在于镁的生物可降解和可吸收特性,其中镁的降解产物可被排泄或用于代谢过程,并且其机械性能与皮质骨相当。镁是人体细胞内和细胞外液中最丰富的阳离子之一,对骨骼和牙齿的形成至关重要。人体中50%~60%的镁存在于骨骼中,其中细胞外液的镁离子浓度在0.70~1.05 mmol/L之间,人体通过肾脏和肠道来维持体内镁离子的稳态。尽管镁是一种有前途的适用于承重医疗植入物的材料,但它由于在生理条件下降解得太快而无法满足临床要求[10-13]。镁合金的降解速率应足够慢,以便在组织再生前保持植入物的承载性能。快速降解会导致过早的机械故障或植入物脱落,并增加局部pH值。与纯镁材料相比,合金化可以不同程度地降低镁合金材料的降解速率,提高其机械性能,同时促进骨骼的形成等[14-16]。因此,应进一步研究并优化镁合金成分,以改善应用于骨科和颌面修复领域中的镁合金植入物的生物降解性、生物活性、生物相容性和机械性能等。
与纯镁相比,改善镁合金材料的降解性能及与细胞相互作用的研究可以潜在地控制其晶粒尺寸、表面微观结构、降解及机械性能[16-20]。镓(Ga)和锶(Sr)作为合金元素除了可以提高镁合金的物理和机械性能外,Ga还具有一定的抗菌能力,研究发现Ga在骨代谢中也发挥着一定的作用;Sr具有与钙(Ca)类似的化学特性,主要集中在骨骼中的骨小梁处[21, 22]。另外,研究发现,Sr可以改善骨质疏松症患者的骨质量和结构完整性[23-26],且可以改善羟基磷灰石水泥的降解和生物相容性[27, 28]。本研究在纯镁中加入不同质量分数的Ga和Sr元素制备了镁合金材料,探索了这些镁合金材料在体内外的相容性及是否有促进骨愈合的能力。此外,还选用人脊髓间充质干细胞(human marrow mesenchymal stem cells,hMSCs)培育法对镁合金体外生物相容性效果进行评价,并将材料植入到SD大鼠股骨内以此来评价材料在体内的相容性和对骨愈合的促进作用。
2 实 验
2.1 样品制备
实验材料用高纯度金属Mg(99.95%,杂质含量≤0.05%)和商业级纯度金属Ti由澳大利亚奥古斯特金属合金公司提供。Mg-0.1Ga,Mg-0.1Sr和Mg-0.1Ga-0.1Sr(质量分数)铸锭是通过真空感应熔炼法融化纯Ga(99.9%)、Sr(99.9%)(Alfa Aesar,美国)和高纯Mg共同制备的。将原材料Mg,Ga和Sr储存在阴凉、干燥和密封的环境中,将制备的镁合金样品放置在真空干燥设备中,以避免在露天环境中的污染和氧化(腐蚀)。为了最大程度地减少熔融Mg的氧化和燃烧,将炉膛抽真空至0.2~1 MPa、加温至约50 ℃,并用保护性氩气吹扫。将与熔融镁接触的设备(包括搅拌器、热电偶保护器和模具)均预先喷洒涂覆石墨,以减少铁的污染。将金属混合物以3~5 ℃/s的升温速率加热到760 ℃,并保持25~30 min,每5 min剧烈搅拌一次;然后将熔体转移到预热至250 ℃(以减少收缩)的矩形模具中,并自然冷却至室温;将纯镁、镁合金和纯钛分别加工成直径为15 mm、厚度为3 mm的圆片状和直径为1 mm、长为10 mm的棒状试样,以进行体外相容性实验以及动物实验。在实验之前,使用蒸馏水作为润滑剂,用砂纸对加工后的样品进行机械打磨直到2000粒度,然后分别在丙酮、乙醇(96%)和去离子水中超声清洗5 min,后在通风橱内风干备用。
2.2 体外实验
采用hMSCs进行体外细胞毒性评价(hMSCs细胞购买于上海泽叶生物科技有限公司)。将含有16% 胎牛血清(Gibco,美国)和1%双抗的杜氏改良Eagle培养基(DMEM,Gibco,美国)与hMSCs细胞共同培养24 h后,用胰酶将贴壁的hMSCs从培养液中分离出来,用计数板计数。将hMSCs细胞以1×104/孔的密度接种于24孔板的培养基中(每组3孔),培养24 h使细胞获得最佳粘附后,再与制备的镁合金样品在DMEM培养基中浸泡72 h。后用溴化乙锭(EB)和吖啶橙(AO)染色15 min,用磷酸缓冲盐(phosphate buffered saline,PBS)溶液冲洗3次,然后采用激光共聚焦显微镜(CLSM,奥林巴斯,FV1000)进行观察,以此来评价各组培养基中细胞的增殖情况。
2.3 体内实验
体内实验采用牡丹江医学院动物实验中心提供的3个月的无特定病原体(SPF)级 SD大鼠36只,其平均体重为215 g(140~228 g)。将大鼠随机分成6组,每组6只。用聚维酮碘消毒后,在大鼠腹腔注射4%水合氯醛(0.9 mL/100 g)对大鼠实施麻醉,确定穿刺点,并在股骨内上髁最高点位置使用克氏针定位钻孔,沿通踝线方向钻开直径2 mm小孔,钻透双层皮质,并将准备好的材料插入钻开的骨髓腔中,如表1和图1所示。用骨蜡封闭,然后用无菌生理盐水冲洗,逐层缝合(未给予抗生素),手术后的大鼠被安置在无菌、通风的房间饲养。

表1 动物实验设计分组
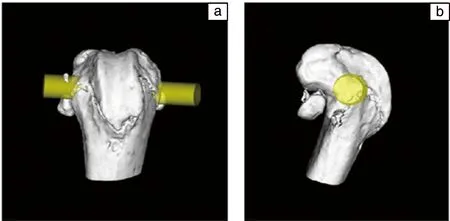
图1 植入材料与大鼠股骨冠状位(a)和矢状位(b)示意图Fig.1 Schematic diagrams of coronal view (a) and sagittal view (b) of planted material and femur of rats
2.3.1 X射线透视观察
植入术后第3 d和第5 d,取出实验大鼠进行呼吸麻醉,后进行X射线透视观察。
2.3.2 Micro-CT扫描
植入术后7 d,将大鼠处以安乐死,后取出股骨标本固定,并进行Mirco-CT扫描(哈尔滨医科大学分子影像研究中心,SuperArgus 小动物PET/CT)。
2.3.3 扫描电镜观察
将20 g重铬酸钾溶于40 mL蒸馏水中,边搅拌溶解边加入400 mL浓硫酸配置得到铬酸溶液,将Mirco-CT扫描后的股骨标本材料用铬酸洗液清洗表面化合物沉积,然后使用扫描电镜(德国蔡司,SIGMA500)观察植入材料的表面形貌。
2.4 统计学分析
采用SPSS 21.0软件对细胞计数数据进行统计分析,3组间比较采用方差分析。数据资料比较采用卡方检验。
3 结果与讨论
3.1 体外相容性
纯镁、各组镁合金材料和纯钛对hMSCs的细胞毒性结果如图2所示。其中具有完整细胞膜的活细胞被染色成荧光绿色,而具有受损细胞膜的死细胞被染色成荧光红色。由图2a~2f可以明显看出,空白组细胞(图2f)显示出良好的细胞扩散能力且几乎没有死亡细胞;纯钛组细胞仍能很好地分布(图2e),同空白对照组结果相似;纯镁组及镁合金材料组中,可以在培养基中观察到一定比例的死细胞(图2a~2d),进一步观察发现,镁合金材料Mg-Ga-Sr的培养基中死亡细胞比例低于Mg、Mg-Sr和Mg-Ga的,这表明Mg-Ga-Sr镁合金材料对细胞的毒性较小。通过Image J软件对细胞荧光染色图进行细胞计数,死亡细胞占比数据结果如图2g所示。相较于纯钛,纯镁和镁合金材料都显示出一定的细胞生长抑制性;相比镁合金材料,纯钛与细胞展现出更加兼容的状态,这表明在体外环境镁合金材料的降解过程尤其是在早期阶段会对细胞增殖产生一定的抑制作用,这可能是镁合金材料在培养基中降解释放的OH离子、过量的Mg离子以及Ga离子和Sr离子所致。

图2 各实验组细胞荧光染色照片,绿色为活细胞,红色为死亡细胞(a~f);用Image J软件分析得到的死亡细胞占比数据(g)Fig.2 Fluorescent staining pictures of cells in each experimental group, green is the living cells and red is the dead cells (a~f); the proportion of dead cells analyzed by Image J software (*p<0.05, **p<0.01 and ***p<0.001) (g)
3.2 体内相容性
3.2.1 X射线透视结果
大鼠术后第3 d和第5 d两个时间点麻醉拍摄的X射线透视照片如图3所示。其中黑色箭头指示材料所在部位,白色箭头指示气腔。由图3可以看出,随着时间的延长,纯镁和镁合金材料体积逐渐缩小,对比纯钛和空白组(图3e和3f),植入初期镁合金材料周围形成了一些气腔(图3a~3d),这些气腔是镁合金材料降解产生;随着时间的推移,气腔逐渐缩小(图3g~3j),一是因为被机体自行吸收,二是纯镁和镁合金表面形成的氧化层减缓了降解速率。由图3g~3j可以看到,Mg-Ga-Sr合金组气腔小于其他组,表明加入Ga和Sr元素可以延缓镁合金材料的降解速率,从而使反应产生的气体减少。

图3 各实验组术后第3 d(a~f)和第5 d(g~l)大鼠X射线透视照片Fig.3 X-ray fluoroscopy images of rats in each experimental group at 3rd (a~f) and 5th (g~l) after surgery
3.2.2 Micro-CT结果
大鼠术后7 d安乐死后的股骨Micro-CT扫描照片如图4所示。对比镁材料组(图4a~4d),纯钛组与空白对照组(图4e和4f)周围无任何白色信号。此外,可以看到加入Sr元素的镁合金周围有不同程度的线性不规则白色信号影(钙盐沉积),Micro-CT显影程度表明,Mg-Sr及Mg-Ga-Sr材料周围的沉积显影比其他材料组更为明显。这表明加入Sr元素可以提高镁合金材料促进骨愈合的能力。
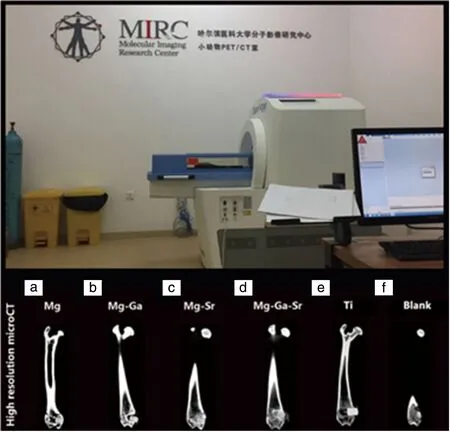
图4 各实验组术后7 d股骨样本的Micro-CT扫描照片Fig.4 Micro-CT scan images of the samples at 7 d after surgery in each experimental group
3.2.3 扫描电镜结果
大鼠术后7 d后取骨组织中植入材料清洗,后拍摄的扫描电镜照片如图5所示,可以看出纯钛表面几乎无任何改变,纯镁和镁合金材料表面有不同程度的腐蚀痕迹,且镁合金材料表面腐蚀痕迹更小,也进一步证明合金化可以减缓镁材料的降解。

图5 术后7 d植入材料清洗后的扫描电镜照片Fig.5 SEM images of the planted material surface after material removal and clean at 7 d after operation
从临床角度来看,理想的镁材料植入物应在一定时间段内具有良好的支持作用,以适应骨折的愈合过程,并向周围组织释放无毒无害物质。镁合金材料具有较高的化学和电化学活性,在与生理环境接触后容易发生降解(或腐蚀)。目前的研究工作主要集中于探索抑制镁合金降解动力学的方法,以满足临床要求,即植入物在12~18周内仍可保持较好的机械强度[27-29]。Wang等[17]首次提出通过将原始Mg基质与Sr合金化来控制Mg合金生物学性能的概念性工作,通过延缓Mg-Sr合金降解的方式,将Sr元素缓慢地释放到生物系统中,使Sr元素发挥促进骨细胞生长的作用。本文在制备镁合金材料时使用添加0.1%的Ga和0.1%的Sr元素的微合金化方案,是因为从电化学的角度来看,0.1%的Ga和0.1%的Sr含量远低于两种元素在镁中的固溶度,因此不会产生微电偶而影响材料的降解速率。因此,在镁材料中通过合金化方法加入具备其它作用的元素,不仅可以实现镁材料功能化,还可以延缓镁材料降解过快的问题。结合图3中植入材料释放的气体量和图5中植入材料表面形貌,可以看出Ga和Sr微合金化可以进一步减缓镁材料的降解。
前期研究发现,镁材料的过快降解会导致缓冲的生理介质的pH值急剧上升(高达10.0),并释放出过量Mg离子[3],这些离子对包括成骨细胞在内的活生物体的大多数代谢功能均具有一定的毒性作用[30-33]。镁材料在体外实验中会对细胞增殖产生不同程度的抑制(图2),这主要是因为镁材料降解导致培养基中Mg2+浓度高和pH迅速改变使得细胞生长环境发生转变[34-36]。根据报道,当用含Mg离子的MEM培养基培养hMSCs时,100倍的稀释提取物比10倍稀释的培养基具有更低的抑制作用[25-30],因此找到合适的镁合金成分配比,使材料具备理想的降解率,可以使镁合金材料具有良好的生物相容性。研究表明,DMEM中Sr离子的存在促进了hMSCs和成骨细胞的生长[7]。尽管目前尚未有研究明确定义Ga离子的体外生物相容性,但一些研究表明Ga离子的存在可能会促进破骨细胞的生长[3],而相关机制还不明确。
体内模型是一种成本高昂但直接有效的实验方法,可用于评估生物系统与植入材料之间的相互作用并为后续的临床试验提供参考。本研究采用基于SD大鼠的动物模型来对镁合金材料进行体内评价,揭示了Ga离子和Sr离子在短时间内的释放有助于骨组织恢复。图4中的Micro-CT照片显示,与纯钛相比,纯镁和镁合金材料植入物周围均有不同程度的钙盐沉积,加入Sr元素的镁合金材料钙盐沉积的显影较其他镁材料更为明显,而钙盐沉积是骨修复的前提条件,这一结果与文献报道一致[35, 36]。体内动物实验结果表明,实验动物在镁合金材料植入后骨损伤在一定程度上得到了修复,与体外实验结果不同(表现出对细胞的抑制作用),分析认为镁材料体外生物相容性实验表现出对细胞的抑制作用和培养基的固定性相关,培养基内环境组成固定,镁材料降解释放的离子浓度只会越来越高,而机体是一个时刻都在进行物质交换的大环境,材料降解产生的离子很少会在一处大量聚集,离子会通过体液交换代谢掉,因此镁合金材料相容性在体内的实验结果比体外实验更具代表性。
4 结 论
本实验研究发现通过向镁材料中微量添加Ga和Sr元素的合金化手段可以减缓镁合金的降解速率,同时Ga和Sr元素的加入可以促进骨组织恢复。镁基合金材料作为新型临床医用材料具有广阔的前景,而Ga,Sr元素以及Mg元素在机体中对骨愈合的促进作用的具体机制仍需更加深入的研究。
