调控肿瘤血管微环境的智能纳米药物研究进展
2022-12-02吴素英聂广军李素萍
吴素英,聂广军, 李素萍
(国家纳米科学中心 中国科学院纳米生物效应与安全性重点实验室,北京 100190)
1 前 言
肿瘤血管微环境是肿瘤微环境的重要组成部分,肿瘤生长和转移高度依赖于血管的发生和形成,没有新生血管的实体肿瘤直径难以超过2 mm[1]。因此,肿瘤细胞在快速增殖过程中表达并分泌多种促血管生成因子,尤其是血管内皮生长因子(vascular endothelial growth factor, VEGF),以快速诱导大量新生血管的新生[2]。然而,一方面,和正常血管相比,异常的形成过程导致肿瘤血管呈现出显著的病理特性,譬如血管结构不完整、分布不规则、血流紊乱等,导致肿瘤组织中血液灌注不足、缺氧及间质流体压力升高[3]。另一方面,肿瘤组织高度表达组织因子(tissue factor, TF)、凝血酶、二磷酸腺苷(adenosine diphosphate, ADP)等多种凝血相关因子,导致患者呈全身性血液高凝态,发生癌症相关血栓性并发症的风险显著升高[4]。
基于肿瘤发生、发展对血液供应的依赖性,以抑制肿瘤血管新生、破坏肿瘤血管结构和诱导肿瘤血管栓塞为目的的多种血管靶向的“饥饿疗法”被提出并广泛研究[5]。由于所有实体瘤的生长都依赖于血管提供氧气和营养物质,靶向血管形成或诱导血液栓塞的策略理论上具有普适性[6];另外,相比于肿瘤细胞,血管内皮细胞或血液成分更易和药物接触,且内皮细胞基因表达更稳定,不易产生耐药性[7]。而随着抗血管生成疗法作为单一疗法的局限及其增强化疗效果的发现和研究[8-10],血管正常化的概念逐渐被广泛接受,即抗血管生成药物可以暂时使肿瘤血管正常化,恢复肿瘤血液灌注并使血流分布更加均匀,降低肿瘤侵袭性,增加化疗药物输送并提高肿瘤细胞敏感性,最终增强疗效[11, 12]。因此,相较于需要渗透至肿瘤组织或进入肿瘤细胞才能发挥作用的靶向肿瘤细胞的疗法,靶向肿瘤血管的治疗策略具有起效快、靶点易获得、普适性强和不易产生耐药性的优势。
纳米技术的发展和应用使得传统癌症疗法更有效、更安全,然而早期纳米药物的临床应用经验及癌症病理特征的复杂性提示我们,传统类型纳米药物(如脂质体、聚合物胶束等)的实际应用仍面临着巨大的挑战。譬如肿瘤的高度异质性和个体差异使同一种纳米药物在不同肿瘤类型中的疗效存在差异;纳米药物主要依赖尺寸效应被动到达肿瘤组织,极大限制了疗效的发挥;药物的释放主要依赖于纳米材料的降解等[13]。随着对包括肿瘤血管微环境在内的肿瘤微环境生物学特性的深入认知,以及纳米药物载体构建技术的进步,癌症治疗纳米药物的研发进入新的阶段。根据不同肿瘤的病理特征,设计能够精确制备和可控释药的个体化功能集成智能载药体系进行肿瘤微环境精准调控成为可能,这亦是目前肿瘤纳米医学发展的重要方向。新一代功能集成、形貌高度可控的智能纳米药物载体的发展和应用,如基于DNA折纸技术的DNA纳米机器,为实现纳米药物更精细地应对体内和瘤内微环境提供了新的机遇。而在肿瘤微环境调控领域中,肿瘤血管微环境中存在异常表达的多种分子可作为药物递送的特异性靶点,将一种或多种配体共修饰在纳米颗粒表面,可较为方便地将纳米药物精准导向到特定部位的肿瘤血管[14]。本文围绕肿瘤血管血供阻断和肿瘤血管调控两种策略,综述了智能纳米药物在抗血管生成、血管结构破坏、血管栓塞以及血管调控中的重要代表性进展,并对该领域智能纳米药物未来的发展提出了展望。
2 阻断肿瘤血供的智能纳米药物
2.1 抗血管纳米药物
抗血管药物(anti-vascular agents,AVAs)可分为血管生成抑制剂(angiogenesis inhibitors, AIs)和血管破坏剂(vascular disrupting agents, VDAs)[15],其中血管生成抑制剂包括贝伐单抗、索拉非尼、阿帕替尼等,主要通过抑制血管生成因子或受体的活性来抑制肿瘤血管新生;而血管破坏剂,如考布他汀A4(CA4)及其衍生物,可通过破坏已有血管的结构诱导次级血栓形成,二者最终都是通过阻断肿瘤血液供应达到抑制肿瘤生长和进展的目的[16]。然而,多数抗血管药物为小分子药物或单克隆抗体,具有水溶性差、清除速度快、靶向性差等固有缺点,临床应用的疗效和安全性亟需提高[15]。
2.1.1 提高抗血管疗效的纳米药物
多种纳米颗粒都被用于抗血管药物的递送,纳米化抗血管药物呈现出较强的稳定性、较长的血液循环时间及良好的肿瘤靶向性,最终体现为增效减毒的抗肿瘤效果。Zhang等利用介孔二氧化硅纳米颗粒(MSNs)的内部多孔结构高效负载VEGF抗体药物——贝伐单抗,同时利用MSNs表面羧基和抗体的酰胺反应在其表面偶联肿瘤内皮标志物1(TEM1)单抗,赋予MSNs肿瘤血管靶向性。偶联的TEM1单抗可将MSNs特异性导向到卵巢癌部位的血管,显著降低MSNs对正常组织的毒性[17]。基于肿瘤局部较高水平谷胱甘肽(glutathione, GSH)的特性,Liu等合成了一种新型的具有GSH响应功能的聚乙二醇(PEG)化聚α硫辛酸(PALA)纳米载体,将CA4通过PEG链键合到该载体上,当PALA到达肿瘤部位时,瘤内高水平的GSH还原聚α硫辛酸中的二硫键,使得聚合物降解,实现CA4的原位释放,具有较强的抗肿瘤活性且未引起全身性副作用,该研究首次利用简单的纳米材料实现了血管破坏剂的肿瘤选择性递送[18]。值得注意的是,单一的血管生成因子抑制疗法易产生耐药性,Gao等基于索拉非尼通过激活基质衍生细胞因子-1α/C-X-C基序趋化因子受体4(SDF1α/CXCR4)轴促进肝癌耐药的现象,设计了一种阳离子脂质包被的聚乳酸-羟基乙酸共聚物(PLGA)纳米颗粒,其内部的PLGA纳米粒子通过疏水作用载带索拉非尼,外层阳离子脂质通过静电相互作用吸附AMD3100(CXCR4拮抗剂),在赋予该材料靶向性的同时阻断CXCR4活性,该纳米体系可将索拉非尼靶向递送至肿瘤部位并恢复肝癌细胞对索拉非尼的敏感性,显示了CXCR4靶向的纳米颗粒在递送索拉非尼和克服肝癌获得性耐药方面的临床应用潜力[19]。
2.1.2 具有抗血管作用的纳米材料
某些用于构建纳米药物载体的材料本身具有抗血管活性,将它们运用于抗肿瘤药物递送可协同增强药物的抗肿瘤疗效,同时简化纳米药物的组成,使之更易于制备和应用。纳米材料的抗血管作用主要包括抑制血管生成和破坏肿瘤血管结构两种机制。
近年来的研究发现,金、银、氧化铜、氧化铈、壳聚糖等纳米颗粒等都具有一定的抑制肿瘤血管新生的作用,其中以金纳米颗粒的研究最为深入和广泛[20]。Bhattacharya等首先在体外水平报道了金纳米颗粒可以通过结合VEGF抑制诱导的人脐静脉血管内皮细胞(human umbilical vein endothelial cells, HUVEC)的增殖,表明金纳米颗粒具有潜在的抗血管生成作用[21]。该研究团队进一步发现,金纳米颗粒可以以尺寸和表面电性依赖的方式与VEGF、碱性成纤维细胞生长因子(bFGF)的肝素结合结构域结合,竞争性地抑制VEGF与受体VEGFR-2的结合,达到抑制血管新生和肿瘤生长的效果[22-24]。此外,利用金纳米颗粒表面易于功能化的特性,Seo等进一步在金纳米颗粒表面通过巯基偶联了VEGFR-1拮抗肽,显著增强了金纳米颗粒的血管抑制效应[25]。
除了传统的血管破坏剂可引起血管破坏以外,用于光动力、光热治疗的纳米材料也可以通过在近红外光照下吸收光能产生活性氧(reactive oxygen specie, ROS),或者将光能转化为热能的方式直接破坏肿瘤血管结构。如Lu等制备了一种β-丙氨酸修饰的钆富勒烯纳米粒子(GFNPs)[26],由于富勒烯具有扩展的π体系,在光照下可以通过能量或电子转移过程产生ROS直接杀伤肿瘤细胞,同时,GFNPs可作用于肿瘤血管内皮细胞,破坏血管内皮连接,进而破坏血管结构,在富血供的黑色素瘤中取得了显著的抗肿瘤效果。Gao等采用中空的硫化铜纳米粒载带叠氮化乙烯,外部修饰含精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)序列的多肽(RGD肽),制备了一种靶向肿瘤血管的“纳米炸弹”,在近红外光激发下,硫化铜产热导致叠氮化乙烯迅速产生大量N2破坏肿瘤血管,诱导周围肿瘤细胞坏死,在小鼠皮下移植瘤模型中一次给药即可使肿瘤完全消退,且30 d内不复发,显示出强大的抗肿瘤疗效[27]。
2.2 肿瘤血管栓塞纳米药物
肿瘤血管栓塞疗法是通过选择性栓塞血管进而导致肿瘤缺血,诱发肿瘤细胞凋亡、坏死[28],是一种短时间内即可观察到疗效、且不易产生耐药性的抗肿瘤策略。经导管动脉化疗栓塞术(transarterial chemoembolization, TACE)在肝癌治疗中的重要地位也已证实了这一点。然而TACE难以实现肿瘤血管特异性栓塞,在肝癌以外的其他类型癌症中应用十分受限[29],智能纳米药物的发展使特异性栓塞肿瘤血管以及拓宽栓塞疗法的应用范围变得可行。
2.2.1 纳米体系递送凝血因子
肿瘤患者的血液往往伴随着全身性高凝态,向肿瘤血管内递送凝血因子激活局部凝血级联反应形成血栓,从而阻断肿瘤血供,是一种非常有效的治疗策略。然而,凝血因子半衰期短,不具有特异性,且裸露的凝血因子不能与血液直接接触,纳米技术的应用可有效克服该类问题,实现肿瘤靶向递送。目前被应用于特异性诱导肿瘤血管血栓形成的凝血因子主要是一种包含组织因子胞外结构域的截短形式,即截短组织因子(truncated tissue factor, tTF)[30]。自1997年Huang等将tTF与抗体偶联,特异性递送至肿瘤血管用于治疗小鼠神经母细胞瘤以来[28],多种tTF与靶向配体的偶联物或融合蛋白被研制出来,靶点涉及了前列腺特异性膜抗原(PSMA)、血管细胞粘附分子-1(VCAM-1)、整合素αVβ3和αVβ5等[30]。作者研究团队构建了一种低pH穿膜肽(pHLIP)和tTF的融合蛋白,pHLIP可在微酸性pH环境中形成跨膜α螺旋插入细胞膜,从而将tTF定位在血管内皮细胞表面,特异性诱导肿瘤血管栓塞,减少肿瘤灌注,抑制肿瘤生长,且无明显副作用[31]。在此基础上,基于CREKA五肽(Cys-Arg-Glu-Lys-Ala)对肿瘤血管内皮表面异常升高的纤维蛋白-纤连蛋白复合物的特异性识别作用,作者研究团队进一步发展了一种tTF和CREKA组成的融合蛋白,在抗肿瘤治疗中显示出了较强的特异性和高效性[32]。
理想的肿瘤血管栓塞药物应该能够在整个肿瘤区域诱导和维持持久的血栓形成,以产生足够强的抗肿瘤效应,然而大多数TF融合蛋白不能维持持续的血栓形成,且由于容易诱发非特异性血栓而具有较窄的治疗窗口,治疗效果有限[30, 33]。凝血酶是凝血级联反应中更下游的蛋白,可直接将纤维蛋白原转化为纤维蛋白并激活血小板[34],理论上可产生比TF更强的栓塞效果。但凝血酶活性较强,不可在循环中直接和血液接触,因此将凝血酶安全、精准地递送到肿瘤血管是一个很大的挑战。DNA折纸技术的发展使得按需合成目标纳米载体成为可能[35],为实现凝血酶的递送提供了机遇。作者研究团队利用DNA折纸技术发展了一种DNA纳米机器结构用于凝血酶的体内精准递送,将定量的凝血酶分子锚定在DNA折纸片层上,通过包含靶向适配体AS1411及互补链的双链结构沿长边连接片层两端,使它们闭合形成中空的管状纳米结构以保护内部凝血酶。当该纳米机器到达肿瘤部位时,AS1411结合肿瘤内皮表面特异性表达的核仁素受体发生变构,导致管状结构打开,暴露凝血酶,触发凝血反应,在不同程度血管化的肿瘤类型中均显示出较强的抗肿瘤效果以及较高的生物安全性和免疫惰性,该研究首次实现了凝血酶的体内递送,将难以成药的活性分子成功转变为有效的药物,表明DNA纳米机器结构是肿瘤治疗中实现药物精确递送的一种非常有潜力的纳米平台(图1)[36]。

图1 用于肿瘤血管精准递送凝血酶的DNA纳米机器结构设计思路和作用原理示意图[36]:(a)DNA折纸技术构建载带凝血酶的纳米机器人及响应核仁素发生重构的示意图,(b)处于“关闭”(左)和“打开”(右)状态的DNA纳米机器人的原子力显微镜(AFM)照片,(c)载带凝血酶的纳米机器人在肿瘤血管内的作用机制Fig.1 Schematic design and action mechanism of DNA nanorobot delivering thrombin into tumor vessels precisely[36]: (a) schematic illustration of the construction of thrombin-loaded nanorobot using DNA origami technique, and its reconfiguration in response to nucleolin binding; (b) representative AFM images of DNA nanorobots in closed (left) and open (right) state; (c) therapeutic mechanism of thrombin-loaded DNA nanorobots within tumor vessels
2.2.2 新型纳米栓塞剂
临床上TACE所用的固体或液体栓塞剂往往由于流动性差和易被吸收降解等问题,导致肿瘤血管再通或形成侧支循环[37]。具有纳米三维网络的温敏型高分子纳米凝胶被用于解决已有肿瘤血管栓塞剂存在的问题,其温度敏感性溶胶-凝胶相变使该高分子凝胶可以自由流过导管并在进入血液后响应温度变化,形成具有高强度的水凝胶网络,栓塞肿瘤血管。如温敏型聚(N-异丙基丙烯酰胺-co-甲基丙烯酸丁酯)(PIB)纳米凝胶应用于肿瘤栓塞治疗时表现出优于碘化油的外周栓塞效果,且栓塞持续时间长,有效抑制了侧支循环和血管再通[38]。纳米凝胶的高载药量、药物可控释放及可整合诊断试剂等特性也使其应用范围进一步扩大[37]。
一些可响应肿瘤微环境而发生结构变化阻塞肿瘤血管或特异性诱导肿瘤血管栓塞的新型纳米栓塞剂进一步拓宽了栓塞治疗的思路。Agemy等利用氧化铁纳米颗粒的促凝效应设计合成了一种偶联两种肿瘤归巢肽(CREKA和CRKDKC)的超顺磁性氧化铁“纳米虫”,在肿瘤血管内诱导了广泛的凝血反应而不影响正常血管,有效减少了肿瘤血供,抑制了肿瘤生长[39]。Zhang等设计了一种基于双重响应性层粘连蛋白模拟肽(laminin mimic peptide, LMMP)的纳米颗粒,LMMP肽同时具有pH响应序列His6、肿瘤微血栓靶向肽CREKA及纤维形成序列KLVFF,静脉注射的纳米颗粒通过CREKA富集至肿瘤部位, His6序列响应肿瘤微酸性环境从而发生电荷和结构改变,导致LMMP分子由亲水性转为疏水性,模拟天然层粘连蛋白形成纤维的过程,在肿瘤血管中形成纤维网络,堵塞肿瘤血管,抑制肿瘤生长(图2)[40]。
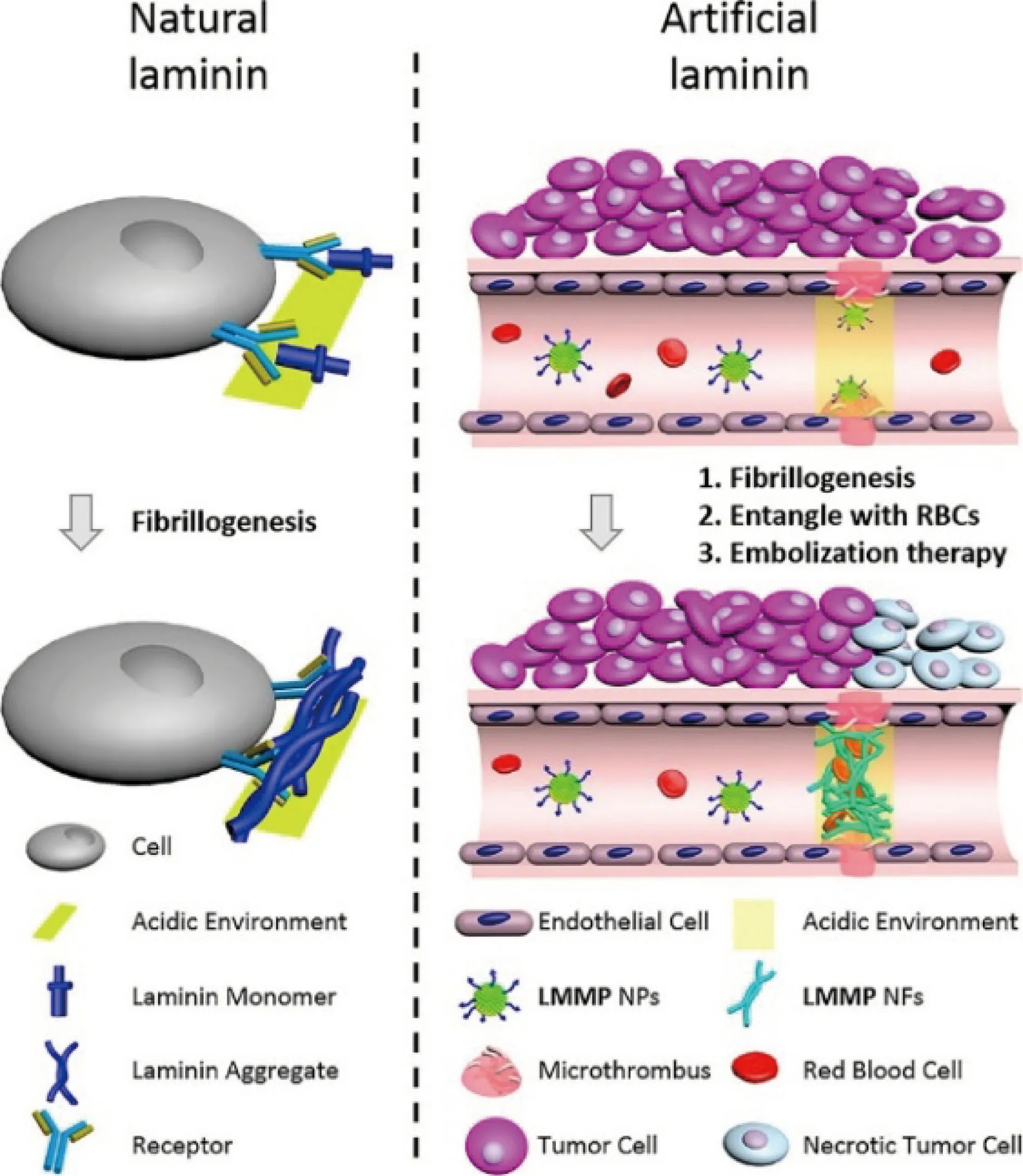
图2 天然层粘连蛋白和人工层粘连蛋白形成纳米纤维网络的原理示意图[40]Fig.2 Schematic illustration of nanofibrillogenesis from natural laminin or artificial laminin[40]
纳米栓塞剂主要通过自身结构变化堵塞肿瘤血管,不引起生物体内天然凝血级联反应,因此相较于递送的凝血因子而言具有更高的安全性,但是也降低了局部血栓形成的效率和栓塞的永久性,如何平衡其安全性和有效性还有待更进一步的研究。
2.3 阻断肿瘤血管的联合治疗纳米药物
单一的抗血管疗法效果往往比较有限,临床应用中的抗血管疗法多作为辅助疗法,以改善化疗、放疗等药物的疗效,而纳米药物载体本身适用于携带多种药物用于联合治疗,使共递送抗血管药物及放/化疗药物更易于实现。从抗肿瘤机制来看,血管生成抑制剂主要干扰肿瘤边缘新生血管的形成,对已形成的血管无显著抑制作用,因而它们仅对边缘的肿瘤细胞有抑制效应,对中心缺氧区域细胞无显著影响[41];而血管破坏剂和血管栓塞剂干预的主要是已形成的中心肿瘤血管,对周边新生血管的干预效果不显著,残余的边缘细胞是导致该类疗法中肿瘤复发和血管再生的主要原因[42, 43]。
针对血管破坏剂初期抗肿瘤效果显著而在后期引发血管生成导致肿瘤复发的问题,作者研究团队采用血小板膜包覆的MSNs共递送CA4和抗血管生成药物阿帕替尼,成功将血管破坏剂与血管生成抑制剂联合应用,血小板膜的包覆避免了纳米颗粒被快速清除,并通过血小板对肿瘤的归巢性使纳米颗粒靶向肿瘤部位,并且由于血小板膜可粘附在损伤的血管上,还可以使更多纳米粒聚集到损伤部位产生放大效果。该研究结果表明纳米平台共递送血管破坏剂与血管生成抑制剂有望实现肿瘤的彻底根除[44]。
另外,文献报道显示,肿瘤血管靶向/阻断药物与细胞毒性药物联用的疗效强于单一血管靶向疗法[45-47],但两种药物给药的时间间隔、顺序和剂量需要严格把控,因为细胞毒性药物本身依赖于肿瘤血管输送[48]。作者研究团队采用离子凝胶法制备了一种可生物降解的壳聚糖-三聚磷酸钠纳米载体,通过静电相互作用载带促凝因子凝血酶和化疗药物阿霉素(Dox),实现联合治疗,纳米粒表面偶联CREKA肽以实现对肿瘤血管的靶向效应。研究结果表明,凝血酶在肿瘤部位的特异性释放有效诱导了瘤内血栓的形成,同时Dox在瘤内积累导致肿瘤边缘细胞被有效杀伤,在不同血管化程度的肿瘤模型中都显示出了明显强于单一疗法(单载凝血酶或Dox)的疗效,肿瘤复发率降低,显著延长小鼠生存期,从而提供了一种简单高效、易于转化的生物栓塞与化疗联用新策略[49]。
3 肿瘤血管特性调控的纳米药物
肿瘤血管具有结构不成熟、高通透性的特点,导致肿瘤内血流时空异质性、缺氧和间质液体压力增加,是临床治疗中药物无法有效富集在肿瘤组织的主要原因[12]。基于此提出的“血管正常化”策略旨在通过纠正肿瘤血管结构和功能的异常,使肿瘤微环境正常化,最终控制肿瘤进展;另外,正常化的肿瘤血管恢复了一定的灌注能力,可增加药物输送从而增强疗效[11, 12, 50]。此外,高渗透长滞留(enhanced permeability and retention, EPR)效应是纳米药物在肿瘤部位蓄积的主要途径,而EPR效应在不同大小、不同类型的肿瘤中存在较大差异[51],通过调节肿瘤血管通透性来调节EPR效应作用效果,从而增加纳米药物渗透,已成为肿瘤纳米医学的研究重点之一。
3.1 肿瘤血管正常化
理论上,恢复肿瘤促血管生成信号和抗血管生成信号的平衡即可使肿瘤血管正常化,比如加入血管生成抑制因子(如内皮抑素)或干扰促血管生成信号(如血管生成抑制剂)[52]。Li等采用金纳米颗粒(AuNPs)递送人重组内皮抑素(rhES-AuNPs),rhES-AuNPs通过EPR效应被动靶向至肿瘤部位,延长rhES的循环时间并增加它在肿瘤部位的聚集,给药后4~8 d内肿瘤血管通透性降低、灌注增加,与化疗药物5-氟尿嘧啶(5-FU)联用增加了5-FU在肿瘤部位的输送,显示出明显强于5-FU单一疗法的抑瘤效果,显著延长了小鼠的生存期[53]。与游离的内皮抑素相比,rhES-AuNPs诱导血管正常化的时间窗口更长[53, 54],且因已有药物只能诱导暂时性的肿瘤血管正常化,这个窗口的延长对于临床应用具有十分重要的意义。因此,采用纳米载体递送血管正常化诱导剂不仅可以克服药物的固有缺陷,还有利于与其他疗法的联合。然而,肿瘤血管正常化对于本身依赖EPR效应富集到肿瘤的纳米颗粒可能产生不同影响,即改善小尺寸(直径10 nm左右)而阻碍较大尺寸(直径100 nm左右或更大)纳米颗粒的递送[55]。因此,将肿瘤血管化策略与其他疗法联用时需要谨慎控制纳米药物的尺寸范围。
3.2 肿瘤血管通透性调控
3.2.1 递送NO供体
氧化氮(NO)作为一种天然的血管扩张剂,是最常用的肿瘤血管通透性调节剂之一,其供体通过扩张血管增加血流量,从而增加药物(尤其是纳米药物)在肿瘤组织中的积累。然而,NO供体的半衰期极短,且稳定性低,在生理环境中易释放NO,导致不良反应,很大程度上限制了其临床应用[56]。针对此类问题,各种纳米载体如脂质体、二氧化硅、金属氧化物和聚合物纳米粒子等被用于递送NO供体,通过控制纳米载体的行为实现NO的时空特异性释放[57]。NONOate是一种常用的NO供体,在生理条件下通过质子化诱导自身分解释放NO[58]。Tahara等采用脂质体载带NONOate,在脂质体内部使用碱性缓冲液增强其稳定性,而进入到肿瘤微酸性环境中的NONOate可加速分解产生NO,在实现肿瘤部位NO持续释放的同时不引起血液中NO增加,有效扩张肿瘤血管,最终载NONOate脂质体在肿瘤部位的蓄积是空脂质体的2倍[59]。然而,尽管采用脂质体包裹NO供体可显著增强其稳定性,但由于脂质体本身稳定性不足,脂质体渗漏易导致血液环境中NO的非特异性释放[60],未来开发高生物相容性和生物可降解性的聚合物载体可能扩大NO供体的临床应用。
3.2.2 调控肿瘤相关血小板
肿瘤细胞可以通过分泌凝血酶、ADP等血小板激活剂或直接结合血小板表面受体的方式使血小板处于活化或高活性状态[61]。处于活化或高活性状态的血小板可通过直接粘附到肿瘤血管表面或者释放血管生成素(ANGPT1)、5-羟色胺(5-HT)等物质保护肿瘤血管的完整性[62, 63]。因此,抑制血小板活化/高活性或敲除血小板可增加肿瘤血管通透性,进而增加化疗、放疗等药物在肿瘤部位的渗透和富集[64, 65]。通过调节血小板来调节肿瘤血管通透性已成为一种有效提高抗癌药物疗效的新兴策略。然而,现有的抗血小板药物或血小板耗竭抗体由于不具有靶向性,作用于全身血小板时,出血性并发症出现的风险较高[66],限制了它们在肿瘤治疗中的应用,采用纳米体系靶向调节肿瘤相关血小板可实现较为安全的血小板功能或数量调节。
由于血小板活化主要发生在已活化的血小板周围,而活化的血小板主要分布在肿瘤的炎性微环境中,Cao等将活化血小板靶向肽(TM33)连接到明胶上,与未修饰的明胶一起,采用乳化-溶剂挥发法制得了包裹载有丹参酮IIA(TNA)的油酸疏水性内核的明胶/油酸纳米粒(TM33-GON/TNA)。在TM33肽通过结合活化血小板表面P-选择素在活化血小板周围使纳米药物局部富集后,活化血小板分泌的金属蛋白酶2(MMP2)降解明胶导致TNA的释放,形成局部高TNA暴露,抑制局部环境中的血小板进一步活化、聚集、粘附,从而打破血管屏障,显著增加纳米药物(尤其是尺寸较大的纳米药物)在肿瘤组织中的渗透和富集,且与白蛋白紫杉醇联用显示出明显增强的疗效。尽管上述对血小板的抑制理论上是可逆的,但TM33-GON/TNA在给药后2~6 h内仍然对小鼠止血功能产生了一定程度的抑制[67]。
基于血小板在肿瘤进展中的重要作用,作者研究团队制备了一种核壳结构的聚合物-脂质-多肽纳米载体,用于递送血小板耗竭抗体R300和化疗药物Dox,其核心纳米颗粒由嵌段共聚物聚醚酰亚胺-聚(乳酸-乙醇酸)2(PEI-(PLGA)2)组装而成,并通过疏水相互作用载带Dox;壳层由可被MMP2裂解的多肽、卵磷脂及PEG化磷脂分子组成,并通过静电相互作用携带R300抗体,最终获得的纳米体系PLP-Dox-R300通过EPR效应富集到肿瘤部位,多肽层响应局部高水平的MMP2释放R300,诱导血小板形成微聚体进而被清除,打破血管完整性,增加携带Dox的纳米颗粒核在肿瘤部位的渗透、富集,在荷瘤小鼠和家兔模型中导致肿瘤持续消退,肿瘤转移被显著抑制,且无明显的毒副作用(图3)[68]。需要注意的是,尽管采用纳米体系递送抗血小板药物或局部敲除血小板显示出非常好的增强血管通透性的效果,但药物存在一定的非特异性释放,仍然可能导致出血风险,因此需要谨慎选择靶点和抗血小板药物的用量,以及与联合应用的纳米药物之间的给药时间间隔等。
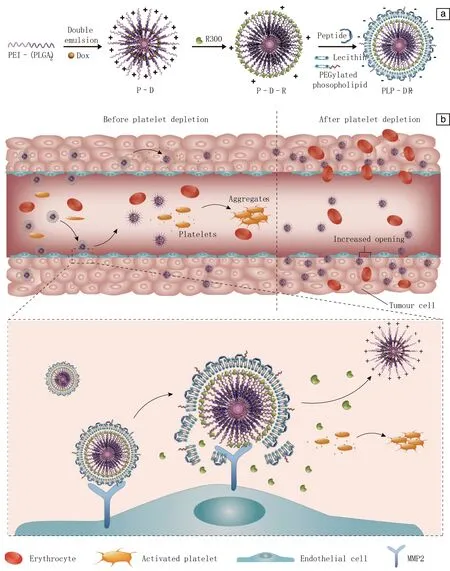
图3 PLP-Dox-R300纳米药物的设计思路和作用机制[68]:(a)MMP2响应性纳米药物的制备流程示意图;(b)PLP-Dox-R300纳米药物的作用机制,PLP-Dox-R300纳米颗粒的壳层被肿瘤内过表达的MMP2降解后,暴露并在局部释放R300抗体,R300抗体可以结合血小板表面受体,诱导形成血小板微聚集体,从而使血小板被清除,肿瘤内血小板敲除导致肿瘤血管内皮出现孔隙,增加负载Dox的内核结构的瘤内渗透Fig.3 Design and proposed action mechanism of PLP-Dox-R300 in tumor blood vessels in vivo[68]: (a) schematic illustration of the preparation of the MMP2-responsive nanoparticles; (b) the proposed mechanism of action of the PLP-Dox-R300 in vivo, the shell layer is cleaved by overexpressed MMP2 within tumors, consequently exposing R300 and leading to its release locally, which binds to platelet surface receptors and facilitates the formation of platelet microaggregates to accelerate platelet clearance. The depletion of platelets in tumors induces openings in the vessel walls, which provide access for the Dox-encapsulated core nanoparticles to enter the tumor
4 结 语
本文主要从阻断肿瘤血供和肿瘤血管特性高效调控两个方面综述了肿瘤血管靶向智能纳米药物的研究进展。总体而言,智能纳米载体的应用有效延长了传统游离抗血管药物的半衰期、实现了药物的精准递送和释放,降低毒性并提高了疗效,为扩大其临床应用以及多药联合提供了可能。部分纳米载体不仅可以承担药物递释的功能,同时本身也具有抗血管作用。利用该类纳米材料作为药物载体不仅解决了部分药物分子(如抗体)载药效率低的问题,同时亦为抗血管治疗和肿瘤细胞杀伤的协同作用提供了新思路。
值得注意的是,采用联合疗法时需要着重考虑不同抗肿瘤药物的作用机制和特点。比如血管生成抑制剂可以抑制肿瘤新生血管的形成而对成熟的血管无影响[41],而血管破坏剂或栓塞剂主要破坏成熟的肿瘤血管[42],理论上两者联用可产生良好的协同治疗效果;此外,血管破坏剂和栓塞剂对肿瘤中心血管丰富的区域有较强的治疗效果,而对边缘区域疗效较差[69],亦可将它们与化疗、免疫治疗等联合应用。肿瘤血管不仅是治疗的靶点,也是药物输送的通道,血管正常化策略的出现为增加抗肿瘤药物的输送拓宽了思路。然而,肿瘤血管正常化对纳米药物渗透的影响具有尺寸依赖性,需要增加小尺寸纳米药物的渗透而不影响或阻碍较大尺寸纳米药物的富集,因此在将血管正常化与具有肿瘤细胞杀伤效应的纳米药物联用时需要谨慎选择纳米载体的尺寸。纳米药物被动靶向依赖的高渗透长滞留(enhanced permeability and retention, EPR)效应在不同患者、不同肿瘤类型中的表现都存在差异,即使是同一患者的肿瘤,其EPR效应也会随疾病进展发生变化[13],因此通过调节肿瘤血管通透性增加纳米药物在肿瘤中的积累变得更加重要。传统的肿瘤血管通透性调节以递送NO供体为主要策略,近年来的研究发现靶向调节肿瘤相关血小板以破坏肿瘤血管是一种可有效增加血管通透性的新兴策略。然而尽管智能纳米载体最大化地实现了肿瘤局部的血小板抑制或耗竭,对全身血小板的影响目前仍然难以避免,因此需要进一步优化纳米载体的设计理念以期最终实现真正地特异性干预肿瘤相关血小板。
靶向作用于肿瘤细胞或肿瘤间质成分的纳米药物,发挥作用时需要先跨过几十微米至几百微米的血管屏障,而且肿瘤微环境存在高度异质性,这可能是造成许多主动靶向智能纳米药物在体外对肿瘤细胞显示出很高的靶向效率,而在体内则很少显示出高于非靶向纳米药物效率的重要原因之一[70]。相比较而言,血管内皮细胞直接暴露于血液中,非常便于纳米药物的靶向识别及功能发挥,因此靶向肿瘤血管的纳米药物在药物递送方面具有天然的优势。然而,目前可用于靶向的相关靶点或是微环境响应的特异性还需要进一步优化。如目前多采用的靶向肿瘤局部微血栓的CREKA肽,在动脉粥样硬化相关的微血栓存在时其特异性则会受到限制[39];响应肿瘤微环境低pH值的纳米药物,在其它炎症导致的微酸性环境中亦可导致药物的非特异性释放。此外,尽管纳米技术已在肿瘤纳米医学领域取得了巨大进展,纳米药物临床转化最主要的挑战仍然来源于对肿瘤生物学的复杂性与异质性的认知不足,对纳米结构-生物界面相互作用的了解有限以及纳米药物的可重复合成和大规模生产技术欠缺[13]。DNA纳米机器药物在凝血酶递送中的成功应用表明了将DNA折纸技术应用于药物精准递送的巨大潜力,但若要实现临床应用还有许多问题亟待解决,如DNA纳米材料的免疫原性、体内代谢行为以及规模化生产等[29]。因此,未来的智能纳米药物在向更精细的设计方向发展的同时,需要更深入地研究纳米药物和细胞相互作用的机制,通过调控相关靶分子来调节细胞对药物的摄取,此外,应尽可能选择生物安全性好、体内代谢行为明确的纳米材料,并发展先进的制备方法和表征体系以扩大纳米药物的临床应用。
