二甲双胍对大鼠脑出血后血肿周围组织继发损害有保护作用
2022-12-02向攀懿李作孝
向攀懿,李作孝
脑出血(intracerebral hemorrhage,ICH)存在原发性和继发性损害,前者指血肿扩大导致淤血所引起的机械性破坏,后者则与多种因素有关,包括脑水肿、炎症反应、自由基损害及细胞凋亡等。研究发现[1],血肿周围脑组织的继发性损害与ICH 的高残疾率和高死亡率密切相关。因此,研究ICH后继发性损害的机制及防治药物具有重要价值。
二甲双胍(Metformin,Met)为双胍类口服降血糖药,是临床治疗2型糖尿病的一线药物,在血浆中不与血浆蛋白结合,通过抑制人体糖异生作用及增加对外周葡萄糖的消耗,发挥降血糖作用,且可减弱胰岛素抵抗,不影响胰岛素在人体内的分泌。相关研究证实[2],Met 会抑制葡萄糖在肠道的吸收,且不促进脂肪合成,对正常人的血糖无影响;且可在人体内通过清除氧自由基,减轻炎症反应,抗细胞凋亡等机制,发挥对各脏器的保护作用。本研究通过制备大鼠ICH 模型,观察Met 对大鼠ICH 后神经功能障碍评分、血肿周围脑组织含水量、自由基含量、炎症反应及细胞凋亡蛋白等指标变化的影响,探讨Met对ICH后血肿周围组织继发性损害的保护作用及其机制,旨在为Met 的作用领域与ICH 的临床治疗提供新的选择方案。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性健康成年体质量250~300 g的Sprague-Dawley 大鼠(由西南医科大学动物室提供),适应性喂养。
1.1.2 主要试剂及设备 Met,购于上海麦克林生物化学科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)测定试剂盒,购于南京建成生物科技有限公司;B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2 相关X 蛋白(Bcl-2 associated X,Bax)抗体,购于武汉恒意赛生物科技有限公司;立体定向仪、胶片扫描仪,购于西南医科大学动物中心实验室;50 μL 微量进样器,购于无锡德凡玻璃仪器有限公司;转移电泳仪槽,购于北京市六一仪器厂。
1.2 方法
1.2.1 动物分组、模型制备 将60只大鼠采用随机数字抽样法分为假手术组、对照组及Met 组,每组20 只,每组再分为1、3、7、14 d 四个亚组。造模方法:对照组及Met组大鼠称重后,腹腔注射10%水合氯醛3 mL/kg 麻醉,固定于立体定向仪行大鼠头部正中线纵切口,暴露出颅骨标志,在前囟后1.6 mm、中线左侧旁开3 mm 处钻孔,调整微量注射仪尖端移至钻孔处。消毒大鼠尾后在距末端0.5 cm 处断尾取自体不凝血50 μL[3],沿钻孔进针将血注入脑内,注射完毕后封闭钻孔并缝合头皮。假手术组在相同位置注入50 μL 生理盐水。按Bederson[4]的评定方法分成四级判定大鼠ICH模型是否成功,若达1、2、3 级判定为成功。给药方法:Met 组予以Met 100 mg/(kg·d)连续灌胃,对照组与假手术组连续灌胃生理盐水100 mg/(kg·d)。
1.2.2 神经功能障碍评分 造模后第1、3、7、14 天对各组大鼠按改良Garcia[5]方法对进行神经功能障碍评分(3~18分),分数越低提示神经功能障碍越重。
1.2.3 标本制备 造模后第1、3、7、14天腹腔注射1%戊巴比妥钠2~3 mL,断头处死每组5只大鼠,迅速开颅取距血肿边缘外侧1 cm范围内脑组织4~5块(1 mm3),取1~2 块脑组织用电子天平称重后放入称量瓶,存放在电热鼓风干燥箱中备用;1~2 块脑组织进行脱水包埋石蜡切片处理,常规HE染色,采用ELISA进行测定SOD活力、MDA含量;1 块脑组织放入-80 ℃冰箱保存备用,拟作Western blot检测。
1.2.4 血肿周围脑组织含水量测定 采用干湿法测定含水量。于相应时间点,取干燥箱中各组脑组织块,然后置于恒温烤箱中,恒温105 ℃24 h 烤至恒重,运用Elliott 公式计算:脑组织含水量=(湿重-干重)/湿重×100%。
1.2.5 血肿周围脑组织病理变化观察 于相应时间点,各组取血肿周围脑组织块,置于4%多聚甲醛中固定24 h以上后,脱水行常规石蜡包埋切片,按照HE染色说明书进行染色,光镜下观察脑组织病变情况。
1.2.6 血肿周围脑组织SOD 活力与MDA含量检测 于相应时间点,各组取血肿周围脑组织块加生理盐水配成3%脑组织匀浆,离心10 min,取上清液用于检测MDA 和SOD,按照说明书步骤进行检测,并通过公式计算出组织块中总SOD 活力与MDA含量。
1.2.7 血肿周围脑组织Bax 及Bcl-2 蛋白表达的测定 于相应时间点,各组取低温保存的血肿周围脑组织块置于预冷的PBS缓冲液中漂洗数次,清洗表面血污后切割成均匀小块放入匀浆器中,加入相应体积裂解液,冰浴彻底匀浆后转移至离心管中振荡,保证匀浆液完全裂解。4 ℃12 000 rpm 离心5 min,收集上清,即为总蛋白溶液。样品蛋白浓度用BCA测定试剂盒测定,根据样品浓度调控每个样品总蛋白上样量均为40 μg。将适量的蛋白上样缓冲液加入样品中,沸水浴5 min。室温冷却并离心后,取样品进行SDS-PAGE 丙烯酰胺凝胶电泳并转移至PVDF滤膜上,加入稀释液室温依次孵育一抗、二抗,化学检测法曝光。扫描存档胶片,运用相关软件分析计算Bax 及Bcl-2 蛋白平均灰度值及分析目标带的光密度值。
1.3 统计学处理
应用SPSS20.0软件分析数据,计量资料以(均数±标准差)表示,单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能的变化
与假手术组相比,对照组各时间点神经功能障碍评分降低(P<0.05);与对照组相比,Met 组各时间点神经功能障碍评分增高(P<0.05),见表1。
表1 3组神经功能障碍评分比较(±s)
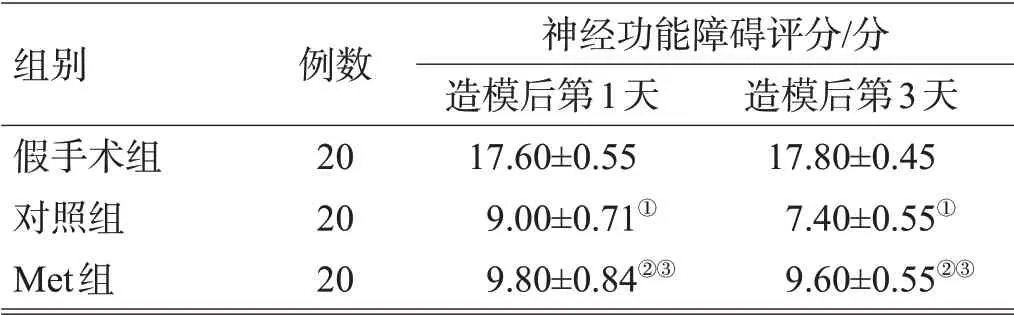
表1 3组神经功能障碍评分比较(±s)
组别假手术组对照组Met组例数20 20 20神经功能障碍评分/分造模后第1天17.60±0.55 9.00±0.71①9.80±0.84②③造模后第3天17.80±0.45 7.40±0.55①9.60±0.55②③
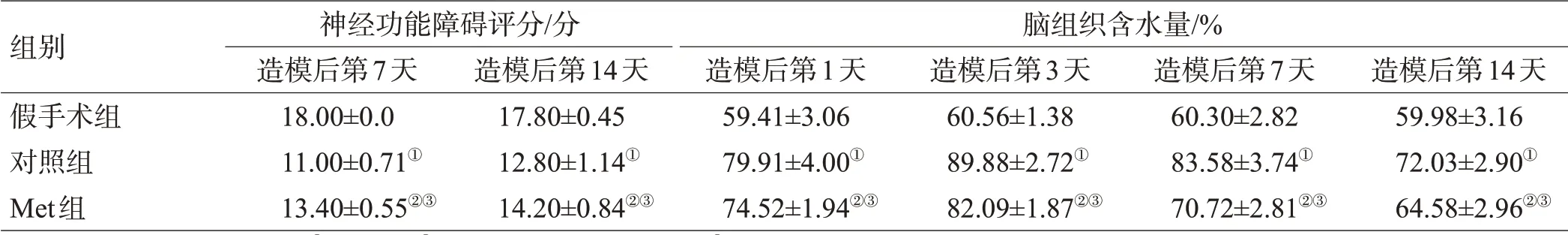
注:与假手术组比较,①P<0.01,②P<0.05;与对照组比较,③P<0.05
2.2 血肿周围脑组织病理变化
假手术组第1、3、7、14天各时间点脑组织未见明显病理改变;对照组各相应时间点血肿周围脑组织形态异常,可见细胞明显肿胀、周围间歇增宽,有大量淋巴细胞浸润和胶质细胞增生,还可见少量血管扩张;与对照组比较,Met组各相应时间点上述病理改变程度明显减轻,见图1。
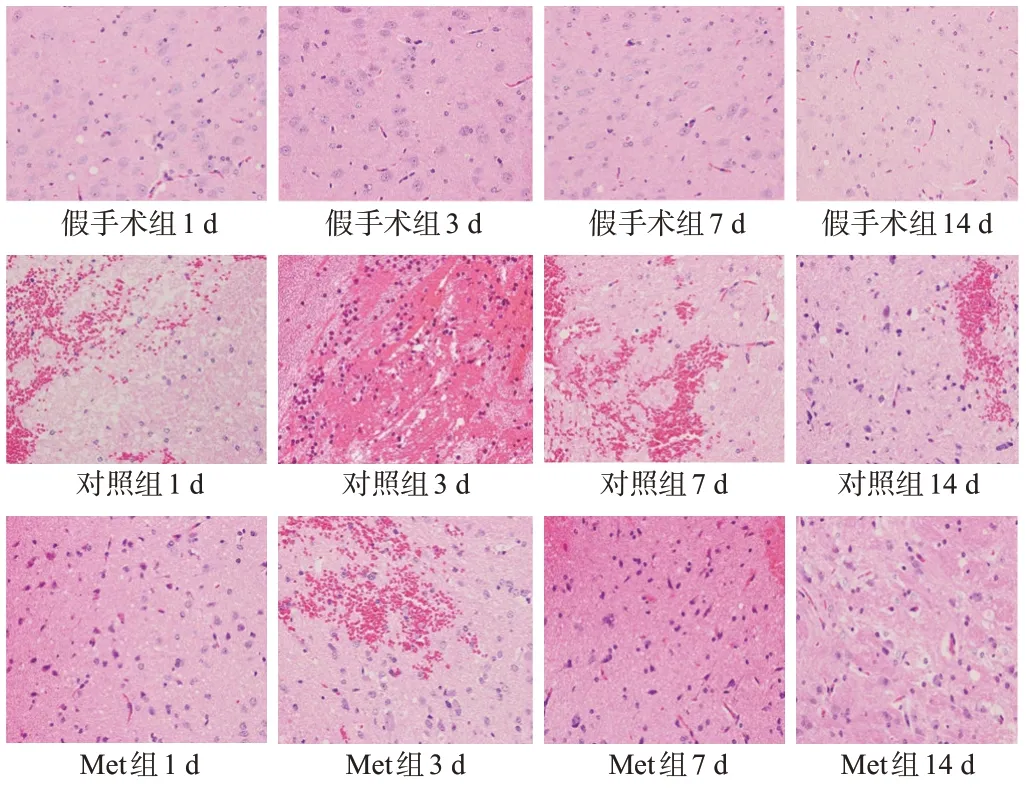
图1 3组脑组织(HE染色,×400,n=5)
2.3 血肿周围脑组织含水量变化
对照组各时间点血肿周围组织含水量较假手术组各相应时间点增多(P<0.05);Met组各时间点血肿周围组织含水量较对照组各相应时间点降低,差异有统计学意义(P<0.05),见表1。
2.4 血肿周围脑组织SOD活力和MDA含量变化
对照组各时间点血肿周围组织较假手术组各相应时间点SOD活力降低,MDA含量升高(P<0.05);Met组各时间点血肿周围组织较对照组各相应时间点SOD 活力升高,MDA 含量降低,差异有统计学意义(P<0.05),见表2。
表2 3组造模后SOD活力和MDA含量比较(±s)
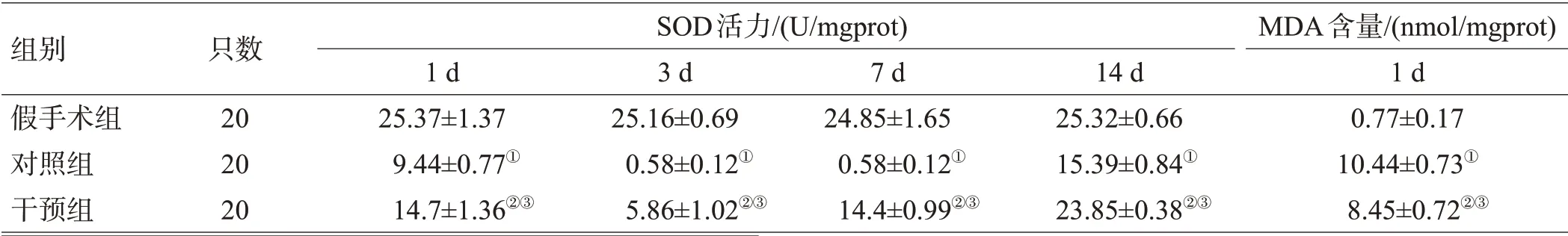
表2 3组造模后SOD活力和MDA含量比较(±s)
组别假手术组对照组干预组只数20 20 20 SOD活力/(U/mgprot)1 d 25.37±1.37 9.44±0.77①14.7±1.36②③3 d 25.16±0.69 0.58±0.12①5.86±1.02②③7 d 24.85±1.65 0.58±0.12①14.4±0.99②③14 d 25.32±0.66 15.39±0.84①23.85±0.38②③MDA含量/(nmol/mgprot)1 d 0.77±0.17 10.44±0.73①8.45±0.72②③
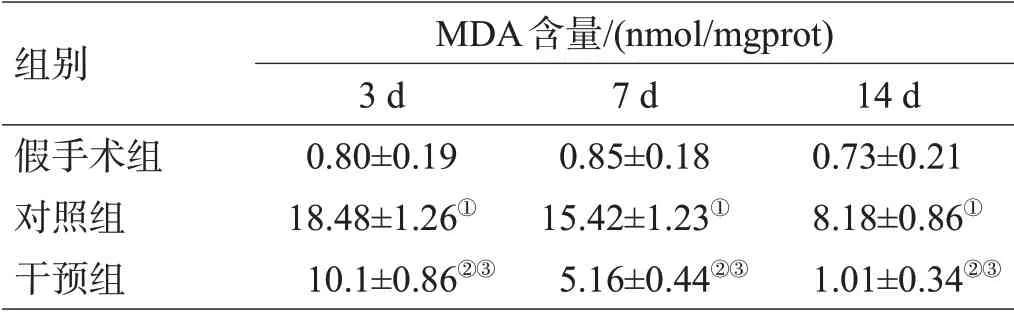
注:与假手术组比较,①P<0.01,②P<0.05;与对照组比较,③P<0.05
2.5 血肿周围脑组织Bax和Bcl-2表达的变化
对照组各时间点血肿周围组织较假手术组各相应时间点Bax表达增加,Bcl-2表达降低;Met组各时间点血肿周围组织较对照组各相应时间点Bax 表达降低,Bcl-2 表达增加,差异有统计学意义(P<0.05),见图2、表3。
表3 3组脑组织中造模后不同时间点Bax和Bcl-2平均灰度值的比较(±s)
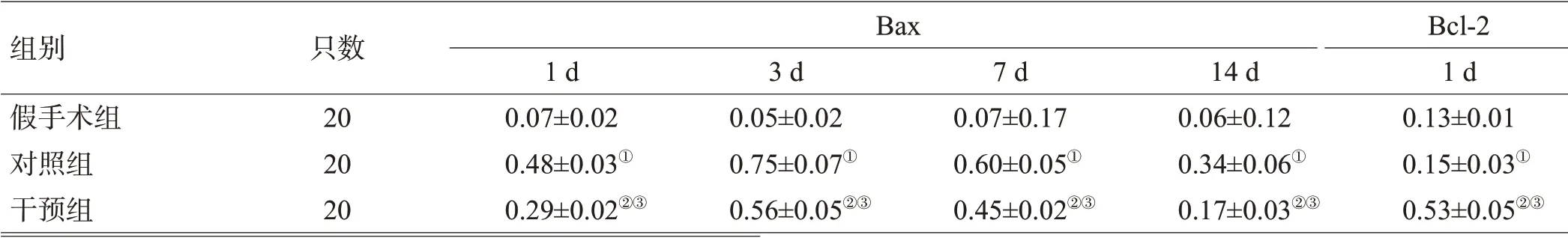
表3 3组脑组织中造模后不同时间点Bax和Bcl-2平均灰度值的比较(±s)
组别假手术组对照组干预组只数20 20 20 Bax 1 d 0.07±0.02 0.48±0.03①0.29±0.02②③3 d 0.05±0.02 0.75±0.07①0.56±0.05②③7 d 0.07±0.17 0.60±0.05①0.45±0.02②③14 d 0.06±0.12 0.34±0.06①0.17±0.03②③Bcl-2 1 d 0.13±0.01 0.15±0.03①0.53±0.05②③
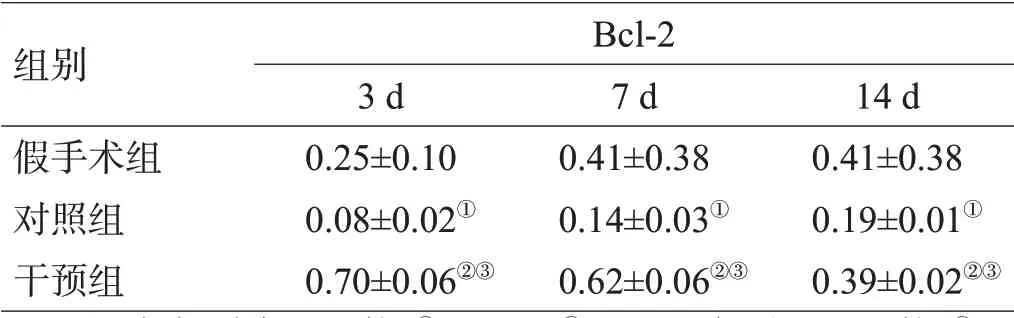
注:与假手术组比较,①P<0.01,②P<0.05;与对照组比较,③P<0.05
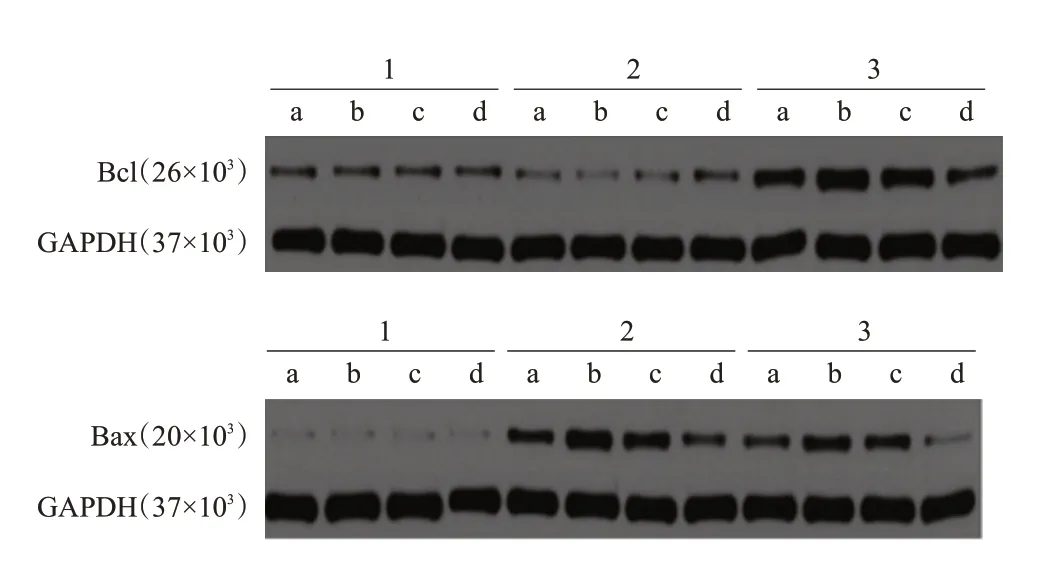
图2 3组大鼠造模后各时间点血肿周围组织Bax和Bcl-2蛋白的表达
3 讨论
ICH 后血肿周围白细胞浸润和小胶质细胞活化会释放炎症细胞因子加重细胞炎性病理改变[6]。同时血肿压迫可致局部脑组织缺血、缺氧而产生大量氧自由基攻击脑细胞膜磷脂,可造成细胞损伤发生脑水肿,加速细胞凋亡[7-10]。SOD是生物体内一种抗氧化酶,其活力与清除氧自由基的能力相关,在氧化与抗氧化平衡中起到至关重要的作用。MDA作为生物体内脂质过氧化反应的终产物,其含量可反映氧自由基水平,间接反映出细胞损伤的程度[7]。Bcl-2蛋白作为内源性神经保护物质,主要通过抑制神经元细胞凋亡参与脑细胞保护作用[11]。Bax蛋白是促细胞凋亡蛋白,可抑制Bcl-2保护效应而加速细胞凋亡[12]。细胞凋亡抑制作用强弱与Bcl-2/Bax的值有关,较高的值表示细胞凋亡被抑制,较低的值表示细胞凋亡受到促进[13]。本研究结果显示大鼠ICH后可见神经功能障碍评分升高,血肿周围组织炎症细胞的浸润及血管扩张等病理反应,血肿周围脑组织含水量明显增加,SOD活力值降低及MDA含量增加,Bax表达增加及Bcl-2表达降低。说明大鼠ICH后血肿周围组织局部缺血、炎症反应等多因素共同作用下氧化及抗氧化失衡,大量氧自由基产生,发生脂质过氧化反应,造成明显脑损伤和脑水肿,促进细胞凋亡发生,加重继发性脑损害。
Met是人工合成的双胍类口服降血糖药,无促使脂肪合成的作用,药效稳定,且不降低非糖尿病患者的血糖[14]。近年的研究发现,Met 给药后可透过血脑屏障于中枢神经系统中产生疗效,减轻脑组织过度氧化引起的白细胞活性降低与细胞凋亡[15]。其途径包括Met通过直接抑制NLRP3炎性小体激活,从而抑制促炎症蛋白酶Caspase-1活化与自切割,阻碍炎症细胞因子的成熟,降低炎症反应的表达;Met通过激活含有氧化应激的血清标志物修饰蛋白,促进抗OH 自由基生成,抑制氧化应激反应,从而降低自由基水平,提升细胞抗氧化能力,维持组织稳态;Met通过抑制bax/bax 同源二聚体的过量表达及Caspase-3 的活化,影响细胞凋亡的效应与执行阶段,从而减少细胞凋亡[16-18]。本研究结果显示Met 干预后ICH 大鼠神经功能障碍评分降低,大鼠血肿周围脑组织炎症细胞的浸润及血管扩张等病理反应及血肿周围脑组织含水量减少,SOD 活力增高及MDA 含量降低,Bax表达降低及Bcl-2表达增高,说明Met可改善大鼠ICH后神经功能缺失症状,减轻脑组织水肿及炎性细胞浸润,抑制细胞凋亡而减轻血肿周围组织继发损害,发挥保护作用。
综上所述,Met可对ICH后血肿周围组织继发损害产生保护作用,其机制可能与炎症反应、氧化及凋亡作用减弱有关,这为Met 在急性ICH 治疗中的应用提供实验依据,也为急性ICH的临床防治提供新的应用前景。
