一种花生高效复合微生物菌剂及其应用
2022-12-01张俊杰王楠李硕彭姗姗尚益民柴帅杰陈锦永陈文峰
张俊杰王 楠李 硕彭姗姗尚益民柴帅杰陈锦永陈文峰
(1.郑州轻工业大学食品与生物工程学院,河南 郑州 450001;2.中国农业科学院郑州果树研究所,河南 郑州 450000;3.中国农业大学根瘤菌研究中心,北京 100193)
花生(ArachishypogaeaL.)属豆科植物,是我国重要的经济作物之一,也是河南省第一大油料作物,果实中不仅含有较丰富的蛋白质和油脂,还具有药用保健价值[1]。河南是我国农业大省,花生种植面积和总产量常年居全国首位。长期以来,高产优质一直是花生生产追求的目标。但在传统耕作时期,由于无机化肥具有价格低、施用方便和高效等特点,农民种植花生时过度依赖化肥,且施肥方法不科学,使得产区花生的产量、品质大大下降,同时土壤板结、酸化等问题逐渐显露出来,严重制约了我国生态环境的改善[2]。农业可持续发展在我国仍面临着重大挑战,减肥增效已成为我国走绿色农业和农业可持续发展道路的必然选择。
近年来,微生物菌剂在提高农作物产量、抗病虫害等方面已成为研究热点。微生物菌剂是通过大量有益微生物的生命活动和新陈代谢产物来改善土壤微生态环境,最终可以达到促进作物生长、减轻作物病害、改善作物产量和品质等目的[3]。在农业可持续发展的背景下,微生物菌剂以低成本来提高作物产量,有助于缓解无机化肥给环境带来的破坏。大量研究表明,微生物菌剂已在大豆[4]、紫云英[5]、马铃薯[6]、玉米[7]等农作物的种植过程中得到应用,能显著提高农作物的产量及其他生长指标。近年来,人们将根瘤菌和芽孢杆菌作为制作微生物菌剂的常用菌种。花生慢生根瘤菌可通过与花生根系部位共生结瘤,提高植株生物量,从而达到增产目的[8]。芽孢杆菌可以释放土壤中的钾素,改善土壤肥力,并通过分泌激素、氨基酸等物质来促进农作物的生长[9]。目前,根瘤菌剂已向多功能的复合菌剂方向发展,将根瘤菌与有益菌株复合接种,更加利于豆科植物进行共生结瘤和生长。刘晔等[10]在华北地区土中筛选出一株产IAA的芽孢杆菌,分泌IAA量高达49.06 mg/m L,能够显著促进花生的生长。孔涛等[11]研究发现将胶质芽孢杆菌和根瘤菌复合接种紫花苜蓿,显著提高了紫花苜蓿的产量指标,具有明显协同作用。马鸣超等[12]认为复合接种胶质类芽孢杆菌和慢生大豆根瘤菌后,改善了大豆品质和土壤微生物环境,并实现大豆增产9.3%。酵母菌在改善作物产量方面也有一定研究,李想等[13]研究发现在种植花生过程中施用粘红酵母菌剂对花生生长和产量存在促进作用,同时也提高了土壤中细菌群落的丰富度和均匀度。由此可知,选用合适的复合菌剂对花生共生固氮和生长是有必要的。目前关于芽孢杆菌、花生慢生根瘤菌单接种的微生物菌剂应用较广泛,但两者复合接种、结合酵母菌在花生上的抗病性、促生性方面的研究则较少。
本研究以河南地区主栽花生品种远杂9102为试验材料,以花生慢生根瘤菌ZB15、芽孢杆菌1C-6和酵母菌1-103为研究对象,在实验室条件下,通过盆栽试验探究不同菌株单接种、复合接种对花生生长指标和光合作用的影响,以期获得最优菌剂组合,为开发花生复合菌剂提供理论依据和技术指导。
1 材料与方法
1.1 试验材料
花生品种为远杂9102,由河南省农业科学院棉花油料作物研究所提供。花生慢生根瘤菌ZB15(产IAA值为82.585 mg/L)、芽孢杆菌1C-6(产IAA值为37.15 mg/L)和广谱生防酵母菌1-103(抗花生尖孢镰刀菌)均为郑州轻工业大学微生物资源挖掘与应用研究室筛选获得的优良菌株。
1.2 试验设计与方法
1.2.1 供试菌株的培养
参考黄晓娜等[14]的方法,将保存在郑州轻工业大学微生物资源挖掘与应用研究室的优势菌株的花生慢生根瘤菌ZB15、芽孢杆菌1C-6、广谱生防酵母菌1-103分别接种于YMA 固体培养基、LB固体培养基和YEPD 固体培养基上,28℃恒温培养7、2、3 d,并挑取单菌落到YMA 液体培养基、LB液体培养基和YEPD 液体培养基中[15],于28℃、180 r/min 摇床中培养至对数生长期,OD600值统一调为0.8。
1.2.2 盆栽实验
挑选颗粒饱满、大小适当且表面完整的花生种子,在无菌环境下对种子进行消毒,消毒处理为:95%乙醇浸泡30 s,加入0.2%升汞溶液浸泡5 min,无菌水清洗种子7次[16]。消毒后的种子摆在0.8%水琼脂培养基上,置于28℃恒温培养箱中暗培养3 d,待花生种子根长长至2 cm 左右即可栽种。无菌条件下,将已灭菌的蛭石装进上层钵体(已灭菌)中,以距离上层钵体口1~2 cm为宜,挑选芽长2 cm 左右的花生栽种在上层钵体中的蛭石中,根部朝下,待上层钵体中种子种植后即可在下层钵体(已消毒)补充适量水分[17]。
试验共设7个处理,具体处理如表1所示。单接种T1、T2、T3时分别吸取菌液1 mL加至花生根部,复合接种T4、T5、T6时分别吸取0.5 mL菌液至花生根部,封口膜封住上层钵口,每处理6次重复。将各处理组置于人工气候培养箱(25℃光照16 h,湿度60%;20℃黑暗8 h,湿度40%)中,期间适当向下层钵体中补充水分,45 d(初花期)后收获并测定生长指标[17]。

表1 试验设计Table 1 Experiment design
1.3 测定项目与方法
1.3.1 叶绿素的测定
按照参考文献[18]的方法测定花生叶片的叶绿素相对含量,采用SPAD-502 Plus便携式叶绿素测定仪,选取花生主枝顶端下左侧第2片叶片进行测定,求其平均值。
1.3.2 根瘤的测定与观察
对花生植株的根瘤进行计数,观察根瘤的形状与根瘤横切面的颜色[16]。
1.3.3 生长指标的测定
测量花生的茎基部到顶端的长度为株高,而根长则是从茎基部到主根根尖[19]。将植株的地上部与地下部从茎基部剪开,将同一处理植株的地上部、地下部分别置于70℃烘箱中烘至恒质量,称量地上部与地下部的干质量。每组处理选5株花生植株,求出平均值,并计算花生植株的根冠比,计算公式如下[20]:

1.3.4 促生性综合评价
接种菌剂对花生促生能力的评价是参考文献[21-22]中的方法,应用模糊数学中的隶属函数值法,对测定的各指标进行综合评价,隶属函数值计算公式如下:
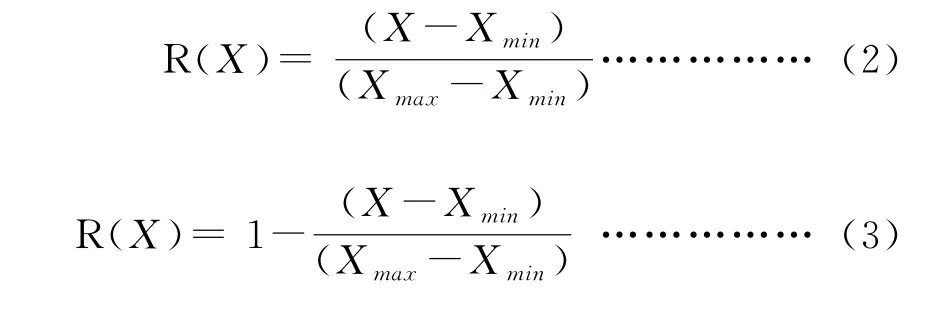
式中:X为测量不同处理组花生植株各指标的平均值,Xmin和Xmax分别为测量花生植株各指标的最小值和最大值。隶属函数值公式(2)适用于测量花生指标与促生能力呈正相关,否则适用公式(3)。将每个处理的7个指标隶属函数值相加,求平均值,隶属函数值的平均值越大,表明该处理对花生的促生能力越强[22]。
1.4 数据处理
利用Excel 2010 和SPSS 19 对所测试验数据进行单因素方差分析及显著性分析。
2 结果与分析
2.1 接种不同菌株对花生叶片叶绿素含量的影响
叶绿素含量与豆科植物光合作用和吸收养分紧密联系[23]。由图1可以看出,接菌处理的花生植株叶片的叶绿素含量均高于不接菌的叶绿素含量,且构成显著差异(P<0.05)。接菌处理的花生植株叶片SPAD 值在37.16~50.13 之间,以复合接种T6 处理的花生植株叶片SPAD 值最高,达50.13,是不接菌处理的1.77 倍,其次为T5、T4处理,分别是不接菌处理叶片SPAD 值的1.68、1.58倍。
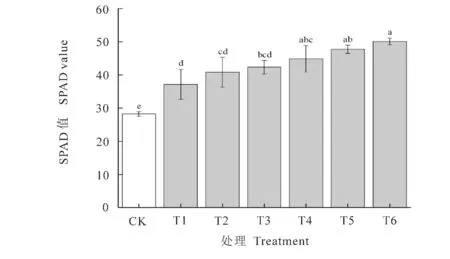
图1 接种不同菌株对花生叶片叶绿素含量的影响Fig.1 Inoculation of different strains on chlorophyll content of peanut leaves
2.2 接种不同菌株对花生植株生长特性的影响
2.2.1 对株高的影响
植株株高反映出在不同菌株处理条件下对花生植株生长的影响。由图2可以看出,接菌处理对花生植株的株高有不同程度的促进作用。与不接菌处理相比,所有接菌的花生株高增幅范围在5.03~11.60 cm 之间,差异显著(P<0.05)。其中,复合接种T6处理对花生植株株高生长的促进效果最佳,高达38.53 cm,较不接菌处理增加了43.06%。单接种T3 处理和复合接种T5 处理的植株株高次之,分别高于不接菌植株株高41.10%、39.85%,但三者差异不显著。
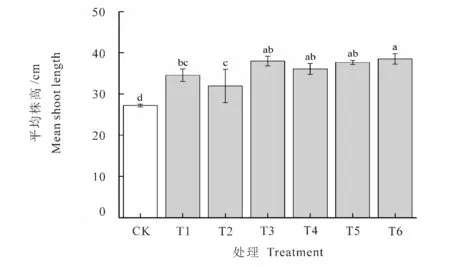
图2 接种不同菌株对花生植株株高的影响Fig.2 Inoculation of different strains on the height of peanut plant
2.2.2 对根长的影响
从图3看出,接种不同菌株处理对花生植株根长生长的影响差异显著(P<0.05)。所有接种菌株处理的花生植株根长都高于不接菌处理,增幅范围在15.10%~62.28%之间。其中,复合接种T6处理的花生植株根长最长,比不接菌处理的长62.28%,复合接种T5、T4处理次之。单接种T1处理对花生植株根长的生长促进效果不明显,仅比不接菌根长长1.6 cm,与单接种T2处理的根长无显著差异。
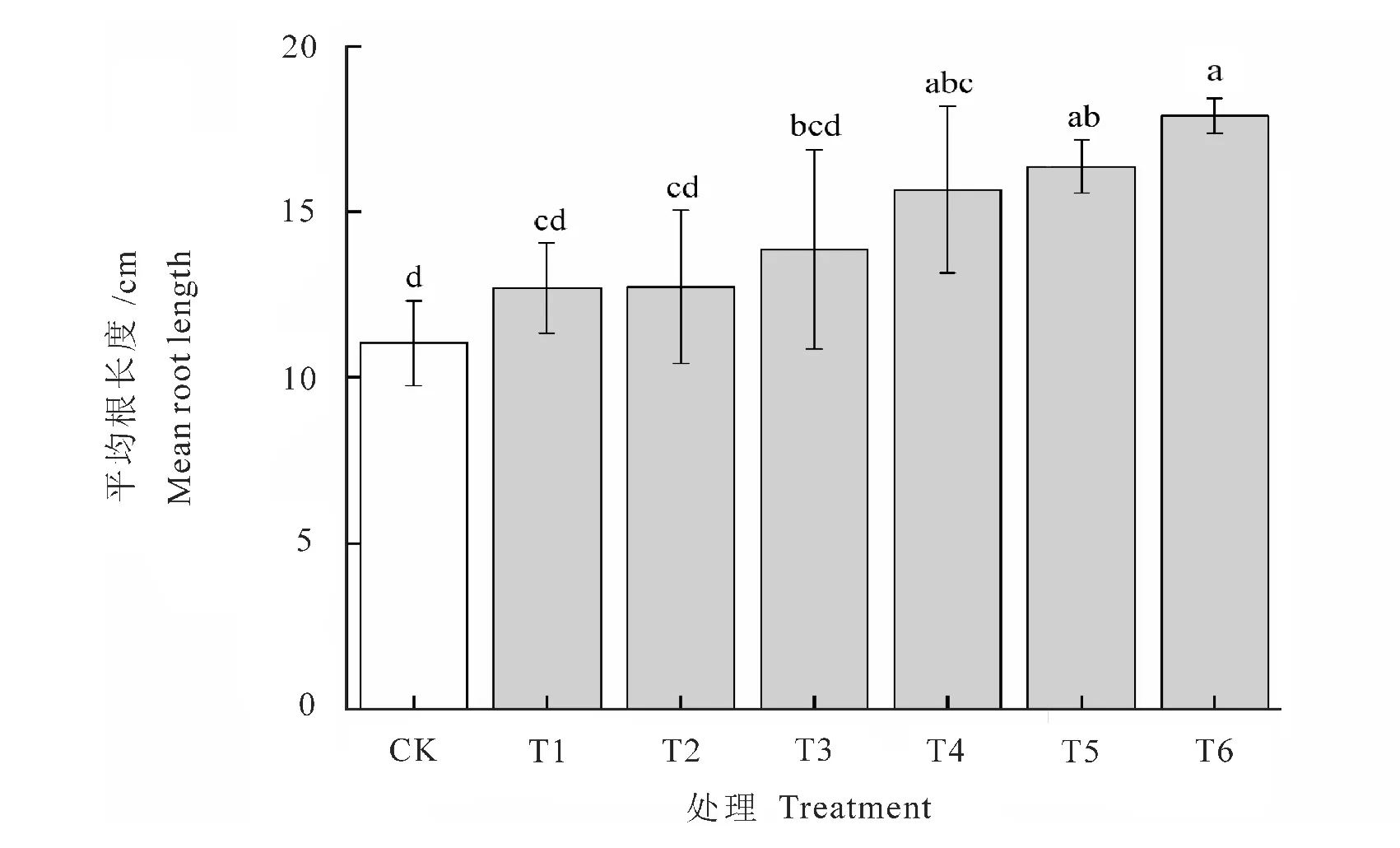
图3 接种不同菌株对花生植株根长的影响Fig.3 Inoculation of different strains on the root length of peanut plant
2.2.3 对生物量的影响
表2可知,接种菌株处理对花生植株生物量有较明显的促进作用,各处理花生地上部生物量、地下部生物量和根冠比之间差异显著(P<0.05)。与不接菌处理相比,所有接菌处理的花生植株地上部生物量明显增加,增幅为27.67%~92.99%。其中,复合接种T6处理植株地上部生物量最大,复合接种T5处理次之。所有接菌处理的花生植株地下部生物量比不接菌处理提高了57.54%~152.83%,其中地下部生物量增幅高于100%的处理组有复合接种T6、复合接种T4、单接种T3,以复合接种T6处理地下部生物量增幅最大。接种菌株处理的植株根冠比与不接菌处理相比提高了6.34%~49.20%,其中以单接种T1处理根冠比为最大,其次为单接种T3、复合接种T4 和单接种T2处理。

表2 接种不同菌株对花生植株生物量及根冠比的影响Table 2 Effect of inoculation with different strains on the biomass and root-shoot ratio of peanut plant
2.2.4 对结瘤的影响
评价植株结瘤效率的重要指标之一是单株结瘤数,结瘤数越多,花生固氮能力越强。图4可见,不接菌处理、单接种T1和单接种T2处理不能与花生形成结瘤,表明单接种芽孢杆菌和酵母菌不能与花生结瘤。单接种T3处理和复合接种T4、T5、T6处理均能与花生形成根瘤,且为粉红色、圆形的有效根瘤。花生单株结瘤数以T6处理最多,高达82个,这表明复合接种ZB15+1C-6+1-103能促进花生根部根瘤的形成,且效果优于其他处理。
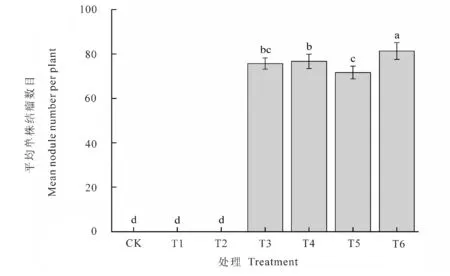
图4 接种不同菌株对花生植株结瘤数的影响Fig.4 Inoculation of different strains on the root nodule number of peanut plant
2.3 不同菌株处理对花生综合指数效应的隶属函数分析
隶属函数分析是将所测植株叶绿素含量和一些生长指标作为综合指标,以此来分析不同菌株处理对花生植株的促生能力影响的大小。综合评价值越大,其促生能力就越强。表3可知,复合接种T6处理的综合评价值最高,为0.561,其次为复合接种T4处理,单接种T3处理再次之。这表明了复合接种ZB15+1C-6+1-103处理对花生植株的生长具有良好的促生作用。
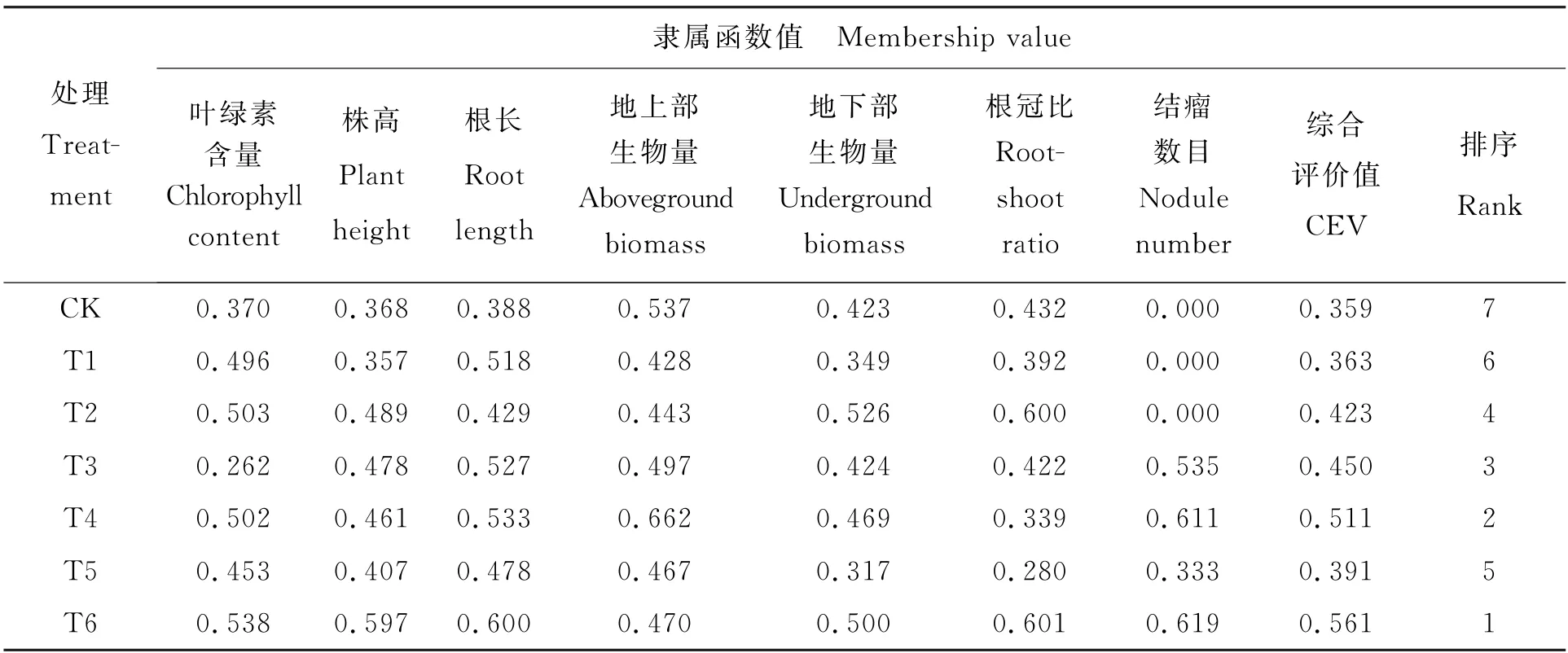
表3 花生植株的生长指标及叶绿素含量的平均隶属函数值Table 3 Average membership function value of growth indicators and chlorophyll content of peanut plant
3 讨论
微生物菌剂替代无机化肥,是顺应我国绿色农业发展的潮流,已成为我国农业可持续发展的迫切要求。施加微生物菌剂能促进花生生长,有助于花生根部根瘤的形成和共生固氮[3]。诸多研究表明,豆科植物的叶绿素含量与氮素、光合作用三者之间紧密相连,叶绿素含量的大小影响植株光合产物的形成与积累,从而影响作物产量[24]。施用复合菌剂能够显著增加大豆的叶绿素含量,Chl a/b比值低于单接种菌剂,意味着两种菌剂能够互利共生,改善土壤根际环境,提高土壤有机质含量,促进了根对氮素的吸收[25]。本研究表明,接种不同菌剂后提高了花生叶片的叶绿素含量,其中以根瘤菌ZB15、芽孢杆菌1C-6和酵母菌1-103三者复合接种处理花生的叶绿素含量最高,这与赵丹丹[26]研究发现在番茄生长过程中接种微生物菌剂后叶绿素含量升高,提升了光合作用的结果相似。本研究发现,与对照相比,复合接种T6处理的花生地上部生物量、地下部生物量、株高和根长分别提高了92.99%、150.83%、28.44%、62.28%,这与Atieno[27]和李想[13]分别在大豆、花生上的研究结果一致。接种单一菌株对豆科植物的作用效果明显弱于复合菌株组合接种,但目前复合菌剂对植物的作用机理还有待深入研究。
本研究表明,复合接种芽孢杆菌、根瘤菌、酵母菌对花生生长有一定的促进作用,各处理的促进效果排序为T6>T4>T5>T3>T1>T2,其中以复合接种ZB15+1C-6+1-103对花生植株生长的促进作用最优,该处理下花生结瘤数、根长、株高、生物量和叶绿素含量均为最高,表明复合菌种可以显著促进花生的生长。因此,筛选合适的复合微生物菌剂的菌种组合对绿色农业的发展十分重要,同时也为复合菌剂对河南主产区花生产量和品质的提升给予了一定的数据参考。
