花生转录因子Ahb HLH 18克隆与功能分析
2022-12-01赵小波闫彩霞李春娟党彦学孙全喜王奇邱俊兰单世华
赵小波闫彩霞李春娟党彦学孙全喜王 奇邱俊兰单世华*
(1.山东省花生研究所,山东 青岛 266100;2.临沂市农业科学院,山东 临沂 276003;3.威海市农业农村事务服务中心,山东 威海 264200)
花生(ArachishypogaeaL.)是世界四大油料作物之一,在100多个国家广泛种植,主要分布在亚洲、非洲和美洲地区。我国是世界花生生产大国,占世界花生总产的40%以上,居世界第一位[1]。2021年中央1号文件明确指出发展花生等油料作物。我国盐碱土面积占耕地总面积的6.2%,目前利用率仅20%左右[2]。通过培育耐盐品种,充分利用盐碱土地种植花生,扩大花生种植面积,是提高花生总产的重要途径之一。通过对花生种质耐盐性的评价研究表明,花生对盐胁迫具有一定的耐受性[3],目前花生耐盐基因利用方面的研究较少,通过分子生物学方法研究花生耐盐机制具有重要意义。
bHLH(basic Helix-Loop-Helix)转录因子家族广泛存在于真核生物,是植物最大的转录因子家族之一[4]。bHLH 结构域可分为碱性氨基酸区(10~15个氨基酸)和α-螺旋-环-α-螺旋区(HLH 区,40个氨基酸左右)[5]。越来越多的研究表明,该转录因子参与植物众多的生长发育过程。另外,大量的研究表明,bHLH 转录因子在植物逆境胁迫响应机制中发挥重要作用。拟南芥转录因子ICE1(Inducer of CBF expression1,bHLH 转录因子家族成员)通过结合CBF启动子调节下游相关基因表达,从而响应低温胁迫[6];AtbHLH92[7]、SlbHLH22[8]、bHLH122[9]等转录因子均通过ABA 通路调节以及提高抗氧化防护机制提高植株耐盐性。此外,bHLH 转录因子参与植物盐胁迫响应还有其他途径,例如ZmbHLH55通过提高抗坏血酸的生物合成提高植株耐盐性[10]。前期研究中,我们发现盐胁迫时,花生转录因子AhbHLH18是表达量显著提高的转录因子之一[11]。本研究验证了花生转录因子AhbHLH18的功能,并分析了其作用机制,为深入研究花生耐盐分子机制提供理论基础。
1 材料与方法
1.1 转录因子克隆
以耐盐花生品种花育6303为研究对象。加Hoagland氏培养液于28℃,湿度60%,光照强度500μmol/(m2·s)条件下培养。种子培养21 d后,于200 mmol/L NaCl溶液分别处理0、4、8、12、24 h后取根部组织,液氮冷冻后保存于-80℃冰箱以用于RNA 提取[12]。使用MiniBEST Universal RNA Extraction Kit试剂盒(TaKaRa,大连宝生物)提取根部RNA,并利用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa,大连宝生物)进行反转录,参考peanutbase(www.peanutbase.org)上的序列设计引物(表1)。反应程序为:94℃,5 min。随后30个循环设为:94℃,30 s;56℃,50 s;72℃,1 min。最后72℃,8 min。
1.2 目标转录因子表达分析
根据扩增得到的序列,用Beacon Designer 7.0设计荧光定量PCR特异引物(表1)。以盐胁迫处理后0、4、8、12、24 h的根部组织为样本,以0 h样本为对照,使用7500 FAST荧光定量PCR仪(ABI公司)分析AhbHLH18的相对表达情况。反应条件:95℃,10 s;95℃,5 s;60℃,30 s;72℃,10 s;40个循环。试验设置3 次重复。相对表达量的计算采用2-ΔΔCT方法[13],选择Actin 11作为内参基因[14],试验数据采用SPSS12.0 分析(SPSS Inc.,Chicago,USA)。
1.3 进化比较与生物信息学分析
AhbHLH18氨基酸序列与拟南芥基因组中已有序列信息[15]进行比对。然后利用Clustal W软件对测序数据进行人工对齐排序。选择Kimura2-parameter公式计算遗传距离。MEGA6.0中采用邻近法(Neighbor-Joining,NJ)构建系统树,自举值Bootstrap为1000次重复。DNAMAN软件对其氨基酸序列进行理化性质分析。
1.4 拟南芥遗传转化
提取耐盐品种花育6303总RNA,反转录成总cDNA。利用表1引物,以cDNA为模板,扩增花生AhbHLH18基因。反应程序为:94℃,5 min;随后30个循环为:94℃,1 min;57℃,50 s;72℃,50 s;最后72℃,10 min。用SacI和XbaI双酶切载体pCAMBIA2300,T4连接酶将酶切产物与扩增产物连接至DH5α感受态细胞,筛选阳性克隆,转化农杆菌GV3101,然后利用花序侵染法转化拟南芥[16]。

表1 研究所用引物Table 1 Primers used in this research
1.5 转基因拟南芥的筛选与鉴定
将收获的转AhbHLH18转录因子的拟南芥T0代种子,播种于含卡那霉素50μg/mL 的MS培养基上,4℃黑暗放置1~2 d后,转至光周期16 h/8 h(光照/黑暗)条件下培养1个月,提取其基因组DNA 与RNA,利用引物18-CDS-F、18-CDS-R 进行PCR与RT-PCR检测。对检测合格的株系保种繁殖,直至获得T3代植株。
1.6 转基因拟南芥耐盐性检测
野生型与转基因拟南芥种子放置于4℃黑暗条件下培养3 d,进行春化作用。随后,种子转移至光照培养箱中培养,培养条件设置为:昼夜节律16 h/8 h,温度22℃,光照强度200μmol/(m2·s),相对湿度65%。培养20 d 后,用400 mmol/L NaCl溶液进行盐胁迫处理10 d,检测野生型与转基因拟南芥盐胁迫下POD(过氧化物酶)、SOD(过氧化物歧化酶)、CAT(过氧化氢酶)活性和MDA(丙二醛)含量[17]。
2 结果与分析
2.1 目标转录因子序列与表达分析
测序结果表明,AhbHLH18 转录因子的编码区(coding sequence,CDS)为585 bp,共编码194个氨基酸,与栽培花生基因组(www.peanutbase.org)中的arahy.5IZP5X 序列一致。该基因位于栽培花生第18号染色体,长度为1 501 bp。编码氨基酸中丝氨酸、亮氨酸、赖氨酸含量居前三位,分别为26、22和21个,占比分别为11.16%、9.44%和9.01%。AhbHLH18蛋白的分子量为26.147 k D,等电点为10.27,图1为其二级结构。进化分析显示AhbHLH18蛋白质与拟南芥同源基因AtbHLH18 蛋白(At2g22750)聚成一支。按照Toledo-Oritiz[15]的分类模式,AtbHLH18蛋白属于14 亚家族,因此AhbHLH18 也属于bHLH 家族14亚家族 (图2)。

图1 AhbHLH18氨基酸序列二级结构Fig.1 Secondary structure of AhbHLH18 amino acids

图2 基于拟南芥基因组的AhbHLH18系统进化树Fig.2 Phylogenetic analyses of AhbHLH18 protein based on bHLH domains from A rabidopsis thaliana
盐胁迫处理后,AhbHLH18转录因子的表达有明显变化(图3)。12 h内,AhbHLH18转录因子的相对表达量处于上升阶段,12 h后趋于稳定。相比0 h,6 h的相对表达量为显著差异(P<0.05),12~48 h的表达量为极显著差异(P<0.01)。

图3 Ahb HLH 18盐胁迫处理后表达模式Fig.3 Expression of Ahb HLH 18 under salt stress
2.2 植物表达载体pCAMBIA2300-AhbHLH18的构建与转基因植株的筛选与鉴定
用SacI和XbaI双酶切载体pCAMBIA2300和PCR扩增产物,T4 连接酶连接,构建了植物超表达载体。利用基因特异引物进行PCR 检测,在转基因拟南芥株系(T3-1与T3-2)中可以扩增到约700 bp的条带,而在野生型拟南芥株系中未见对应条带(图4)。RT-PCR 检测进一步表明,AhbHLH18 在转基因拟南芥中已成功表达 (图5)。
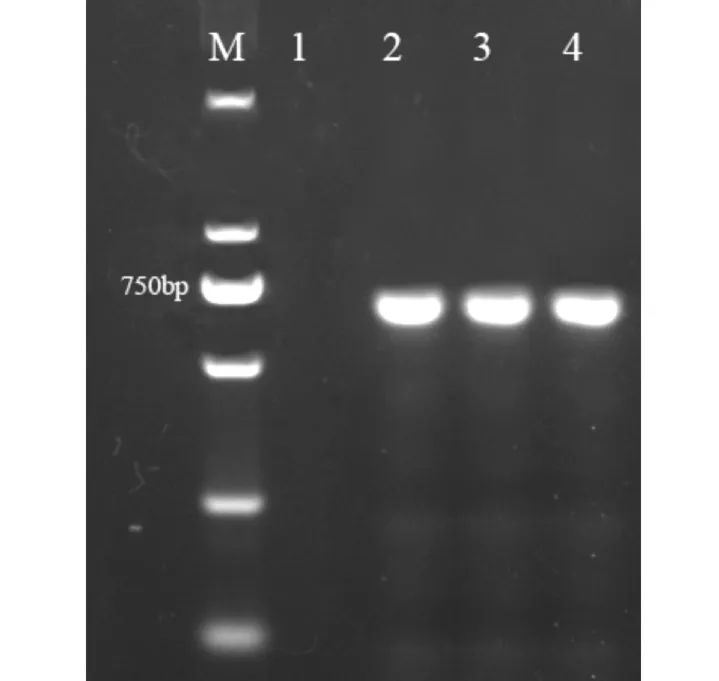
图4 转基因拟南芥的PCR 检测Fig.4 Detection of transgenic lines A rabidopsis thaliana by PCR
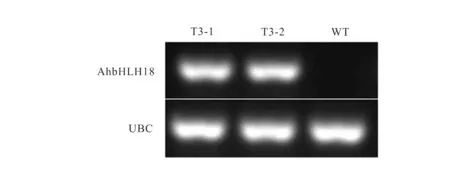
图5 转基因与野生型(WT)拟南芥RT-PCR 检测Fig.5 The transcript level of AhbHLH18 overexpression in transgenic Arabidopsis and wild type(WT)plants assayed by RT-PCR
2.3 转基因拟南芥耐盐性检测
正常条件下,野生型与转基因拟南芥表型无差异。盐胁迫处理10 d后野生型拟南芥表现出更加明显的萎蔫状态(图6)。正常条件下,野生型与转基因拟南芥中的抗氧化酶、MDA 含量无显著差异。盐胁迫处理后,转基因拟南芥各类抗氧化酶如SOD、POD 和CAT 活性显著高于野生型,野生型拟南芥的MDA 含量则显著高于转基因拟南芥(图7)。试验数据表明,抗氧化酶活性的增长在AhbHLH18基因应答盐胁迫时发挥重要作用。花生AhbHLH18基因可调节植物体内抗氧化酶系统以应答盐胁迫环境。

图6 盐处理转基因与野生型拟南芥Fig.6 Salt-treatment assay of wild type and transgenic Arabidopsis plants

图7 不同条件野生型拟南芥与转基因拟南芥的生理指标变化Fig.7 The change of physiological indexes of the wild type and transgenic Arabidopsis plants under normal and salt stress condition
3 讨论与结论
bHLH 转录因子家族被认为广泛参与了植物非生物胁迫应答活动,包括干旱胁迫[18-19]、盐胁迫[22-21]以及低温胁迫[22-23]。但在花生中,相关研究仍然缺乏。本研究克隆了花生bHLH 转录因子AhbHLH18。进化分析显示,AhbHLH18 蛋白质与拟南芥AtbHLH18(At2g22750)具有较近的亲缘关系,属于bHLH 家族14亚族。柑橘CsbHLH18 被认为由低温所诱导,过表达CsbHLH18显著提高了柑橘的耐冷性,沉默CsbHLH18则显著降低了柑橘的耐冷性[24]。通过植物超表达载体构建,将花生AhbHLH18 基因转入拟南芥中,盐胁迫试验结果显示,过表达该基因可提高植株耐盐性。进一步分析,转基因拟南芥盐胁迫处理后,一些抗氧化酶,如POD、SOD 和CAT 活性显著高于野生型拟南芥,同时MDA含量显著低于野生型拟南芥。结果显示,AhbHLH18可通过调节过氧化物酶系统以降低植株的活性氧(reactive oxygen species,ROS)活性,从而提高植株的耐盐性。ROS能够破坏植物细胞元件,植物的抗逆性很大程度上取决于ROS的产生与消除之间的平衡[25]。研究表明,大量的基因可通过调节抗氧化酶的活性从而提高植株的抗逆性。Magwanga等发现,拟南芥中超表达CYP450基因,可以提高转基因植株的抗旱性和耐盐性,转基因植株抗氧化酶活性显著高于野生型拟南芥[26];通过提高过氧化酶活性,转录因子NtERF172能够提高烟草抗旱性[27]。除过氧化酶系统外,bHLH 转录因子家族成员也可以通过其他方式影响植株的耐盐性。AtMYC2 可调节Na+/H+转运蛋白NHX 的表达,提高拟南芥耐盐性[28];水稻bHLH 转录因子OrbHLH001 通过调节OsAKT1基因的表达以保持植株钾离子平衡,从而提高植株的耐盐性[29]。
现有研究表明,转录因子调控植物分子抗逆机制是一个极其复杂的动态网络,其中包括整合以及协同竞争作用。下一步的工作应该是在这个动态网络中,明确不同bHLH 转录因子家族成员的精准角色,从而为通过基因工程手段充分利用转录因子提高植物的抗逆性发挥更大作用。
