低温胁迫对不同含水量花生种子萌发幼苗干物质量及功能叶片内源激素含量的影响
2022-12-01霍俊豪李峰刘璇韩猛邹晓霞
霍俊豪李 峰刘 璇韩 猛邹晓霞*
(1.青岛农业大学农学院/山东省旱作农业技术重点实验室,山东 青岛 266109;2.枣庄市市中区农业农村局,山东 枣庄 277100)
花生是重要的油料作物和经济作物,中国是世界最大的花生生产国和消费国[1],大力发展花生产业对加快我国农业结构调整、推进农业可持续发展具有重要作用和积极的战略意义[2]。
温度是花生种子萌发的必要条件,研究表明14~23℃范围内日均气温每升高1℃,出苗时间缩短约1.5 d[3],日均温度升至25℃左右时,花生株高显著增加[4]。花生种子不仅在贮藏和播种过程中可能会受到低温冷害,在我国东北地区,花生如未能及时收获或遇初霜期提前,很容易发生冻害,也会导致花生种子发芽率大幅降低甚至丧失萌发能力[5-7]。陶群等[8]研究发现,种子经低温处理后能降低花生幼苗主、侧根长度和侧根数量,降低根系活力。史普想等[9]观察到,花生种子含水量为5%时,经-20℃低温贮藏后,种子活力下降不明显,对出苗率的影响较小;但种子含水量为10%时,活力明显降低,出苗率仅为70.0%;种子含水量为15%时则完全丧失发芽能力。
植物对逆境信号的响应是一个极其复杂的过程,而内源激素水平的变化是植物逆境响应的重要信号因子。生长素(IAA)最基本的生理作用是促进生长,但对不同器官生长的促进作用因浓度而异[10],于运华等[11]发现,受低温胁迫时,冬小麦根系中生长素(IAA)含量会提高,利于解决根系生长的胁迫以恢复正常功能;赤霉素(GA3)能促进种子萌发和植物生长发育,在植物响应非生物胁迫过程中同样发挥着重要作用[12]。刘瑜霞[13]研究发现,在桢楠种子萌发过程可通过调控GA3水平来响应温度的变化,提高种子发芽率。脱落酸(ABA)具有协调作物体内代谢的能力,可促进碳水化合物向库的运输,对提高农作物的产量和品质具有重要作用[14]。张东琴等[15]研究发现,低温对内源ABA 的形成和积累有抑制作用,可减缓黄瓜子房发育的进程。李雪苗[16]研究大叶黄杨的抗寒性时发现,IAA 能够抵御一定程度的寒冷环境,但随着温度的降低,IAA 增强抗寒的效果减弱。玉米素核苷(ZR)是植株体内主要的并可在木质部中转运的细胞分裂素[17],研究发现,在根部受到低温胁迫和生长延缓剂共同作用下,ZR 含量有明显提高[18]。综上可见,低温胁迫可引起多种植物内源激素水平发生变化,尽管作用机制不同,但激素水平的变化并不是孤立单一的,而是彼此相互作用、相互影响。如罗宁[19]观察到玉米受低温胁迫时,ABA 显著高于对照,IAA 变化不显著,GA3减少;王晓娇等[20]研究发现,受水分胁迫时,IAA 含量逐渐降低,ABA 含量升高,IAA/ABA 降低;胡朝晖等[21]研究表明,水分胁迫下,花生幼苗GA3含量先升后降,出现两个高峰值,ABA 含量则逐渐升高,IAA 和ZR先降低后升高,随着胁迫时间的延长,叶片中ABA/IAA 先升后降,ABA/ZR 则逐渐升高。
前人对低温胁迫下花生种子生活力、幼苗形态变化、根系活力、叶绿素含量及部分生理特性展开了研究[22-23],但不同含水量花生种子受低温胁迫后,幼苗生长特性和内源激素含量变化并不明确。因此,本研究以青花7号花生品种为供试材料,以自然风干未受低温胁迫处理种子为对照,研究了不同含水量种子经低温胁迫后其萌发幼苗干物质积累和功能叶片的内源激素含量变化,明确了低温胁迫对不同含水量花生种子品质的影响,以期为花生种植生产提供有效保障。
1 材料与方法
1.1 供试材料
试验于2019-2020年在青岛农业大学可控温湿培养室进行,供试花生品种为青花7号,供试土壤为营养土与蛭石混合的培养基质(营养土∶蛭石=7∶3),试验培养装置规格为直径10 cm,高15 cm 的花盆。
1.2 试验设计
将成熟饱满花生荚果设(36±1)%、(43±1)%两个含水量(其中(43±1)%含水量为收获后未晾晒,(36±1)%含水量为收获后晾晒1 d),分别置于2℃和-1℃下处理12 h,然后自然风干,组合为4 个处理,以自然风干成熟饱满荚果为对照(CK),共计5个处理:CK,自然风干荚果,未受低温胁迫;T1,含水量(36±1)%,2℃低温处理;T2,含水量(36±1)%,-1℃低温处理;T3,含水量(43±1)%,2℃低温处理;T4,含水量(43±1)%,-1℃低温处理。将浸种后的种子播于花盆中,每组处理25盆(每盆1粒),置于培养室内培养,温度设置为25℃,期间每日保持12 h黑暗,12 h光照,空气相对湿度稳定为75%。
1.3 测定指标与方法
出苗后10 d开始取样,之后每4 d取样一次,共取样5次,每次每处理取样3盆。取样后,取植株倒三叶于自封袋中,置于-80℃冰箱保存,用于测定内源激素,采用酶联免疫吸附测定法(ELISA)[24]。将植株分为地上和地下两部分,于烘箱中105℃杀青30 min,然后75℃烘干到恒质量,冷却至室温,分别测定两部分干物质量。
1.4 数据处理
试验结果利用Excel 2019 进行数据处理和绘图,利用DPS统计软件进行数据分析。
2 结果与分析
2.1 低温胁迫对不同含水量种子萌发植株干物质量的影响
2.1.1 地上部干物质积累
图1结果显示,花生地上部干物质量随植株生育进程呈现逐渐升高的趋势,出苗后10~18 d生长较为缓慢,18~22 d增长速率达到最大,最后一次取样时(出苗后26 d)地上部干物质量达最大值。出苗后22~26 d,T1和T2处理地上部干物质量均显著高于对照,T3处理显著低于对照,T4与对照差异不显著,出苗后26 d取样时,相较于对照,T1、T2地上部干物质量分别增加24.38%、35.88%,T3处理降低18.23%。就生育期内地上部干物质量的总体趋势而言:含水量36%(T1、T2)的种子萌发植株地上部干物质量总体高于含水量43%(T3、T4)的种子,并且在相同含水量下,处理均以-1℃处理(T2、T4)干物质量最高。
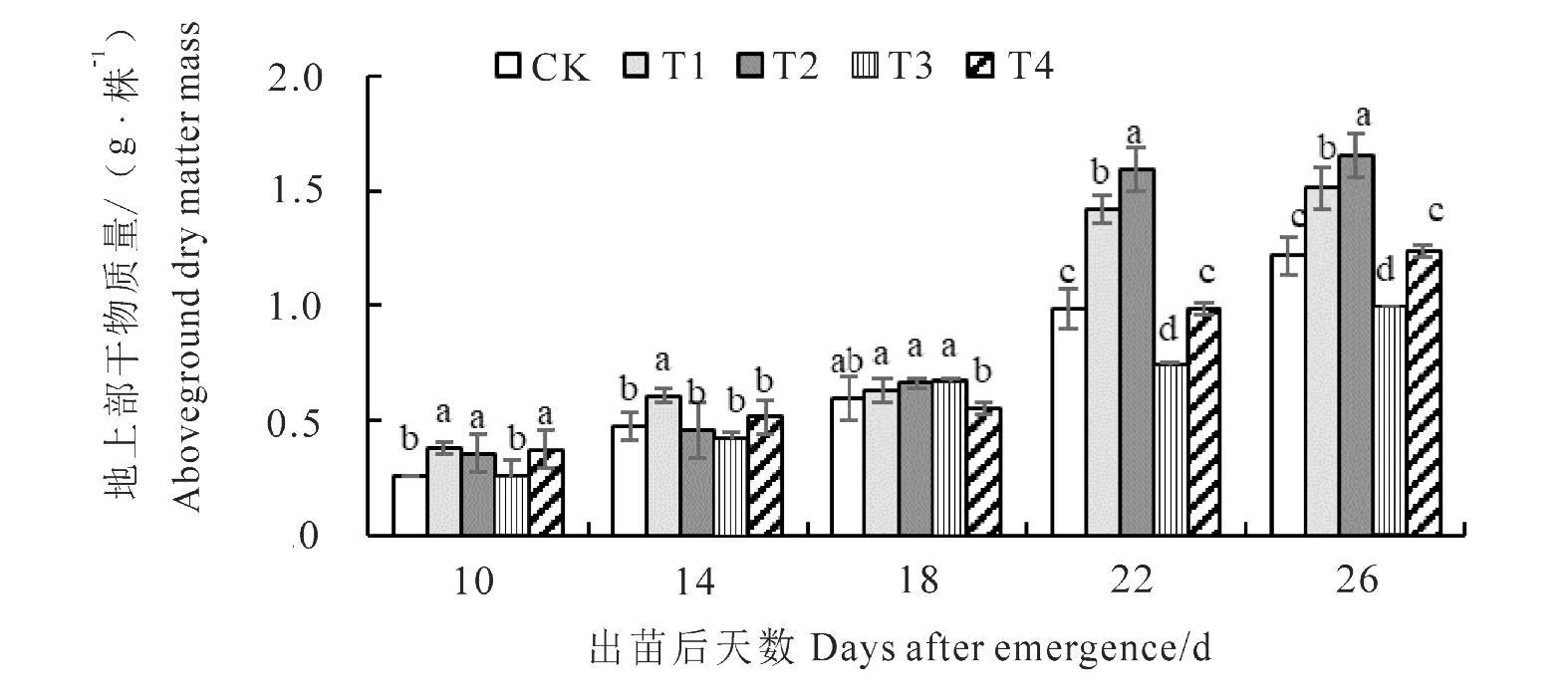
图1 不同处理对花生地上部干物质量的影响Fig.1 Effect of different treatments on aboveground dry matter mass of peanut
2.1.2 地下部干物质积累
图2显示,花生地下部干物质量随生育时期逐渐增加,10~14 d增长速率最大,出苗后26 d达到最大值。出苗后22~26 d,各低温处理地下部干物质量均显著高于对照,出苗后26 d 取样时,相较于对照,T1、T2、T3、T4地下部干物质量分别增加63.39%、85.43%、15.35%和20.87%。地下部干物质量的总体积累趋势与地上部干物质量积累趋势相似:含水量36%(T1、T2)的种子萌发植株地下部干物质量总体高于含水量43%(T3、T4)的种子,并且在相同含水量种子处理下,均以-1℃处理(T2、T4)地下部干物质量最高。
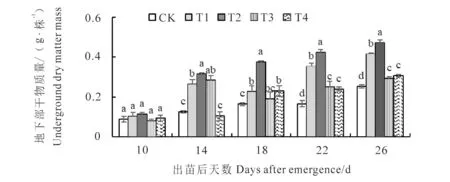
图2 不同处理对花生地下部干物质量的影响Fig.2 Effect of different treatments on underground dry matter mass of peanut
2.2 低温胁迫对不同含水量花生种子萌发植株叶片内源激素的影响
2.2.1 玉米素核苷(ZR)
表1可见,在培养周期内,各处理花生功能叶片ZR含量均呈上升趋势,其中T2、T4处理变化趋势相似,在出苗后18 d达最大值;CK、T3处理变化趋势相似,在出苗后26 d达最大值。出苗后18 d采样时,T1处理功能叶片ZR含量最高,较CK、T3和T2处理分别高出3.54%、16.45%和14.76%;第26 d采样时,CK 处理功能叶片ZR 含量最高,此时T3、T2、T1和T4处理的功能叶片ZR含量分别比CK 低2.50%、12.46%、13.30%和15.62%。由此表明,低温胁迫和含水量处理种子对其萌发植株功能叶片ZR 含量均有影响:出苗后10~18 d,温度和含水量越低的处理,功能叶片ZR 含量越高,出苗后18~22 d,低温胁迫越轻、含水量越低的处理,功能叶片ZR 含量越高。
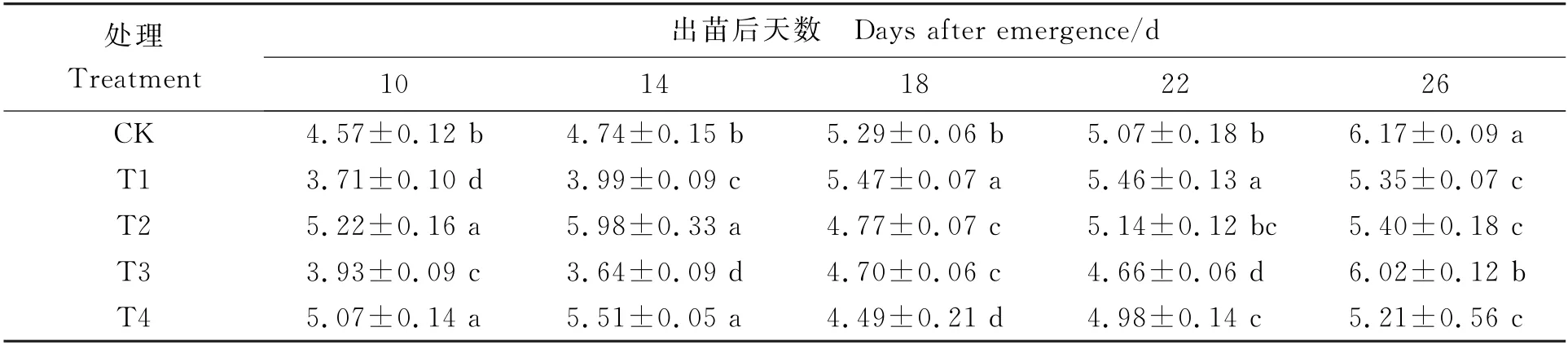
表1 不同处理下各取样时期花生功能叶片ZR 含量 (ng·g-1)Table 1 ZR content of functional leaves at different sampling time under different treatments
2.2.2 生长素(IAA)
随着处理种子萌发幼苗的生长,花生功能叶片IAA 含量在T1、T3和CK 处理下均呈逐渐下降趋势;T2、T4处理均呈现先上升后下降的变化趋势。出苗后第10 d采样时,2℃处理(T1、T3)种子萌发幼苗功能叶片IAA 含量明显高于CK和-1℃处理(T2、T4),此时,T1 比T2、CK 分别高出49.02%、39.00%,T3比T4、CK 分别高出41.39%、14.91%,表明种子含水量相同时,温度越低,种子萌发幼苗功能叶片IAA 含量越高;出苗后第26 d采样时,-1℃处理(T2、T4)IAA 含量明显高于2℃处理(T1、T3)和CK 处理,在相同含水量43%情况下,-1℃处理的T4比2℃处理的T3和CK 分别高出51.23%和70.30%。以上结果表明,胁迫温度和含水量越低,IAA 含量越高 (表2)。

表2 不同处理下各取样时期花生功能叶片IAA 含量 (ng·g-1)Table 2 IAA content of functional leaves at different sampling time under different treatments
2.2.3 赤霉素(GA3)
研究发现,T2、T4处理下花生功能叶片GA3含量呈现高—低—高的动态变化,均在出苗后18 d降到最低值;T1、T3处理呈现先降低后升高的变化趋势,分别在出苗后的26 d、22 d达到最大值。出苗后14 d采样时,-1℃处理(T2、T4)的GA3含量显著高于T1、T3和CK,T2比T1和CK 分别高出82.93%、45.78%,T4比T3和CK 分别高出99.84%、51.47%;出苗后22 d采样时,T4比T3和CK 分别高出36.21%和13.54%,T2较T1高0.95%;出苗后26 d采样时,36%含水量处理(T1、T2)GA3含量显著高于CK 和43%含水量处理(T3、T4),T2 处理比T4、CK 分别高出50.15%、52.91%,T1 处理比T3、CK 分别高出32.29%、46.93%。综上可见,出苗后10~22 d,GA3的变化趋势与种子受胁迫温度有一定相关性,胁迫温度越低,GA3含量越高 (表3)。
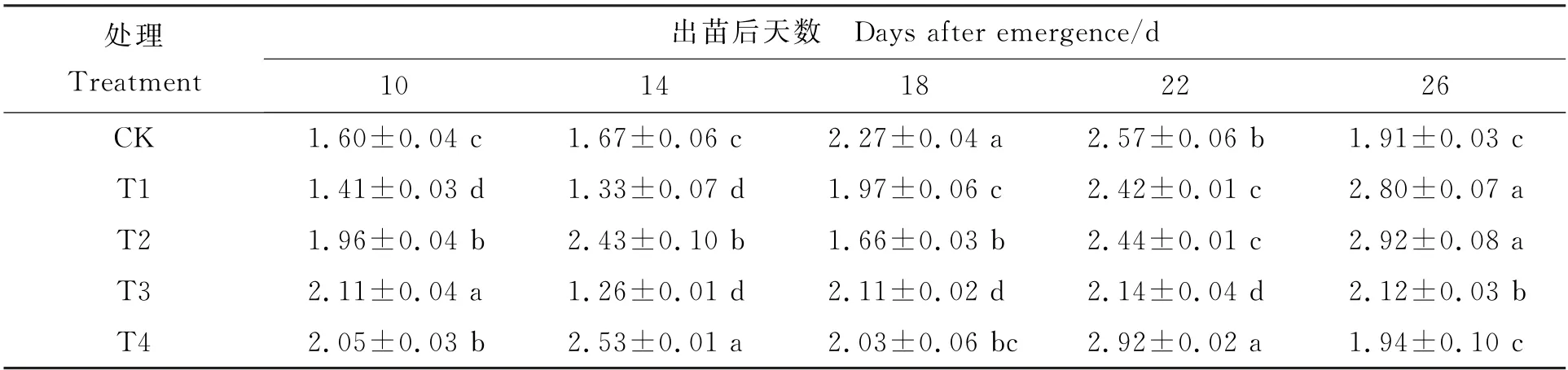
表3 不同处理下各取样时期花生功能叶片GA3含量 (ng·g-1)Table 3 GA3 content of functional leaves at different sampling time under different treatments
2.2.4 脱落酸(ABA)
表4可看出,在培养周期内,CK 和T3处理种子萌发花生幼苗功能叶片ABA 含量变化趋势相近,均在出苗后26 d时达最大值;T2和T4处理趋势相近,T1呈先高后低趋势,在出苗后18 d达到最大值。出苗后18 d采样时,各处理间均存在显著差异,除T1处理外,其余处理均低于CK,由高至低依次为T1>CK>T3>T4>T2,表明在含水量相同时,胁迫温度越低叶片ABA 含量越低;出苗后26 d采样时,T2和T3处理叶片ABA含量显著高于CK,T1和T4处理显著低于CK,此时T2和T3 处理较CK 分别提升10.25%和12.63%,在36%含水量情况下,温度越低叶片ABA 含量越高,在43%含水量情况下,随温度的降低,叶片ABA 含量逐渐降低。
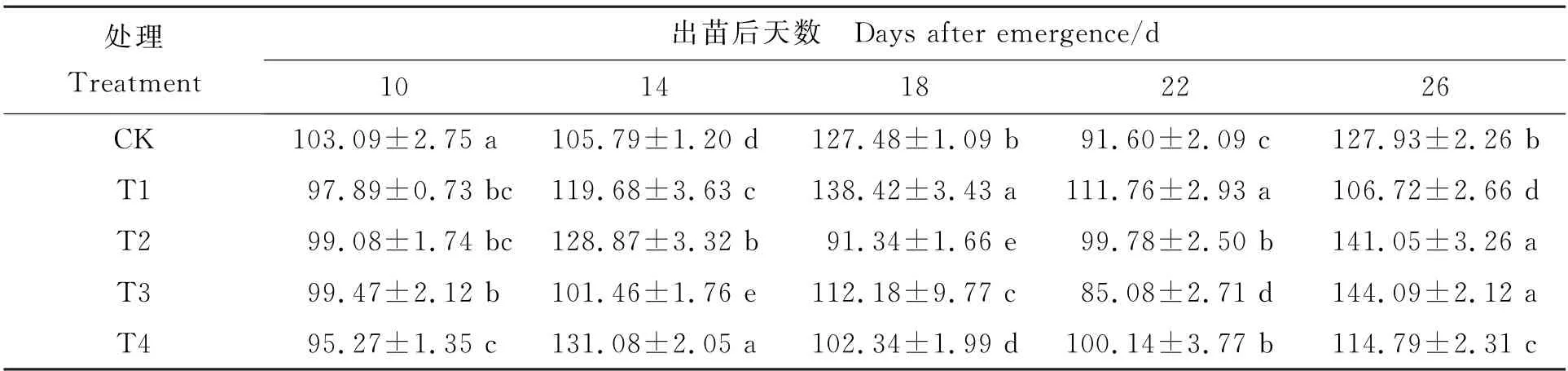
表4 不同处理种子萌发幼苗各取样时期花生功能叶片ABA 含量 (ng·g-1)Table 4 ABA content of functional leaves at different sampling time under different treatments
2.3 内源激素变化影响因素分析
取样时间、取样时间×种子胁迫温度及取样时间×种子含水量的交互作用,对种子萌发幼苗功能叶片4种内源激素含量均有极显著影响。除GA3外,种子含水量对叶片ZR、IAA、ABA 含量均有极显著影响,种子胁迫温度对叶片ZR、IAA、GA3含量有极显著影响,对叶片ABA含量有显著影响,种子含水量与胁迫温度的交互作用对叶片GA3含量影响不显著,对ABA 和ZR、IAA 含量分别呈显著和极显著影响。取样时期、种子含水量和胁迫温度三者的交互作用对叶片ZR 含量无显著影响,对叶片IAA、GA3、ABA 含量均呈极显著影响。可见,取样时间可能对判断种子胁迫温度和含水量对萌发幼苗功能叶片内源激素含量的影响有一定干扰,具体还需进一步研究验证 (表5)。

表5 种子胁迫温度、含水量及幼苗取样时期对花生叶片内源激素含量的影响Table 5 Effects of stress temperature and water content of seeds and sampling period on endogenous hormone content in peanut leaves
3 讨论
种子含水量会影响其对低温胁迫的耐受性[25]。干物质量是指示作物生长状况的基本特征,而种子受到低温胁迫后会导致萌发幼芽生长减缓,植株干物质量下降[26],林煜春[25]研究发现花生种子经过低温处理后含水量高的种子生活力、出苗率及其发育植株的高度、叶绿素含量均下降。本研究也发现低温胁迫(-1℃、2℃)后,含水量36%的花生种子发育植株苗期干物质积累总量明显高于含水量43%的花生种子,这表明花生种子遭遇一定范围的低温胁迫后,含水量越高,受害越明显,原因可能是由于种子含水量越高,脂肪酶和其他酶活性增强,呼吸作用加强[26],抗性降低,不利于抵御低温胁迫。
低温条件下,作物生长活力下降,为保证作物的生长,主要通过调控作物体内的内源激素含量调节植株的生理反应[27]。马学才等[28]发现随低温处理时间的延长,ABA/IAA、ABA/GA3 的比值升高,通过增加ABA 的合成,同时适当减少IAA、GA3的合成来抵御低温;赵彩霞[29]发现油菜可以通过积累ABA含量缓解低温受到的胁迫;王兴[30]研究发现小麦抗寒性强的品种IAA 含量高于抗寒性差的品种;田小霞等[31]在对薰衣草的研究中发现低温影响植株体内GA3合成导致其含量降低,进而使植株生长速率减慢以适应低温胁迫;闫世江[32]研究表明低温胁迫的黄瓜种子萌发后叶片中内源激素(ABA、IAA、GA3)含量都较对照增幅显著。在本研究中也发现相较于含水量,内源激素变化与低温胁迫的相关性更强,并且随低温胁迫程度的增加,植物体的内源激素含量也逐渐增加。
探究不同含水量花生种子受低温胁迫后萌发幼苗的生长和功能叶片中内源激素含量变化,对深刻理解低温胁迫对花生种子活力的影响有积极意义。但本研究也发现,取样时间、取样时间×温度及取样时间×含水量的交互作用,对内源激素含量均有极显著影响,表明在花生幼苗生长阶段内源激素含量随着植株生长变异较大。王宝卿[33]研究也发现甘薯苗期内源激素含量在时间上存在显著差异,因此,取样时期可能会干扰对含水量和低温胁迫影响的判断,具体还需开展进一步的研究验证。
4 结论
花生种子含水量对受低温胁迫后萌发幼苗的干物质积累量有显著影响,呈种子含水量越高,受低温胁迫后萌发幼苗的干物质积累量越低的趋势;种子受低温胁迫后萌发幼苗的功能叶片内源激素变化与低温和含水量均有一定相关性,但受低温胁迫的影响更显著,因此,生产上应避免种子受到低温胁迫危害,同时在花生种子贮藏期间应尽量降低其含水量。
