花生芽白藜芦醇超声-微波协同提取及其抗氧化活性研究
2022-12-01王娜宁灿灿赵楠雨李娜李军伟郑玉茹赵峥余秋颖
王娜 宁灿灿 赵楠雨李娜李军伟郑玉茹赵峥余秋颖*
(1.河南农业大学食品科学技术学院,河南 郑州 450002;2.郑州市营养与健康食品重点实验室,河南 郑州 450002;3.农业农村部大宗粮食加工重点实验室,河南 郑州 450002)
花生芽是花生萌发后生成的一种食疗兼备的食品,也叫长寿芽。其营养丰富,口感清脆,深受消费者的青睐[1]。经研究发现,花生在发芽过程中蛋白质降解为肽和氨基酸,脂肪含量迅速降低,其生物利用率显著增加,特别是具有重要生物活性功能的多酚类物质白藜芦醇含量迅速增加[2]。
白藜芦醇最初是由日本学者Takaoka 于1940年在毛叶藜芦中所发现的,从此为世人所知[3]。1963年,在我国中药材虎杖中首次发现了白藜芦醇[4]。白藜芦醇是一种多酚类物质,易溶于乙酸乙酯、乙醇、丙酮等有机溶剂,难溶于水[5],具有抗氧化、清除自由基、消除炎症、调控血糖、抗衰老、抗癌、抗肿瘤、保护心脑血管等作用[6-13]。近年来,白藜芦醇已逐渐被人们接受,其应用已扩展到食品、保健品、化妆品等领域[14]。白藜芦醇提取方法众多,常用的有酶水解法、乙醇提取法、超声提取法、微波提取法、碱提酸沉法等,但超声-微波协同提取白藜芦醇的研究报道较少。本研究采用超声-微波协同提取花生芽白藜芦醇,通过PB试验设计和响应面试验优化白藜芦醇提取工艺,同时对其进行体外抗氧化活性评价,以期为花生芽的综合开发提供新的思路,增加花生产业的附加值,为白藜芦醇的工业化生产提供新的来源和技术支持。
1 材料与方法
1.1 试验原料与仪器
试验室自制培养花生芽;阿卡波糖、反式白藜芦醇分析对照品(纯度≥98.0%,北京索莱宝科技有限公司);无水乙醇、乙酸乙酯、甲醇、石油醚(30~60℃)、DPPH、VC、30%双氧水、硫酸亚铁、水杨酸、浓盐酸、碳酸钠(分析纯,国药集团化学试剂公司);α-葡萄糖苷酶(50 U/mg)、对硝基苯基-α-D-吡喃葡萄糖苷(PNPG)(上海源叶生物科技有限公司)。
FA1204型电子天平(宁波市鄞州华丰电子仪器厂);RE-52AA 旋转蒸发仪(上海亚荣生化仪器厂);UV2000紫外分光光度计(尤尼柯仪器公司);超声波微波萃取仪(宁波新芝生物有限公司);双列四孔电热恒温水浴锅(上海树立仪器有限公司);高速多功能粉碎机(永康市铂欧五金制品有限公司)。
1.2 试验方法
1.2.1 白藜芦醇标准曲线的制作
参照周焕霞等的标准曲线制作方法并略作修改[15-19]。以吸光度对白藜芦醇浓度做标准曲线。
1.2.2 培养天数对花生芽白藜芦醇含量的影响
选取颗粒饱满、无霉变的花生种子,将其浸泡于25~30℃温水中8~12 h,待充分吸水膨胀后移至恒温恒湿培养箱(温度26℃、湿度60%左右),避光催芽,每天淋水2~3次,待芽长至约5 cm 时,移至育苗盆继续培养,根据发芽时间每天取样100 g,冻干磨粉备用。
1.2.3 不同提取方法对白藜芦醇提取含量的影响
溶剂提取法:参照汪海峰等[20]。碱提酸沉法:参照尚天翠等[21]。超声提取法:参照初丽君等[22]。微波提取法:参照缪文玉等[23]。超声+微波提取法:参照马密霞等[24]。
1.2.4 单因素试验设计
称量1.0 g花生芽干粉,提取工艺同1.2.3,研究超声功率、超声时间、微波功率、微波时间、料液比、乙醇浓度6个因素对白藜芦醇提取含量的影响。
1.2.5 Plackett-Burman试验设计
利用Plackett-Burman 试验设计筛选出对响应值影响较大的因素[25]。在单因素试验的基础上,筛选乙醇浓度、料液比、超声时间、超声功率、微波时间、微波功率6个因素对白藜芦醇提取含量的影响,每个因素设为高(1)、低(-1)两个水平,试验因素及水平见表1。

表1 Plackett-Burman 试验设计因素及水平表Table 1 Factors and levels of Plackett-Burman test design
1.2.6 响应面试验设计
根据Plackett-Burman 试验的筛选结果,选择对白藜芦醇提取影响具显著性的因素,根据Box-Benhnken中心组合试验设计原理,对花生芽白藜芦醇的超声-微波协同提取工艺进行优化,以获得最佳提取工艺。
1.2.7 白藜芦醇抗氧化活性测定
①白藜芦醇对DPPH自由基清除能力的影响。参照乔晓月等的方法并略作修改[26]。

式中:A1-样品、DPPH;A2-样品、无水乙醇;A0-DPPH、无水乙醇。
②白藜芦醇对ABTS自由基清除能力的影响。参照张宽朝等的方法并略作修改[27]。
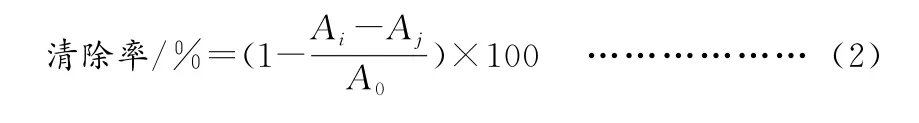
式中:Ai-样品、ABTS;Aj-样品、无水乙醇;A0-无水乙醇、ABTS。
③白藜芦醇对α-葡萄糖苷酶活力的影响。参照赵姝婷等的方法并略作修改[28]。
固定酶浓度0.2 U/mL,PNPG为5.0 mmoL/L,用0.1 moL/L(p H6.8)磷酸盐缓冲液溶解。96孔板中加入60μL不同浓度样品溶液,同时加入50μL PNPG,37℃恒温震荡15 min,取出后加入50μL α-葡萄糖苷酶,37℃恒温震荡20 min,最后加入50μL 0.2 mo L/L碳酸钠溶液终止反应,酶标仪测定405 nm 波长吸光度。
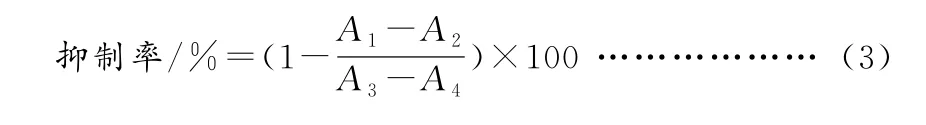
式中:A1-样品、α-葡萄糖苷酶、PNPG、碳酸钠;A2-样品、磷酸缓冲液、PNPG、碳酸钠;A3-磷酸缓冲液、α-葡萄糖苷酶、PNPG、碳酸钠;A4-磷酸缓冲液、PNPG、碳酸钠。
1.3 数据处理
采用Excel 2019 对单因素试验数据进行处理,使用SPSS对单因素进行P<0.05水平显著性分析。运用Design-Expert 12.0中的Plackett-Burman试验设计和Box-Behnken 中心试验设计,试验结果进行分析并作图。
2 结果与分析
2.1 花生发芽天数对白藜芦醇含量的影响
由图1可知,随着花生发芽天数的增加,白藜芦醇的含量逐渐升高,当培养天数为13 d时,白藜芦醇含量达到最高值,再增加培养天数白藜芦醇含量略微降低,且消耗时间较长,因此选择培养13 d的花生芽作为提取原料。
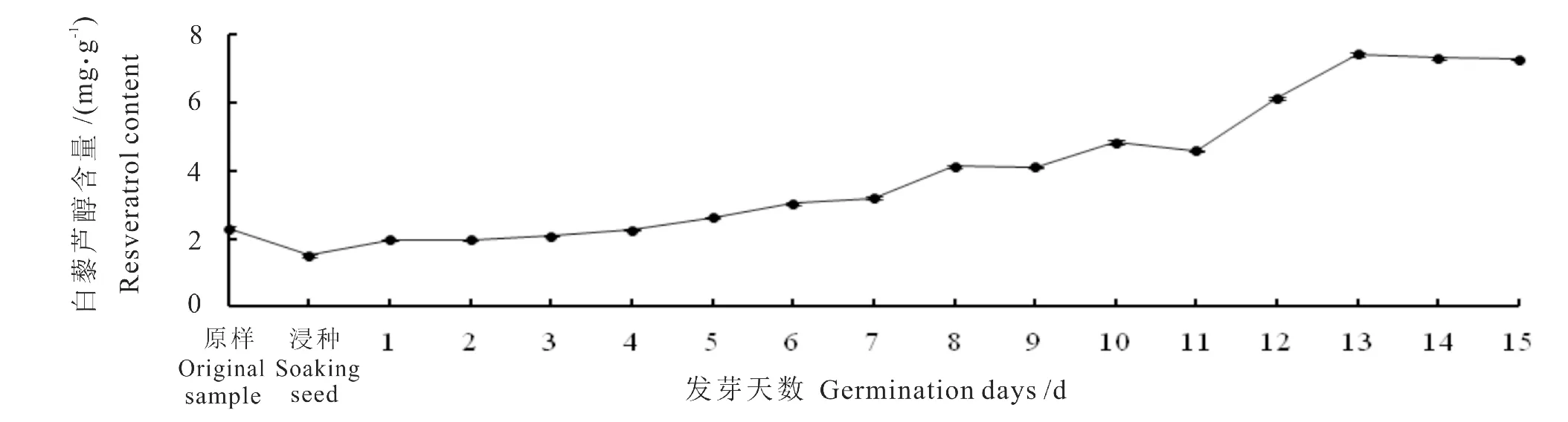
图1 不同培养天数对花生芽中白藜芦醇含量的影响Fig.1 Effect of different culture days on resveratrol content in peanut sprouts
2.2 不同提取方法对白藜芦醇提取含量的影响
不同提取方法对白藜芦醇的提取效率会产生不同的影响,我们对提取产物中白藜芦醇的含量进行了分析,结果如表2所示。表2可看出,碱提酸沉提取法的白藜芦醇含量最低为2.27 mg/g,超声-微波协同提取的效率最高,白藜芦醇提取含量高达8.00 mg/g,显著高于微波提取法、碱提酸沉提取法和溶剂提取法(P<0.05),故选择超声-微波协同提取法进行试验。

表2 提取方式对白藜芦醇提取含量的影响Table 2 Effect of extraction method on extraction content of resveratrol
2.3 单因素试验
2.3.1 超声功率和超声时间对白藜芦醇提取含量的影响
由图2(A)可知,白藜芦醇提取含量随超声功率呈先增大后减少的趋势,在290 W 时提取含量最高为7.80 mg/g,并显著高于其他功率时的提取含量,故最佳超声功率为290 W。由图2(B)可知,随着超声时间延长,白藜芦醇提取含量显著增加,在3 min时提取含量达7.89 mg/g,继续延长时间,呈显著减少趋势,因此,综合提取含量和时间成本的考虑,提取时间选择3 min为宜。
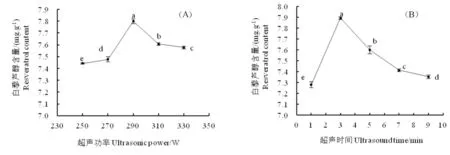
图2 超声功率和超声时间对白藜芦醇提取含量的影响Fig.2 Effect of ultrasonic power and ultrasonic time on the extraction content of resveratrol
2.3.2 微波功率和微波时间对白藜芦醇提取含量的影响
由图3(A)可知,随微波功率的增加,白藜芦醇提取含量逐渐增加,当微波功率为380 W 时,白藜芦醇提取含量达到最高值7.91 mg/g,继续增加功率,呈显著减少趋势,因此,微波功率选择380 W 为宜。由图3(B)可知,白藜芦醇提取含量在微波作用90~120 s时随微波时间的增加而增加,到120 s时提取含量达到最大,所以最适微波提取时间为120 s。继续延长时间,呈逐渐减少趋势,因此,选择微波提取120 s为最佳。

图3 微波功率和微波时间对白藜芦醇提取含量的影响Fig.3 Effect of microwave power and microwave time on resveratrol extraction content
2.3.3 料液比和乙醇浓度对白藜芦醇提取含量的影响
由图4(A)可知,随料液比的增加,提取含量逐渐提高。当料液比继续增大到一定程度后,由于花生芽粉中的白藜芦醇含量有限,所以提取率反而略有降低。因此选择最佳料液比为1∶30。由图4(B)可知,随着乙醇浓度的增加,白藜芦醇的提取含量逐渐增加,当乙醇浓度为65%时,白藜芦醇提取含量达到最高,之后继续增大乙醇浓度白藜芦醇含量逐渐降低,因此选择65%乙醇溶液较为合适。
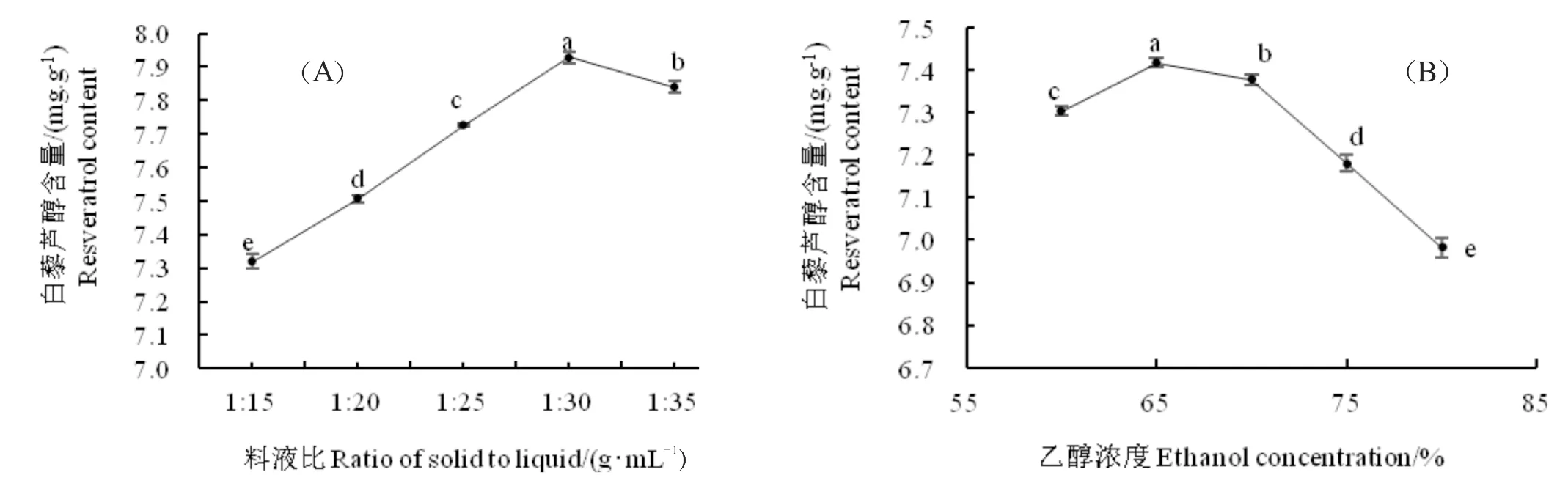
图4 料液比和乙醇浓度对白藜芦醇提取含量的影响Fig.4 Effect of solid to liquid ratio and ethanol concentration on resveratrol extract content
2.4 Plackett-Burman试验设计结果与分析
通过Plackett-Burman试验设计对影响白藜芦醇提取的因素进行显著性分析,试验设计及结果见表3,各因素效应显著性评价结果见表4。另外,由表征影响因素次序的Pareto图可知,影响因素的显著性由大到小依次为料液比(B)>乙醇浓度(A)>微波功率(F)>超声功率(D)>微波时间(E)>超声时间(C),其中料液比对白藜芦醇得率的影响达到了显著水平(P<0.05),按照各因素的影响大小顺序,选择料液比(B)、乙醇浓度(A)、微波功率(F)三个因素进行响应面优化设计。在优化提取的过程中,将超声功率、微波时间和超声时间这三个因素分别固定为290 W、120 s和3 min(图5)。
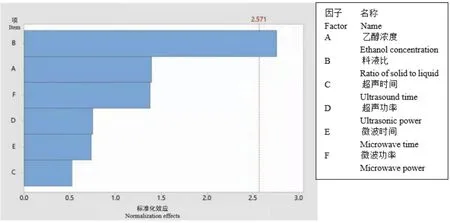
图5 影响因素标准化的Pareto图Fig.5 Pareto chart of influencing factor standardization
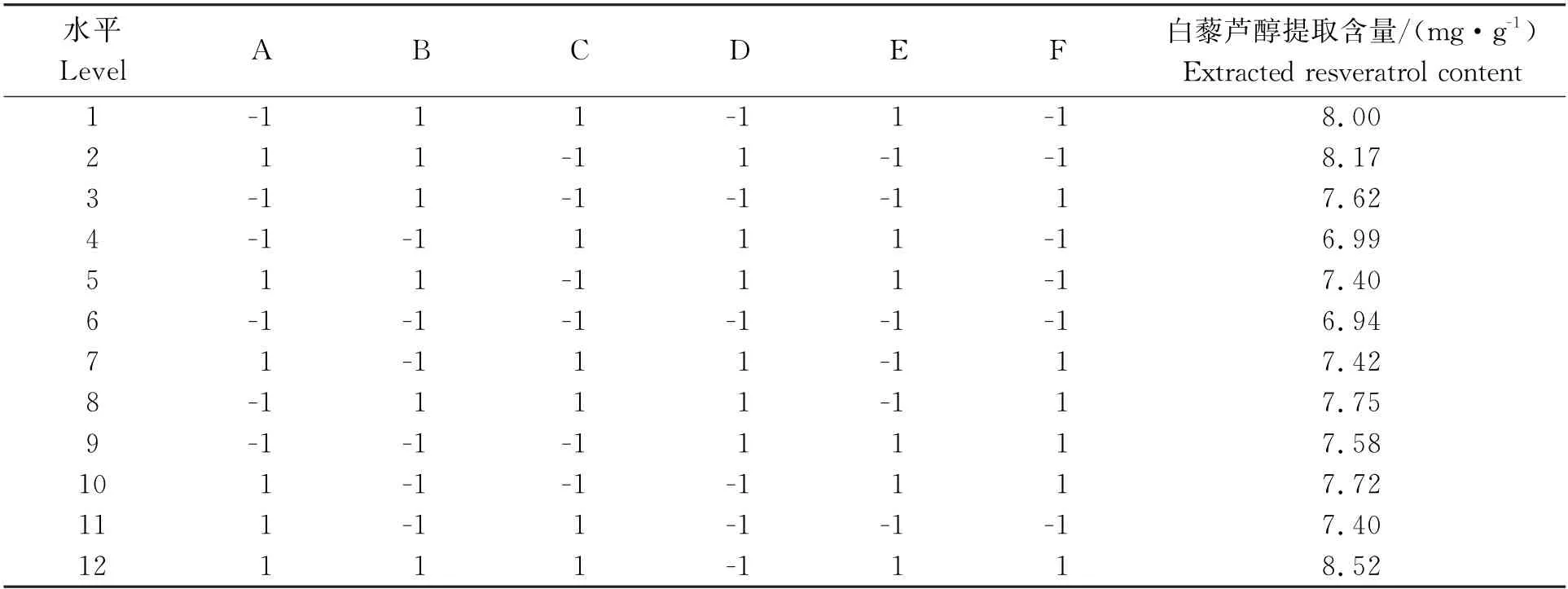
表3 Plackett-Burman试验方案和结果Table 3 Experimental design and result of Plackett-Burman design
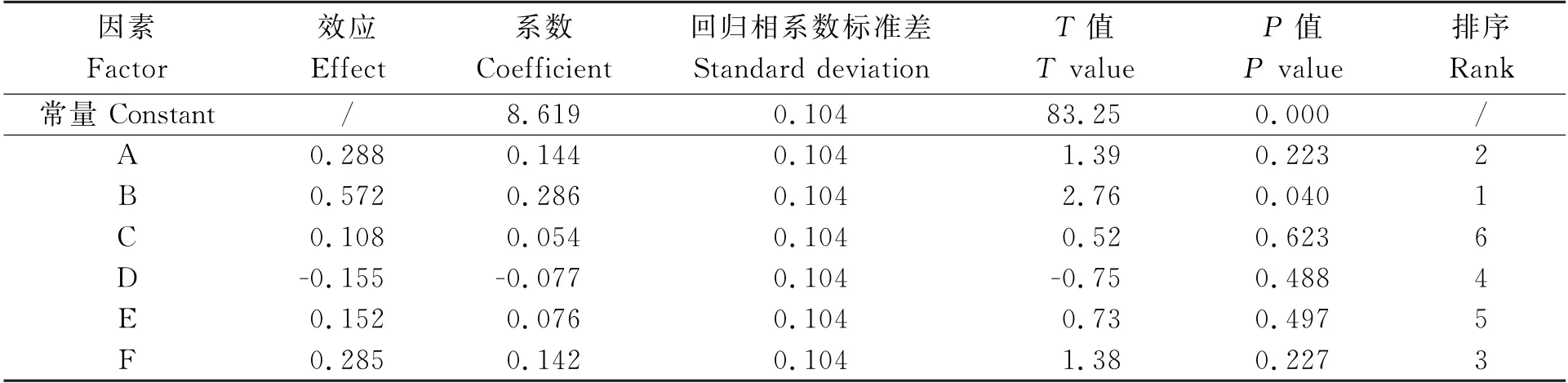
表4 Plackett-Burman 试验设计各因素效应评价Table 4 Effect evaluation of each factor under Plackett-Burman test design
2.5 响应面试验设计结果及分析
在Plackett-Burman 试验设计结果分析的基础上对乙醇浓度、料液比、微波功率3个因素设计响应面分析试验(表5),分析结果见表6,对表6中的数据进行回归分析处理,结果见表7。由表7可以看出,乙醇浓度对提取含量有显著影响(P<0.05),微波功率对提取含量有极显著影响(P<0.01)。乙醇浓度与料液比之间存在极显著的交互作用(P<0.01),乙醇浓度与微波功率之间交互作用不显著。
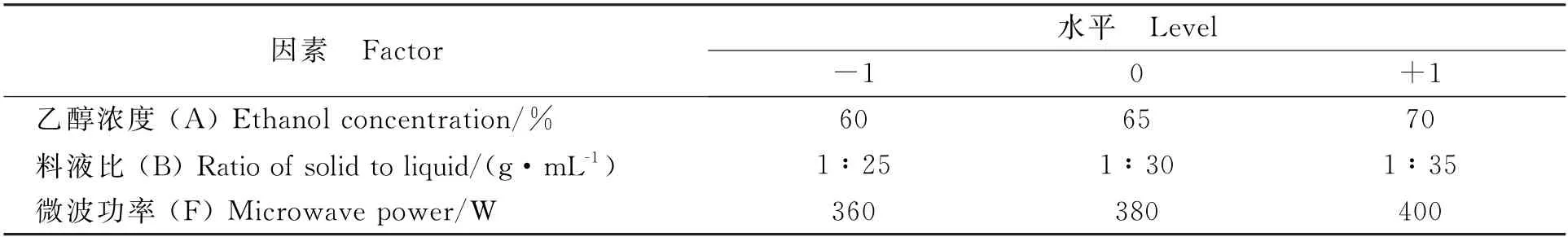
表5 试验设计因素和水平表Table 5 Experimental factors level
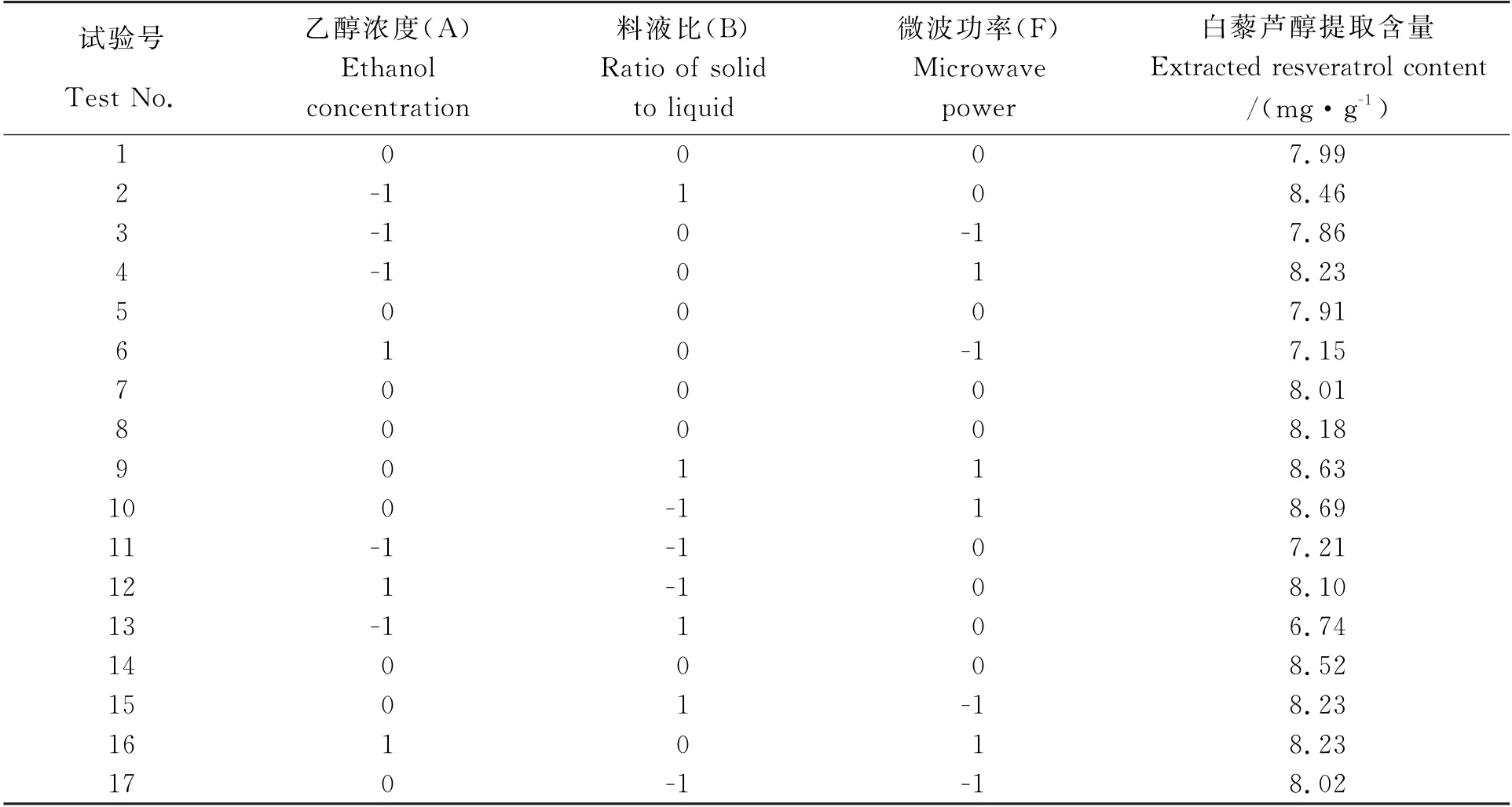
表6 响应面试验设计及结果Table 6 Response surface test design and results
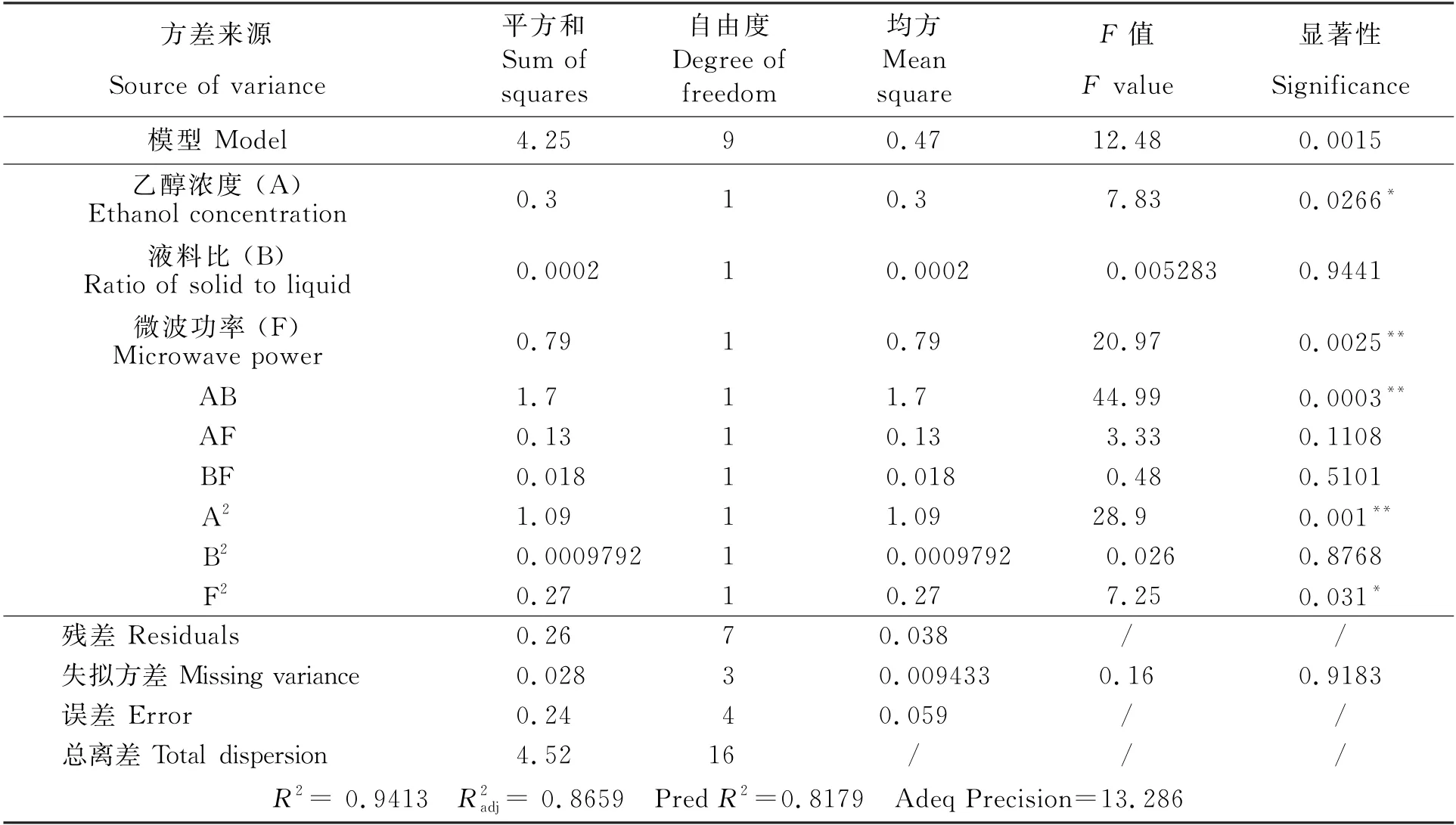
表7 回归模型方差分析Table 7 Variance analysis for regression model
经逐步回归分析,取得最佳二次回归方程(P<0.05),由=0.8659、PredR2=0.8179、Adeq Precision(信噪比)值远大于4可见,回归方程拟合度和可信度均很高,能够较好地反应三个变量之间的关系。白藜芦醇提取量=-3.59150+2.72070A+1.91740×B-0.56435×F-0.026100×AB+0.001775×AF-0.0006750×BF-0.0203900×A2+0.0006100×B2+0.000638125×F2。
2.5.1 响应面交互作用分析
响应面3D 曲面图反映两两因素之间对响应值的影响作用,其中3D曲面图越陡峭,说明两因素之间交互作用越明显[29]。图6可看出,乙醇浓度和料液比之间交互作用显著(P<0.05),乙醇浓度和微波功率、料液比和微波功率之间交互作用不显著(P>0.05)。该结果与方差分析结果一致。

图6 交互作用对白藜芦醇含量影响的响应面图Fig.6 Response surface diagram of the effect of interaction terms on the content of resveratrol
2.5.2 最优提取工艺参数及验证
通过Design-Expert 8.0设计分析得到超声-微波协同提取白藜芦醇最佳工艺:乙醇浓度60.75%、料液比1∶34.58,微波功率399.64 W、预测白藜芦醇含量为8.84 mg/g。结合实际操作,修订为乙醇浓度60%、料液比1∶35、微波功率400 W。此时白藜芦醇提取含量为8.64 mg/g,RSD 为0.2%,说明模型有效。
2.6 抗氧化活性的测定
2.6.1 DPPH 自由基清除能力的测定
如图7所示,花生芽白藜芦醇对DPPH 自由基的清除率随质量浓度的增加而增大,质量浓度在15~30μg/mL 范围内,花生芽白藜芦醇对DPPH 自由基清除率显著低于VC。当质量浓度在30~240μg/m L时,白藜芦醇对DPPH 自由基的清除率趋近于VC,且质量浓度为240μg/m L时,花生芽白藜芦醇对DPPH 自由基的清除率达92.80%,VC对DPPH 自由基的清除率达94.80%,表明花生芽白藜芦醇具有良好的抗氧化活性。
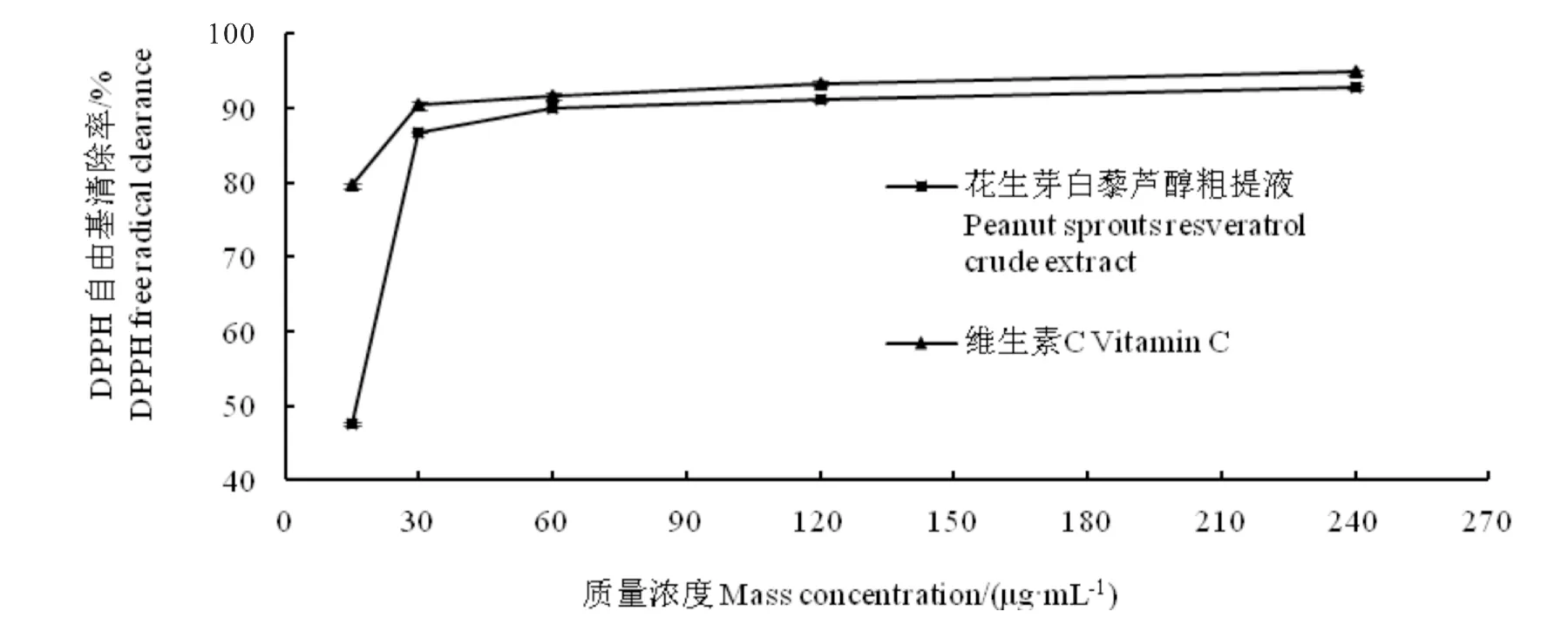
图7 花生芽白藜芦醇对DPPH 自由基清除率曲线Fig.7 DPPH radical scavenge rate by resveratrol from peanut sprouts
2.6.2 ABTS自由基清除能力的测定
如图8所示,在试验条件下,花生芽白藜芦醇粗提液对ABTS自由基有明显的清除能力,且随着质量浓度的增加,清除率也逐渐上升,在浓度为260μg/m L时,花生芽白藜芦醇对ABTS自由基的清除率达97.84%,VC对ABTS自由基的清除率达93.76%,花生芽白藜芦醇对ABTS自由基的清除率远高于相同浓度下VC对ABTS的清除率,说明花生芽白藜芦醇对ABTS自由基的清除效果强于VC。

图8 花生芽白藜芦醇对ABTS自由基清除率曲线Fig.8 ABTS radical scavenge rate by resveratrol from peanut sprouts
2.6.3 花生芽白藜芦醇对α-葡萄糖苷酶活性抑制率的测定
由图9可看出,花生芽白藜芦醇和阿卡波糖对α-葡萄糖苷酶都有较好的抑制作用,均随着质量浓度的增加而增大,但在相同浓度下阿卡波糖抑制效果强于花生芽白藜芦醇,在质量浓度为620μg/m L时,阿卡波糖抑制率为96.29%,花生芽白藜芦醇抑制率为90.73%,花生芽白藜芦醇抑制率略低于阿卡波糖,由此证明阿卡波糖和花生芽白藜芦醇都能抑制α-葡萄糖苷酶的活性,从而使α-葡萄糖苷酶对PNPG的水解能力降低。研究结果为白藜芦醇产品的研发提供了一定的理论参考。

图9 花生芽白藜芦醇对α-葡萄糖苷酶活性的抑制率Fig.9 The inhibition rate of resveratrol from peanut sprouts on α-glucosidase activity
3 结论
试验采用花生培养13 d时的花生芽作为提取白藜芦醇原料,通过单因素、PB 试验设计和响应面中心组合试验得出,花生芽白藜芦醇的最佳提取工艺为:乙醇体积分数60%,料液比1∶35(g/m L),超声功率290 W,超声时间3 min,微波功率400 W,微波时间120 s,在此条件下花生芽白藜芦醇提取含量为8.64 mg/g。
通过体外抗氧化活性评价表明,花生芽白藜芦醇在清除DPPH 自由基和ABTS自由基能力方面具有较好的能力,且对ABTS的清除能力强于VC;花生芽白藜芦醇在抑制α-葡萄糖苷酶活力方面也具有较强的能力。综上所述,花生芽白藜芦醇是一种天然的抗氧化物,具有极大的应用价值和潜力,有必要对其做进一步研究。
