辐照对红景天提取物活性成分及降血糖作用的影响
2022-12-01常艳秋崔承弼
曲 孟 常艳秋 齐 欣 崔承弼,
(1. 延边大学农学院,吉林 延吉 133002;2. 延边大学药学院,吉林 延吉 133002)
糖尿病已经成为了世界范围内威胁人类健康的主要慢性病之一[1],其中1型糖尿病多发于儿童和青少年[2],发病原因主要是机体内胰岛β细胞受损,丧失合成胰岛素的功能,最终引发糖代谢紊乱,使血糖水平居高不下[3]。糖尿病患者需终身注射(服用)胰岛素药物并面对因此带来的不良反应[4]。
红景天(RhodiolaroseaL.)系景天科多年生草本或亚灌木植物[5],从红景天根部提取出的活性物质主要成分为红景天苷、酪醇、络塞维、槲皮素、肉桂醇、多糖等,其中红景天苷和酪醇是红景天质量的评价指标,而络塞维是红景天的特有成分[6]。红景天的活性成分具有抗炎[7]、肝保护[8]、抗氧化[9]、抗疲劳[10]、抗衰老[11]等功效。有研究[12]表明,红景天中的活性成分红景天苷可通过抑制炎症发挥保护β细胞,改善胰岛素抵抗作用从而达到降低血糖的目的。还有研究[13]表明,红景天通过调节相关抗氧化酶的活性进而改善糖尿病模型动物氧化应激状态,从而达到抗糖尿病的作用。
食品辐照技术是一项安全、无污染对食品品质风味影响小的食品保藏技术[14]。其中60Co-γ射线辐照灭菌法近年来在中药灭菌中得到越来越广泛的应用[15]。有研究[16]发现,辐照能使提取物活性成分发生变化,如辐照处理能提升人参皂苷的含量,增加其活性,包括肿瘤抑制、抗转移、抗癌、保肝、神经保护和免疫刺激活动。但目前尚无辐照处理红景天提取物的降血糖方面的研究。
研究拟采用不同辐照剂量60Co-γ射线对红景天进行辐照处理,通过HPLC分析辐照前(0 kGy)后RRE化合物并对1型糖尿病小鼠进行体内试验,研究其降血糖作用及对相关指标的变化,以期为辐照红景天提取物在降血糖作用上的研究提供依据。
1 材料与方法
1.1 材料和仪器
1.1.1 材料和试剂
高山红景天:由长白山科学研究院提供,并于四川省原子能研究院进行辐照处理;
无水乙醇:分析纯,天津市科密欧化学试剂有限公司;
红景天苷标准品、酪醇标准品、络塞维标准品:色谱级(≥98%),上海源叶生物科技有限公司;
甲醇、乙腈、2-丙醇:色谱级(≥99.9%),北京经科宏达生物技术有限公司;
链脲佐菌素(STZ):纯度≥98%,美国Sigma公司;
盐酸二甲双胍缓释片:0.5 g/片,天方药业有限公司;
葡萄糖:药用级,潍坊盛泰药业有限公司;
总胆固醇(TC)试剂盒、甘油三酯(TG)试剂盒、糖化血红蛋白(GHb)试剂盒、丙二醛(MDA)试剂盒、过氧化氢酶(CAT)试剂盒、超氧化物歧化酶(SOD)试剂盒:南京建成生物工程研究所。
1.1.2 主要仪器设备
电热恒温水浴锅:HWS-24型,上海百典仪器设备有限公司;
电子分析天平:JJ-BC型,生工生物工程(上海)股份有限公司;
医用离心机:TDZ5-WS型,湖南湘仪实验室仪器开发有限公司;
冷凝器:CCA-1111-CE型,东京理化器械株式会社;
水浴锅:OSB-2100-CE型,东京理化器械株式会社;
旋蒸支架:N-1110型,东京理化器械株式会社;
真空泵:DTC-22B型,日本Uluac Kiko公司;
冷冻干燥机:LyoQuest-85实验型,西班牙Telstar集团;
高效液相色谱仪:安捷伦1290+型,美国安捷伦科技有限公司;
多功能荧光酶标仪:SP-Max3500FL型,上海闪谱生物科技有限公司。
1.2 方法
1.2.1 红景天的辐照处理 将高山红景天根送于四川省原子能研究院,以60Co-γ射线作为辐射源,依次按照0,5,10,20,30 kGy的辐照剂量进行处理。
1.2.2 辐照红景天提取物的制备 红景天粉碎处理后,过60目筛,用70%乙醇按照m红景天粉∶V乙醇=1∶10 (g/mL)的料液比在80 ℃水浴中浸提1 h后,3 000 r/min 离心20 min,汇集上清液,沉淀物按照上述条件再次提取,共提取3次,将其蒸发浓缩后放入-80 ℃冰箱中冷冻12~24 h后,冷冻干燥24 h后研磨成粉末,常温下密封保存,以备后续试验使用。
1.2.3 提取物活性成分 采用高效液相色谱法(HPLC)。称量不同辐照剂量RRE粉末50 mg,用甲醇定容,体积为5 mL,配制成10 mg/mL的溶液,装入1.5 mL进样瓶中前用0.45 μm滤膜过滤。以C18色谱柱为固定相,柱温40 ℃,进样体积10 μL,流动相恒定流量1.0 mL/min,流动相A为水,流动相B为乙腈,将A、B两个流动相按照设定体积比梯度洗脱,开始时V流动相A∶V流动相B为95∶5,25 min时V流动相A∶V流动相B为85∶15,50 min时V流动相A∶V流动相B为78∶22,红景天苷和酪醇在275 nm的紫外波长下进行检测,络塞维在254 nm的紫外波长下进行检测[17]。
1.2.4 1型糖尿病动物模型的建立及分组 将7周龄体重为18~22 g的C57BL/6雄性小鼠50只按照每组6只的数量随机分成8组,分别记为正常组、模型组、阳性对照组(阳性组)、0 kGy组、5 kGy组、10 kGy组、20 kGy组、30 kGy组,称重,并于延边大学食品研究中心动物室喂养,喂养条件为室内湿度(55±5)%,室温(24±1) ℃,对小鼠适应性喂养1周后,称重,正常饮水但禁食6 h(8:00—14:00),测定空腹血糖水平并记录。隔天所有小鼠禁食不禁水12 h,注射STZ,剂量为50 mg/kg。注射结束1 h后对所有小鼠恢复饮食,并于20:00继续禁食,接连5 d 腹腔注射STZ来建立1型糖尿病模型。造模的小鼠全部进行1周的正常喂养后,正常饮水但禁食6 h后进行空腹血糖值的测定,数值>11.1 mmol/L即认定建模成功[18],将建模不成功的剔除。
1.2.5 动物试验流程 成功造模后,按照表1每天对小鼠进行灌胃给药,试验期间每周固定时间测定空腹血糖值,灌胃6周后,最后1 d测定小鼠的空腹血糖值,以及口服葡萄糖耐量试验,于21:00到次日9:00禁食。禁食结束后,先眼球取血后把血液放于1.5 mL EP管中,之后将其脱颈处死,解剖,取心、肝、脾、肾4个脏器,处理后称重并记录。在4 000 r/min 的转速下离心5 min后取上清液,以备后续使用。
1.2.6 小鼠体重、摄食量、饮水量及脏器系数测定 小鼠适应环境喂养1周后,记录体重、饮水量以及饲料使用量,造模成功后,再次测量体重并记录,进行灌胃之后,每隔1 d测量体重并记录,小鼠处死前最后一次称重并记录,解剖,将心、肝、脾、肾4个脏器取出后测量其重量并记录、计算各脏器系数。
1.2.7 小鼠空腹血糖值测定 测定时,将小鼠尾尖剪开后擦掉第1滴血用第2滴血进行测定,测定后用75%酒精处理尾部伤口来达到消毒的目的,并将小鼠放回原笼。

表1 不同辐照剂量RRE降血糖作用动物试验分组
1.2.8 口服葡萄糖耐量试验 在为期6周的灌胃后,首先测定所有小鼠的空腹血糖,然后经口灌胃质量分数为40%的葡萄糖溶液,分别在灌胃葡萄糖溶液后的0.0,0.5,1.0,1.5,2.0 h时测定小鼠血糖水平。
1.2.9 小鼠血液TC、TG、GHb、MDA、CAT、SOD水平测定 将解剖后存放的血清按照试剂盒说明书进行操作。
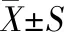
2 结果与分析
2.1 辐照红景天提取物得率
辐照剂量分别为0 kGy组、5 kGy组、10 kGy组、20 kGy 组和30 kGy组时辐照红景天提取物得率分别为31.33%,31.32%,31.31%,31.31%,31.33%,各辐照剂量下用70%乙醇提取红景天得到的提取物的得率之间无显著性差异(P>0.05)。
2.2 辐照对RRE中主要活性成分的影响
图1和图2分别为275 nm和254 nm紫外波长下红景天标准品和RRE的HPLC图谱。由图2可知,在60Co-γ射线辐照处理后,RRE的活性成分发生了变化。由表2可知,与未辐照RRE相比,辐照处理后红景天苷的含量显著减少(P<0.05);在5,10,30 kGy处理的样品中未检测出酪醇,在20 kGy处理的样品中检测出酪醇;样品经5,10,20 kGy处理时络塞维的含量显著提高(P<0.05);经20 kGy处理时红景天苷、酪醇以及络塞维三者含量之和显著高于其他辐照剂量处理的(P<0.05)。推测可能因为其他化合物在20 kGy时转化合成为酪醇,所以在20 kGy 处理的样品中检测到酪醇。其次红景天苷、酪醇和络塞维可能对20 kGy的辐照剂量较敏感,所以成分含量之和显著高于其他辐照剂量组。

图1 275 nm和254 nm波长下红景天标准品的HPLC图谱Figure 1 HPLC chromatogram of Rhodiola rosea standards at 275 nm and 254 nm

图2 275 nm和254 nm波长下RRE的HPLC图谱Figure 2 HPLC chromatogram of RRE at 275 nm and 254 nm

表2 辐照前后RRE中红景天苷、酪醇和络塞维含量的变化†
2.3 辐照处理RRE对模型小鼠体重、摄食量、饮水量和食物效价的影响
由图3可以看出,造模成功的小鼠体重低于正常组,并存在显著性差异(P<0.05),用RRE和盐酸二甲双胍灌胃后,随灌胃次数增加,各给药组小鼠体重都有所增加,但仍显著低于正常组(P<0.05),第9周时,20 kGy组的小鼠体重显著高于其他辐照剂量组的(P<0.05)。表明RRE可以改善1型糖尿病小鼠体重减轻的症状,并且在20 kGy时对1型糖尿病小鼠体重改善效果较好。张露等[18]对辐照处理后的桦褐孔菌多糖的降血糖作用进行研究时,也发现桦褐孔菌多糖能够改善糖尿病小鼠的糖尿病症状,使小鼠体重减轻的症状得到改善。

小写字母不同表示差异显著(P<0.05)图3 RRE对小鼠体重的影响Figure 3 Effects of RRE on body weight of mice
从图4可以看出,注射STZ的各组小鼠的体重增量低于正常组,且存在显著性差异(P<0.05),注射STZ的各组小鼠摄食量和饮水量均显著高于正常组的(P<0.05),但食物效价低于正常组并存在显著性差异(P<0.05),灌胃RRE的各组小鼠的摄食量和饮水量显著低于模型组(P<0.05)而食物效价显著高于模型组(P<0.05),灌胃20 kGy RRE的小鼠的食物效价显著高于灌胃其他辐照剂量的(P<0.05),与刘素欣等[19]发现RRE能够改善1型糖尿病小鼠的饮食状态,提高1型糖尿病小鼠的食物利用率的试验结果一致,并且20 kGy的RRE对于小鼠饮食状态的改善效果较好。

小写字母不同表示差异显著(P<0.05)图4 RRE对小鼠摄食量、饮水量和食物效价的影响Figure 4 Effects of RRE on food intake, water intake and food titer in mice
在试验过程中1型糖尿病小鼠表现出了饮食量、饮水量以及排尿量过多而体重下降的现象,并且其对食物的利用率要低于正常组小鼠。试验期间,注射STZ的1型糖尿病小鼠有时会表现出萎靡不振,毛色干燥,灌胃给药后,小鼠的精神状态好转,随着灌胃给药,毛色由干燥转变为黑光油亮;模型组小鼠的垫料明显潮湿,灌胃给药后,给药组小鼠的垫料潮湿情况有所改善,所以说明RRE能够改善小鼠的身体、精神状态和垫料潮湿情况,并且20 kGy 的RRE效果最好。
2.4 辐照处理前后的RRE对小鼠空腹血糖值的影响
由图5可知,建模后,与正常组相比,模型组空腹血糖水平显著上升(P<0.05),经不同辐照剂量RRE灌胃后,各组小鼠空腹血糖水平均有所改善,且20 kGy组水平显著低于模型组(P<0.05),同时显著低于其他各辐照剂量组(P<0.05)。表明RRE能够降低1型糖尿病小鼠空腹血糖水平,并且20 kGy的RRE降血糖效果优于其他辐照剂量的。

小写字母不同表示差异显著(P<0.05)图5 RRE对小鼠空腹血糖值的影响Figure 5 Effects of RRE on fasting blood glucose in mice
2.5 RRE对小鼠口服葡萄糖耐量的影响
由图6(a)可知,经口灌胃葡萄糖溶液后,正常组小鼠血糖水平缓慢上升,其余组别小鼠血糖水平急剧上升,在0.5 h时达到最大,0.5 h以后所有组别小鼠血糖水平逐渐下降,在2 h时20 kGy组的小鼠血糖水平接近灌胃葡萄糖之前的水平,与0.5 h时的血糖水平相比,2 h时20 kGy组的小鼠血糖水平下降了41.24%,下降幅度仅次于阳性组且高于其他辐照剂量组,所有给药组小鼠的血糖值均显著低于模型组(P<0.05)。由图6(b)可知,与模型组相比灌胃RRE的小鼠糖耐量显著提高(P<0.05),并且20 kGy 组的糖耐量显著高于其他辐照剂量组的(P<0.05)。因此RRE能够改善由STZ导致的小鼠的糖耐量损伤,并且20 kGy的RRE对小鼠糖耐量的改善效果较好,表明其具有提高STZ诱导的1型糖尿病小鼠抗高血糖的潜力。

小写字母不同表示差异显著(P<0.05)图6 RRE对小鼠口服葡萄糖耐量的影响Figure 6 Effects of RRE on oral glucose tolerance in mice
2.6 RRE对小鼠血液TC、TG、GHb、MDA、CAT和SOD的影响
糖尿病病人机体胰岛素本身不足会导致脂蛋白脂肪酶活性下降,从而引起其对TG的水解能力减弱,致使与TG相关的脂蛋白出现代谢障碍,使TG含量升高而高密度脂蛋白(HDL)含量减少,进而使HDL从周围组织中将胆固醇转运至肝脏的能力减弱,导致体内胆固醇因不能转化和排泄而使TC含量升高[20]。由图7(a)和图7(b)可知,注射STZ的小鼠其血清中TC和TG含量显著高于正常组(P<0.05),灌胃RRE后,灌胃的各组小鼠其血清中TC和TG含量显著低于模型组的(P<0.05),并且20 kGy组血清中的TC和TG含量显著低于其他辐照剂量组的(P<0.05)。表明RRE能够降低STZ诱导的1型糖尿病小鼠血清中TC和TG的含量,并且20 kGy的RRE降低TC和TG含量的效果较好。
由图7(c)可知,注射STZ的1型糖尿病小鼠GHb含量显著高于正常组(P<0.05),灌胃RRE的各组小鼠血清中GHb含量低于模型组并存在显著性(P<0.05),其中20 kGy组小鼠GHb含量显著低于灌胃其他辐照剂量的(P<0.05),表明RRE能够降低由STZ诱导的1型糖尿病小鼠糖化血红蛋白的含量,并且20 kGy的RRE降低糖化血红蛋白含量的效果较好。
MDA、CAT与SOD在机体中具有较强的抗氧化能力,压制氧自由基的生成,可降低其对细胞的伤害,并且可以降低MDA的生成量[21]。由图7(d)~图7(f)可知,注射STZ的小鼠血清中MDA含量高于正常组并存在显著性差异(P<0.05),CAT和SOD活力显著低于正常组(P<0.05),与模型组相比灌胃RRE的各组小鼠血清中MDA含量显著降低(P<0.05)而CAT和SOD活力显著提高(P<0.05),20 kGy组小鼠血清中MDA含量显著低于其他辐照剂量的(P<0.05),CAT和SOD活力显著高于其他辐照剂量的(P<0.05)。因此RRE能够降低STZ诱导的1型糖尿病小鼠血清内MDA含量,并提高CAT和SOD活力,表明RRE能够提高1型糖尿病小鼠的抗氧化能力,具有降血糖的效果。20 kGy辐照处理的RRE的抗氧化效果较好。

小写字母不同表示差异显著(P<0.05)图7 RRE对小鼠血液TC、TG、GHb、MDA、CAT和SOD的影响Figure 7 Effects of RRE on blood TC, TG, GHb, MDA, CAT and SOD in mice
2.7 RRE对小鼠脏器系数的影响
由表3可知,注射STZ建模后,模型组小鼠脾脏脏器系数与正常组相比不存在显著性差异(P>0.05),表明STZ未造成小鼠脾脏的肿大,并且灌胃RRE的小鼠脾脏与正常组相比也无显著性差异(P>0.05),说明RRE不会对小鼠脾脏造成伤害。但在建模后,注射STZ的小鼠心、肝、肾的脏器系数高于正常组并存在显著性差异(P<0.05),经口灌胃RRE的小鼠其心、肝、肾的脏器系数显著小于模型组(P<0.05),表明RRE能够缓解1型糖尿病小鼠脏器肿大的现象。在灌胃RRE的组别中,20 kGy组的脏器系数显著低于其他辐照剂量的(P<0.05),说明20 kGy 辐照处理的RRE缓解1型糖尿病小鼠脏器肿大的效果较好。

表3 RRE对小鼠脏器系数的影响†
3 结论
不同辐照剂量的60Co-γ射线处理会影响红景天提取物活性成分,改善其对1型糖尿病小鼠相关指标的水平,降血糖作用显著,且20 kGy时效果最佳。但该试验仅研究了辐照剂量对降血糖效果的影响,后续将进一步研究最佳辐照剂量下的降血糖作用,并通过体内外试验探讨其降血糖机制。
