复合植物提取物对皮肤刺激的舒缓作用研究
2022-12-01周利丹卢伊娜王新亮施雪梅
周利丹,卢伊娜,王新亮,施雪梅,张 磊
(上海珈凯生物科技有限公司 上海 200241)
皮肤每天都暴露在可能导致皮肤刺激性的因素中,其中许多清洁剂(如洗手液)的基础成分表面活性剂是最重要的刺激因素之一[1]。特别是为了预防新冠肺炎(Corona virus disease 2019,COVID-19)传染,清洁剂的使用次数大大增加[2]。因此,明确开发具有对表面活性剂刺激皮肤的抗刺激剂/物质是工作和生活所必须的,也是应用研究的目标之一。本研究选择一种典型的表面活性剂十二烷基硫酸钠(Sodium lauryl sulphat,SLS)和细菌细胞壁的代表性成分脂多糖(Lipopolysaccharide,LPS)作为刺激物,分别从角质形成细胞、巨噬细胞、三维体外重组表皮模型(Episkin)、鸡胚绒毛尿囊膜(CAM)维度,探讨由苦参根、胀果甘草根、黄芩根制备而成的复合植物提取物(SGS)对抗外界刺激的作用及可能的机制,为SGS在化妆品中的应用和SLS导致皮肤刺激性的机制研究提供参考。
1 材料和方法
1.1 SGS制备:前期研究发现单一苦参提取物、胀果甘草提取物、黄芩提取物均具有一定的抗炎作用[3-5]。SGS为上海珈凯生物科技有限公司提供,由甘草根粗提取物经加热处理,再与胀果甘草根粗提物、黄芩根粗提物复配,经分离提纯、脱色、脱味、调节pH等工艺制备而成,其中甘草酸含量经高效液相色谱法检测超过0.6%。
1.2 试剂:人永生化表皮细胞(HaCaT细胞)、正常人表皮角质形成细胞(NHEK细胞)、小鼠单核巨噬细胞(Raw 264.7),北纳生物细胞库;EpiSkin,上海斯安肤诺生物科技有限公司;SLS、LPS、四甲基偶氮唑盐(MTT)、地塞米松(Dex),美国Sigma公司;DMEM高糖培养基、胎牛血清(FBS)、0.25%胰蛋白酶、RNA抽提试剂盒、Taqman荧光探针、实时荧光定量(RT-PCR)检测试剂盒,美国Thermo fisher公司;本研究所使用的Taqman荧光探针有KRT10(TaqMan探针货号:Hs00166289_m1)、KRT16(TaqMan探针货号:Hs00373910_g1)、AQP3(TaqMan探针货号:Hs00185020_m1)、FLG(TaqMan探针货号:Hs00856927_g1)、CASP14(TaqMan探针货号:Hs00201637_m1)、LOR(TaqMan探针货号:Hs01894962_s1)、GAPDH(TaqMan探针货号:Hs02786624_g1)。白介素1α(IL-1α)、白介素6(IL-6)、前列腺素2(PGE2)酶联接免疫吸附剂测定(Enzyme linked immunosorbnent assay,ELISA)试剂盒,深圳欣博盛生物科技有限公司;SPF鸡蛋,浙江立华农业科技有限公司。
1.3 仪器:酶标仪、CO2恒温培养箱、生物安全柜,美国Thermo fisher公司;倒置显微镜、体视显微镜,江南永新光学有限公司。
1.4 细胞培养与传代:HaCaT细胞、NHEK细胞、Raw264.7细胞均使用含10% FBS的DMEM高糖培养基,于5% CO2、37℃恒温培养箱中维持培养。细胞汇合率达到80%时采用0.25%胰蛋白酶消化,进行常规传代培养。每2~3 d传代一次,细胞每次复苏后培养不超过10代。
1.5 HaCaT细胞刺激损伤检测:将培养至对数期的HaCaT细胞以1×104/孔接种于96孔板中,培养24 h,细胞贴壁生长。弃旧培养基,样品处理组(样品组)按每孔加入50 μl不同浓度的SGS,模型对照组(SLS组)、正常对照组(Normal组)每孔加入50 μl新鲜培养基。孵育4 h后,模型对照组、样品处理组均按每孔50 μl终浓度分别为80 μg/ml或95 μg/ml的SLS溶液,正常对照组每孔加入50 μl新鲜培养基,混匀后继续培养(19±1)h。每个处理组至少3复孔。采用MTT对细胞进行染色,使用酶标仪检测各组在492 nm处的吸光值,并于倒置显微镜下观察细胞形态[6]。收集培养上清液,按照PGE2ELISA试剂盒标准操作流程检测各组中PGE2含量。计算公式如下:细胞活力提升率(%)=(OD492样品组-OD492SLS组)/OD492SLS组×100%;抑制率
1.6 NHEK细胞中屏障相关基因表达检测:根据HaCaT细胞刺激损伤检测实验结果,选择95 μg/ml SLS和0.1% SGS浓度进行屏障相关基因mRNA表达检测。NHEK细胞以3×105/孔接种至6孔板上,培养24 h,细胞贴壁生长。弃旧培养液,正常对照组(Normal组)按每孔2 ml加入新鲜培养基;模型对照组(SLS组)按每孔2 ml加入含有SLS的新鲜培养基;样品处理组(样品组)按每孔2 ml加入含有SLS和SGS的新鲜培养基继续孵育24 h。每个处理组至少3复孔。收集细胞,应用RNA抽提试剂盒对细胞总RNA进行提取,核酸浓度定量后,每管200~800 ng RNA作为模板,采用Taqman荧光探针按一步法反应进行RT-qPCR(20 μl体系),检测KRT10、KRT16、AQP3、FLG、CASP14、LOR基因的CT值[7]。以三磷酸甘油醛脱氢酶(GAPDH)作为内参,计算各个基因的相对表达量,计算公式如下:相对表达量Fold
1.7 巨噬细胞刺激反应检测:将培养至对数期的Raw264.7细胞以5×104/孔接种于96孔板中,培养24 h,细胞贴壁生长。弃去细胞培养液,样品处理组(样品组)每孔100 μl加入不同浓度的SGS和100 μl LPS;模型对照组(LPS组)每孔200 μl加入LPS;正常对照组(Normal组)每孔200 μl加入新鲜培养基;混匀后继续培养(24±1)h。LPS终浓度均为1 μg/ml,每个处理组至少3复孔。收集培养上清液,按照PGE2、IL-6 ELISA试剂盒标准操作流程检测各组中PGE2、IL-6表达量。计算公式如下:
1.8 Episkin刺激损伤检测:将购买的Episkin从表皮培养板中移至含有维持培养液的12孔板中,于37℃、5% CO2恒温培养箱中培养24 h。取15 μl的1.25% SLS(等同于12.5 mg/ml SLS)溶液均匀涂抹于Episkin表面作为模型对照组(SLS组),样品处理组(样品组)涂抹15 μl含1.25% SLS和0.25% SGS或0.125% SGS的混合溶液,正常对照组(Normal组)涂抹15 μl的培养基,于恒温培养箱中继续培养42 h。每个处理组5复孔。孵育结束后,收集外室培养液,依据PGE2、IL-1α ELISA试剂盒标准操作方法进行PGE2、IL-1α含量测定。Episkin采用MTT法进行细胞活力检测(3复孔),即将其转移到含有MTT工作液的12孔板中,37℃孵育3 h,使用打孔器取下Episkin,除去残留物质后转移至2 ml离心管中,每管500 μl加入酸性异丙醇洗脱、提取颜色,取200 μl洗脱液至96孔板,于酶标仪492 nm处检测OD值。同时Episkin于组织固定液中固定(2复孔),石蜡包埋、切片后,苏木素-伊红(HE)染色进行组织结构分析[8]。
1.9 CAM血管刺激反应检测:将SPF鸡蛋置于(37.5±0.5)℃、相对湿度为55%~70%的恒温孵育箱中孵化至9日龄,参照文献制备CAM[9]。分别取0.3 ml生理盐水、0.05%的SLS溶液、含0.05% SLS和1% SGS的混合溶液滴加入CAM表面,观察CAM反应情况,并记录作用300 s内血管出血、凝血、血管溶解效应出现的时间,计算刺激性评分值(Irritation score,IS)及分类。每个处理组6复孔。IS<1,为无刺激性;1≤IS<5,为轻刺激性;5≤IS<9,为中度刺激性;IS>9,为重度刺激性。计算公式如下:IS=(301-Sec出血时间)×5/300+(301-Sec血管融解时间)×5/300+(301-Sec凝血时间)×9/300。
1.10 统计学分析:采用Graph Pad Prism软件对数据进行统计分析,采用配对t检验对数据进行统计分析。P<0.05为差异有统计学意义,P<0.01、P<0.001为差异极其显著。
2 结果
2.1 SGS对HaCaT细胞刺激损伤的缓解作用:通过SLS刺激HaCaT细胞损伤实验来探讨SGS的保护作用。首先检测细胞活力及细胞形态的变化。由图1可知,与正常对照组相比,80 μg/ml、95 μg/ml的SLS处理HaCaT细胞后,细胞活力分别降低51.24%、81.22%,细胞数量也显著减少。0.004%~0.0625%浓度的SGS同步处理后,细胞活力均呈现剂量依赖性的显著提升,在0.0625%浓度时细胞活力提升率可分别达到28.00%、73.42%,并且与1 μmol/L地塞米松(Dex)无显著性差异。在0.25%浓度时,细胞活力也显著上升,且细胞数量也呈现一定程度的恢复。由此可知,SGS显著提高SLS刺激损伤状态下的HaCaT细胞活力,且刺激损伤越强,SGS对细胞活力的提升率更大。

图1 SGS对HaCaT细胞刺激损伤后细胞活力的促进作用
对细胞形态检测结果也支持上述观点。如图2所示,正常对照组HaCaT细胞多边形拉长形状,细胞间接触良好,细胞质均匀。而95 μg/ml SLS处理组可显著降低细胞活力,细胞变圆,细胞间接触消失,部分细胞死亡(出现无细胞区域)。而0.25%的SGS处理细胞后,细胞活力、细胞的形状及细胞间连接均有明显恢复。

图2 SGS对HaCaT细胞刺激损伤后细胞活力的促进作用(MTT染色,100×)
再检测促炎细胞因子PGE2的表达量变化。由图3可知,与正常对照组相比,80 μg/ml、95 μg/ml的SLS处理HaCaT细胞后,PGE2含量分别上升至832.3 pg/ml、295.8 pg/ml。高浓度SLS作用下的PGE2表达量更低,可能与细胞活力的明显减少相关。而在80 μg/ml或95 μg/ml的SLS作用下,0.001%~0.25%浓度的SGS同步处理时,PGE2含量均呈现显著剂量依赖性下降,在0.25%浓度时,相比模型对照组,抑制率分别为67.70%、81.66%。SGS处理组的PGE2表达量低于正常对照组,可能也与细胞活力的变化有一定关系。

图3 SGS对HaCaT细胞刺激损伤后PGE2表达量的抑制作用
2.2 SGS对屏障修复相关基因表达量的促进作用:根据HaCaT细胞刺激损伤实验结果,选择0.1% SGS研究其对屏障修复相关基因表达的影响。95 μg/ml的SLS处理细胞24 h后,可使参与细胞分化的KRT10、KRT16和参与皮肤水合的AQP3基因表达量下降至0.12、0.11、0.08,而角化包膜组成的关键蛋白LOR、FLG以及促进丝聚蛋白降解的CASP14基因的表达分别上升至5.04、3.47、6.81(见表1),说明SLS可调控皮肤屏障相关基因的表达,从而抑制细胞分化,影响皮肤屏障功能。而SGS处理下,这些基因的表达量均呈现上调,分别上调至0.23、0.32、0.25、7.45、3.69、26.92,除FLG外,与模型对照组相比,差异有统计学意义(P<0.05)。由此可知,SGS可一定程度上加速细胞受刺激状态下的细胞分化,提升皮肤水合能力,促进角化包膜的形成,来改善皮肤屏障。

表1 皮肤屏障形成相关基因的表达量变化
2.3 SGS对巨噬细胞促炎细胞因子的抑制作用:通过LPS刺激Raw264.7细胞来探索SGS对巨噬细胞促炎细胞因子表达量的抑制作用。由图4~5可知,与正常对照组相比,1μg/ml的LPS刺激Raw264.7细胞24 h后,细胞形态由圆球变成不规则形,细胞培养液中IL-6、PGE2的含量分别上升至19 987 pg/ml、14 225 pg/ml,均增加10 000倍以上,且细胞形态由圆球变成不规则形,说明LPS可诱导巨噬细胞分化成树突状,分泌大量的细胞因子,造成刺激性炎症反应。与1μg/ml的LPS组相比,0.003%~0.3%的SGS处理下,IL-6、PGE2的含量均呈现显著剂量依赖性下降,在0.3%浓度时抑制率分别达到69.84%、96.00%。
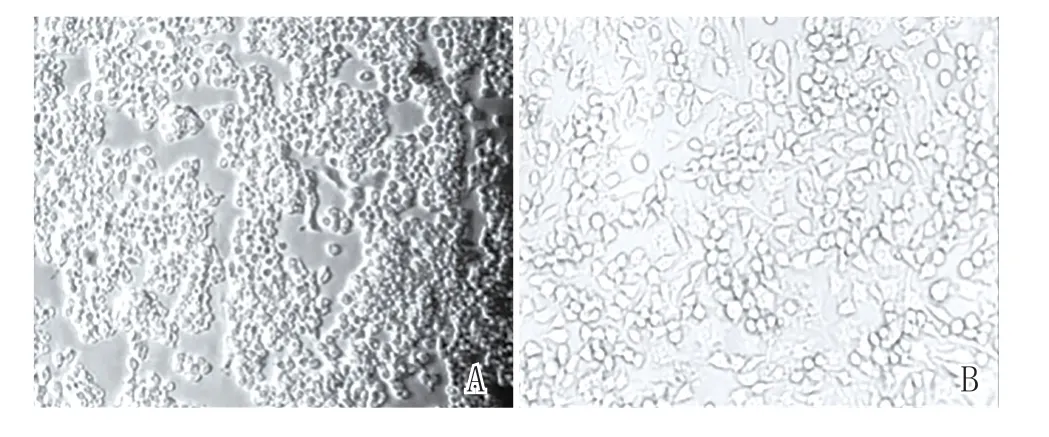
图4 LPS刺激后巨噬细胞形态变化(100×)

图5 SGS对巨噬细胞刺激后促炎细胞因子的抑制作用
2.4 SGS对Episkin刺激损伤的缓解作用:通过Episkin模拟SLS对皮肤的刺激反应,来为进一步研究SGS对皮肤组织刺激损伤后的保护作用。由图6可知,与正常对照组相比,1.25%的SLS溶液处理Episkin后,皮肤组织细胞活力下降至18.44%。0.0625%~0.5%浓度的SGS与SLS共同处理时,细胞活力显著剂量依赖性地提高,在0.5%浓度时,细胞活力提升率高达54.34%。
图6 SGS对Episkin刺激损伤后组织结构的改善作用
皮肤组织结构的改变如图7所示,与正常对照组相比,1.25%的SLS处理后,蓝色(基底层、棘层和颗粒层细胞的细胞核)明显减少,细胞间连接降低、间隙增大、角质层变薄,说明SLS刺激下,表皮层结构紊乱、活细胞数量减少、皮肤屏障受损。使用0.125%或0.25%浓度SGS时,蓝色明显增加、细胞间连接紧密及细胞间隙缩小、角质层增厚,与细胞活力的变化趋势一致。

图7 SGS对Episkin刺激损伤后组织结构的改善作用(HE染色,200×)
再对培养上清液中的初始细胞因子IL-1α、PGE2进行检测。与正常对照组相比,1.25% SLS处理后,IL-1α、PGE2表达量分别7.1 pg/ml、97.8 pg/ml上升至110.0 pg/ml、401.5 pg/ml。0.0625%~0.5%浓度的SGS共同处理时,与模型对照组相比,IL-1α、PGE2表达量均有显著剂量依赖性下降,在0.5%浓度时,抑制率为28.28%、48.38%(见图8)。因此,SGS对SLS刺激表皮组织所产生的初始促炎细胞因子也具有抑制作用。

图8 SGS对Episkin刺激损伤后促炎细胞因子的抑制作用
2.5 SGS对CAM血管刺激损伤的缓解作用:为进一步探讨SGS对血管刺激的影响,选择CAM作为体外替代模型进行研究。通过对不同浓度SLS的血管刺激性程度探索发现,0.05%SLS对CAM造成轻微刺激,而0.1% SLS为中度刺激性,0.5%SLS可造成重度刺激性。中度刺激下,血管溶解现象即可出现,且无法逆转。因此,选择0.05%的SLS作为刺激物进行测试。如图6所示,0.05% SLS处理CAM后,血管在300 s内出现轻微出血,IS值为2.28±0.54,属于轻微刺激性。而使用含1% SGS与0.05% SLS的混合液处理CAM时,300 s内未见血管出血,IS值为0,属于无刺激性。见图9。
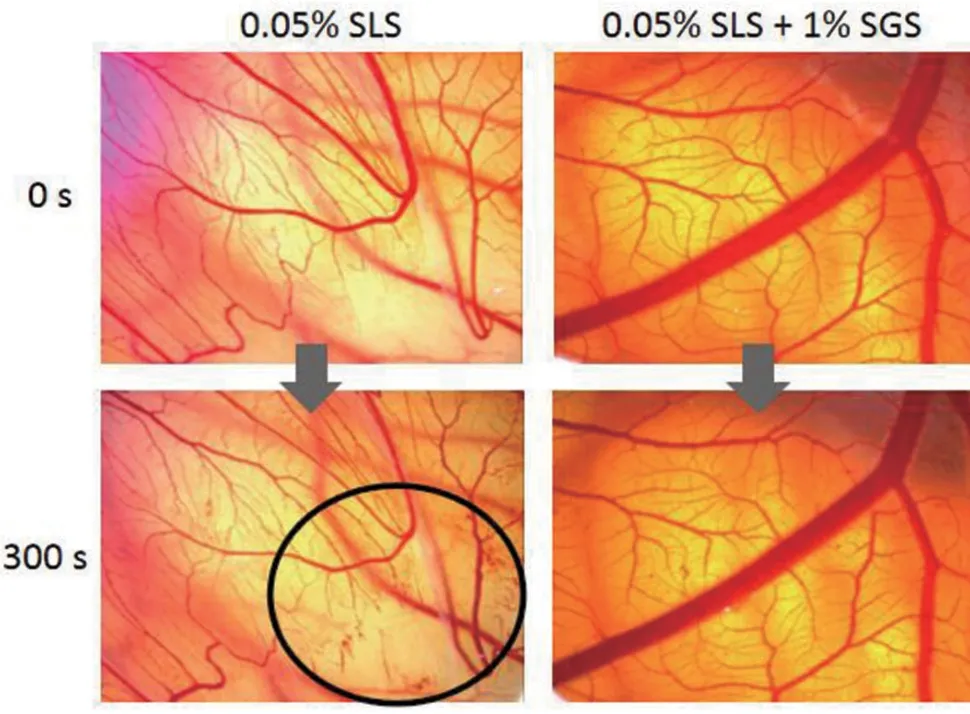
图9 SGS对CAM血管刺激损伤的保护作用(标记处为血管损伤部位)
3 讨论
敏感性皮肤的发生诱因中,不良的护肤习惯和使用非法添加激素等成分的护肤品起主要作用[10]。不良护肤习惯主要体现在反复多次的对皮肤清洁,而表面活性剂是许多皮肤清洁剂(如洗手液、洗衣液、洁面乳)的基础成分也是诱发皮肤屏障功能紊乱、皮肤刺激性、皮肤敏感性的主要因素之一[11]。根据前人文献[12-15],推测表面活性剂启动和调节皮肤刺激性的主要途径为刺激物先通过角质层造成屏障功能损伤,同时诱导皮肤表皮层细胞产生初级刺激性因子,进而再激活真皮层细胞产生级联放大反应,最终让皮肤出现皮肤干燥、绷紧、粗糙、脱屑、龟裂、红斑、红疹、水肿、痒、痛等各种临床症状。因此,本研究选择HaCaT细胞、Raw264.7细胞、重组表皮模型和CAM建立基于皮肤刺激损伤的评价模型,来探讨皮肤刺激性发生的分子机理,同时进行植物提取物的筛选。
皮肤作为人体最大的器官,是抵御外源物理化学刺激的第一道防线,角质形成细胞是表皮中的主要细胞类型[16],刺激物作用于皮肤,会引起表皮层的刺激损伤[17]。表面活性剂通过角质层渗透到皮肤深层区域,也可诱发巨噬细胞、单核细胞释放促炎细胞因子,如IL-1、IL-6、IL-8和PEG2等[18]。表面活性剂刺激角质形成细胞启动IL-1α释放,并随后导致次级细胞因子(IL-6等)的表达量增加及激活磷脂酶A2,促进PGE2的产生,引发血管扩张,血流减慢等变化,最后出现红斑、水肿、痒、痛等皮肤刺激性典型症状[19]。因此,血管扩张和血流减慢是皮肤刺激性临床红斑形成的最直接因素[20]。越来越多的证据表明皮肤刺激性发生是一个复杂的、相互关联的过程,涉及皮肤屏障完整性、细胞变化和各种促炎介质释放。本研究发现,SLS刺激后,参与表皮层分化的KRT10、KRT16和参与皮肤水合的AQP3基因表达量均下降,而角化包膜组成的关键蛋白LOR、FLG以及促进丝聚蛋白降解的CASP14基因的表达量均上升,说明SLS通过调控皮肤屏障相关基因的表达,从而抑制细胞分化,影响皮肤屏障功能。同时,显微镜下观察SLS刺激后的角质形成细胞形态和表皮模型结构,说明SLS通过影响角质形成细胞间的连接及细胞内部结构的变化影响细胞和皮肤。研究发现,表皮细胞在免疫监视和表皮炎症的启动和调节中起着至关重要的作用[21]。大量体外研究还表明,各种刺激物可诱导角质形成细胞中IL-1α表达, IL-1α的激活会刺激周围表皮细胞、真皮细胞、巨噬细胞进一步产生促炎细胞因子和趋化因子,如IL-1、IL-6、IL-8、PGE2。本研究发现,IL-1α、IL-6和PGE2的表达量在SLS刺激状态下均显著上调。此外,本文通过CAM模拟血管损伤反应试验表明SLS可导致血管出血损伤。
综上所述,SLS通过刺激细胞损伤、上调促炎细胞因子、破坏表皮结构和血管损伤的机制诱发皮肤刺激反应。SGS通过改善SLS对角质形成细胞的损伤,促进皮肤屏障修复相关基因表达,降低促炎因子IL-1α、IL-6、PGE2的表达,缓解血管损伤的机制来降低皮肤刺激性。
