miR396-MsGRFs参与调控紫花苜蓿愈伤组织再生
2022-12-01陈筱冉严建萍仇如梦刘燕蓉张万军
陈筱冉,严建萍,仇如梦,刘燕蓉,张万军
(中国农业大学草业科学与技术学院,北京 100193)
紫花苜蓿(MedicagosativaL.)是我国重要的豆科牧草,被誉为“饲料皇后”[1],是我国广泛栽培的优良牧草[2],其具有异花授粉、同源四倍体、自交不亲和等特性。这些特性使得我国紫花苜蓿育种手段一直停留在以群体选择和杂交选育为主的传统育种阶段[3-5]。现有的高新育种技术手段如转基因、基因编辑、分子设计育种等几乎未进入牧草育种领域,而这些技术的实施都是基于高效的遗传转化体系。因此,转化体系的缺乏或不成熟是限制牧草分子育种的“卡脖子”技术之一[5]。在遗传转化过程中,如何刺激转基因细胞再生成完整可育的植株一直是植物育种者努力攻克的难题[6]。
紫花苜蓿不同基因型对愈伤组织体细胞胚的产生具有十分显著的影响,有些研究者甚至认为其产生的影响可以使培养基的差异忽略不计[6]。研究发现,苜蓿的杂合程度和胚状体及再生苗的形成呈正相关,并且再生率高的材料用不同方式培养均可获得愈伤组织,其他基因型对形成愈伤及再生条件都更加严格[7-9]。因此,苜蓿及多数草类植物的研究开始趋向于探索特定品种的培养条件。这严重限制了苜蓿遗传改良中种质资源的利用和育种进程。
近年来,研究者鉴定了一批参与体细胞胚胎发生及形态建成的基因,如生长调控因子(GROWTH-REGULATING FACTOR,GRF)转录因子家族基因[6]。在多种植物中研究发现,异位过表达参与分生组织维持、体细胞胚胎发生或植物激素代谢的基因可克服植物再生障碍,这为体细胞再生及遗传转化提供了有用的工具[6]。GRF家族为植物体内保守的转录因子家族,其编码的蛋白含有的QLQ和WRC结构域,分别介导蛋白质-蛋白质和蛋白质-DNA的相互作用[10-12]。许多被子植物和裸子植物的GRF携带microRNA396(miR396)的靶位点,受miR396转录后剪切调控[13]。目前研究认为,miR396-GRF通路是调控植物器官大小的重要途径。其主要通过促进细胞增殖和生长,从而调控各器官的生长发育,如叶片扩张、茎和根的伸长、种子和花的形成等[14-15]。另外,植物体内GRF蛋白与GIF辅助因子形成复合物,这些复合物在体内也与染色质重塑复合物相互作用[16-17]。近年来研究发现,过表达小麦GRF4-GIF1嵌合体的转基因植物均表现出正常的表型,其再生效率较空载体对照高7.8倍[18]。GRF5的异位表达,在促进各种作物物种的再生和遗传转化中有积极的作用[19]。而紫花苜蓿miR396-GRF通路基因信息及其对苜蓿再生的影响尚未见报道。
本研究中,我们鉴定了紫花苜蓿中含有miR396靶位点的MsGRFs基因,通过过表达MIM396基因获得miR396降低的转基因植株,评价转基因植株愈伤组织的再生效率及愈伤组织中MsGRFs基因的表达量,探究miR396-MsGRFs通路调控紫花苜蓿愈伤再生的功能。本研究的实施为提高苜蓿再生效率及打破再生过程中的基因型限制提供基因资源。
1 材料与方法
1.1 试验材料
以紫花苜蓿‘中苜1号’植株成熟叶片为试验材料。
1.2 试验方法
1.2.1MsGRFs基因查找及miR396结合位点预测 利用NCBI在线分析软件(https://www.ncbi.nlm.nih.gov/)查找拟南芥9个GRF蛋白的氨基酸序列,分别为AtGRF1(AT2G22840.1),AtGRF2(AT4G37740.1),AtGRF3(AT2G36400.1),AtGRF4(AT3G52910.1),AtGRF5(AT3G 13960.1),AtGRF6(AT2G06200.1),AtGRF7(AT5G53660.1),AtGRF8(AT4G24150.1),AtGRF9(AT2G45480.1)。以拟南芥AtGRFs氨基酸序列为模板,在紫花苜蓿基因库The Alfalfa Gene Index and Expression Atlas Database(AGED,http://plantgrn.noble.org/AGED/index.jsp)中利用TBLAST在线比对,查找紫花苜蓿MsGRFs基因。利用DNAMAN6.0和MEGA5.0软件对紫花苜蓿和拟南芥GRF蛋白的氨基酸序列进行比对与进化树分析。利用免费RNA分析网站miRBase(http://www.mirbase.org/)和RegRNA 2.0(http://regrna2.mbc.nctu.edu.tw/index.html)对紫花苜蓿GRF基因和miR396的结合位点进行预测。
1.2.2愈伤组织诱导及分化 选取两株‘中苜1号’紫花苜蓿植株(WT49和WT1)叶片作为外植体,50%次氯酸钠(NaClO)溶液震荡漂洗5 min左右,无菌水冲洗5~10次。将消毒处理后的叶片置于愈伤诱导培养基(MS 4.43 g·L-1+蔗糖30 g·L-1+ 2,4-D 4 mg·L-1+ 6-BA 0.2 mg·L-1+琼脂8 g·L-1,pH值5.8),(25±1)℃,暗培养4周。将愈伤组织转接至分化培养基(MS 4.43 g·L-1+蔗糖30 g·L-1+ 2,4-D 2 mg·L-1+ KT 0.05 mg·L-1+琼脂8 g·L-1,pH值5.8),16 h光照/8 h黑暗,(25± 1)℃,培养,每2周继代一次。分别取未分化的愈伤组织及胚性化愈伤组织为样品,液氮速冻,用于基因表达检测。
1.2.3基因表达量检测 Trizol法提取愈伤组织RNA,取1 μg RNA为模板,应用反转录试剂盒(RR047,Takara)合成第一链cDNA。以cDNA为模板,应用Starlighter SYBR Green qpcr Mix(北京启衡星生物科技有限公司,FS-Q1002)试剂,qTOWER3G(analytik jena)仪器进行基因表达量检测。利用2-ΔΔCT方法[20]计算miR396和MsGRFs的表达量。每个处理3个生物学重复,应用SAS9.0软件进行统计分析。引物信息详见表1。

表1 基因及引物信息
1.2.4农杆菌介导的遗传转化 菌液制备:将已报道的抑制miR396表达的MIM396基因[21]重组至植物表达载体pZH01中导入农杆菌EHA105,潮霉素基因为筛选标记基因。将含有目的基因的农杆菌用YEP培养基(NaCl 10 g·L-1+酵母提取物5 g·L-1+胰蛋白胨10 g·L-1)摇培至OD600≈0.8。菌液3 000 r·min-1离心10 min,用重悬液(MS 4.43 g·L-1+蔗糖30 g·L-1+ 2,4-D 4 mg·L-1+ 6-BA 0.2 mg·L-1+乙酰丁香酮100 μM,pH值5.4)重悬菌液至OD600至0.5,28℃放置30 min,备用。
农杆菌侵染:以‘中苜1号’紫花苜蓿成熟叶片为外植体,消毒处理后的叶片切为0.5×0.5 cm2左右大小,浸泡于侵染液,负压处理10 min。然后80 r·min-1摇培浸染20 min,弃菌液。将侵染后的叶片置于含有一层无菌滤纸的共培养基中(MS 4.43 g·L-1+蔗糖30 g·L-1+ 2,4-D 4 mg·L-1+ 6-BA 0.2 mg·L-1+乙酰丁香酮150 μM +琼脂8 g·L-1,pH值5.8),暗培养3天。
筛选培养及分化:将共培养后的植物材料置于筛选培养基(MS 4.43 g·L-1+蔗糖30 g·L-1+ 2,4-D 4 mg·L-1+ 6-BA 0.2 mg·L-1+特美汀200 mg·L-1+潮霉素10 mg·L-1+琼脂8 g·L-1,pH 5.8),光照培养2周。两周后将愈伤组织置于添加有200 mg·L-1特美汀和10 mg·L-1潮霉素的分化培养基中进行胚状体诱导。2周继代一次。将胚状体转接至生根培养基中(MS 2.95 g·L-1+蔗糖15 g·L-1+特美汀200 mg·L-1+潮霉素2 mg·L-1+琼脂8 g·L-1,pH值5.8),16 h光照/8 h黑暗,(25±1)℃培养,直至生长出再生植株。将再生植株移栽移栽至土壤中,置于日光温室培养。
1.2.5转基因材料鉴定 以野生型和转基因抗性紫花苜蓿植株叶片为材料,利用CTAB法提取总DNA,以35 s_F:GAAACCTCCTCGGATTCCATT和MIM396_R:GAGGAATTCACTATAAAGAGAATCG为引物,进行PCR检测。Trizol法提取植株叶片总RNA。取1 μg RNA为模板,以stem-loop miR396a:GTCGTATCCAGTGCAGG-GTCCGAGGTATTCGCACTGGATACGACCAG-TTC为引物,应用反转录试剂盒(RR047,Takara)合成第一链cDNA。以cDNA为模板,以miR396_F:CGGCGGTTCCACAGCTTTCTT和miR396_R:GTGCAGGGTCCGAGGT为引物,依据上述方法检测miR396的表达量。每个处理3个生物学重复,应用SAS9.0软件进行统计分析。
1.2.6再生效率比较 以野生型紫花苜蓿植株M49-5和转基因阳性植株M17成熟叶片为外植体。消毒处理后,置于愈伤诱导培养基中,光照培养。培养2周后,取叶片诱导的愈伤组织液氮速冻,用于基因表达检测。培养4周后,统计总外植体数量及再生出胚状体的外植体数量,计算分化率(再生外植体数/总外植体数×100%)。每个材料包括2个生物学重复,应用SAS9.0软件进行统计分析。
2 结果与分析
2.1 紫花苜蓿MsGRFs基因鉴定
以AtGRF蛋白序列为模板,在紫花苜蓿基因组数据库同源比对获得9个MsGRFs基因。MsGRFs和AtGRFs蛋白序列构建系统进化树,发现两者具有较高的同源性(图1A)。依据进化关系将MsGRFs命名为:MsGRF1a(contig_6458),MsGRF1c(contig_6458),MsGRF1e(contig_55260),MsGRF3a(contig_100313),MsGRF3c(contig_20682),MsGRF4a(contig_68482),MsGRF5b(contig_100394),MsGRF7a(contig_100293),MsGRF9a(contig_106145)。对MsGRFs基因CDS序列中miR396的靶点进行预测。发现6个GRF有zma-miR396c(MIMAT0010076)的靶点,另外3个则有zma-miR396 g×(MIMAT0015351)的靶点,初步确定这些MsGRFs基因为miR396靶基因(图1B)。
2.2 MsGRFs在紫花苜蓿胚性愈伤中高表达
为了研究GRF家族基因是否参与调控紫花苜蓿愈伤组织再生,我们分别比较了两个‘中苜1号’植株胚性愈伤组织(WT49ec和WT1ec)和非胚性愈伤组织(WT49c和WT1c)中MsGRFs的表达(图1C和1E)。如图1D所示,在胚性愈伤组织WT49ec中,除MsGRF3a外,其余8个MsGRFs的表达量均显著高于WT49c。其中,MsGRF1a,MsGRF1c,MsGRF4a和MsGRF9a在WT49ec中的表达量为在WT49c中的5~7倍;MsGRF1e,MsGRF3c和MsGRF5b在WT49ec中的表达量比在WT49c中高20~80倍;在WT49ec中,MsGRF7a的表达量最高,相当于WT49c材料中的600多倍。在WT1ec中,除MsGRF3a和MsGRF4a外,其余MsGRFs的表达量均显著高于(约为5~20倍)其在WT1c中的表达(图1F)。以上结果暗示,GRF家族基因可能参与调控紫花苜蓿愈伤组织胚状体产生。
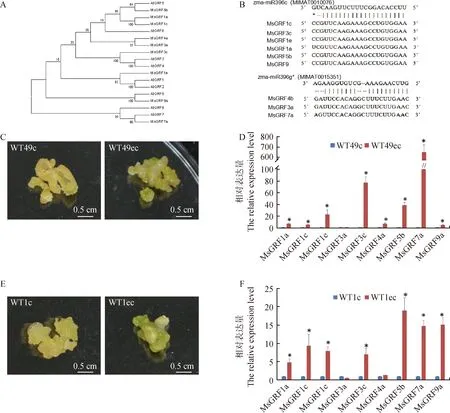
图1 紫花苜蓿MsGRFs基因鉴定及表达模式分析
2.3 过表达MIM396转基因紫花苜蓿的获得
为了研究MsGRFs对紫花苜蓿愈伤再生效率的影响,我们借助Target mimicry技术降低苜蓿体内miR396的活性(图2A)。通过农杆菌转化法,将MIM396基因转入‘中苜1号’紫花苜蓿中,经PCR检测获得7个转基因阳性株系(图2B)。选取M49-5和M17为本研究试验材料,qRT-PCR结果表明转基因植株M49-5和M17叶片中miR396的含量显著降低(图2C)。
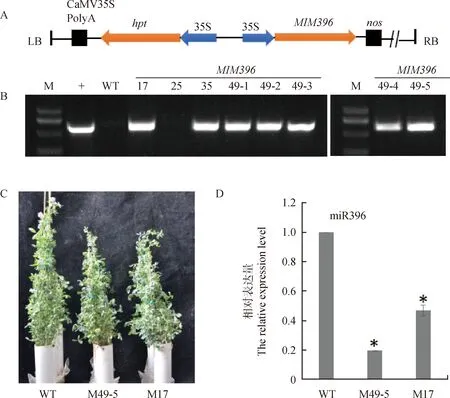
图2 过表达MIM396植物表达载体及转基因紫花苜蓿分子鉴定
2.4 过表达MIM396转基因紫花苜蓿愈伤再生率提高
为了研究miR396-MsGRF通路对紫花苜蓿愈伤再生效率的影响,我们以WT,M49-5和M17的成熟叶片为外植体诱导愈伤组织。结果发现,在愈伤诱导培养基(含2,4-D 4 mg·L-1和 6-BA 0.2 mg·L-1)中培养4周后,野生型植株叶片产生愈伤组织,但无胚状体产生,MIM396转基因株系叶片产生的愈伤组织直接分化产生胚状体,分化率达80%以上(图3)。以上结果表明,抑制miR396活性后可促进愈伤组织分化,并且降低了再生过程中对细胞分裂素的需求。
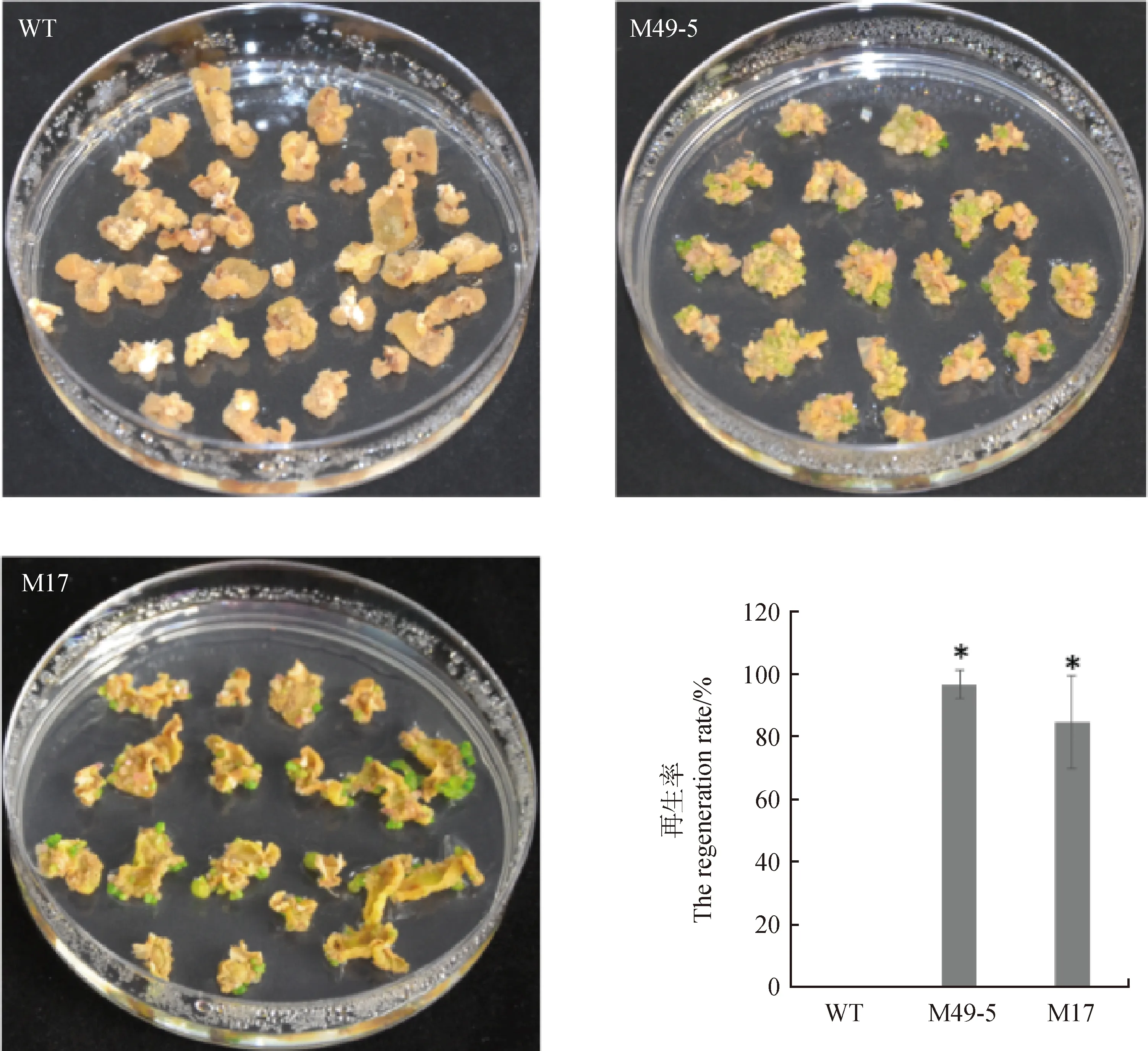
图3 野生型(WT)和MIM396过表达植株(M49-5和M17)愈伤分化率检测
2.5 过表达MIM396紫花苜蓿愈伤中MsGRFs显著高表达
对WT和M49-5植株成熟叶片诱导2周产生的愈伤组织中MsGRFs的表达量进行检测。结果如图4所示,除MsGRF3a外,其余8个MsGRFs的表达在M49-5c中显著高于其在WTc中的表达。其中,MsGRF3c和MsGRF5b的表达量在M49-5c中超过在WTc中200倍,可能是促进愈伤组织再生的主要GRF基因。
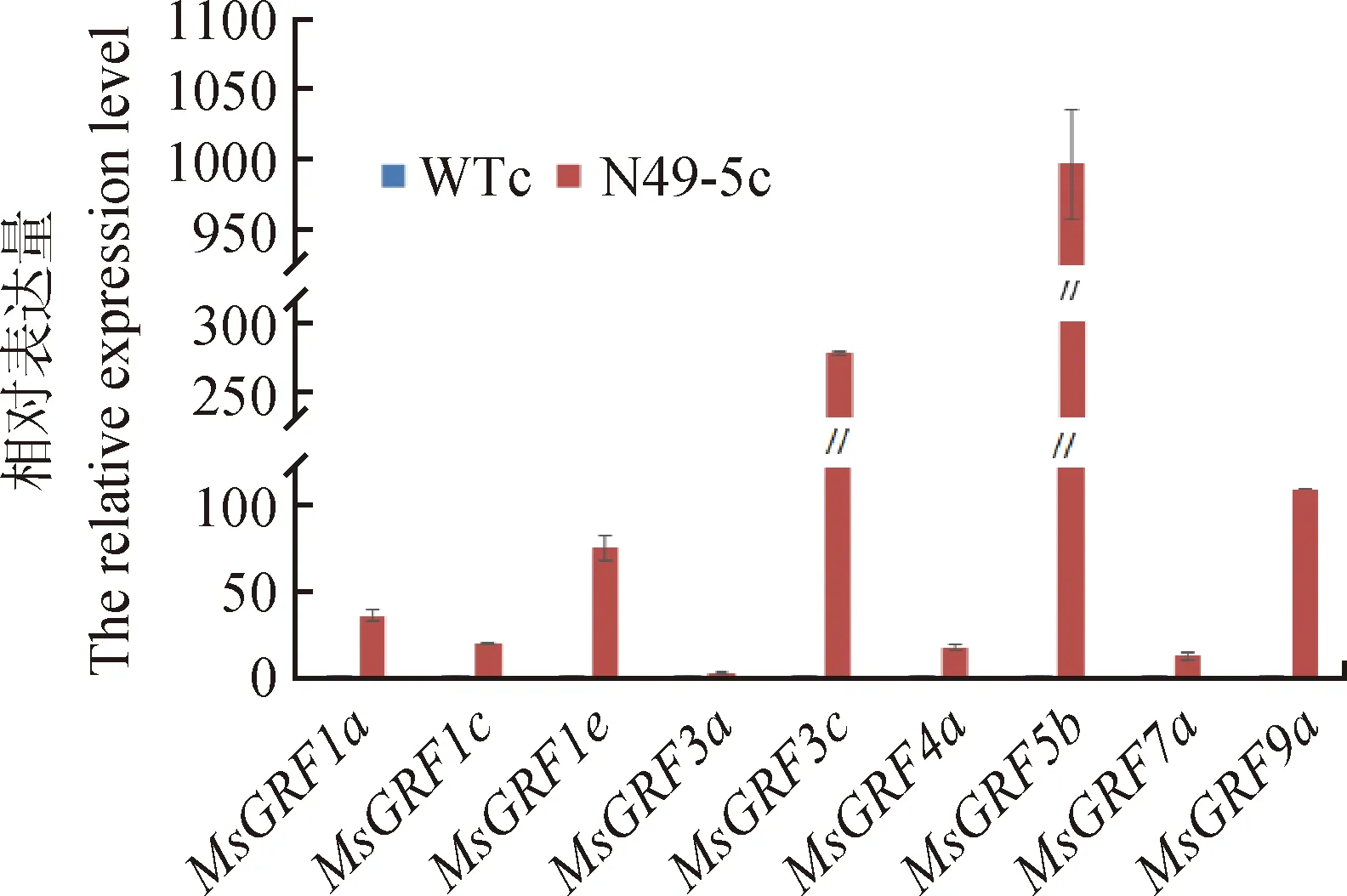
图4 野生型愈伤组织(WTc)和MIM396植株愈伤组织(M49-5c)中MsGRFs表达模式
3 讨论
在植物组织培养过程中,调控培养基中生长素和细胞分裂素的组合及含量是调控愈伤组织再生的主要方法[22]。而建立一个成功的再生体系通常需要针对外植体自身定制植物激素比例及其他影响因素条件,不仅费时费力,而且受基因型限制常导致无法成功[3]。紫花苜蓿具有复杂的遗传背景,目前仅有十几个品种对组培再生体系进行了探索,且再生效率较低[3]。如抗逆性强的‘中苜1号’品种,再生及转化效率不足5%[23]。近年来,人们逐渐认识到通过对外部条件如培养基、外植体、菌株等的优化已很难将苜蓿的再生效率进行大幅度的改良。因此,亟需针对影响植物再生的内在因素进行调控及改良[6]。据报道,利用形态发生基因的表达是克服基因型限制再生这一障碍的有效策略[6,24]。本研究中,我们发现预测的8个miR396靶MsGRFs基因在胚性愈伤中显著上调,进一步通过抑制紫花苜蓿中miR396表达,从而提高其靶基因MsGRFs表达,可显著提高紫花苜蓿再生效率。
miR396-GRF通路在促进细胞增殖和生长,调控各器官的生长发育中具有保守性功能[14-15]。近年来研究发现,GRF转录因子家族的成员可以用于改进基于器官发生或胚胎发生的遗传转化效率[18-19,25]。植物中GRF家族基因多为miR396的靶基因,本研究鉴定了9个含有miR396的MsGRFs基因,并且其中8个在胚性愈伤中显著高表达。为了研究GRF家族基因在紫花苜蓿再生中的功能,我们过表达了MIM396基因,抑制了转基因苜蓿中miR396的表达,间接提高了8个MsGRFs的表达量。组培试验发现,MIM396转基因植株叶片再生率显著提高。在小麦中也发现,过表达抗miR396剪切的rGRFs相比过表达GRFs可进一步提高愈伤再生效率[18]。说明miR396-GRF通路参与调控植物再生效率的功能在紫花苜蓿中具有保守性。
一般情况下,紫花苜蓿叶片诱导的愈伤组织通常需要在含有高水平细胞分裂素的培养基中诱导胚状体产生[23]。而此过程往往需要根据愈伤组织状态多次调整激素含量,费时费力。以过表达MIM396的植株叶片为外植体,诱导的愈伤组织在含有较高水平生长素的培养基中即可分化出胚状体,这大大缩短了再生时间。相似的是,过表达GRF4-GIF融合基因的小麦愈伤组织,在不含有细胞分裂素的培养基中即可分化出再生芽[18]。作者推测,这可能是由于GRF-GIF复合物在促进植物细胞增殖的能力有关[26]。
研究表明,一些发育基因的持续过表达导致了植物发育过程中严重的生长缺陷,如营养器官和生殖器官的异常发育和不育,如过表达AP2/ERF家族的一种转录因子BABY BOOM(BBM)和WUS基因等[27-28]。本研究发现,过表达MIM396转基因苜蓿虽然显著提高了叶片愈伤再生效率,但显著抑制了转基因植株地上部分的生长。因此,使用这些发育基因仍然需要通过基因切除或使用诱导性或组织特异性启动子等方法来限制或消除它们在植物中的持续表达[29-30]。因此,如何应用MIM396基因使之促进苜蓿再生的同时不影响植株生长发育仍需进一步研究。
GRF为多基因家族,不同的GRF基因在提高植物再生效率中作用不同[18]。在小麦中含有10个GRF基因,研究者发现GRF4-GIF1和GRF5-GIF1融合表达后可显著提高小麦的再生效率,其中GRF4-GIF1融合表达后愈伤的再生率最高,而GRF1和GRF9基因分别与GIF1融合表达后对小麦再生效率无显著影响[18]。但是,在本研究中鉴定获得的9个MsGRFs基因中,比较其在野生型胚性愈伤组织及MIM396转基因材料愈伤组织中表达,MsGRF3c,MsGRF5b均显著高表达,而MsGRF4a虽然也均上调,但上调倍数显著低于MsGRF5b的表达量。研究发现,拟南芥GRF5(AtGRF5)在愈伤组织细胞中的异位表达加速了芽的形成,显著提高了转化效率。AtGRF5和GRF5同源物引入油菜(甘蓝型油菜)、大豆和向日葵中,均显著增加了外植体组织的遗传转化。过表达GRF5,AtGRF6和AtGRF9对油菜中转基因愈伤组织细胞的增殖均有积极作用。在大豆和向日葵中,GRF5基因的过表达似乎增加了转化细胞的增殖,促进了转基因芽的形成。此外,两个AtGRF5同源基因在玉米(ZeamaysL.)中的转化显著提高了转化效率,并获得了完全可育的转基因植株[19]。因此我们推测在MIM396转基因材料中,MsGRF3c和MsGRF5b可能是促进紫花苜蓿再生的重要GRF基因。
4 结论
本研究在紫花苜蓿中鉴定了9个含有miR396靶位点MsGRFs基因,除MsGRF3a外,其余MsGRFs基因均显著响应愈伤组织胚性化。过表达MIM396基因,间接提高MsGRFs表达,可显著提高苜蓿叶片的再生效率和速度,消除愈伤组织再生对细胞分裂素的需求。结合靶MsGRFs在胚性与非胚性愈伤组织、MIM396转基因及野生型愈伤组织间的表达模式,我们推测MsGRF3c和MsGRF5b可能在促进苜蓿再生中起着重要作用。总之,我们明确了miR396-MsGRF通路在苜蓿再生中的重要作用,为提高苜蓿再生效率,并打破基因型对不同苜蓿品种再生的限制提供了候选基因。
