海绵动物共附生石油烃降解菌的筛选、复配及其降烃影响因素响应面优化
2022-12-01侯亚楠刘书伟张田田王阿文沈梦霞
侯亚楠, 刘书伟, 王 燕, 张田田, 王阿文, 沈梦霞
(海南热带海洋学院 生态环境学院, 海南 三亚 572022)
0 引言
石油被誉为工业的血液,它不仅是社会发展的重要能源,也是许多化工产品的原料[1].近年来,在石油开采、炼制和运输等过程中,溢油事故频发[2],释放到海洋环境中的石油烃化合物影响海洋生态系统,进而威胁人类健康[3].消除石油污染和保护海洋环境已经成为全世界关注的环境问题[4].目前,海洋石油烃污染的处理方法主要有物理法、化学法和生物法[5],但物理法处理不彻底,化学法易造成海洋环境二次污染,生物法具有降油效果好、成本低和二次污染小等优点,因此,生物法已成为最具有应用前景的石油烃污染的修复技术[6].然而,海洋溢油事件发生后,常采用围油栏、撇油器收集海面上大量的石油烃,对于已扩散或残留的石油烃,暂无有效的处理方法,进一步分散到海水中,致使这类石油烃污染物的集中处理成为一个难题.
海绵是一种多细胞滤食性海洋动物,具有较强的泵水能力,每天泵水量可达自身的体积的170~72 000倍,加勒比海的海水几乎每天都被海绵过滤一遍[7].海绵动物独特的孔状结构使其成为许多海洋微生物的优良宿主[8],其滤食性使微生物在海绵体内不断积累,并与之形成共生体,所以海绵动物体内含有大量微生物,许多种类其体内微生物的比重高达40%~60%[9].海绵-微生物共生体类似于布满微生物的筛子——“微生物筛”,其利用海绵动物不断泵水的特征,将海水源源不断地泵入“微生物筛”,海水中的污染物在通过“微生物筛”时,有一部分被微生物降解,所以,海绵-微生物共生体对海水具有一定的净化能力[10].可见,从海绵中分离具有降解功能的微生物,用于海洋环境的生物修复具有非常重要的意义.
本研究从海绵动物中筛选降烃菌株,并对其进行鉴定、复配和响应面优化实验,探讨和分析不同温度、pH值、转速和石油烃浓度等环境因素对目标菌株降烃效果的影响,以期构建具有良好降烃效果的海绵-降烃菌株共生体,从而解决海洋石油烃污染物难以集中处理的问题.
1 实验部分
1.1 试验材料
1.1.1 主要材料
海绵动物样品取自海南省黎族自治县清水湾;实验所用石油烃由中国海洋石油集团有限公司提供,密度为0.92 g/mL.
1.1.2 主要试剂
氯化钠(AR)、磷酸氢二钠(AR)、氯化铵(AR)、硫酸镁(AR)和硝酸钾(AR)等试剂购自天津市福晨化学试剂厂,石油醚(AR)购自西陇科学股份有限公司,D2000 DNA Marker、2×Taq PCR Master Mix购自天根生物科技有限公司.
1.2 主要仪器设备
DGL-35B高压灭菌锅(上海力辰邦西仪器科技有限公司)、UV-5100紫外分光光度计(上海元析仪器有限公司)、Flexcycler多功能PCR仪(德国耶拿分析仪器股份公司)、Enduro GDS凝胶成像系统(深圳市赛进生物科技有限公司)等.
1.3 试验方法
1.3.1 石油烃降解菌的富集、分离和纯化
将海绵剪碎后置于无菌研钵中,并加入适量无菌海水,充分研磨后取上清液5 mL于100 mL石油烃培养基[11]中,在28 ℃、160 r/min条件下富集7 d,当培养基中出现浑浊现象,取5 mL培养液转入100 mL新鲜的石油烃培养基中,连续富集3次后,对降烃菌进行稀释涂布和纯化[12].
1.3.2 石油烃降解率的测定
采用紫外分光光度法[13]绘制石油烃标准曲线,以石油烃浓度为横坐标,吸光度为纵坐标,得到标准曲线方程为y=0.005 5x-0.005 9,R2=0.999 1;石油烃降解率计算公式[14]如式(1)所示:

(1)
1.3.3 菌株的鉴定
以降解率为指标,优选降烃效果最佳的3株单菌株进行鉴定,如果3株单菌株种属相同,则鉴定降烃效果次之的单菌株,以此类推,直至选出降烃效果最佳的3种菌株.鉴定方法采用16S rDNA测序,即:将菌株培养至对数期,离心并提取总DNA,以总DNA为模板,采用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-CTACGGCTACCTTGTTACGA-3′)进行PCR扩增,取5 μL PCR产物在琼脂糖凝胶上电泳20 min,送至上海生工生物公司进行测序.测序结果运用Genbank中的BLAST进行序列比对,鉴定菌株的种属,并采用MEGA7.0软件建立发育树.
1.3.4 石油降解复合菌系的构建
对优选的3种菌株采用2种菌种或3种菌种复配,共计4个组合.组合内各菌株量比例相等,每个组合菌株总浓度相等(用无菌生理盐水调节对数生长期的菌株浓度为OD600=1.5),从每个组合中取体积1 mL的菌液分别加入4个50 mL石油烃培养基中,并设置空白对照(无菌的50 mL石油烃培养基),30 ℃、160 r/min培养7 d.测量各培养基中石油的含量,计算降解率,选择降解率最高的一组作为优势菌群进行下一步试验.本实验设置三个重复.
1.3.5 单因素试验
参考吴秉奇等[15]的方法并改良设定单因素试验的培养条件:(1)培养温度:20 ℃、25 ℃、30 ℃、35 ℃和40 ℃;(2)培养基初始pH值:5.6、6.4、7.2、8.0和8.8;(3)摇床转速:120 r/min、140 r/min、160 r/min、180 r/min和200 r/min;(4)石油烃初始浓度:10 g/L、20 g/L、30 g/L、40 g/L和50 g/L.石油烃降解率的测定方法同1.2.2.本实验设置三个重复.
1.3.6 响应面优化条件、模型拟合与验证
根据单因素试验结果,选取对降解率影响较大的3个因素为自变量,以石油烃降解率为响应值,设计3因素3水平响应面试验,对所得结果进行二次回归拟合及方差分析检验,得出各变量最佳参数.按照模型最佳参数进行验证实验,检验模型的可靠性,分析最终优化结果.本实验设置三个重复.
1.3.7 数据统计
利用SPSS19.0软件对试验数据进行统计分析,采用单因素方差分析法进行显著性检验,并选用Origin5.0进行作图,利用Design Expert 8.0软件对响应面实验结果进行分析,并提出回归模型.
2 结果与讨论
2.1 降烃菌株的筛选、鉴定和复配
2.1.1 降烃菌株的筛选
经过稀释涂布法初步分离,筛选降烃菌株23株(图1),分别命名为Y1、Y2、Y3……Y23.根据标准曲线测定菌株的降解率,其中降解率超过20%的微生物有7株,降解率超过30%的微生物有3株为Y2、Y5和Y6,其降解率分别是30.09%、33.90%、30.45%,优选降烃效果最佳的3株单菌株开展后续鉴定实验.如果3株单菌株种属相同,则鉴定降烃效果次之的单菌株,以此类推,直至选出降烃效果最佳的3种菌株.

图1 单菌株对石油烃的降解能力
2.1.2 降烃菌株的鉴定
对菌株Y2、Y5和Y6进行16S rDNA基因扩增与测序,并将所得序列进行BLAST比对,利用MEGA7.0软件的N-J法建立系统发育树,如图2所示.从系统发育树上可以看出,菌株Y2与Stappia属菌株Stappiaconradaestrain MIO处于一个最小的独立分支,且自展支持率为99,并与该属其他物种处于相近却又不同的分支,由此可以鉴定菌株Y2为Stappia属的菌株,并且为Stappiaconradae物种.同理分析可得,菌株Y5为Halomonas属的菌株,并且为Halomonasaquamarina物种;菌株Y6为Sphingopyxis属的菌株,并且为Sphingopyxisterrae物种.
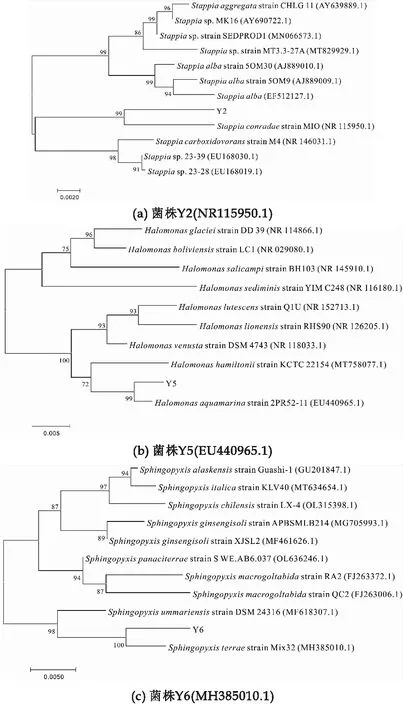
图2 菌株Y2(NR115950.1)、Y5(EU440965.1)和Y6(MH385010.1)的16S rDNA系统发育树
2.1.3 降烃菌株的复配
对Y2、Y5和Y6开展复配实验,其结果如表1所示.由表1可知,复合菌系Y5-Y6对石油烃的降解率最高,因此,选取复配菌群Y5-Y6进行后续的降解条件优化实验.由于石油成分复杂,单一菌株难以完成对石油全组分的降解,通过不同菌株间的共生和协同作用形成复杂的微生物区系,可以实现污染物的有效降解,进而提高石油降解率[16].宁卓等[17]研究发现石油降解菌组合的降解率或高于或低于单菌株的降解率,这是由于微生物之间存在各种相互关系,如共附生、竞争和拮抗等.本研究中也观察到了类似的结果,Y2-Y5-Y6组合的降解率低于Y5-Y6组合,可能是由于微生物之间存在拮抗关系.细菌组合的选定仅靠“降解率”单一指标来进行,各种微生物之间的相互作用以及降解机理有待进一步研究.
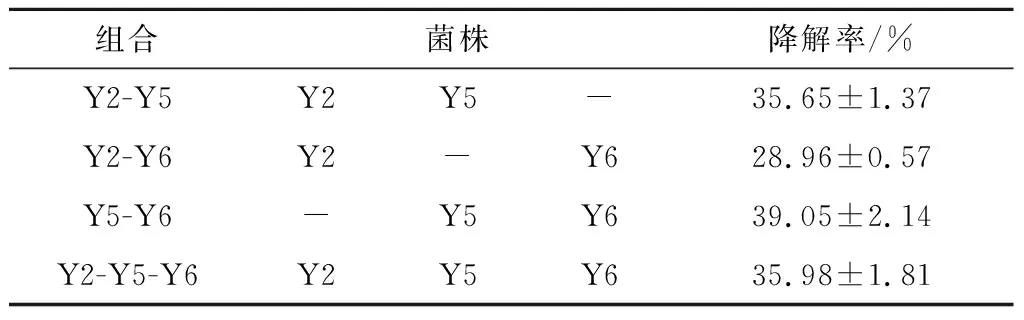
表1 石油混合菌群复配方案及结果
2.2 单因素试验
2.2.1 初始pH值对降解率的影响
酸碱环境是微生物生长代谢的主要影响因素之一,环境pH值过高或过低都会影响微生物酶的活性,从而影响菌株对石油烃的降解.由图3可知,石油烃降解率随着pH值的升高呈现先上升后下降的趋势,其中pH=8.0时降解率达到峰值(39.90%).
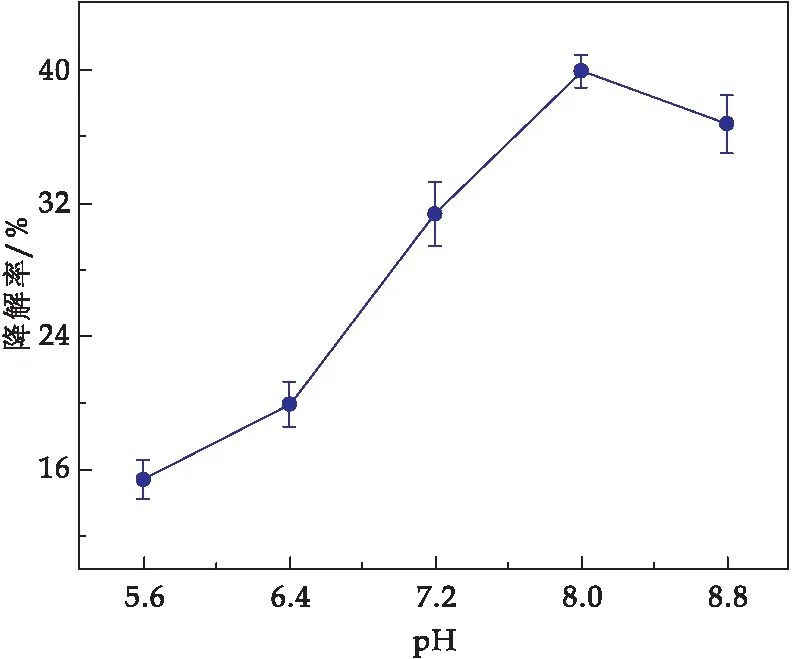
图3 初始pH值对石油烃的降解率影响
2.2.2 石油烃浓度对降解率的影响
图4显示了降解率随石油烃浓度呈先升高后降低趋势,当石油烃浓度为20 g/L降解率达到峰值;石油烃浓度从20 g/L升至50 g/L,降解率急剧下降,同时石油烃的实际降解量也随之降低,说明高浓度的石油烃,抑制了微生物的活性,影响了菌体生长,也会导致溶解氧含量的降低,影响微生物的代谢作用.

图4 石油烃浓度对降解率影响
2.2.3 转速对降解率的影响
由图5可知,随着转动速度由120 r/min提高至160 r/min,组合Y5-Y6的降烃效果逐渐升高,当转速为160 r/min时,石油烃的降解率随着溶解氧的升高而变大;当转速继续上升至200 r/min时,降解效果反倒有所下降,可能是由于振速过高影响细菌与碳源的接触情况.

图5 转速对石油烃的降解率影响
2.2.4 温度对降解率的影响
温度会影响微生物自身的代谢活性[18].由图6可知,组合Y5-Y6降烃的最佳温度是30 ℃,石油烃的去除率达40%以上.当温度低于或高于30 ℃时,酶的活性可能降低,导致该组合的降解率变小.
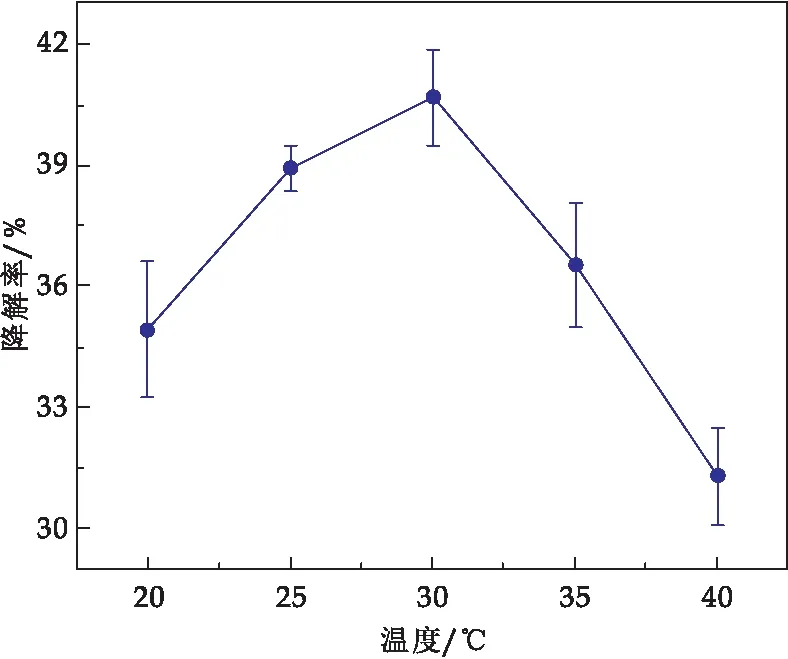
图6 温度对石油烃的降解率影响
2.3 响应面结果分析
2.3.1 响应面法实验方案与结果
利用SPSS对单因素试验结果进行分析,选取对降解率影响较大的3个因素初始pH值、温度和石油烃浓度为自变量,各因子和水平情况见表2所示.依据Box-Behnken 设计原理进行了17次试验,其结果见表3所示.
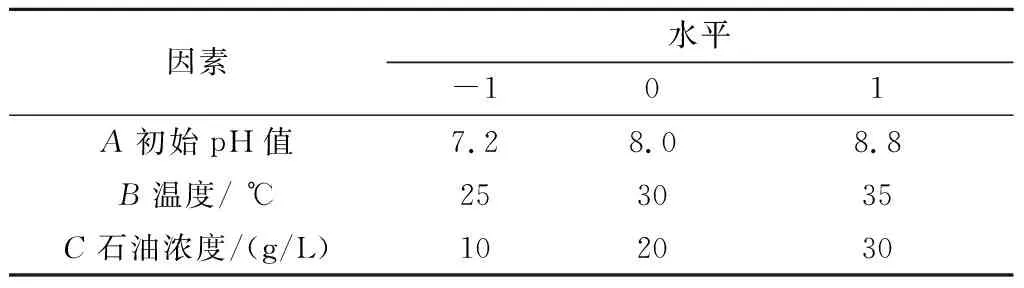
表2 各因子和水平

表3 响应面试验方案及结果
2.3.2 回归方程与方差分析
采用Design Expert 10软件对响应面实验结果进行回归拟合,得出降解率对三个因素的多元二次回归模型:Y=51.22+4.17A+1.71B-6.26C+2.63AB+0.018AC-0.88BC-14.99A2-10.56B2-11.11C2.表4显示,其失拟项P值为0.721 0>0.05,说明该模型建立合理.模型的相关系数R2=0.996 7,表明石油烃降解率的实际值与预测值之间拟合度较好,模型的调整决定系数R2adj=0.992 5,说明有99.25% 的石油烃降解条件可以用该模型进行分析解释.

表4 回归模型方差分析
2.3.3 响应面曲线图和等高线图分析
响应曲面的坡度及等高线的偏离程度可反映两两因素间的交互作用,响应面坡度越陡,表明二者间的交互作用越显著,对石油烃降解率影响较大,反之越平缓则影响越小[19].由图7~9可知,3个因素对石油烃降解率的影响为:C>A>B;在交互项对石油烃降解率的影响中,A与B交互作用显著,A与C、B与C交互作用不显著.这与回归方程模型的方差分析结果一致.
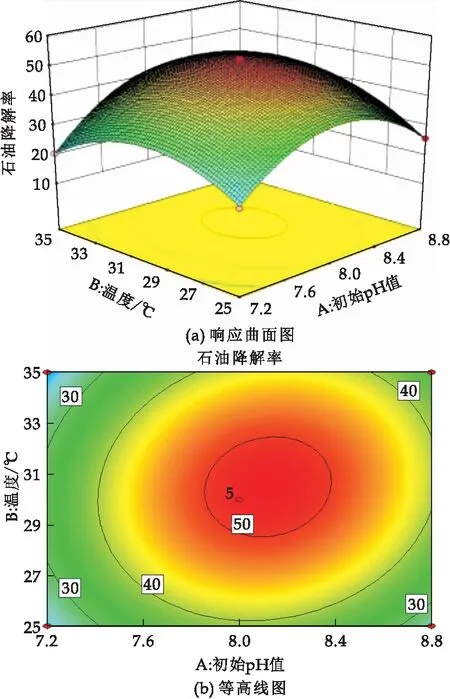
图7 pH值与温度交互影响石油降解率的响应面
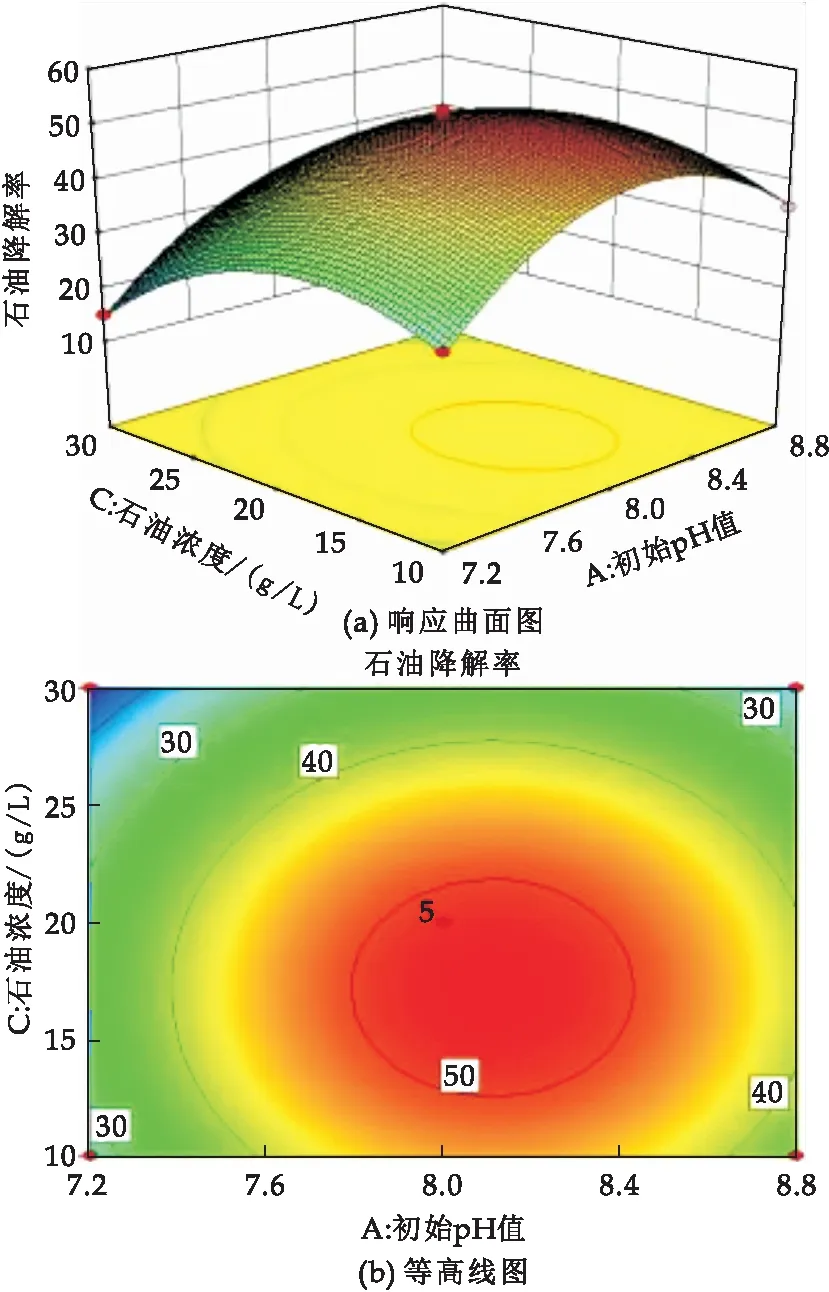
图8 初始pH值与石油浓度交互影响石油烃降解率的响应面

图9 温度与石油浓度交互影响石油烃降解率的响应面
2.3.4 最佳降解工艺及验证实验
利用Design Expert软件对模型方程求解,预测最优条件初始pH值、温度、石油烃浓度相应值为8.12、30.55 ℃、17.14 g/L时,其响应值降解率最大为52.52%.根据实际情况,将浓度和温度分别修改为17 g/L、30.5 ℃,其它条件不变.在此工艺下进行验证性试验,重复3次,得到降解率平均值为50.73%,与模型预测值52.52%吻合度较高,表明该模型可以较好地预测实际情况.
3 结论
(1)本研究从海绵动物中筛选出23株石油烃降解菌,其中有3株细菌石油烃降解率较高,对其进行鉴定得出Y2为Stappiaconradae、Y5为Halomonasaquamarina、Y6为Sphingopyxisterrae.根据菌株复配后组合的降解率可得知,由Y5和Y6组成的菌群组合降解率最高,7 d后,石油烃降解率达到39.05%.
(2)本试验在单因素试验的基础上,通过Box-Bchnken响应面法,对石油烃降解率的影响条件进行了优化,发现对降解率的影响较大的3个因素依次石油浓度>初始pH值>温度;建立了回归模型,该模型预测得到最优条件初始pH值、温度、石油烃浓度相应值为8.12、30.55 ℃、17.14 g/L时,其响应值降解率最大为52.52%,验证试验的石油烃降解率为50.73%.实测值和模型预测值相近,表明该模型可以较好地预测实际情况.
