外源茉莉酸甲酯与根际促生菌对番茄幼苗镉毒性的影响
2022-12-01杨代忠张亚文张春平
魏 婷, 李 红, 杨代忠, 张亚文, 张春平
(1.陕西科技大学 环境科学与工程学院, 陕西 西安 710021; 2.中国建筑材料工业建设西安工程有限公司, 陕西 西安 710000)
0 引言
土壤是一个国家最重要的自然资源,它是农业发展的物质基础,但环境中约90%的污染物存在于土壤中,其中主要以无机污染物为主[1].城市化建设、固体废弃物堆积、农药施用、污水灌溉、污泥农用等人类活动均可使土壤重金属含量增加,污染加重.镉(Cadmium,Cd)是我国土壤重金属污染的主要元素之一,毒性极强,易被植物吸收,不仅对植物的生长发育有抑制作用,还会通过食物链进入人体并在人体内累积,具有致病、致癌和致突变作用[2].2014年全国土壤污染状况调查公报显示,我国土壤重金属总超标率达到16.1%,其中,Cd的点位超标率高达7%[3].因此,土壤Cd污染已经成为了影响生态环境、耕地质量以及制约经济发展的重要因素.
当植物受到重金属胁迫时,会导致植物细胞内活性氧(Reactive oxygen species,ROS)积累并引起膜脂过氧化.丙二醛(Malonyldialdehyde,MDA)作为膜脂过氧化产生的一种有毒物质,是衡量植物细胞膜受到的氧化损伤程度的重要指标[4],研究表明,Cd胁迫会使得植物体内MDA含量升高[5,6].另一方面,ROS能和植物体内的蛋白质和核酸等生物大分子反应从而破坏其结构和功能[7].植物体在未受到生物或非生物胁迫时,ROS的含量处在一个动态平衡的水平,一旦受到胁迫,便会产生过量的ROS,对植物体的正常生长造成影响.但是,植物细胞可通过自身具有的抗氧化系统维持植物体内ROS的动态平衡,该系统包括抗氧化酶系统和非酶系统,抗氧化酶系统由超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、过氧化氢酶(Catalase,CAT)等组成[8].其中,SOD是植物细胞内的第一道氧化防线,它可以催化ROS中的O2-发生歧化反应,转化为H2O2和H2O,接着POD和CAT将反应生成的H2O2和细胞膜脂过氧化累积的H2O2催化分解为H2O和O2,同时,APX对清除植物体内的H2O2有重要的作用,可将其还原为H2O[9],这些抗氧化酶共同协作,共同抵御ROS对植物细胞的伤害.张茂等[10]的研究发现,黑麦草中SOD和POD活性均随着Pb2+,Zn2+和Cd2+胁迫浓度的增加呈现先增加后减少趋势.Hediji等[11]的研究也发现,在Cd胁迫下,豆子中SOD、POD和APX活性都升高.
茉莉酸甲酯(Methyl jasmonate,MeJA)是受外界刺激后反应最快的信号分子之一,作为内源性植物生长调节剂,在植物应激反应和生长调节过程中具有广泛作用[12,13].研究发现,MeJA对于提高植物重金属抗性和调控植物重金属累积具有重要意义[14].Yan等[15]通过对观赏辣椒外源施用MeJA发现,Cd胁迫下可增加观赏辣椒的干重和叶绿素含量.有研究发现[16],MeJA可有效抑制Cd从秋茄地下部向地上部运输,减轻地上部Cd累积.
植物根际土壤中存在着数量和种类惊人的微生物种群,定殖在植物根际通过产生植物生长激素、固氮、溶解无机磷酸盐、拮抗植物病源菌等方式,促进宿主植物生长发育,这类细菌被称为植物根际促生菌(Plant Growth Promoting Rhizobacteria,PGPR)[17].一方面,PGPR通过分泌各种植物激素直接影响其根系发育,另一方面则通过分泌多种信号物质调控植物根系的内源激素途径而影响根系构型,以达到活化根际养分和促进根系发育提高养分的利用效率,缓解重金属、干旱、盐分等环境因子胁迫,促进植物的生长的目的[18,19].此外,根际促生菌与植物根系以及土壤形成特殊的微环境,影响植物重金属抗性、吸收转运以及在植物可食用部分的累积,是一种理想的植物逆境胁迫生物调控措施.研究表明[20],接根际促生菌可显著增加小麦根部和地上部干重,降低根部和地上部Cd含量.
番茄是世界范围内重要的蔬菜作物,也是植物学研究的经典模式植物,我国番茄栽培面积和总产量均居世界首位.但由于我国番茄产地的土壤Cd污染较普遍,对番茄的产量和品质安全造成了严重影响[21].本研究通过水培试验,研究了MeJA与根际促生菌单独或联合施用对Cd胁迫下番茄幼苗Cd抗性和Cd累积的影响,旨在为利用MeJA和根际促生菌缓解番茄重金属胁迫提供理论依据和实践指导.
1 实验部分
1.1 供试材料
本试验的番茄种子购自新疆石河子蔬菜研究所.MeJA购自国药集团化学试剂有限责任公司.试验所用细菌是前期从重金属污染的土壤中分离出的具有耐Cd性的鞘氨醇单胞菌D36菌株,其GenBank登录号为:MN540917.1.
1.2 实验设计
挑选籽粒饱满的番茄种子用3%的次氯酸钠溶液将其浸泡约15 min,再用去离子水将种子冲至无色无味后均匀放置于装有蛭石的穴盘表面,在种子表面撒一层薄蛭石避光发芽,并移至人工气候室继续培养.人工气候室的昼夜温度为26 ℃/20 ℃,时间为16 h/8 h,相对湿度60%.待幼苗长至“两叶一心”时,将其转移至装有10 L营养液的周转箱,先用1/4浓度的Hoagland培养液培养两周,一周更换一次培养液,第三周选取长势一致的幼苗转移至水培罐内用1/2浓度的Hoagland培养液继续培养.幼苗在1/2培养液中培养一周后,对番茄幼苗进行处理.24 h后进行Cd(CdCl2·2.5H2O)胁迫处理.
处理组如下:CK、Cd、MeJA、D36、Cd+MeJA、Cd+D36和Cd+MeJA+D36,其中,CK为对照,Cd的处理浓度为3 mg L-1,MeJA处理浓度为2.5 μmol L-1,D36接菌处理将菌液(OD600=1.0)浸根90 min.MeJA用酒精溶解后稀释到工作浓度,使用喷壶均匀地喷施在番茄幼苗叶面上,喷至叶面全湿,有液滴低落为止.在24 h后对番茄幼苗进行Cd(CdCl2·2.5H2O)胁迫处理,样品于Cd处理7天后采样进行检测.
1.2.1 根长株高的测定
选取8株番茄幼苗,水平放置在吸水纸上,用刻度尺分别量取根长与株高.
1.2.2 鲜重与干重的测定
选取8株番茄幼苗,用去离子水冲去根部残留的营养液,并用滤纸吸干表面水分,用分析天平称取鲜重并记录,再将其放置在105 ℃烘箱中杀青半小时后,于80 ℃烘箱烘干至恒重并称重记录,即为干重.
1.2.3 番茄幼苗对Cd的抗性指数的计算
按下式计算番茄幼苗对Cd的抗性指数[22,23]:
抗性指数(%)=(m1/m2)×100
其中:m1指经处理后番茄幼苗的干重;m2指未经处理番茄幼苗的干重.
1.2.4 番茄幼苗光合色素含量的测定[24]
称取叶片鲜重0.2 g,用2~3 mL 95%乙醇研磨成匀浆,加95%的乙醇至10 mL,继续研磨至组织变白,静置2~3 min.在波长665 nm、649 nm、470 nm下,以95%乙醇为空白,测定叶绿体色素提取液的吸光度.
1.2.5 番茄幼苗丙二醛(MDA)含量的测定
取不同处理的番茄幼苗0.2 g,在冰浴中用5 mL 0.05 mol L-1磷酸缓冲液研磨成匀浆,加入5 mL 0.5%硫代巴比妥酸溶液摇匀,将试管放入沸水浴中煮沸10 min(自试管出现小气泡时开始计时),冷却后,离心,并以硫代巴比妥酸溶液为空白测532 nm、600 nm和450 nm处的吸光度.
1.2.6 番茄幼苗抗氧化酶活性的测定
取不同处理的番茄幼苗0.2 g,用0.1 mol L-1磷酸缓冲液(pH 7.0)在冰浴研磨成匀浆,即为酶提取液[25].POD和SOD均采用魏婷等[26]的方法.POD活性采用愈创木酚氧化法测定.酶活性测定体系含有:磷酸缓冲液、愈创木酚溶液、H2O2溶液和酶提取液.迅速混合启动反应,同时立即开始计时.于470 nm下测定30 s和90 s之间的变化值.SOD活性测定采用四唑氮蓝法.酶活性测定体系含有:磷酸缓冲液,甲硫氨酸溶液,四唑氮蓝溶液,核黄素溶液,乙二胺四乙酸二钠(EDTA-Na2)溶液、酶粗液和蒸馏水.在避光条件下加入全部试剂,摇匀,将试管至于4 000×荧光灯下显色15~20 min,温度控制在25 ℃~35 ℃之间,反应结束后避光终止反应,在560 nm下测定反应液的吸光度.测定时除样品管外,需添加光下和黑暗对照各4管.
抗坏血酸过氧化物酶(APX)参考卢倩倩[27]的方法.酶活性测定体系含有:APX反应液,酶提取液和H2O2反应液,并于290 nm下测定1 min内的吸光度变化值.
1.2.7 番茄幼苗的Cd含量
分别收集番茄幼苗的根、茎和叶,将幼苗的根在5 mmol L-1EDTA-Na2溶液中浸泡15 min以去除根部表面吸附的Cd,然后用去离子水冲洗数次.将样品在110 ℃杀青后,在70 ℃烘干至恒重.将植物干样分别称取0.1 g于消解管中,每个处理做四个平行,并贴好标签,加入10 mL HNO3加盖浸泡10 h后进行消解,消解条件为:80 ℃消解1.5 h,120 ℃消解1.5 h,150 ℃消解3 h,升至175 ℃时开盖赶酸至1 mL,用2% HNO3定容至10 mL,过滤,然后使用原子吸收光谱仪进行Cd含量的测定.
1.3 数据分析
本实验采用Excel 2010统计数据,采用SPSS 20.0进行单因素方差分析和多重比较(p<0.05),用Origin Pro8软件进行绘图,所有数据均为三次实验平均值.
2 结果与讨论
2.1 MeJA和D36处理对Cd胁迫下番茄幼苗根长和株高的影响
Cd是一种植物非必需的重金属元素,对植物的生长具有毒害作用,会抑制其正常的生长发育.如图1所示,在Cd胁迫下,番茄幼苗植株的根长和株高受到明显抑制(p<0.05),相比于CK,Cd处理使得番茄幼苗的根长降低了14.52%,而MeJA和D36能在一定程度上缓解Cd胁迫引起的番茄生长抑制,其中,相比于单独Cd处理,Cd+MeJA处理使番茄根长和株高分别提高了5.24%和14.32%,Cd+D36处理使番茄幼苗株高提高16.39%.Cd+MeJA+D36处理与单独Cd处理相比可显著提高番茄幼苗的根长和株高,分别提高了11.37%和14.76%.由此可知,在Cd胁迫下,外源MeJA和D36处理可缓解Cd胁迫引起的番茄生长抑制.
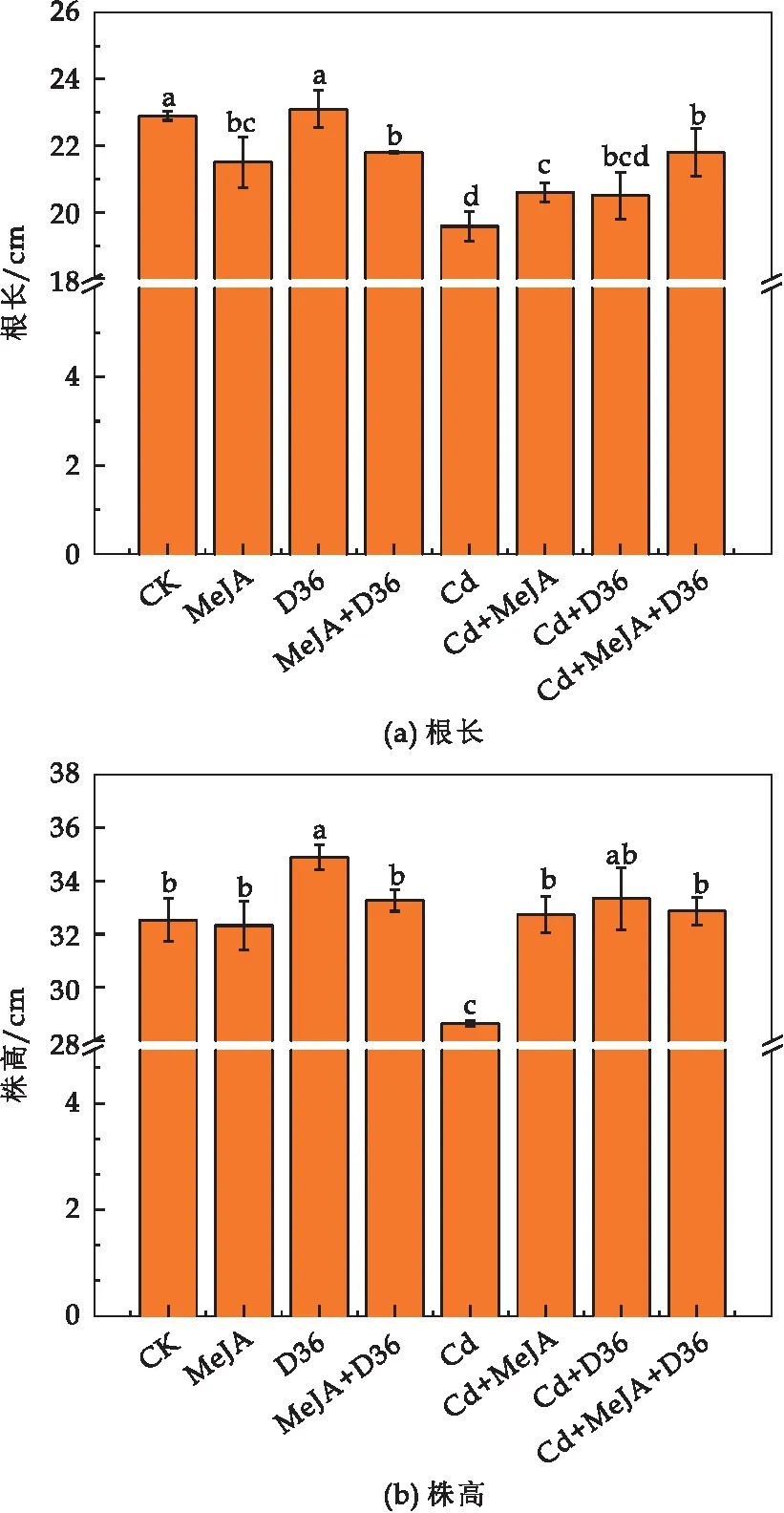
图1 不同处理对番茄幼苗根长和株高的影响
2.2 MeJA和D36处理对Cd胁迫下番茄幼苗鲜重和干重的影响
植物的生物量是研究植物的生长状况时选取的主要指标.由图2可知,在Cd胁迫下,番茄幼苗的生物量明显受到抑制.番茄地上部和地下部鲜重分别降低了24.44%和26.05%,干重分别降低了23.53%和11.13%.Cd+MeJA,Cd+D36,Cd+MeJA+D36处理均显著提高了Cd胁迫下番茄的生物量.其中,Cd+MeJA+D36处理效果最为显著,使得番茄地上部和地下部的鲜重分别增加了14.13%和30.59%,干重分别增加了35.54%和44.62%.这可能是因为MeJA作为一种植物生长调节剂,可以调控植物体内其他内源激素(如乙烯、赤霉素、生长素等)的含量,对植物的生长发育和抗逆生理反应起着重要作用,从而直接或间接的使番茄幼苗的生物量升高[28,29].此外,D36菌株具有产IAA的能力[30],IAA已被证明对细胞增大、分裂以及组织分化等一些物理过程会产生积极影响,从而刺激植物生长和发育[31].
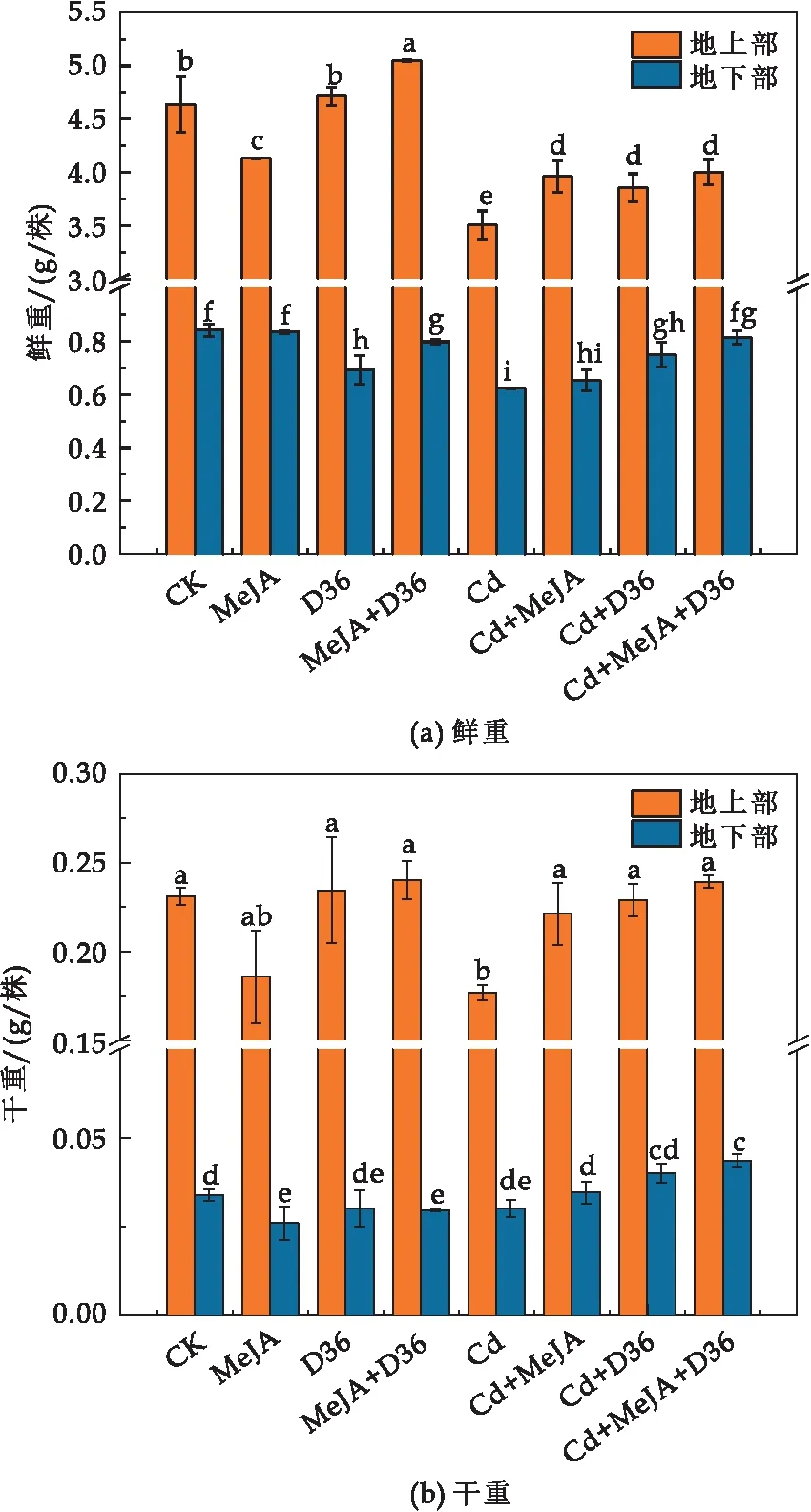
图2 不同处理对番茄幼苗生物量的影响
2.3 不同处理对番茄幼苗Cd的抗性指数的影响
由图3可知,与CK对照组相比,Cd处理使番茄幼苗对Cd的抗性显著降低了24.94%.与单独的Cd处理相比,Cd+MeJA+D36处理使得番茄幼苗对Cd的抗性增加了42.33%(p<0.05).其原因可能是MeJA具有诱导番茄幼苗系统抗性和抗氧化反应的能力,可缓解Cd胁迫引起的生长发育抑制.此外,根际促生菌可以通过固氮、溶解磷酸盐和产铁载体来提高植物的营养水平[32].另一方面根际促生菌可以刺激植物生长和发育,因为它们能够产生植物激素和分泌次生代谢物[33],诱导植物产生一系列生理生化变化,从而直接或间接调节植物对重金属的吸收和植物毒性.

图3 不同处理对番茄幼苗Cd抗性指数的影响
2.4 MeJA和D36处理对Cd胁迫下番茄幼苗光合色素含量的影响
叶绿素是植物光合作用的重要物质基础,其含量是衡量叶片衰老的重要生理指标,各种环境胁迫均可导致叶绿素的破坏与降解[34].如图4所示,与Cd处理相比,Cd+MeJA+D36处理提高了番茄幼苗叶片中叶绿素a和类胡萝卜素的含量,叶绿素b含量无显著变化(p<0.05).接种根际促生菌对叶绿素累积具有促进作用,这可能是因为根际促生菌可以通过释放有助于合成光合色素的物质来增加植物对的养分吸收,从而提高光合色素含量[35].此外,有研究表明,适当浓度的MeJA对有毒金属胁迫下光合色素的积累有积极作用[36,37].同时,MeJA可以提高光合色素合成相关关键酶的基因表达从而提高植物叶片中的色素含量[38].

图4 不同处理对番茄幼苗光合色素含量的影响
2.5 MeJA和D36处理对Cd胁迫下番茄幼苗MDA含量的影响
MDA是由于膜脂过氧化而产生的一种有毒物质,大量积累会导致植物细胞过氧化程度升高,破坏细胞结构甚至导致细胞致死[39].由图5可知,与CK相比,Cd处理使得番茄幼苗地上部和地下部的MDA含量分别增加了46.33%和22.51%(p<0.05).这可能是因为Cd与植物体内的其他阳离子存在竞争,其与巯基(-SH)结合后会破坏了蛋白质的结构和功能,从而打破自由基产生和清除之间的平衡,使得MDA累积增加[40].另外,受Cd胁迫的番茄幼苗细胞膜中存在的不饱和脂肪,由于活性氧自由基对细胞膜的破坏作用,促进了丙二醛的合成[41].与单独Cd处理相比,Cd+MeJA,Cd+D36,Cd+MeJA+D36显著降低了番茄体内的MDA含量,其中,Cd+MeJA+D36处理使番茄幼苗地上部和地下部的MDA含量降低了28.63%和45.84%,这可能是由于外源添加MeJA和植物促生菌后,番茄幼苗中抗氧化酶活性和抗氧化物质含量升高,加速了Cd胁迫诱导产生的过量MDA降解,减少Cd胁迫下MDA的累积,从而减轻番茄幼苗的氧化损伤.
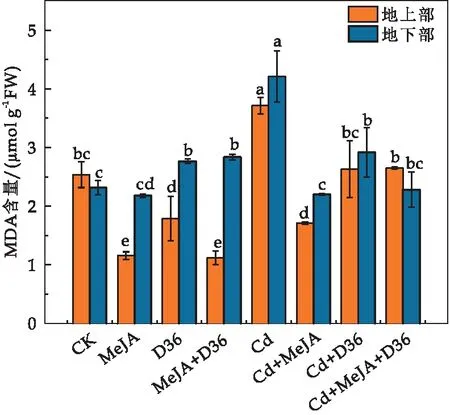
图5 不同处理对番茄幼苗的MDA含量的影响
2.6 MeJA和D36处理对Cd胁迫下番茄幼苗SOD活性的影响
SOD是活性氧清除反应过程具有重要作用的抗氧化物酶之一,在抗氧化酶类中处于核心地位.SOD对于清除氧自由基,避免细胞受氧自由基的氧化损伤,保护细胞正常的组成、结构和功能具有十分重要的意义[42].由图6可知,与CK相比,Cd处理后番茄幼苗地上部SOD活性升高5.38%,地下部的SOD活性无明显变化(p<0.05).与单独Cd处理相比,Cd+MeJA,Cd+D36,Cd+MeJA+D36处理提高了SOD活性,其中,Cd+MeJA+D36处理效果最为显著,使得地上部和地下部SOD活性分别增加了10.53%和28.17%,说明MeJA和D36在一定程度上可以提高SOD的活性,减轻番茄幼苗受到的氧化损伤.
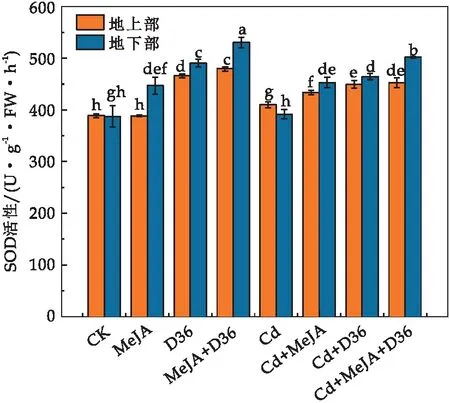
图6 不同处理对番茄幼苗的SOD活性的影响
2.7 MeJA和D36处理对Cd胁迫下番茄幼苗POD活性的影响
植物体在POD的催化作用下,可将H2O2转化为H2O,减轻植株的氧化损伤.由图7可知,与CK相比,Cd处理使番茄幼苗地上部POD活性上升了35.41%(p<0.05),Cd+MeJA+D36处理相比于单独的Cd处理,地上部POD活性增加了25.58%,表明MeJA和D36会升高番茄幼苗POD活性,提高处理过的番茄幼苗的抗氧化水平.研究显示,MeJA和根际促生菌影响了抗氧化酶合成相关基因的表达,提高番茄幼苗对Cd的耐受性,从而减轻Cd对番茄幼苗的胁迫[30].Farooq等[43]的研究发现,重金属胁迫可以诱导抗氧化酶的基因的表达,而外源MeJA处理进一步增强了这些基因在相应处理条件下的表达.
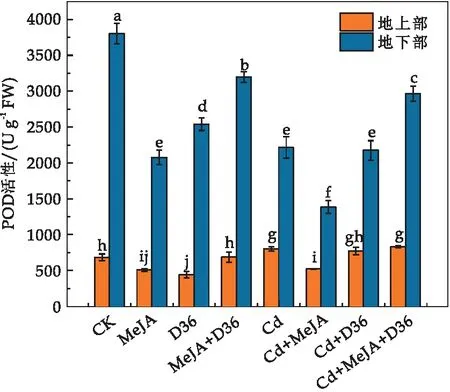
图7 不同处理对番茄幼苗的POD活性的影响
2.8 MeJA和D36处理对Cd胁迫下番茄幼苗APX活性的影响
APX对植物细胞内H2O2的清除有着举足轻重的作用,可将其还原为H2O.如图8所示,与CK对照组相比,Cd处理后番茄幼苗APX活性无显著变化(p<0.05).与单独Cd处理相比,Cd+MeJA+D36处理后,番茄幼苗地下部APX的活性显著提升44.89%,表明抗氧化酶对于清除由Cd胁迫引起的ROS累积具有重要作用,抗氧化酶活性的提高可能是番茄幼苗的重金属解毒机制之一[44].

图8 不同处理对番茄幼苗的APX活性的影响
抗氧化酶活性受胁迫植物的种类、生长条件、培养方式和胁迫因子的暴露时间和剂量不同也会影响抗氧化酶的活性[45].在胁迫条件下,茉莉酸甲酯和植物根际促生菌处理植株后SOD、APX、POD活性均高于单独胁迫处理的植株,这也在其它研究[25,46,47]中被证明,说明施用外源植物激素和根际促生菌可以提高SOD、POD、APX这些常规抗氧化酶的活性,通过减少细胞膜脂过氧化,保持细胞膜完整性进而有效降低胁迫对植株造成的伤害.
2.9 MeJA和D36处理对Cd胁迫下番茄幼苗Cd含量的影响
不同处理对番茄幼苗Cd含量的影响如图9所示,与Cd处理相比,Cd+MeJA、Cd+D36和Cd+MeJA+D36处理使得根部Cd含量分别降低了5.57%、9.31%和18.57%,茎部Cd含量分别降低了9.42%、12.42%和15.49%,叶部Cd含量分别降低了44.80%、2.66%和44.80%.表明在Cd胁迫下,MeJA或D36均可使番茄幼苗各组织的Cd含量降低,其中,Cd+MeJA+D36处理效果最为显著(p<0.05).研究显示,根际促生菌分泌的铁载体可通过抑制铁调控转运体的表达而增加植物对铁的获取从而减少对Cd的吸收[48].研究显示,MeJA可通过降低番茄幼苗根部Cd2+的内流速率,从而抑制番茄幼苗对Cd的吸收[49],此外,MeJA能够调节重金属转运相关基因的表达,从而干扰Cd在植物体内的吸收和运转.

图9 不同处理对番茄幼苗的Cd含量的影响
3 结论
(1) MeJA和D36处理可有效缓解Cd胁迫引发的番茄幼苗生长抑制,增加Cd胁迫下番茄幼苗的生物量,提高番茄幼苗对Cd的抗性提高.
(2) Cd胁迫造成番茄幼苗细胞膜氧化损伤,而MeJA和D36菌株联合施用可诱导番茄幼苗的抗氧化系统发生响应,提高抗氧化酶活性,减轻膜脂过氧化的程度,缓解Cd胁迫对番茄幼苗的毒害.
(3) MeJA和D36单独或共同处理对番茄幼苗根、茎和叶中的Cd累积都具有调控作用,减少了Cd在番茄幼苗内的累积.
