棕榈酸对溶藻弧菌的抑制效果及其作用机制研究
2022-12-01赵燕妮周宁宁赵洁妤
赵燕妮, 韩 洁, 周宁宁, 赵洁妤, 刘 欢*
(1.陕西科技大学 食品科学与工程学院 陕西农产品加工技术研究院, 陕西 西安 710021; 2.河北环境工程学院 环境工程系, 河北 秦皇岛 066102)
0 引言
溶藻弧菌(Vibrio.alginolyticus)是一类含有鞭毛的革兰氏阴性弧菌,广泛生存繁殖于世界各地的沿海、溪流及水生等生态环境中,能够感染海洋鱼类、贝类、蟹类以及虾类等多种海水养殖动物[1-6],出现细菌性出血、贫血及腮部溃烂等病症[4,7],从而给海水养殖业带来巨大的经济损失[8].溶藻弧菌还是一种典型的人-畜-鱼共患的高致病性微生物,是细菌性的食源性致病菌,会导致人类中耳炎、创伤性感染,食用其某些菌株感染的水产食物还会引发人类食物中毒、肠道炎等疾病[9],直接对人类生命健康造成严重威胁.有报道显示在1988~2012年期间感染溶藻弧菌病例达1 331例,其中高达96%的病例来自沿海国家[10].目前,抗生素是应对溶藻弧菌病害的主要防治手段,然而,抗生素的滥用不仅会造成细菌的耐药性增强,而且残留抗生素跟随海产品进入人体,也会引发食品安全问题.因此,开发新型安全有效海洋病原菌抑菌剂是目前亟待解决的问题.
脂肪酸作为细胞膜的重要组成部分,与细胞识别、种族特异性、细胞免疫、毒力、耐药性等有着极为密切的关系.近年来的研究发现,脂肪酸(FAs)及其衍生物可以选择性抑制微生物病原体的生物被膜形成,改变细胞膜流动性、干扰细胞电子传递链系统、产生有毒降解产物.Kim等[11]发现锯棕榈油可抑制金黄色葡萄球菌、大肠杆菌O157∶H7等多种微生物生物膜的形成,转录组学技术发现月桂酸和肉豆蔻酸可抑制大肠杆菌生物膜相关基因(csgAB、fimH和flhD)的表达.Ryan等[12]和zhou等[13]发现野油菜黄单胞菌产生的脂肪酸(顺-11甲基-2-十二烯酸),是可扩散信号因子(DSF)家族的第一个成员,该家族被发现可通过控制合成胞外酶(包括参与胞外多糖降解的内葡聚糖酶)来诱导自身生物膜的分散.棕榈酸作为一种重要的脂肪酸,已被美国食品药品监督管理局(Food and Drug Administration,FDA)认证是安全的食品成分并且被批准可用作食品添加剂,在食品中作为润滑剂、粘合剂、消泡剂和作为其他“食品级”添加剂中的复合物.我国GB2760-89规定,其也可用于配制各种食用香料、消泡剂和其他食品添加剂的原料.这意味着棕榈酸已经被认可作为食品添加剂使用.已有研究发现棕榈酸可抑制热带假丝酵母的生物膜、酶活性等毒力因子[14].然而目前尚未发现有关棕榈酸对溶藻弧菌的抑菌效果及作用机制的研究工作.
本文通过测定棕榈酸对溶藻弧菌的最小抑菌浓度、最小杀菌浓度以及其对溶藻弧菌生长曲线、细胞膜的影响,同时通过扫描电镜观察细胞表面形态变化来探究棕榈酸对溶藻弧菌的抑制作用及可能机理,旨在为棕榈酸对海产品病害防控技术的开发奠定理论基础.
1 材料与方法
1.1 实验材料
1.1.1 实验菌株及培养条件
(1)菌株:本研究所用的菌株为溶藻弧菌EPGS(菌种保藏号 CCTCC No.AB209306),由华东理工大学阿华生物工程研究所提供,溶藻弧菌长期储存于-80 ℃.
(2)培养条件:实验时取菌种1%的接种量接种于LBS液体培养基(3%(w/v)NaCl,1%(w/v)Tryptone,0.5%(w/v)Yeast Extract),加入0.1%(v/v)的氨苄青霉素,于200 r/min,30 ℃条件下活化复苏培养12 h,本研究中所有实验操作前,溶藻弧菌均作此上活化培养.
1.1.2 试剂及仪器
(1)主要材料与试剂
棕榈酸(CAS 57-10-3),购买于上海泰坦科技股份有限公司;NaCl,天津市天力化学试剂有限公司;Tryptone(LP0042)、Yeast Extract(LP0021),美国赛默飞世尔科技公司;氨苄青霉素,北京博奥托达科技有限公司;硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂,青岛高科技工业园海博生物技术有限公司;葡萄糖(Glu)测试盒、丙二醛(MDA)测定试剂盒(TBA法),南京建成生物科技有限公司;磷酸缓冲溶液,陕西中晖赫彩生物医药科技有限公司;戊二醛,天津市科密欧化学试剂有限公司;乙酸异戊酯,福晨化学试剂有限公司(天津).
(2)主要仪器与设备
LDZX-50KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂;ZD-85气浴恒温振荡器,常州金坛良友仪器有限公司;H-1850R高速离心机,长沙湘仪离心机仪器有限公司;JA2003电子分析天平,赛多利斯科学仪器有限公司;HWS-24恒温水浴锅,上海一恒科学仪器有限公司;VORTEX-5涡旋混合器,海门市其林贝尔仪器制造有限公司;SW-CJ-IFD单人单面净化工作台,苏州净化设备有限公司;Varioskan Flash全波长扫描式多功能读数仪,赛默飞世尔科技有限公司(芬兰);Verios 460场发射扫描电镜,美国FEI公司;DDS-307电导仪,佑科仪器有限公司.
1.2 实验方法
所有实验均以未加棕榈酸的溶藻弧菌培养液为对照组.
1.2.1 棕榈酸对溶藻弧菌的最小抑菌浓度测定
最小抑菌浓度(Minimum Inhibitory Concentration,MIC)指在体外培养菌体24 h后能抑制培养基内病原菌生长的最低药物浓度.取-80 ℃甘油管冻存的溶藻弧菌,按1%的接种量接种于LBS液体培养基中,加入1%的氨苄青霉素,摇床活化培养12 h(30 ℃,200 r/min),使菌液最终浓度约为108~109CFU/mL备用(4 ℃保存),本实验采用二倍稀释法对棕榈酸扰动溶藻弧菌的MIC进行测定,具体操作如下:先将棕榈酸溶解于无水乙醇中,制备成10 mg/mL的母液,之后加入不同毫升数的棕榈酸母液至LBS培养基中,使棕榈酸最终的浓度为0 mg/mL、0.037 5 mg/mL、0.075 mg/mL、0.15 mg/mL、0.3 mg/mL、0.6 mg/mL、1.2 mg/mL,再按1%(v/v)接种量接入活化后的溶藻弧菌摇匀,将含有棕榈酸的LBS菌悬液移植24孔板中,同时以不含棕榈酸的菌悬液作为本实验的对照组.将24孔板置于30 ℃培养箱培养24 h后,观察菌体生长情况.培养液澄清,肉眼不可见菌体时所加入的棕榈酸最低浓度即为棕榈酸对溶藻弧菌的MIC.
1.2.2 棕榈酸对溶藻弧菌的最小杀菌浓度测定
称取海洋弧菌鉴别培养基粉末硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂(Thiosulfate citrate bile sucrose,TCBS)8.9 g,溶解至100 mL蒸馏水中煮沸,冷却至50 ℃,倒入无菌培养板(固体培养基).经章节1.2.1测定实验得出MIC后,于LBS液体培养基中加入不同毫升数的棕榈酸,使得棕榈酸最终的浓度分别为0、1/2 MIC、MIC、2 MIC、4 MIC,按1%的接种量加入活化后溶藻弧菌,摇床培养9 h(30 ℃,200 r/min)之后,将菌液划线至TCBS固体培养板上,倒置培养24~36 h,观察菌落生长,将未有溶藻弧菌菌落生长的最低浓度定为最小杀菌浓度(Minimum Bactericidal Concentration,MBC).
1.2.3 棕榈酸对溶藻弧菌生长曲线的影响
经章节1.2.1、1.2.2测定实验得出MIC、MBC后,对以上不同浓度的棕榈酸对溶藻弧菌的生长曲线进行测定.将经活化后的溶藻弧菌菌悬液按1%的接种量加入LBS液体培养基中,并按0.1%的加入氨苄青霉素,摇床(30 ℃,200 r/min)培养12 h,每小时取200 uL于96孔板中,测定600 nm处的吸光值,并绘制生长曲线.
1.2.4 棕榈酸对溶藻弧菌的细胞膜完整性的影响
(1)棕榈酸对溶藻弧菌电解质外泄的影响
取活化后的菌液扩大培养3 h后,加入0、MIC、2 MIC浓度的棕榈酸,继续培养6 h(30 ℃,200 r/min),之后取1 mL菌液于6 000 r/min,4 ℃条件下离心5 min,使用电导率仪测定上清液的电导率,以去离子水作为空白对照.
(2)棕榈酸对溶藻弧菌胞外葡萄糖的影响
取活化后的菌液扩大培养3 h后,加入0、MIC、2 MIC浓度的棕榈酸,继续培养6 h(30 ℃,200 r/min),之后取1 mL菌液于6 000 r/min,4 ℃条件下离心5 min,使用葡萄糖试剂盒测定胞外葡萄糖含量.
(3)棕榈酸对溶藻弧菌核酸、蛋白质泄露的影响
取活化后的菌液扩大培养3 h后,加入0、MIC、2 MIC浓度的棕榈酸,继续培养6 h(30 ℃,200 r/min),之后取1 mL菌液于8 000 r/min,4 ℃条件下离心3 min,在波长分别为260 nm(胞外核酸)、280 nm(胞外蛋白)处测定上清液的吸光值,以不加棕榈酸的菌液上清作为对照.
(4)棕榈酸对溶藻弧菌丙二醛含量(Malondialdehyde,MDA)的影响
取活化后的菌液扩大培养3 h后,加入0、MIC、2 MIC浓度的棕榈酸,继续培养6 h(30 ℃,200 r/min),之后取1 mL菌液于4 000 r/min,4 ℃条件下离心3 min,使用丙二醛试剂盒测定上清液中MDA的含量.
(5)棕榈酸对溶藻弧菌胞内活性氧(Reactiveoxygen species,ROS)含量的影响
取活化后的菌液扩大培养3 h后,加入0、MIC、2 MIC浓度的棕榈酸,继续培养6 h(30 ℃,200 r/min),之后取1 mL菌液于5 000 r/min,4 ℃条件下离心5 min,弃上清加入1 mL 10 umol/L的2,7—二氯二氢荧光素二乙酸酯溶液(2,7-Dichlorodihydrofluorescein diacetate,DCFH-DA),于37 ℃下培养20 min后去除上清液,并用磷酸缓冲溶液(PBS)洗涤菌体3次,以增强测试结果的准确性.测定细菌悬浮液的荧光强度(激发波长488 nm,发射波长525 nm).
1.2.5 棕榈酸对溶藻弧菌细胞形态的影响
取活化后的菌液扩大培养3 h后,加入0、MIC、2 MIC浓度的棕榈酸,继续培养6 h(30 ℃,200 r/min),之后取1 mL菌液离心弃上清,加入1 mL 2.5%(v/v)戊二醛水溶液,于4 ℃冰箱静置2~4 h.经戊二醛固定后于8 000 r/min,4 ℃条件下离心3 min,去除上清液并加入1 mL PBS振荡混匀10 min,再离心3 min(8 000 r/min,4 ℃)弃上清,洗脱3次除去菌体表面的培养液,之后依次用30%、60%、80%、100%(v/v)乙醇梯度洗脱(期间换梯度离心8 000 r/min,4 ℃,3 min),弃上清加入1 mL乙酸异戊酯混匀,置于4 ℃冰箱浸泡30 min或过夜.离心去除上清液,菌体在干燥箱70 ℃下干燥3~4 h至固体粉末状.最后将粉末状菌体均匀涂抹于导电胶并装载在载物台,喷金后在高分辨场发射扫描电镜下进行观察拍照.
1.3 数据分析
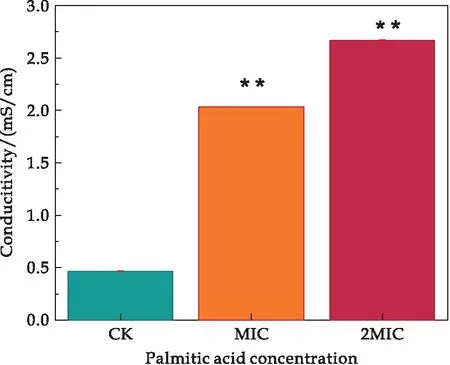
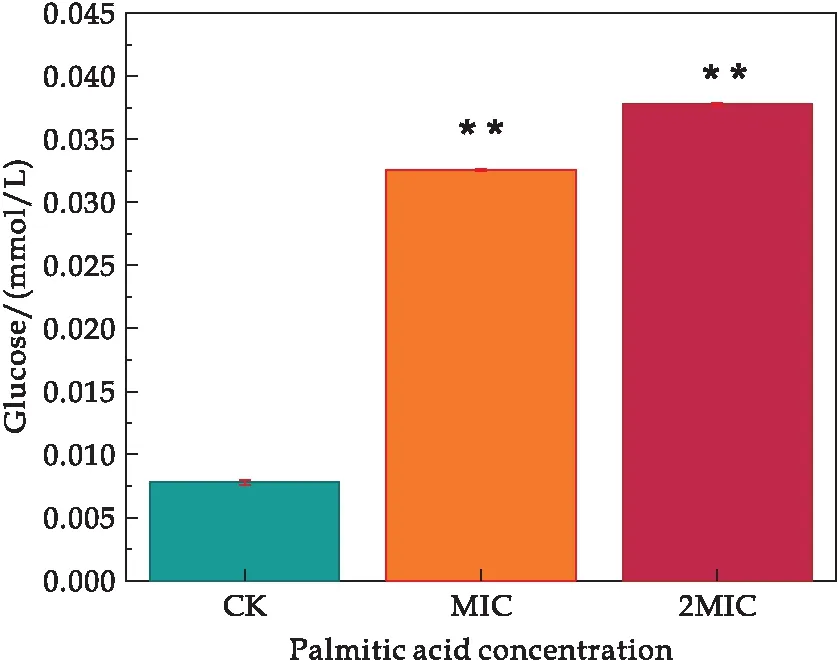
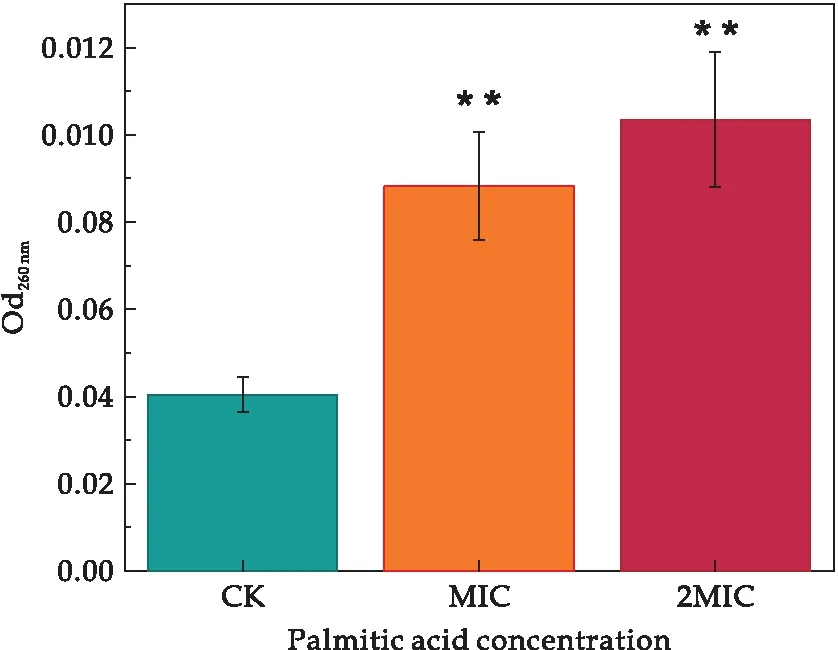
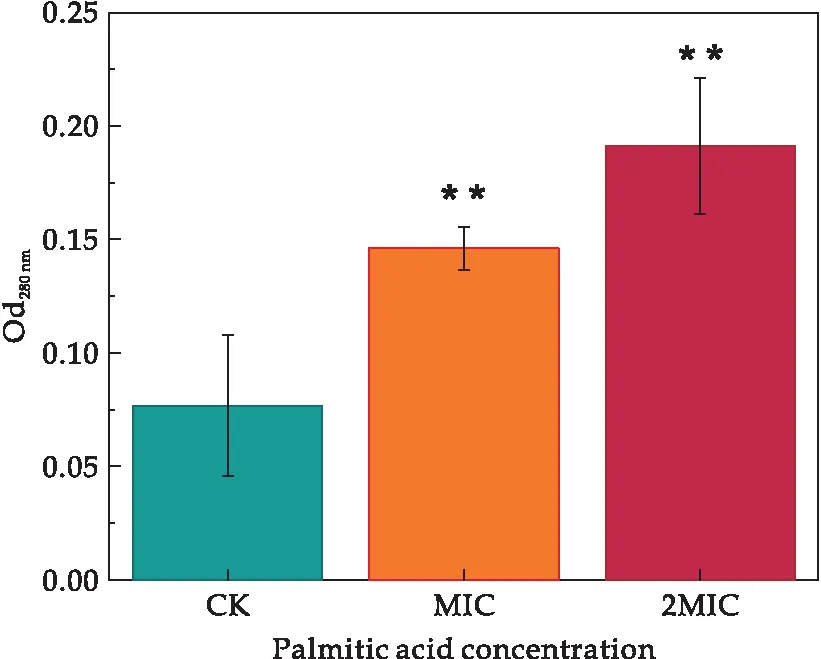
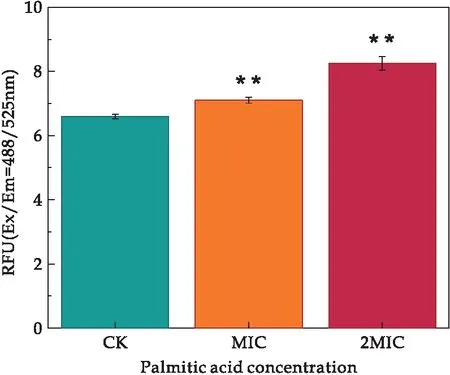
本研究中所有试验重复三次,所得数据结果均以平均值±标准差表示.使用GraphPad Prism 8.0.2软件对试验数据进行统计分析,并且使用T检验对数据结果进行显著性差异分析(“*”表示实验组与对照组有显著差异(0.01 溶藻弧菌在最适培养条件下,经棕榈酸处理后,测定发现棕榈酸对溶藻弧菌的MIC为0.6 mg/mL.当棕榈酸的浓度低于0.6 mg/mL时,菌体经24 h的生长繁殖,培养液出现不同程度的浑浊;当棕榈酸浓度达到或高于0.6 mg/mL时,溶藻弧菌经24 h的培养未出现肉眼可见的细菌生长,且培养液澄清透亮,与不加溶藻弧菌的空白组基本一致.结果表明棕榈酸对溶藻弧菌有一定的抑菌作用,其MIC为0.6 mg/mL.基于所得的MIC,进一步探究棕榈酸对溶藻弧菌的抑菌作用. 经上述实验得知,棕榈酸对溶藻弧菌具有一定的抑菌作用,本文进一步探究其对溶藻弧菌的杀菌作用.将经不同浓度棕榈酸(CK、1/2 MIC、MIC、2 MIC、4 MIC)处理后的溶藻弧菌菌悬液均匀划线于TCBS琼脂平板上进行菌落观察,将TCBS平板倒置于恒温培养箱(30 ℃)24 h,其结果如图1所示. 图1 棕榈酸对溶藻弧菌的最小杀菌浓度研究 由图1可知,未加棕榈酸的对照CK组,溶藻弧菌长满了平板,且菌落密集;经1/2 MIC浓度的棕榈酸处理后,溶藻弧菌亦有大量生长,形成了较为密集的菌落;当浓度为MIC时,平板上仍有小部分菌体生长;而当棕榈酸浓度为2 MIC和4 MIC时,TCBS琼脂板上未出现肉眼可见的菌落生长.故可确定棕榈酸对溶藻弧菌的MBC为2 MIC,即MBC=2 MIC=1.2 mg/mL.为进一步探究棕榈酸对溶藻弧菌的抑菌作用,本文选择CK(未加棕榈酸)、MIC、2 MIC三组进行后续研究. 生长曲线是根据培养物中存在的活细胞数量确定的.棕榈酸对溶藻弧菌的生长曲线(所有实验组及对照组的起始OD600值≈0)影响如图2所示. 图2 棕榈酸影响下溶藻弧菌的生长曲线 由图2可知,当棕榈酸浓度低于MIC时,溶藻弧菌的生长在0~3 h为迟缓期,菌体接入LBS后,菌体体积增大、代谢活跃,对新环境短暂的适应,其中不适应的菌体因转种而死亡,即表明在迟缓期低于MIC棕榈酸浓度下的菌体未出现明显差异;在3~9 h内溶藻弧菌进入对数增长期,活菌数直线上升,不同浓度的棕榈酸暴露,溶藻弧菌的生长曲线出现明显梯度降低趋势,即棕榈酸对溶藻弧菌的生长曲线有明显影响;9~12 h内,溶藻弧菌进入稳定期(OD600≈1.56),该期的生长菌群总数几乎处于平坦阶段,12 h时对照组的OD600≈2.04,1/2 MIC组的OD600≈1.20,菌群总数约降低了0.59倍,即表明在棕榈酸浓度低于MIC处,其对溶藻弧菌亦有明显的影响作用.当棕榈酸浓度达或高于MIC时,溶藻弧菌在整个检测周期中未出现菌体增长,即溶藻弧菌完全被抑制.所有的生长结果表明:棕榈酸严重干扰了溶藻弧菌的生长曲线. 基于对生长曲线的测定,菌体在对数增长期(3~9 h)内细菌形态、染色、生物活性都很典型,对外界环境因素的作用敏感,因此在菌体生长9 h时研究细菌性状最好,且抑菌作用在该时期的细菌效果最佳. 微生物细胞膜的完整性是保证其维持自身新陈代谢等正常生理活动的重要因素.目前,对于脂肪酸的抑菌机理大部分研究认为,其主要以细胞膜为靶点的作用机理[11].由于细胞膜是控制细胞与外界进行物质交换的主要屏障,细胞内外物质可被细胞膜有选择地控制进出,避免胞内物质外泄以及胞外物质非正常进入.细胞膜作为大部分抑菌剂的作用靶点,其功能性质随抑菌剂发生变化.抑菌剂处理菌体会引起细胞膜流动性变差,细胞膜的选择透过能力被破坏,胞内例如K+、DNA、RNA等多种内容物流出,导致细胞自身调控失调、细胞破裂、甚至死亡.Zhang等[15]发现经抑菌剂-多糖干扰后菌液的电导率、蛋白质等呈浓度依赖性增加,证明了该多糖对该菌的抑制作用,即表明通过测定电导率等指标可监测细胞膜功能性质及抑菌剂的抑菌作用. 因此,为了进一步明确棕榈酸对溶藻弧菌细胞膜通透性、选择透过性等功能的破坏程度,本研究使用电导率研究棕榈酸对溶藻弧菌细胞膜的通透性影响,监测棕榈酸对溶藻弧菌胞外核酸、胞外蛋白质含量的影响,分别利用葡萄糖试剂盒和丙二醛试剂盒对胞外葡萄糖和丙二醛进行测定,以及对胞内活性氧的监测. 2.4.1 棕榈酸对溶藻弧菌电解质外泄的影响 细胞膜是微生物防止细胞外的有害物质进入细胞的重要屏障,其保证了细胞内环境稳态.当细胞膜被破坏,导致其通透性增大,大量的细胞内容物外泄,从而影响细胞的正常生长代谢[16].使用电导率仪检测菌液上清的电导率变化研究棕榈酸对溶藻弧菌电解质外泄的影响,如图3所示. 图3 棕榈酸对溶藻弧菌电导率的影响 结果发现,随着棕榈酸的浓度增加,处理组的电导率相比对照组有明显的提高,MIC与2 MIC两组的电导率相比较对照组随棕榈酸浓度的增大,电导率成正相关变化,分别增加了约4.36倍、5.71倍.电导率的增加可能是因为棕榈酸引起溶藻弧菌细胞膜损伤,改变了菌体细胞膜的通透性、完整性,直接导致细胞内除正常胞内外运输的离子以外(如K+、Na+、PO43-等)的离子大量流出,使电导率增大,从而影响了溶藻弧菌菌体的正常生长,达到了抑菌的目的.Zhou等[17]通过测定细胞膜的膜电位发现紫苏精油破坏了粪肠球菌细胞膜的完整性,表明膜电位可用来判断细胞膜的完整性:膜电位增加,细胞膜完整性降低. 2.4.2 棕榈酸对溶藻弧菌胞外葡萄糖含量的影响 葡萄糖主要参与细胞的能量代谢,一般情况下细胞外的葡萄糖含量极少通过主动运输方式进入细胞内.当细胞膜通透性增强时,大部分胞内葡萄糖会泄露到细胞外.经不同浓度棕榈酸处理的溶藻弧菌胞外葡萄糖含量的变化结果如图4所示. 图4 棕榈酸对溶藻弧菌胞外葡萄糖的影响 结果发现,经棕榈酸处理的MIC组、2 MIC组的葡萄糖含量随棕榈酸浓度的增加呈浓度依赖性增加,分别增加了4.17倍、4.83倍.由此可见,随着棕榈酸浓度增加,溶藻弧菌的细胞膜被破坏,胞内的葡萄糖外泄至胞外.棕榈酸扰动溶藻弧菌使菌体胞内的葡萄糖外泄,导致细胞内正常的能量代谢受到严重干扰,从而影响菌体正常生命活动,达到一定的抑制干扰作用. 2.4.3 棕榈酸对溶藻弧菌胞外核酸、胞外蛋白的影响 细胞膜是保护细胞的第一道屏障,当抑制剂处理细胞后,微生物的天然屏障受到损伤,从而造成细菌内容物包括核酸、蛋白质等大分子物质外泄.核酸和蛋白在260 nm、280 nm处有很强的紫外吸收峰.因此,本研究使用全波长扫描式多功能读数仪检测细胞外核酸含量、蛋白含量变化,以探究棕榈酸对溶藻弧菌核酸、蛋白质外泄的影响,结果如图5、图6所示. 图5 棕榈酸对溶藻弧菌胞外核酸的影响 图6 棕榈酸对溶藻弧菌胞外蛋白的影响 由图可知,经棕榈酸处理的MIC组、2 MIC组的胞外核酸(分别增加了2.18倍、2.56倍)及胞外蛋白(分别增加了1.91倍、2.49倍)含量远高于CK组.且随棕榈酸浓度的增大,胞外核酸和胞外蛋白质的含量呈正相关增长.由此可见,随着棕榈酸浓度增加,溶藻弧菌的细胞膜被破坏,胞内的核酸和大分子蛋白外泄至胞外.推测棕榈酸影响了溶藻弧菌细胞膜的通透性和完整性,使菌体胞内核酸、胞内蛋白质外泄,导致细胞内正常的生命代谢受到严重干扰,从而影响菌体正常生命活动,达到一定的干扰作用.王虹懿等[18]通过检测胞外核酸、胞外蛋白质外渗情况,发现绿原酸与Ⅲ型细菌素复配使荧光假单胞菌的膜通透性增强,表明可通过监测胞外核酸、胞外蛋白质来监测细胞膜的通透性. 2.4.4 棕榈酸对溶藻弧菌丙二醛含量的影响 MDA是脂质过氧化的最终产物之一,是监测细胞膜通透性的主要指标,它的产生能加剧细胞膜的损伤[19].本研究利用丙二醛试剂盒对对照组及经棕榈酸处理的实验组的丙二醛进行测定,以检测棕榈酸对溶藻弧菌细胞膜的影响,结果如图7所示. 图7 棕榈酸对溶藻弧菌丙二醛的影响 结果发现,与对照组相比,经棕榈酸处理的MIC组、2 MIC组的丙二醛含量分别增加了1.69倍、2.03倍,呈剂量依赖性增加.以上结果说明棕榈酸可攻击溶藻弧菌细胞膜,导致细胞膜过氧化损伤.Dai等[20]通过检测丙二醛含量,发现经冷等离子体处理使鼠伤寒沙门氏菌细胞膜的氧化损伤,表明丙二醛含量增高,细胞膜结构被破坏. 2.4.5 棕榈酸对溶藻弧菌胞内活性氧的影响 ROS具有较强的氧化活性,过量的ROS会氧化损伤菌体细胞膜脂质、蛋白质、核酸等物质,从而破坏细胞结构[21].Czaika等[22]发现ROS对金黄色葡萄球菌和耐甲氧西林菌有较强的杀灭作用,表明ROS可加快细菌凋亡.本实验测定不同棕榈酸处理后溶藻弧菌细胞内的活性氧含量,结果如图8所示. 图8 棕榈酸对溶藻弧菌胞内活性氧的影响 与对照组相比,经棕榈酸处理的MIC组、2 MIC组的活性氧含量分别增加了1.08倍、1.25倍,且呈剂量依赖性.结果说明棕榈酸可提高胞内活性氧的产量,ROS的积累表明:棕榈酸可显着抑制溶藻弧菌的代谢活性并诱导氧化应激从而导致细胞膜的过氧化损伤. 以上实验结果表明棕榈酸对溶藻弧菌细胞膜完整性的破坏情况,棕榈酸通过破坏溶藻弧菌细胞膜的完整,影响菌体正常的生命代谢活动,从而抑制了溶藻弧菌的生长繁殖. 通过章节2.3的研究结果,发现棕榈酸严重破坏了溶藻弧菌细胞膜的完整性和通透性,引起细胞内容物外泄.为更加直观的观察棕榈酸对溶藻弧菌细胞形态的影响,通过场发射扫描电镜观察经不同浓度棕榈酸处理后溶藻弧菌细胞形态的变化,如图9所示. 图9 扫描电镜观测棕榈酸对溶藻弧菌细胞形态的影响 由图9可知,未经棕榈酸处理的溶藻弧菌呈典型的弧菌形态(短杆状),细胞膜保持完整,菌体光滑饱满,边缘明显且圆滑.当加入棕榈酸之后,溶藻弧菌的细胞形态遭受到一定的破坏,细菌菌体表面呈现明显的凹凸不平、干扁残缺、皱缩、甚至破裂等现象,MIC浓度棕榈酸处理后,几乎所有的细胞呈现出细胞不完整、褶皱的现象.随棕榈酸浓度增大,细胞损伤更加严重,已丧失溶藻弧菌固有的棒状弧菌形态;经2 MIC棕榈酸作用后菌体细胞严重受损,出现畸形,在观察视野下几乎全部细胞呈高度破坏状态.溶藻弧菌细胞的受损程度和数量随棕榈酸浓度的增加而增大.以上结果表明,棕榈酸能够破坏溶藻弧菌细胞壁膜的结构以及完整性,进而抑制菌体正常生长甚至凋亡. 本实验发现,棕榈酸对溶藻弧菌有较良好的抑制作用,能够使细胞发生破损、坍塌,影响细胞膜的完整性和通透性等,进而破坏细胞的正常形态,导致核酸、蛋白质等生物大分子的泄漏,致使细胞稳态被破坏使菌体凋亡.本研究结果可为新型、高效的天然弧菌抑菌剂的开发提供理论依据.本文仅从抑菌活性角度初步解析棕榈酸的抑菌作用,后期还需从棕榈酸对溶藻弧菌毒力因子影响的角度开展深入研究,探究其抑菌机制.2 结果与讨论
2.1 棕榈酸对溶藻弧菌的最小抑菌浓度研究
2.2 棕榈酸对溶藻弧菌的最小杀菌浓度研究

2.3 棕榈酸对溶藻弧菌生长曲线的研究

2.4 棕榈酸对溶藻弧菌细胞膜完整性的影响

2.5 高分辨场发射扫描电镜观察棕榈酸对溶藻弧菌细胞形态的影响

3 结论
